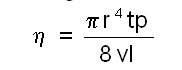This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ദ്രാവകം
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
ദ്രാവകം
Liquid
ദ്രവ്യത്തിന്റെ അവസ്ഥകളിലൊന്ന്. ഖരാവസ്ഥയ്ക്കും വാതകാവസ്ഥയ്ക്കും ഇടയിലായി വര്ത്തിക്കുന്ന ഘനീകൃത അവസ്ഥയാണിത്. വാതകത്തെപ്പോലെ ഒഴുകുന്ന സ്വഭാവമുണ്ടെങ്കിലും ഇതിന് ഖരത്തിനു സമാനമായ സാന്ദ്രതയുണ്ട്. ഖരത്തെ അപേക്ഷിച്ച് ദ്രാവകത്തിന് ഒഴുകുവാന് താരതമ്യേന ചെറിയ സമ്മര്ദ ബലങ്ങളുടെ പ്രഭാവംതന്നെ ധാരാളമാണ്. ഖരങ്ങളില് തന്മാത്രകള്ക്ക് സ്ഥിരവും കൃത്യവുമായ സ്ഥാനീയ വിന്യാസമുണ്ടായിരിക്കും. ഒരു നിശ്ചിത പരിധിവരെ സമ്മര്ദ ബലങ്ങളെ അതിജീവിക്കാന് ഖരങ്ങള്ക്കു സാധിക്കും.
ദ്രവ്യത്തിന്റെ വ്യത്യസ്ത അവസ്ഥകളുടെ ഗതിക സിദ്ധാന്തത്തെ ആസ്പദമാക്കി മാത്രമേ ദ്രാവകങ്ങളുടെ സ്വഭാവത്തെ വിശദീകരിക്കാനാവൂ. ദ്രാവക തന്മാത്രകളുടെ ചലന സ്വഭാവം ഖര-വാതകാവസ്ഥകള്ക്കു മധ്യേയാണ്. ദ്രാവകത്തിനുള്ളിലെവിടെയും സ്വതന്ത്രമായി ചലിക്കുവാന് കഴിയുമെങ്കിലും പുറത്തേക്കു ചലിക്കുവാന് പ്രതലബലം തടസ്സമാണ്. ദ്രാവകത്തിന്റെ പ്രതലത്തിനു പുറത്തേക്ക് ഗതികോര്ജം കൂടിയ തന്മാത്രകള് സ്വതന്ത്രമാകുന്ന അവസ്ഥയാണ് ബാഷ്പീകരണം. താപനില ഉയരുന്നതോടെ കൂടുതല് തന്മാത്രകള് സ്വതന്ത്രമാകുന്നു. ഇപ്രകാരം സ്വതന്ത്രമാക്കപ്പെടുന്ന തന്മാത്രകള് ദ്രാവകത്തിന്റെ പ്രതലത്തിനുമീതെ കൂടിയ സാന്ദ്രതയില് നിലനിന്നാല് അവയില് ഒരു പങ്ക് ദ്രാവകത്തിലേക്കുതന്നെ തിരികെ പ്രവേശിക്കുന്നു. ഒരു നിശ്ചിതവ്യാപ്തത്തിനുള്ളില് (ഉദാ. അടപ്പുള്ള പാത്രം) ദ്രാവകത്തിനു മുകളിലുള്ള വായു ദ്രാവകതന്മാത്രകള്കൊണ്ട് പൂരിതമാകുന്നതോടെ ദ്രാവകത്തില്നിന്ന് സ്വതന്ത്രമാകുന്ന തന്മാത്രകളുടെ എണ്ണവും ദ്രാവകത്തിലേക്ക് തിരികെവരുന്ന തന്മാത്രകളുടെ എണ്ണവും തുല്യമാകുന്നു. ഇപ്രകാരം ഒരു സന്തുലിതാവസ്ഥ സ്ഥാപിതമാകുമ്പോള് ബാഷ്പീകരണം നടക്കാതെവരുന്നു. എന്നാല് ഒരു തുറന്ന പാത്രത്തിലാണെങ്കില് പ്രതലത്തിനു പുറത്തേക്കുവരുന്ന തന്മാത്രകള്ക്ക് കൂടുതല് ദൂരേക്ക് ചലനസ്വാതന്ത്ര്യമുള്ളതിനാല് തുടര്ന്നും ബാഷ്പീകരണം നടക്കുന്നു. ഈ തന്മാത്രകള് ദ്രാവകത്തിനു മുകളിലുള്ള അന്തരീക്ഷത്തില് ചെലുത്തുന്ന മര്ദത്തെയാണ് ബാഷ്പമര്ദം എന്നു പറയുന്നത്. ബാഷ്പമര്ദം താപനിലയോടൊപ്പം ഉയരുന്നു. തിളനിലയെത്തുമ്പോള് ബാഷ്പമര്ദവും അന്തരീക്ഷമര്ദവും തുല്യമാകുന്നതോടെ ദ്രാവകത്തിനുള്ളില് ബാഷ്പത്തിന്റെ കുമിളകള് രൂപപ്പെടുന്നു.
ദ്രാവക തന്മാത്രകള് തമ്മിലുള്ള ആകര്ഷണംമൂലം ദ്രാവക പ്രതലത്തിന് ഗോളാകൃതി പ്രാപിക്കാനുള്ള പ്രവണതയുണ്ട്. പ്രതല വിസ്തൃതി കുറച്ച് പ്രതലഊര്ജം ഏറ്റവും കുറവാക്കാനുള്ള ഈ പ്രവണതയാണ് പ്രതലബലത്തിനു (surface tension) കാരണം. ദ്രാവകോപരിതലം ഗോളാകാരമായിരിക്കാനുള്ള പ്രവണതയ്ക്ക് ഗുരുത്വാകര്ഷണം, പാത്രത്തിന്റെ പ്രതലം ചെലുത്തുന്ന പ്രതിബലം എന്നിവമൂലം വ്യതിയാനം സംഭവിക്കുന്നു. കുഴല്രൂപമുള്ള ഒരു പാത്രത്തിലെടുത്തിരിക്കുന്ന ദ്രാവകം രണ്ടുവിധത്തില് പ്രവര്ത്തിക്കാം. ഒന്ന്, ദ്രാവകതന്മാത്രകള് തമ്മിലുള്ള ആകര്ഷണം ദ്രാവകതന്മാത്രയും പാത്രത്തിന്റെ തന്മാത്രയും തമ്മിലുള്ള ആകര്ഷണത്തെക്കാള് കുറവാണെങ്കില് ദ്രാവകം കുഴലുമായി സ്പര്ശത്തില് വരുന്ന ഭാഗം ഉയരുകയും ദ്രാവകപ്രതലം നതമധ്യരൂപം (concave meniscus) കൈക്കൊള്ളുകയും ചെയ്യുന്നു. ഉദാ. ഗ്ലാസ്ട്യൂബില് എടുത്ത ജലം. രണ്ട്, ദ്രാവകതന്മാത്രകള് തമ്മിലുള്ള ആകര്ഷണം ദ്രാവകതന്മാത്രയും പാത്രത്തിന്റെ തന്മാത്രയും തമ്മിലുള്ള ആകര്ഷണത്തെക്കാള് കൂടുതലാണെങ്കില് ദ്രാവകപ്രതലം ഉന്മധ്യരൂപം (convex meniscus) കൈക്കൊള്ളുന്നു. ഉദാ. ഗ്ലാസ്ട്യൂബില് എടുത്ത മെര്ക്കുറി.
ദ്രാവകത്തിന് ഒരു നിശ്ചിത വ്യാപ്തമുണ്ടെന്നു മാത്രമല്ല, ഈ വ്യാപ്തം സമ്മര്ദവിധേയമായി നാമമാത്രമായേ ചുരുങ്ങുകയുമുള്ളൂ. ഒരു അടഞ്ഞ പാത്രത്തിനുള്ളില് ദ്രാവകത്തില് ഒരിടത്തു പ്രയോഗിക്കുന്ന മര്ദം മൊത്തം ദ്രാവകത്തിലും തുല്യമായി അനുഭവപ്പെടുമെന്ന് 17-ാം ശ.-ത്തില് പാസ്കല് കണ്ടെത്തി. ദ്രാവകങ്ങളുടെ ഹൈഡ്രോളിക് ഉപയോഗങ്ങള്ക്കു നിദാനം പാസ്കല് നിയമം എന്നറിയപ്പെടുന്ന ഈ ഗുണമാണ്. ദ്രാവകത്തിന്റെ ശ്യാനതയും വിക്ഷുബ്ധതയും ഒഴുക്കിന്റെ നിരക്കും സ്ഥിരമായ സമ്മര്ദബലവും കണക്കിലെടുത്തുമാത്രമേ ദ്രാവകത്തിന്റെ യാന്ത്രിക ഗുണധര്മങ്ങള് വിശദീകരിക്കാനാവൂ.
ദ്രാവകങ്ങളെ ഘനീകൃത വാതകങ്ങളായും ദ്രവീകൃത ഖരങ്ങളായും കണക്കാക്കാം. ഏതു വാതകവും തണുപ്പിച്ച് ദ്രവീകരിക്കാനാവും എന്ന് ഇംഗ്ലീഷ് ഭൗതികശാസ്ത്രജ്ഞനായ മൈക്കല് ഫാരഡേ കണ്ടെത്തി (1820). ഒരു നിശ്ചിത താപനില(critical temperature)യ്ക്കു മുകളില് ദ്രാവകത്തെ അതിന്റെ ബാഷ്പത്തില്നിന്ന് ഒരു പ്രതലംകൊണ്ട് വേര്തിരിക്കാന് സാധ്യമല്ലാതായിത്തീരുന്നു അഥവാ പ്രതലം അപ്രത്യക്ഷമാകുന്നു എന്ന് ഐറിഷ് ഭൗതികശാസ്ത്രജ്ഞനായ തോമസ് ആന്ഡ്രൂസ് ദ്രവ കാര്ബണ് ഡൈഓക്സൈഡില് നടത്തിയ പഠനങ്ങളിലൂടെ തെളിയിച്ചു. ഓരോ ദ്രാവകത്തിനും സവിശേഷമായ ഈ താപനിലയ്ക്കു മുകളില് ദ്രാവകത്തിന്റെയും വാതകത്തിന്റെയും ഗുണധര്മങ്ങള് സമ്മേളിക്കുന്ന ഒരു പ്രത്യേക അവസ്ഥാവിശേഷമാണ് അതിക്രാന്തിക ദ്രാവകാവസ്ഥ (super critical liquid). തന്മാത്രാബലങ്ങളുടെ അടിസ്ഥാനത്തില് ഇത്തരം ഒരു അവസ്ഥയെക്കുറിച്ച് ഡച്ച് ഭൗതിക ശാസ്ത്രജ്ഞനായ വാന്ഡര് വാള്സ് സൈദ്ധാന്തികമായി പ്രവചിച്ചിരുന്നു (1873). ദ്രവണാങ്കത്തിനടുത്തുള്ള താപനിലകളില് സാന്ദ്രതയും അനുബന്ധ ഗുണങ്ങളും ഖരത്തിനു സമാനമായിരിക്കും. 20-ാം ശ.-ത്തില് നടത്തിയ എക്സ് റേ വിഭംഗന പരീക്ഷണങ്ങളില്നിന്ന് പരല്ഘടനയുള്ള ഖരങ്ങളില് തന്മാത്രകളുടെ സ്ഥാനീയ വിന്യാസം കൃത്യമായി ആവര്ത്തിക്കപ്പെടുന്നുണ്ടെന്ന് കണ്ടെത്തുകയുണ്ടായി. എന്നാല് ദ്രാവകങ്ങളില് തന്മാത്രകളുടെ കൃത്യമായ ആവര്ത്തന സ്വഭാവം ഇല്ല എന്ന് എക്സ് റേ പഠനങ്ങള് തെളിയിച്ചു. കൂടാതെ അടുത്തടുത്തായി വിന്യസിക്കുമ്പോള് ദ്രാവകാവസ്ഥയില്, മിക്കപ്പോഴും കൂടുതല് ശൂന്യ സ്ഥലങ്ങളുണ്ടാകും. ഖരങ്ങള് ഉരുകുമ്പോള് വികസിക്കുകയും ദ്രാവകങ്ങള് ഉറയുമ്പോള് സങ്കോചിക്കുകയും ചെയ്യുന്നത് ഇക്കാരണത്താലാണ്. ഇതിനു വിരുദ്ധമായ സ്വഭാവം കാണിക്കുന്ന വളരെ അപൂര്വം ദ്രാവകങ്ങളില് ഒന്നാണ് ജലം.ബാഷ്പമര്ദം, പ്രതലബലം, ശ്യാനത എന്നിവയാണ് ദ്രാവകങ്ങളുടെ സവിശേഷ ഗുണങ്ങള്.
ബാഷ്പമര്ദം. ഒരു നിശ്ചിത താപനിലയില് ദ്രാവകവുമായി സമതുലിതാവസ്ഥയില് വര്ത്തിക്കുന്ന ബാഷ്പം ചെലുത്തുന്ന മര്ദത്തെയാണ് ബാഷ്പമര്ദം എന്നു പറയുന്നത്. ദ്രാവകത്തിന്റെ താപനില വര്ധിക്കുമ്പോള് ബാഷ്പമര്ദവും വര്ധിക്കുന്നു. ബാരോമീറ്റര്, ഐസോടെനിസ്കോപ്പ് എന്നീ ഉപകരണങ്ങള് ഉപയോഗിച്ചാണ് ബാഷ്പമര്ദം അളക്കുന്നത്.
പ്രതലബലം. ദ്രാവകത്തിനുള്ളിലെ ശക്തമായ അന്തര് തന്മാത്രാ ബലങ്ങള് ഉളവാക്കുന്ന ഒരു പ്രധാന സവിശേഷതയാണ് പ്രതലബലം. ഒരു ദ്രാവകത്തിനുള്ളിലെ ഓരോ തന്മാത്രയും ചുറ്റുമുള്ള തന്മാത്രകളാല് എല്ലാ ദിശകളിലേക്കും തുല്യമായ അളവില് ആകര്ഷിക്കപ്പെടുന്നു. എന്നാല് പ്രതലത്തിലെ തന്മാത്രകളെ സംബന്ധിച്ചിടത്തോളം മുകളിലേക്ക് ആകര്ഷണമില്ല. തന്മൂലം പ്രതലതന്മാത്രകള് അന്യോന്യാകര്ഷണത്താല് ഒരു റബ്ബര്സ്തരം പോലെ വലിഞ്ഞുനില്ക്കുന്നു. പ്രതലത്തില് തിരശ്ചീനമായി ഒരു മീറ്റര് നീളമുള്ള ഒരു രേഖ സങ്കല്പിച്ചാല് അതില് (ഇരുവശങ്ങളിലേക്കും തിരശ്ചീനമായി) അനുഭവപ്പെടുന്ന വലിവുബലമാണ് പ്രതലബലം എന്നു നിര്വചിക്കാം. സൂചകം T, ഏകകം ന്യൂട്ടണ്/മീറ്റര് (N/m). വലിവുബലത്തിന്റെ ഫലമായി പ്രതലത്തിലെ ഓരോ ചതുരശ്രമീറ്ററിലും സ്വരൂപിക്കപ്പെടുന്ന പൊട്ടന്ഷ്യല് ഊര്ജം (ജൂള്/മീറ്റര്2 ) ആയും പ്രതലബലത്തെ കരുതാം. അന്തര്തന്മാത്രാബന്ധങ്ങള് കൂടുമ്പോള് പ്രതലബലവും കൂടുന്നു. ജലത്തെ അപേക്ഷിച്ച് കാര്ബണിക ലായകങ്ങള്ക്ക് പ്രതലബലം കുറവായിരിക്കുന്നതിനു കാരണമിതാണ്. സ്റ്റാലഗ്മോമീറ്റര്, ടോര്ഷന് ബാലന്സ് എന്നീ ഉപകരണങ്ങളാണ് പ്രതലബലം അളക്കുവാന് ഉപയോഗിക്കുന്നത്.ശ്യാനത. അനുരൂപേണ വൈകൃതങ്ങളെ സ്ഥിരമായി ചെറുക്കുവാന് കഴിവില്ലാത്ത വസ്തു എന്നാണ് ദ്രാവകത്തെ നിര്വചിക്കാറുള്ളത്. എന്നാല് യഥാര്ഥ ദ്രാവകങ്ങളെ സംബന്ധിച്ചിടത്തോളം ഈ നിര്വചനം നിശ്ചലാവസ്ഥയില് മാത്രമേ ബാധകമാവുകയുള്ളൂ. ദ്രാവകത്തിന്റെ വിവിധ സ്തരങ്ങള് തമ്മില് ആപേക്ഷിക ചലനം ഉണ്ടാകുമ്പോള് ദ്രാവകത്തില് ഉളവാകുന്ന ഗണ്യമായ പ്രതിരോധ ബലം ആണ് ശ്യാനത അഥവാ ആന്തരിക ഘര്ഷണം. സാവധാനത്തില് ക്രമവും സ്ഥായിയുമായി പ്രവഹിക്കുന്ന ദ്രവത്തിന്റെ സ്തരങ്ങളെല്ലാം അന്യോന്യം സമാന്തരമായിരിക്കും. ഈ വിധത്തിലുള്ള പ്രവാഹത്തെ ധാരാരേഖീ പ്രവാഹം എന്നു പറയുന്നു. ന്യൂട്ടണ് ധാരാരേഖീ പ്രവാഹത്തെ സംബന്ധിച്ച് ആവിഷ്കരിച്ച നിയമ പ്രകാരം രണ്ട് സമാന്തര സ്തരങ്ങള് തമ്മിലുള്ള സ്പര്ശരേഖീയ ബലം അവ തമ്മിലുള്ള പ്രവേഗ പ്രവണതയ്ക്കും അവയ്ക്ക് പൊതുവായ വിസ്തീര്ണത്തിനും ആനുപാതികമായിരിക്കും. സ്പര്ശരേഖീയ ബലം f-ഉം പ്രവേഗ വ്യതിയാന നിരക്ക് dv/dx -ഉം ആണെങ്കില് f=ηAdv/dx ആയിരിക്കും. η ശ്യാനതാഗുണാങ്കം (coefficient of viscosity) എന്നറിയപ്പെടുന്നു.
പ്രവാഹപ്രവേഗം ഒരു ക്ലിപ്തമൂല്യംവരെ ആയിരിക്കുന്നിടത്തോളം മാത്രമേ പ്രവാഹം സ്തരീയമായിരിക്കുകയുള്ളൂ. പ്രവേഗം കൂടുന്നതോടെ പ്രവാഹം അനിയതമായിത്തീര്ന്ന് വിവിധ സ്തരങ്ങളിലെ ദ്രാവകങ്ങള് തമ്മില് കൂടിക്കലര്ന്നൊഴുകും. ഈ ക്ലിപ്ത വേഗത്തെ ക്രാന്തിക പ്രവേഗം എന്നു പറയുന്നു. ക്രാന്തികപ്രവേഗത്തിലും താഴെ പ്രവേഗമുള്ള പ്രവാഹത്തില് മാത്രമേ ശ്യാനതാ ബലങ്ങള് പ്രവര്ത്തിക്കുകയുള്ളൂ.
ഒരു ട്യൂബില്ക്കൂടി ഒഴുകുന്ന ദ്രാവകത്തിന്റെ പ്രവാഹനിരക്ക് പോയിസ്സെലി സമവാക്യംകൊണ്ടാണ് വ്യക്തമാക്കുന്നത്.
v വ്യാപ്തം ദ്രാവകം t സമയംകൊണ്ട് r ആരവും l നീളവും ഉള്ള ഒരു ട്യൂബിലൂടെ p മര്ദത്തിനു വിധേയമായി ഒഴുകിയാല് ദ്രാവകത്തിന്റെ ശ്യാനതാഗുണാങ്കം ഈ സമവാക്യത്തിലൂടെ ലഭിക്കുന്നു. ദ്രാവകങ്ങളുടെ ശ്യാനത അളക്കുന്നത് ഓസ്വാള്ഡ് വിസ്കോമീറ്റര് ഉപയോഗിച്ചാണ്.
തുല്യവ്യാപ്തം ജലവും ശ്യാനത തിട്ടപ്പെടുത്തേണ്ട ദ്രാവകവും ഒരേ കാപ്പിലറിയിലൂടെ ഒഴുകുവാന് എടുക്കുന്ന സമയം യഥാക്രമം t1,t2കണ്ടെത്തിയാല് ആപേക്ഷിക സാന്ദ്രത
ഇന്നറിയപ്പെടുന്ന ആയിരക്കണക്കിനു വ്യത്യസ്ത ദ്രാവകങ്ങളെ മൂന്ന് വിഭാഗങ്ങളില് ഉള് പ്പെടുത്താം.
i. തന്മാത്രീയ ദ്രാവകങ്ങള് (Molecular liquids). ദ്രവാവസ്ഥയിലുള്ള കാര്ബണിക സംയുക്തങ്ങളും ദ്രവീകൃത വാതകങ്ങളും ദ്രവീകൃത പോളിമറുകളും ഉള് പ്പെടെ ഈ വിഭാഗത്തില് അനവധി ദ്രാവകങ്ങളുണ്ട്. തന്മാത്രീയ ദ്രാവകങ്ങളെക്കുറിച്ചുള്ള സൂക്ഷ്മ പഠനങ്ങള് 20-ാം ശ.-ത്തിലാണ് വികസിച്ചത്. ഇന്നും ഈ മേഖലയില് വ്യക്തമായി സ്ഥാപിക്കപ്പെടേണ്ടതായി പലതും അവശേഷിക്കുന്നു.
തന്മാത്രീയ ദ്രാവകങ്ങളില് തന്മാത്രകള് തമ്മിലുള്ള ബലങ്ങള് അത്ര ശക്തമല്ലാത്തതിനാല് ബാഷ്പീകരണംവഴി അവ വേര്പെടുത്തുവാന് എളുപ്പമാണ്. ഉരുകല് എന്ട്രോപ്പിയെ ആസ്പദമാക്കിയാല് ഈ വിഭാഗത്തില് മൂന്ന് ഉപവിഭാഗങ്ങള് ഉള്പ്പെടുന്നു. ഗോളാകൃതിയുള്ള തന്മാത്രകളുള്ള ദ്രാവകങ്ങളാണ് ആദ്യത്തെ വിഭാഗം. ഈ ദ്രാവകങ്ങളുടെ ഉറയല് നില സുനിശ്ചിതമല്ല, കുറെയധികം വ്യാപിച്ചുകിടക്കുന്നു. എന്നാല് എന്ട്രോപി വളരെ കുറവായിരിക്കും (≈3 cal/mol/oC). ഉരുകുമ്പോള് ഉണ്ടാകുന്ന അവ്യവസ്ഥ വളരെ പരിമിതമാണ് എന്നാണ് ഇതു കാണിക്കുന്നത്. തന്മാത്രകളുടെ സ്ഥാനത്തിനു മാത്രമേ മാറ്റം സംഭവിക്കുന്നുള്ളൂ. ഗോളാകൃതി കൈവരിക്കാന് കഴിയാത്ത വിധത്തില് വലുപ്പമുള്ള തന്മാത്രകളുള്ള ദ്രാവകങ്ങളാണ് രണ്ടാമത്തെ വിഭാഗം. സമീപ തന്മാത്രകള് പരസ്പരം ഞെരുങ്ങിയിരിക്കുന്നതിനാല് തന്മാത്രകളുടെ ഭ്രമണചലനം തടസ്സപ്പെടുന്നു. സമീപ തന്മാത്രകള്ക്ക് ആവശ്യത്തിനു സ്ഥലം ലഭിക്കുകയും എന്നാല് ഒരു പരിധിവരെ താപീയ ചലനം സാധ്യമാവുകയും ചെയ്യുന്ന വിധത്തിലായിരിക്കും ഈ ദ്രാവകങ്ങളില് തന്മാത്രകള് വിന്യസിക്കപ്പെട്ടിരിക്കുക. ഗോളീയ തന്മാത്രകളുള്ള ദ്രാവകങ്ങളെയപേക്ഷിച്ച് ഇവയുടെ ഉരുകല് എന്ട്രോപി കൂടുതലായിരിക്കും (3-12 cal/mol/oC). ആവശ്യാനുസരണം ആകൃതിമാറ്റം വരുത്താന് കഴിയുന്ന വിധത്തില് വഴക്കമുള്ള തന്മാത്രകളുള്ള (ഉദാ. ദ്രവ അപമാര്ജകങ്ങള്) ദ്രാവകങ്ങളാണ് മൂന്നാമത്തെ ഉപവിഭാഗത്തില് ഉള് പ്പെടുന്നത്. മറ്റ് ഉപവിഭാഗങ്ങളെ അപേക്ഷിച്ച് ഉയര്ന്ന എന്ട്രോപി പ്രദര്ശിപ്പിക്കുന്ന ദ്രാവകങ്ങളാണ് ഈ വിഭാഗത്തിലുള്ളത്.
ii. അയോണിക ദ്രാവകങ്ങള് (Ionic liquids). ക്രിസ്റ്റലീയ ലവണങ്ങള് ഉരുകിയുണ്ടാകുന്ന ദ്രാവകങ്ങള് ഈ വിഭാഗത്തില് പ്പെടുന്നു. അലൂമിനിയം, സോഡിയം തുടങ്ങിയ ലോഹങ്ങളുടെ വൈദ്യുത നിഷ്കര്ഷണം പോലുള്ള വ്യാവസായികാവശ്യങ്ങള്ക്ക് അയോണിക ദ്രാവകങ്ങള് പ്രയോജനപ്രദമാണ്. അയോണിക ദ്രാവകങ്ങള് തന്മാത്രീയ ദ്രാവകങ്ങളില്നിന്ന് വളരെ വ്യത്യസ്തമാണ്. തന്മാത്രകള്ക്കിടയിലുള്ളതിനെ അപേക്ഷിച്ച് വൈദ്യുത ചാര്ജുള്ള അയോണുകള് തമ്മില് കൂടുതല് ശക്തമായ ദീര്ഘദൂര ബന്ധങ്ങള് (Langrange correlation) ഉണ്ടാകുന്നതാണ് ഗുണധര്മങ്ങളിലുള്ള വ്യത്യാസങ്ങള്ക്കാധാരം. ശക്തമായ ഈ ബന്ധങ്ങള് അയോണുകള് തമ്മില് ചേര്ന്നിരിക്കുന്നതിനു സഹായിക്കുന്നു. തത്ഫലമായി ഇവയ്ക്ക് താരതമ്യേന കുറഞ്ഞ ബാഷ്പമര്ദവും ഉയര്ന്ന തിളനിലയും സവിശേഷമായ ലായക സ്വഭാവങ്ങളും ആയിരിക്കും ഉണ്ടാവുക.
iii. ഉരുകിയ ലോഹങ്ങള് (Molten metals). സാധാരണ ഊഷ്മാവില് ദ്രവാവസ്ഥയില് നിലകൊള്ളുന്ന മെര്ക്കുറി മാത്രമായിരുന്നു ദ്രവലോഹം എന്ന നിലയില് മുമ്പ് ഉപയോഗം കണ്ടെത്തിയിരുന്നത്. 20-ാം ശ.-ത്തോടെ അണുകേന്ദ്ര റിയാക്റ്ററുകളിലും മറ്റും താപവാഹികളായി പല ദ്രവീകൃത ലോഹങ്ങളും ഉപയോഗിച്ചുതുടങ്ങി. ദ്രവലോഹങ്ങളിലെ അണുക വിന്യാസം ഖരാവസ്ഥയിലുള്ള വിന്യാസത്തിന് തികച്ചും സമാനമാണ്. 3 cal/mol/oC ലും വളരെ താഴെയായിരിക്കും ഉരുകല് എന്ട്രോപി. അണുകങ്ങള് ഒന്നടങ്കം പൂര്ണമായി ചലിക്കാതെതന്നെ ദ്രവലോഹങ്ങള് വൈദ്യുത ചാലകത പ്രദര്ശിപ്പിക്കുന്നു എന്നത് ഒരു സവിശേഷതയാണ്. ഒരു പൊട്ടന്ഷ്യല് ഗ്രേഡിയന്റിനു വിധേയമാകുമ്പോള് സ്വതന്ത്ര ഇലക്ട്രോണുകള് ചലിക്കുന്നതുകൊണ്ടാണ് ഇത് സാധ്യമാകുന്നത്. എന്നാല് ഒരു പൊട്ടന്ഷ്യല് ഗ്രേഡിയന്റിനു വിധേയമാക്കുമ്പോള് അയോണുകള്ക്ക് ഉണ്ടാകുന്ന ചലനമാണ് അയോണിക ദ്രാവകങ്ങളുടെ ചാലകതയ്ക്കു നിദാനം.
iv. സവിശേഷ ദ്രാവകങ്ങള്. മേല്പറഞ്ഞ മൂന്നു വിഭാഗങ്ങളിലുമുള്ള ദ്രാവകങ്ങളുടേതില്നിന്നു വ്യത്യസ്തമായ ഗുണധര്മങ്ങള് പ്രദര്ശിപ്പിക്കുന്ന ഒരു ദ്രാവകമാണ് ജലം. ജലതന്മാത്രകള് സ്വതവേ ധ്രുവിതങ്ങള് (naturally polarised) ആണ്. തന്മൂലം താപനില ഉരുകല്നിലയിലേക്കു താഴുമ്പോള് ജലതന്മാത്രകളുടെ ധന-ഋണ അഗ്രങ്ങള് തമ്മിലുള്ള ആകര്ഷണഫലമായി അവ (ത്രിമാന) തന്മാത്രാചങ്ങലകള്ക്കു രൂപം നല്കുന്നു. ചങ്ങലകള്ക്കുള്ളില് ധാരാളം ശൂന്യസ്ഥലമുണ്ടായിരിക്കും. ദീര്ഘദൂരബന്ധവും ഉള്ളില് ശൂന്യസ്ഥലവുമുള്ള ഈ ഘടനയാണ് ഐസ് അഥവാ ഹിമം. താപനില ഉയരുമ്പോള്, തന്മാത്രകളുടെ ചലന ഫലമായി ഇത്തരം ചങ്ങലകള് ക്രമേണ അപ്രത്യക്ഷമാവുകയും തന്മാത്രകള് ശൂന്യസ്ഥലത്തേക്കു പ്രവേശിക്കുകയും ചെയ്യുന്നു. ഐസ് ഉരുകി വെള്ളമാകുമ്പോള് വ്യാപ്തം കുറയാന് ഇതാണു കാരണം. (മറ്റു മിക്ക ഖരവസ്തുക്കളും ഉരുകുമ്പോള് വ്യാപ്തം കൂടുകയാണു ചെയ്യാറ്). 4oC വരെ ഈവിധം വ്യാപ്തം കുറയുന്നു. 4oC-ല് ദീര്ഘദൂരബന്ധം പൂര്ണമായി നഷ്ടപ്പെടുന്നതിനാല് വ്യാപ്തം മിനിമം ആയിരിക്കും. വീണ്ടും ചൂടാക്കിയാല് ജലത്തിന്റെ വ്യാപ്തം കൂടാന് തുടങ്ങുന്നു. ആന്റിമണി, ഗാലിയം, ബിസ്മത്ത് എന്നിവയും ഉറയുമ്പോള് വികസിക്കുന്ന ലോഹദ്രാവകങ്ങള്ക്ക് ഉദാഹരണങ്ങളാണ്. ഉരുകിയ പൊട്ടാസിയം അസറ്റേറ്റും റുബീഡിയം നൈട്രേറ്റും സമാന സ്വഭാവം പ്രദര്ശിപ്പിക്കുന്ന അയോണിക ദ്രാവകങ്ങള്ക്ക് ഉദാഹരണങ്ങളാണ്.
ചില ദ്രാവകങ്ങള് ഗ്ലാസ്സുകള്ക്ക് മുന്നോടികളാണെന്ന് കരുതാം. കാരണം ഇതാണ്: ഉറയല്നിലയില് മിക്ക ദ്രാവകങ്ങളുടെയും തന്മാത്രകള്ക്ക് ചലനക്ഷമത കൂടുതലായിരിക്കും. എന്നാല് വീണ്ടും തണുപ്പിക്കുന്നതോടെ പരല് ലാറ്റിസിലെ കൃത്യമായ സ്ഥാനങ്ങളില് തന്മാത്രകള് സ്ഥാനമുറപ്പിക്കുന്നു. മറ്റു ചില ദ്രാവകങ്ങള്ക്ക് വളരെ സങ്കീര്ണമായ ഘടനയാകയാല് സ്ഥാനങ്ങളുടെ പുനര്വിന്യാസം എളുപ്പമല്ല. അതിനാല് ഉറയുമ്പോള് കൃത്യമായ പരല്ഘടന ഉണ്ടാകുന്നില്ല. ഫലം ഒരു 'ഗ്ലാസ്സ്' ആണ്. സ്വസ്ഥാനങ്ങളില്നിന്ന് തന്മാത്രകള്ക്ക് ചലിക്കുവാനുള്ള സ്വാതന്ത്ര്യം നഷ്ടമായ ദ്രാവകമാണ് ഗ്ലാസ്സ്. എന്നാല് കൃത്യമായ ലാറ്റിസ്ഘടന അവയ്ക്കുണ്ടാകില്ല.