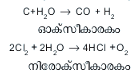This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ജലം
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
ഉള്ളടക്കം |
ജലം
ഭൂമിയല് ഏറ്റവും സുലഭവും സര്വസാധാരണവും സുപ്രധാനവുമായ ഒരു രാസസംയുക്തം. പ്രകൃതിയുടെ ഒരു വരദാനം.
ആമുഖം
ജലത്തിന്റെ അഭാവത്തില് ജീവന്റെ നിലനില്പുതന്നെ അസാധ്യമാണ്. ജീവന്റെ ഉത്പത്തി ജലത്തിലായിരുന്നു എന്ന് ഫോസില് പഠനങ്ങള് തെളിയിക്കുന്നു. ജലം ഇല്ലാത്ത ഒരു ഘന സെ.മീ. വായുവോ ഒരു ഗ്രാം മണ്ണോ ഭൂമുഖത്ത് ഇല്ല. ഭൂബാഹ്യപടലത്തിലൂടെ ഊറി ഇറങ്ങി ജലം പാറകളുടെയും പരലുകളുടെയും ഭാഗമായിത്തീരുന്നു. സകല ജീവകോശങ്ങളുടെയും അവിഭാജ്യഘടകമാണ് ജലം. ജൈവകോശങ്ങളിലെ പ്രോട്ടോപ്ലാസത്തിന് കടല്ജലത്തിനു സമാനമായ ഘടനയാണുള്ളത്. കരസസ്യങ്ങളുടെ 60 ശ.മാ.വും ജലസസ്യങ്ങളുടെ 95 ശ.മാ.വും മത്സ്യങ്ങളുടെ 80 ശ.മാ.വും മനുഷ്യന് ഉള്പ്പെടുന്ന കരജന്തുക്കളുടെ 60 ശ.മാ.വും ജലം ആണ്. ജലം മൂന്ന് അവസ്ഥയില് സ്ഥിതിചെയ്യുന്നു: ഖരം (ഹിമം-മഞ്ഞ്), ദ്രവം (ജലം), വായു (നീരാവി).
രാസഘടന
1781 വരെ ജലം പഞ്ചമൂലകങ്ങളിലൊന്നായിട്ടാണു കരുതപ്പെട്ടിരുന്നത്. ഹൈഡ്രജനും ഓക്സിജനും ചേര്ന്നുണ്ടാകുന്ന ഒരു രാസസംയുക്തമാണു ജലം എന്ന് ഹെന്റി കവന്ഡിഷ് (1781) തെളിയിച്ചു. ഹൈഡ്രജനും ഓക്സിജനും കലര്ന്ന ഒരു മിശ്രിതത്തില് വൈദ്യുതസ്ഫുലിംഗം കടത്തിവിടുമ്പോള് ഇരു വാതകങ്ങളും ചേര്ന്നു ജലകണങ്ങള് ഉണ്ടാകുമെന്ന് കണ്ടെത്തിയത് അദ്ദേഹമാണ്. ബ്രിട്ടീഷ് രസതന്ത്രജ്ഞരായ വില്യം നിക്കോള്സണും എ. കാര്ലിസ്സിയും വെള്ളത്തില് മുക്കിവച്ച രണ്ടു ലോഹക്കമ്പികളില്ക്കൂടി വൈദ്യുതി കടത്തിവിട്ടപ്പോള് കമ്പികളുടെ അറ്റങ്ങളില് വാതകക്കുമിളകള് ഉണ്ടാകുന്നതായി കണ്ടു (1800). ഇത് വൈദ്യുത വിശ്ലേഷണം വഴി ജലത്തിലെ മൂലകങ്ങളേതൊക്കെയെന്നു നിര്ണയിക്കുന്നതിന്റെ മുന്നോടിയായിരുന്നു. പിന്നീട് സര് ഹംഫ്രിഡേവി ജലത്തിന്റെ വൈദ്യുത വിശ്ലേഷണത്തിലൂടെ ഹൈഡ്രജനും ഓക്സിജനും വേര്തിരിച്ചു (1806). ലാവോസിയര് (1743-94) എന്ന ഫ്രഞ്ചു ശാസ്ത്രജ്ഞന് മറ്റൊരു പരീക്ഷണത്തിലൂടെ രണ്ടു വ്യാപ്തം ഹൈഡ്രജന് ഒരു വ്യാപ്തം ഓക്സിജനുമായി ചേരുമ്പോള് ജലമുണ്ടാകുമെന്നു കണ്ടെത്തി. 1860 വരെ ജലത്തിന്റെ ഫോര്മുല 'OH' എന്നായിരുന്നു. H2O എന്ന ഫോര്മുല ആവിഷ്കരിച്ചത് ഇറ്റാലിയന് രസതന്ത്രജ്ഞനായ കാനിസ്സാറോ (1826-1910) ആണ്.
2H2 + O2 → 2H2O
ഈ സമവാക്യത്തില് നിന്ന് ഹൈഡ്രജന്റെയും ഓക്സിജന്റെയും രാസയോഗാനുപാതം വ്യാപ്തപരമായി 2:1 ഉം ഘനപരമായി 1:8 ഉം ആണെന്നു കാണാം. കത്തുന്ന വാതകമായ ഹൈഡ്രജനും കത്തുന്നതിനെ സഹായിക്കുന്ന വാതകമായ ഓക്സിജനും സംയോജിപ്പിച്ചുണ്ടാകുന്ന ജലം കത്തുകയോ കത്താന് സഹായിക്കുകയോ ചെയ്യാത്തതും തീ കെടുത്താന് ഉപയോഗിക്കാവുന്നതുമായൊരു ദ്രാവകമാണ്. ജലത്തിന്റെ സവിശേഷതകള് അനവധിയാണ്. ജലം ഒരു നല്ല ലായകവും പല രാസപ്രവര്ത്തനങ്ങളുടെയും ഉള്പ്രേരകവും വൈദ്യുത താപരോധിയും ആണ്. ഖരാവസ്ഥയിലും ദ്രവാവസ്ഥയിലും ഉള്ള ജലത്തിന്റെ അസാധാരണഘടനും തന്മാത്രയുടെ ധ്രുവതയുമാണ് ജലത്തിന്റെ അദ്വിതീയ ഗുണങ്ങള്ക്കാധാരം.
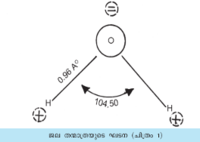
ജലതന്മാത്രയുടെ കോണീയഘടന താഴെ കാണിച്ചിരിക്കുന്നു. ഓരോ ഹൈഡ്രജന് ആറ്റവും ഓക്സിജനില് നിന്ന് ഏകദേശം ഒരു ആങ്സ്ട്രം മാത്ര (1Ao= 10-8സെ.മീ.) അകലെയാണ്. ഓക്സിജനും ഹൈഡ്രജനും തമ്മില് സഹസംയോജക ബോണ്ടുകള് വഴി ബന്ധിക്കപ്പെട്ടിരിക്കുന്നു. എന്നാല് ഈ സഹയംയോജക ബന്ധങ്ങളിലെ ഇലക്ട്രോണ് യുഗ്മങ്ങള് തുല്യമായിട്ടല്ല പങ്കുവയ്ക്കപ്പെട്ടിട്ടുള്ളത്. ഓക്സിജന്റെ ഉയര്ന്ന വിദ്യുത് ഋണതമൂലം ഇലക്ട്രോണുകള് ഓക്സിജനോട് കൂടുതല് അടുത്തിരിക്കുന്നു. അങ്ങനെ ഓക്സിജന് ഭാഗികമായ ഋണചാര്ജും ⊜ ഹൈഡ്രജന് ഭാഗികമായ ധനചാര്ജും ലഭിക്കുന്നു ⊕ ജലതന്മാത്രയുടെ കോണീയഘടനയും തന്മാത്രയുടെ ധ്രുവതയ്ക്കു കാരണമാകുന്നു.
ഖരാവസ്ഥ
ഖരാവസ്ഥ (മഞ്ഞുകട്ട-ഐസ്-ഹിമം). ഐസിന് എട്ടു പരല് രൂപങ്ങളുണ്ട്. I മുതല് VIII വരെയുള്ള റോമന് അക്കങ്ങള് കൊണ്ട് അവയെ നാമകരണം ചെയ്തിരിക്കുന്നു. സാധാരണ ഐസില് (ഐസ് I) ഹൈഡ്രജന് ബോണ്ടുകള് വഴി ബന്ധിക്കപ്പെട്ടിരിക്കുന്ന ജലതന്മാത്രകള്ക്കിടയില് ധാരാളം ശൂന്യസ്ഥലമുണ്ട് (ചിത്രം 1).
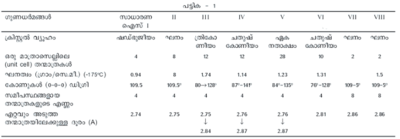
ദിഗ്ബന്ധങ്ങളായതുകൊണ്ട് പരല്ഘടന നിര്ണയിക്കുന്നതില് ഹൈഡ്രജന് ബോണ്ടുകള് പ്രധാന പങ്കുവഹിക്കുന്നു. ഇരുനൂറ് അറ്റ്മോസ്ഫിയറിലധികം മര്ദം ചെലുത്തിയാല് ഐസിന്റെ തന്മാത്രകള് തമ്മില് കൂടുതല് അടുത്ത് മറ്റു രൂപഘടനകളുണ്ടാകുന്നു. ഇപ്രകാരം വ്യത്യസ്ത പരല്ഘടനയുള്ള അഞ്ചുതരം ഐസ് ഉണ്ടാക്കിയിട്ടുണ്ട്. ഇവയെല്ലാംതന്നെ ജലത്തിനെക്കാള് ഘനമേറിയതാണ്. മര്ദം കുറയ്ക്കുമ്പോള് ഇവയെല്ലാം തിരികെ സാധാരണ ഐസിന്റെ ചതുഷ്ഫലകീയഘടന (tetrahedral) പ്രാപിക്കുന്നു (ചിത്രം 2). ചിത്രത്തില് കാണുന്നതുപോലെ ഓരോ ജലതന്മാത്രയിലെയും ഓക്സിജന് ആറ്റം മറ്റ് നാല് തന്മാത്രകളുടെ ഓക്സിജന് ആറ്റങ്ങളുമായി ഹൈഡ്രജന് ബോണ്ടുവഴി ബന്ധിക്കപ്പെട്ടിരിക്കുന്നു. അടുത്തടുത്ത ഓക്സിജന് ആറ്റങ്ങള് തമ്മില് 2.8Ao അകലം ഉണ്ട്. ഐസിന്റെ വിവിധ പരല്രൂപങ്ങളുടെ ചില ഗുണധര്മങ്ങള് പട്ടിക-1-ല് കൊടുത്തിരിക്കുന്നു.
വാതകാവസ്ഥ
വാതകാവസ്ഥ (നീരാവി). വാതകാവസ്ഥയില് ജലതന്മാത്രകള് ഏതാണ്ടു സ്വതന്ത്രമായി ചലിച്ചുകൊണ്ടിരിക്കുന്നു. അതിനാല് തന്മാത്രകള് തമ്മിലുള്ള ആകര്ഷണം വളരെ കുറവാണ്. നീരാവിയില് തന്മാത്രകള് ഏറിയപങ്കും ഒറ്റകളായും ചെറിയതോതില് ഇരട്ടകളായോ ഏറിയാല് മൂന്നു തന്മാത്രകള് ചേര്ന്നോ ആണു സ്ഥിതി ചെയ്യുന്നത്.
ദ്രവാവസ്ഥ
തന്മാത്രാവിന്യാസം ഖരാവസ്ഥയ്ക്കും വാതകാവസ്ഥയ്ക്കും ഇടയിലാണ്. ദ്രവാവസ്ഥയില് ജലതന്മാത്രകള് കൂട്ടം കൂട്ടമായി സ്ഥിതിചെയ്യുന്നു. (H2O)n എന്ന് അതിനെ പ്രതിനിധാനം ചെയ്യുന്നു. 'n' എകദേശം 40 വരെ ആകാം.
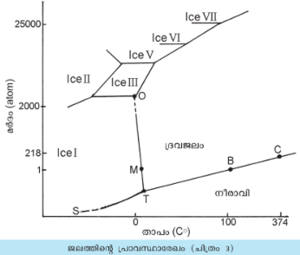
പ്രാവസ്ഥാരേഖം (Phase diagram). ജലത്തിന്റെ പ്രാവസ്ഥാരേഖം ജലത്തിന്റെ ഓരോ അവസ്ഥയും നിലനില്ക്കുന്ന താപ-മര്ദപരിസ്ഥിതികളെ കാണിക്കുന്നു (ചിത്രം 3). താഴ്ന്ന ഊഷ്മാവിലും മിതമര്ദത്തിലുമാണ് സാധാരണ ഐസ് (ഐസ് I) സ്ഥിതിചെയ്യുന്നത്. കുറഞ്ഞ മര്ദത്തിലും ഉയര്ന്ന ഊഷ്മാവിലും ജലം നീരാവിയായിത്തീരുന്നു. ഐസ് ക-നും നീരാവിക്കും ഇടയിലുള്ള ഊഷ്മാവിലും മര്ദത്തിലും ജലം ദ്രവാവസ്ഥയില് സ്ഥിതിചെയ്യുന്നു. 2000 അറ്റ്മോസ്ഫിയറിന് (atoms) മുകളിലുള്ള മര്ദത്തില് മാത്രമേ ഐസിന്റെ മറ്റു പരല് രൂപങ്ങള്ക്കു നിലനില്പുള്ളു.
'B' ബിന്ദു അതായത് 100oC ഊഷ്മാവും 1 atm മര്ദവും ചേരുന്ന ബിന്ദുവാണ് ജലത്തിന്റെ തിളനില. ഐസ് I-ന്റെ ഉരുകല് നിലയാണ് 'M' ബിന്ദു (0.000oC, 1 atm). ജലത്തിന്റെ ക്രാന്തികബിന്ദുവാണ് 'C' പ്രതിനിധാനം ചെയ്യുന്നത്. എത്ര കൂടിയ മര്ദം പ്രയോഗിച്ചാലും ഐസിനെ ദ്രവമാക്കാന് കഴിയുന്ന ഏറ്റവും ഉയര്ന്ന ഊഷ്മാവാണിത് (374oC 218.2 atm). എത്ര മര്ദം പ്രയോഗിച്ചാലും ഇതിലും ഉയര്ന്ന ഊഷ്മാവില് ഐസിനെ ദ്രവീകരിക്കാന് കഴിയില്ല.
ജലത്തിന്റെ മൂന്ന് അവസ്ഥകളും (ഖര-ദ്രവ-നീരാവി) ഒന്നിച്ച് സന്തുലനാവസ്ഥയില് സ്ഥിതിചെയ്യുന്ന അവസ്ഥയെയാണ് 'T' ബിന്ദു പ്രതിനിധാനം ചെയ്യുന്നത് (0.01oC, 0.006 atm). ഈ ബിന്ദുവിനെ ത്രികബിന്ദു (triple point) എന്നു പറയുന്നു. മറ്റു ത്രികബിന്ദുക്കളും ഉണ്ട്. 'O' ബിന്ദുവില് (22.0oC, 2045 atm) ഐസ് I, ഐസ് II, ദ്രവജലം ഇവ മൂന്നും സന്തുലിതാവസ്ഥയില് സ്ഥിതിചെയ്യുന്നു.
ജലത്തിന്റെ തിളരേഖയായ 'TC' കാണിക്കുന്നത് അന്തരീക്ഷമര്ദം കുറയുന്തോറും നിളനിലയും കുറയുന്നതായിട്ടാണ്. അതായത് 0.5 atm-ല് ജലം 81.7oC തിളയ്ക്കുന്നു. ഉത്പാതനവക്രം (Sublimation curve) 'TS' സാധാരണ ഐസ് ക നേരിട്ട് നീരാവിയാകുന്ന താപ-മര്ദ പരിതഃസ്ഥിതികള് കാണിക്കുന്നു.
ഭൗതിക ഗുണങ്ങള്.
ജലത്തിന്റെ ദ്രവാവസ്ഥയിലും ഖരാവസ്ഥയിലുമുള്ള പല സവിശേഷ ഭൗതികഗുണങ്ങള്ക്കും കാരണം ഹൈഡ്രജന് ബോണ്ടുകളാണ്.
ജലത്തിന്റെ ശ്യാനത, പ്രതലബലം, തിളനില, ഉരുകല്നില, ദ്രവണന-ബാഷ്പന ഊഷ്മാവ് എന്നിവയെല്ലാംതന്നെ വളരെ ഉയര്ന്നതാണ്. ഐസിന്റെ ഘനത്വം വെള്ളത്തിന്റെതിനെക്കാള് കുറവാണ്. ഹൈഡ്രജന് ബോണ്ടുകള്മൂലം ഐസിനുണ്ടാകുന്ന ശൂന്യഘടനയാണ് ഇതിനു കാരണം. ഐസ് ഉരുകുമ്പോള് ഹൈഡ്രജന് ബോണ്ടുകള് തകരുകയും ജലതന്മാത്രകള് തമ്മില് കൂടുതല് അടുക്കുകയും ചെയ്യുന്നതുകൊണ്ട് ഘനത്വം വര്ധിക്കുന്നു. മറ്റു വസ്തുക്കളില് നിന്നു വ്യത്യസ്തമായി ജലത്തിനും പരമാവധി ഘനത്വമുള്ളത് 4oC-ലാണ്. ഐസിന്റെ ഘനത്വം വെള്ളത്തിന്റെതിനെക്കാള് കുറവാകയാല് ഐസ്കട്ട വെള്ളത്തില് പൊന്തിക്കിടക്കുന്നു. കടല്ജലം തണുക്കുമ്പോള് ഘനത്വം വര്ധിക്കുകയും തണുക്കുന്ന ജലമത്രയും താഴേക്കു നീങ്ങുകയും ചെയ്യും. എന്നാല് ഈ പ്രക്രിയ തുടരുന്നത് താപനില 4oC എത്തുന്നതുവരെ മാത്രമാണ്. ഈ താപനിലയില് ജലത്തിന്റെ ഘനത്വം പരമാവധി ഉയര്ന്നിരിക്കുന്നതിനാല് ജലാന്തര്ഭാഗം 4oC-ലധികം തണുക്കുകയില്ല. ഉപരിതലം തണുത്ത് ഐസായി മാറുമ്പോഴും അടിഭാഗത്തെ ജലം ദ്രവരൂപത്തില് തന്നെ ഇരിക്കുന്നു. ഈ പ്രത്യേകസ്വഭാവം ജലത്തിനുള്ളതു കാരണമാണ് ശീതകാലത്ത് കടലിന്റെ അടിഭാഗം കട്ടിയാകുകയോ മത്സ്യസമ്പത്ത് നശിച്ചുപോകുകയോ ചെയ്യാത്തത്. ജലത്തിന്റെ അസംഗത വികാസം (anomalous expansion of water) എന്നു വിളിക്കാവുന്ന ഈ സവിശേഷത ശൈത്യകാലത്തെ അതിജീവിക്കാന് ജലജീവികള്ക്കു പ്രകൃതി നല്കിയ വരമായി കണക്കാക്കാം.
ജലത്തിന് ശാസ്ത്രദൃഷ്ട്യാ മറ്റൊരു സവിശേഷതയുള്ളത് അതിന്റെ ഉയര്ന്ന താപപരിധിയാണ്. ഒരു ചെമ്പുകഷണം ചൂടാക്കാന് അഞ്ചുനിമിഷം വേണമെങ്കില് അതേ തൂക്കമുള്ള വെള്ളം അത്രതന്നെ ചൂടാക്കാന് അമ്പതു നിമിഷം വേണ്ടിവരും. ഒരു ഗ്രാം വെള്ളത്തെ ഒരു ഡിഗ്രി ചൂടാക്കാന് വേണ്ട ഊഷ്മാവ് ഒരു ഗ്രാം ഇരുമ്പ് ചൂടാക്കാന് വേണ്ടതിന്റെ ഒന്പതിരട്ടിയും, ഒരു ഗ്രാം മെര്ക്കുറി ചൂടാക്കാന് വേണ്ടതിന്റെ മുപ്പതിരട്ടിയുമാണ്. ജലം സാവധാനം ചൂടാകുന്നു. ചൂടായിക്കഴിഞ്ഞാല് വളരെ സാവധാനത്തില് മാത്രമേ തണുക്കുകയുള്ളു. ജലത്തിന്റെ ഈ ഉയര്ന്ന താപധാരിതയാണ് ഭൂമുഖത്തെ പല കാലാവസ്ഥാ സവിശേഷതകള്ക്കും കാരണം. പകല് സമയത്ത് സൂര്യതാപത്തില് നിന്നു ലഭിക്കുന്ന ചൂട് കടല്ജലം സൂക്ഷിച്ചു വയ്ക്കുക കാരണം രാത്രിയില് കര പെട്ടെന്ന് തണുത്താലും കടല്ജലം ചൂടാറാതെ അധികസമയം വര്ത്തിക്കുന്നു. അതുപോലെ പകല് സമയത്ത് ജലം ചൂടാകാന് കരപ്രദേശത്തെ അപേക്ഷിച്ച് കൂടുതല് സമയം എടുക്കുന്നു. കാലാവസ്ഥയെ ക്രമീകരിക്കുന്നതില് കടല്ജലത്തിനുള്ള കഴിവിനാസ്പദം ജലത്തിന്റെ ഉയര്ന്ന താപധാരിതയാണ്. പകല്സമയത്ത് കടല്ക്കാറ്റും രാത്രിസമയത്ത് കരക്കാറ്റും ഉണ്ടാകുന്നതും ഇക്കാരണത്താലാണ്. ഉഷ്ണമേഖലാ പ്രദേശങ്ങളിലെ കടല്ജലം സൂര്യതാപത്താല് ചൂടാകുന്നു. അവിടെ രൂപംകൊള്ളുന്ന കടല്ജലപ്രവാഹങ്ങള് (ocean currents) തണുത്ത ധ്രുവപ്രദേശങ്ങളിലേക്ക് പ്രവഹിക്കുന്നതിന്റെ ഫലമായി ധ്രുവപ്രദേശങ്ങളിലെ ഊഷ്മാവ് സാരമായി വര്ധിക്കുന്നു.
ജലത്തിന്റെ മറ്റൊരു സവിശേഷത അതിന്റെ പ്രതലബലമാണ് (surface tension). ജലത്തിന്റെ പ്രതലം സങ്കോചിച്ച് ഏറ്റവും കുറഞ്ഞ വിസ്താരമാര്ജിക്കുന്ന പ്രതിഭാസത്തെയാണ് 'പ്രതലബലം' എന്ന സംജ്ഞകൊണ്ട് വിവക്ഷിക്കുന്നത്. ജലത്തിലെ ഓരോ തന്മാത്രയും മറ്റു തന്മാത്രകളാല് ആവൃതമാണ്. എല്ലാ തന്മാത്രയും പരസ്പരം ആകര്ഷിക്കുന്നു. അതിനാല് ഫലത്തില് ആകര്ഷണശക്തികള് പരസ്പരം ഖണ്ഡിച്ചുപോകുന്നു. എന്നാല് ജലത്തിന്റെ ഉപരിതലത്തിലെ തന്മാത്രകള്ക്കു മുകളില് മറ്റു ജലതന്മാത്രകളില്ലാത്തതിനാല് ഈ തന്മാത്രകള് താഴേക്ക് ആകര്ഷിക്കപ്പെടുന്നു. ഈ താഴേക്കുള്ള ആകര്ഷണം ആണ് പ്രതലബലം ഉണ്ടാക്കുന്നത്. ജലോപരിതലത്തില് ചെറുപ്രാണികള്ക്കു നടക്കാന് കഴിയുന്നതും ജലത്തില് സൂചി പൊങ്ങിക്കിടക്കുന്നതും മറ്റും പ്രതലബലം മൂലമാണ്. നനഞ്ഞ മണലില് കാലടി വയ്ക്കുമ്പോള് മണലിനു സാരമായ സ്ഥാനഭ്രംശം സംഭവിക്കുന്നില്ല; നേരെ മറിച്ച് നനയാത്ത മണലില് കാല് പുതയും. ജലത്തിന്റെ പ്രതലബലത്താല് നനഞ്ഞ മണല്ത്തരികള് ദൃഢബദ്ധമായി നില്ക്കും. തന്നിമിത്തം കാലടി പുതയുകയില്ല. സോപ്പുജലത്തിലെ പ്രതലബല വ്യത്യാസംമൂലം അഴുക്കും മെഴുക്കും ചിന്നിച്ചിതറുന്നു. സോപ്പുകൊണ്ട് അഴുക്ക് നീക്കുന്നതിന്റെ ശാസ്ത്രവശം ഇതാണ്. കടല് ക്ഷോഭിക്കുമ്പോള് ശാന്തമാക്കാന് എണ്ണ ഒഴിക്കാറുണ്ട്. എണ്ണ വീഴുന്നിടത്ത് പ്രതലബലം പെട്ടെന്നു കുറയുക കാരണം, അലകളായി ഉയരുന്ന ജലം നാലുഭാഗത്തേക്കും ചിന്നിച്ചിതറി പോകുന്നു. ഒരു നേര്ത്ത സ്ഫടികക്കുഴല് വെള്ളത്തില് മുക്കുമ്പോള് വെള്ളം കുഴലിലൂടെ അല്പദൂരം മുകളിലോട്ട് ഉയരുന്നു. വെള്ളം ഒരിക്കലും മുകളിലേക്ക് ഒഴുകുന്നില്ല എന്ന പൊതു തത്ത്വത്തിന് അപവാദമാണിത്. ജലതന്മാത്രയും ഗ്ളാസിന്റെ പ്രതലവുമായുള്ള ആകര്ഷണം ജലതന്മാത്രകള് തമ്മിലുള്ള ആകര്ഷണത്തെക്കാള് കൂടുതലായതുമൂലമാണിത് സംഭവിക്കുന്നത്. ഈ പ്രതിഭാസത്തെ കാപ്പിലാരിറ്റി (capilarity) എന്നു പറയുന്നു.
ജലത്തിന്റെ ഏറ്റവും പ്രധാന സവിശേഷത, മറ്റ് പദാര്ഥങ്ങളെ ലയിപ്പിച്ച്, ലായനിയാക്കാനുള്ള കഴിവാണ്. ജലം ഒരു സാര്വത്രിക ലായകമായി (universal solvent) അറിയപ്പെടുന്നു. അയോണിക് ബോണ്ടുള്ള മിക്ക തന്മാത്രകളെയും ജലത്തിന് ലയിപ്പിക്കാന് സാധിക്കുന്നത് ജലത്തിന്റെ ഉയര്ന്ന ഡൈ ഇലക്ട്രിക് സ്ഥിരാങ്കം (78.3, 25oC-ല്) മൂലമാണ്. ഇതിനാല് ലീനവസ്തുവിന്റെ കാറ്റയോണും ആനയോണും തമ്മിലുള്ള ആകര്ഷണശക്തി വളരെ കുറയുന്നു.
താപ ഗുണങ്ങള്.
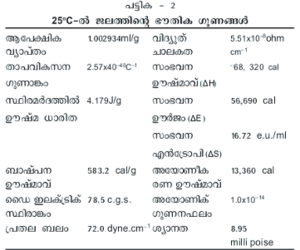
ഒരു ഗ്രാം ജലത്തിന്റെ ഊഷ്മാവ് 1oC (14.5→ 15.5oC) ഉയര്ത്താന് ആവശ്യമായ താപ പരിണാമത്തെയാണ് ഒരു കലോറി എന്നു പറയുന്നത്. ജലത്തിന്റെ ആപേക്ഷികതാപം 1.0 cal.g –1 K –1 ആണ്. ജലം ഖരരൂപത്തില് നിന്ന് ദ്രവരൂപത്തിലേക്ക് മാറുമ്പോള് താപം ആഗിരണം ചെയ്യുന്നു. 0<sp>o</sup>C-ല് ഐസിന്റെ സംലയന ഊഷ്മാവ് (heat of fusion) 80 cals.g –1 ഉം 100oC-ല് ബാഷ്പന ഊഷ്മാവ് (heat of vaporisation) 540 cals.g –1 ഉം ആണ്.
വൈദ്യുത വാഹക ഗുണങ്ങള്.
ശുദ്ധജലം ഒരു നല്ല വിദ്യുത് ചാലകമല്ല. ജലത്തിന്റെ അയോണീകരണം വളരെകുറഞ്ഞ അളവിലായതാണിതിനു കാരണം. എന്നാല് ജലം അയോണീകതന്മാത്രകളെ ലയിപ്പിച്ച് അവയെ അയോണുകളായി വിഘടിപ്പിക്കുന്നു. ഇപ്രകാരം അയോണുകളുടെ സാന്ദ്രത വര്ധിക്കുമ്പോള് വിദ്യുത്ചാലകതയും വര്ധിക്കുന്നു.
ജലം എന്ന പ്രമാണമാത്ര
ഭൗതികത്തിലെ പല യൂണിറ്റുകളും നിര്വചിക്കപ്പെടുന്നത് ജലത്തെ പ്രമാണമാക്കിയാണ്. 4oC ചൂടില് ഒരു ക്യുബിക് സെ.മീ. ജലത്തിന്റെ ഭാരത്തെയാണ് ഒരു ഗ്രാം ആയി സ്വീകരിച്ചിരിക്കുന്നത്. ജലം ഉറച്ച് ഖരാവസ്ഥയിലാകുന്ന ഊഷ്മാവിനെ 0oC ആയും ജലം തിളച്ച് നീരാവിയാകുന്ന താപനിലയെ 100oC ആയും കണക്കാക്കുന്നു. ദ്രവങ്ങളുടെ ഘനത്വത്തെ പ്രസ്താവിക്കുന്നത് ജലത്തിന്റെ ഇത്ര മടങ്ങ് എന്ന നിലയിലാണ്. മണ്ണെണ്ണയുടെ ആപേക്ഷികഘനത്വം 0.8 എന്നു പറഞ്ഞാല് അതിനര്ഥം, തുല്യ അളവ് ജലവും മണ്ണെണ്ണയും തൂക്കി നോക്കിയാല് മണ്ണെണ്ണ വെള്ളത്തിന്റെ 80 ശ.മാ. തൂക്കം മാത്രമേ കാണിക്കുകയുള്ളു എന്നാണ്.
രാസഗുണങ്ങള്
ജലം താരതമ്യേന ഉയര്ന്ന രാസസ്ഥിരതയുള്ളൊരു യൗഗികമാണ്. 2000oC-ല് ഒരു അറ്റ്മോസ്ഫിയര് മര്ദത്തില് ഏകദേശം 2 ശ.മാ. മാത്രമേ വിഘടനം സംഭവിക്കുന്നുള്ളൂ.
സ്വയം അയോണീകരണം
സ്വയം അയോണീകരണം (Auto ionization). ജലത്തിന് ഒരു ചെറിയ അളവില് സ്വയം അയോണീകരണം നടത്താനുള്ള ശേഷിയുണ്ട്.
ശുദ്ധജലത്തില് ഹൈഡ്രോണിയം അയോണ് (H3O+) ഹൈഡ്രേറ്റഡ്ഹൈഡ്രജന് അയോണ് [പ്രോട്ടോണ് (H+)], ഹൈഡ്രോക്സൈഡ് അയോണ് (OH–) എന്നിവ ഒരേ അളവില് ആണുള്ളത്. അതിനാല് ശുദ്ധജലം അമ്ലമോ (H3O+ അയോണ് അല്ലെങ്കില് H+ അയോണ് അധികമുള്ളത്) ക്ഷാരമോ (OH- അയോണ് അധികമുള്ളത്) അല്ല. 25oC-ല് 140 ദശലക്ഷം ജലതന്മാത്രയ്ക്കിടയില് ഒരു H3O+ അയോണും ഒരു OH - അയോണും മാത്രമാണുള്ളത്.
അമ്ല-ക്ഷാര പ്രതിപ്രവര്ത്തനങ്ങള്
അമ്ല-ക്ഷാര പ്രതിപ്രവര്ത്തനങ്ങള് (Acid-base reactions). ജലം ഒരു ഉഭയധര്മിയാണ് (amphoteric). പ്രോട്ടോണ് ദാതാവായ അമ്ലമായും പ്രോട്ടോണ് സ്വീകര്ത്താവായ ക്ഷാരമായും ജലം പ്രവര്ത്തിക്കുന്നു. ഉദാ. ഹൈഡ്രജന് ക്ലോറൈഡ് ജലത്തില് ലയിപ്പിക്കുമ്പോള് ജലം ക്ഷാരം ആയി പ്രവര്ത്തിക്കുന്നു.
HCl(g) + H2O(I) → H3O+ + Cl-
അമോണിയയുമായി പ്രതിപ്രവര്ത്തിക്കുമ്പോള് ജലം ഒരു അമ്ലം ആണ്.
ഉപചയ-അപചയ പ്രതിപ്രവര്ത്തനങ്ങള്
ഉപചയ-അപചയ പ്രതിപ്രവര്ത്തനങ്ങള് (Oxidation - reduction reactions). ജലം ഓക്സീകാരി(oxident)യായും നിരോക്സീകാരി (reductant)യായും പ്രവര്ത്തിക്കും.
പല ലോഹങ്ങളും അലോഹങ്ങളും ജലത്തിനാല് ഓക്സീകരിക്കപ്പെട്ട് അവയുടെ ഓക്സൈഡ് ഉണ്ടാവുന്നു. ഇരുമ്പ് തുരുമ്പിക്കുന്നത് ഈ രാസപ്രവര്ത്തനംമൂലമാണ്.
മറ്റു രാസപ്രവര്ത്തനങ്ങള്. ലോഹങ്ങളുടെ കാര്ബൈഡുകള് ജലവുമായി പ്രതിപ്രവര്ത്തിച്ച് ഹൈഡ്രോകാര്ബണുകള് ആകുന്നു.
Ca C2 + 2H2O → Ca(OH)2 + C2H2
ജൈവ എസ്റ്ററു(ഉദാ. കൊഴുപ്പ്)കളുടെ ജലവിശ്ലേഷണംമൂലം ആല്ക്കഹോളും അമ്ലവും ഉണ്ടാകുന്നു.
ജലകാഠിന്യം
ജലം രണ്ടു തരമുണ്ട്. കഠിനജലം (hard water), മൃദുജലം (soft water). സോപ്പ് പതയാത്തത് കഠിനജലം; പതയുന്നത് മൃദുജലം; കാത്സ്യം (Ca), മഗ്നീഷ്യം (Mg) എന്നീ ധാതുക്കളുടെ ലേയ ലവണങ്ങളായ ക്ലോറൈഡുകള്, സള്ഫേറ്റുകള്, ബൈകാര്ബണേറ്റുകള് എന്നിവ അലിഞ്ഞിരിക്കുന്നതാണ് ജലത്തിന്റെ കാഠിന്യത്തിനു കാരണം. കാത്സ്യം ബൈ കാര്ബണേറ്റ്മൂലമുണ്ടാകുന്ന കാഠിന്യം താത്കാലികമാണ്. കാരണം അത് തിളപ്പിച്ച് മാറ്റാവുന്നതാണ്. മറ്റു ലവണങ്ങളുടെ സാന്നിധ്യംമൂലമുണ്ടാകുന്ന കാഠിന്യം സ്ഥിരമാണ്. സോപ്പു ചേര്ക്കുമ്പോള് കഠിനജലത്തിലെ കാത്സ്യം-മഗ്നീഷ്യം അയോണുകള് സോപ്പിലെ ഫാറ്റി അമ്ലങ്ങളുമായി പ്രതിപ്രവര്ത്തിച്ച് തൈരുപോലെയുള്ള ലയിക്കാത്തൊരു മട്ടിയുണ്ടാവുന്നു. അത് തുണികളില് പറ്റിപ്പിടിച്ചിരിക്കും. നീക്കം ചെയ്യാന് ബുദ്ധിമുട്ടുമാണ്. ഒരു നിശ്ചിത വ്യാപ്തം ജലത്തില് അഞ്ചു നിമിഷനേരത്തേക്ക് തകര്ന്നു പോകാത്ത പതയുണ്ടാക്കാന് ആവശ്യമായ അടിസ്ഥാന സോപ്പു ലായനിയുടെ അളവാണ് കാഠിന്യത്തിന്റെ അളവുകോല്. കാസ്റ്റൈല് സോപ്പ് (ഒലിവെണ്ണ ചേര്ത്തുണ്ടാകുന്ന മേല്ത്തരം സോപ്പ്) ആല്ക്കഹോളില് ലയിപ്പിച്ചാണ് ഈ ലായനി ഉണ്ടാക്കുന്നത്.
ബോയ്ലറുകളിലും മറ്റും കഠിനജലം ഉപയോഗിച്ചാല് ബോയ്ലറിന്റെ ഉള്ഭാഗത്ത് ലവണങ്ങള് നിക്ഷേപിക്കപ്പെടാന് ഇടയുണ്ട്. ഈ നിക്ഷേപങ്ങള് താപരോധികളായതുകൊണ്ട് ഇന്ധനച്ചെലവ് വര്ധിക്കുക മാത്രമല്ല, ബോയ്ലറിന്റെ പുറംഭാഗം ക്രമാധികം ചൂടാവുക വഴി ബോയ്ലര് വളരെ പെട്ടെന്ന് പൊട്ടാനും ഇടയാകുന്നു.
ജലം മൃദൂകരിക്കുന്നതിനു പല മാര്ഗങ്ങളും ഇന്നുണ്ട്. ചുണ്ണാമ്പുവെള്ളം കഠിനജലത്തില് ചേര്ത്ത് താത്കാലിക കാഠിന്യം നീക്കം ചെയ്യുന്ന രീതിയെ 'ക്ലാര്ക് പ്രക്രിയ' എന്നു പറയുന്നു. അമോണിയ, ബോറാക്സ് (സോഡിയം മെറ്റാ ഫോസ്ഫേറ്റ്), അലക്കുകാരം (സോഡിയം കാര്ബണേറ്റ്) എന്നിവ ചേര്ത്ത് കാഠിന്യം നീക്കം ചെയ്യാന് കഴിയും. ഈ പ്രക്രിയയില് കാത്സ്യം അയോണുകളും കാത്സ്യം കാര്ബണേറ്റായും മഗ്നീഷ്യത്തെ മഗ്നീഷ്യം ഹൈഡ്രോക്സൈഡായും അവക്ഷേപിപ്പിക്കുന്നു. ബോയ്ലറുകളില് കഠിനജലം ഉപയോഗക്ഷമമാക്കാനായി സോഡിയം ഹെക്സാ മെറ്റാ ഫോസ്ഫേറ്റ് അഥവാ കാല്ഗണ് (Na2 [Na4 P6 O18]) ഉപയോഗിക്കുന്ന പ്രക്രിയയ്ക്ക് കാല്ഗണ് ഡിമിനറൈലേസേഷന് പ്രക്രിയ എന്നു പറയുന്നു. കാല്ഗണ് കാത്സ്യത്തെയും മഗ്നീഷ്യത്തെയും സങ്കര ലവണങ്ങളാക്കി മാറ്റുകയാണു ചെയ്യുന്നത്.
2Ca SO4 + Na2 [Na4 P6 O18] → 2 Na2 SO4 + Na2 [Ca2 P6O18]
2Mg CI2 + Na2 [Na4 P6 O18] → 4Na CI + Na2 [Mg2 P6 O18]
ജലത്തിന്റെ കാഠിന്യം മാറ്റാനുള്ള പെര്മ്യൂട്ടൈറ്റ് പ്രക്രിയയില് കഠിനജലത്തെ സഹജമോ കൃത്രിമമോ ആയ ഒരു സിയോളൈറ്റിലൂടെ (AI2 O3 . 10 Si O2; 10 Na2O) അരിക്കുന്നു. ജലത്തിലെ കാത്സ്യം, മഗ്നീഷ്യം, ഫെറസ് അയോണുകളെ സിയോളൈറ്റ്, സോഡിയം അയോണ്കൊണ്ട് പ്രതിസ്ഥാപിക്കുന്നു.
Ca Cl2 + 2NaP → 2 Na Cl + Ca P2 കാത്സ്യം പെര്മ്യൂട്ടൈറ്റ്
(P-പെര്മ്യൂട്ടൈറ്റ്)
Mg SO4 + 2Na P → Na2 SO4+ Mg P2 മഗ്നീഷ്യം പെര്മ്യൂട്ടൈറ്റ്
ഇങ്ങനെ നിഷ്ക്രിയമായിത്തീര്ന്ന സിയോളൈറ്റിനെ ഉപ്പിന്റെ ഒരു പൂരിത ലായനി ഉപയോഗിച്ചു വീണ്ടും പ്രവര്ത്തനക്ഷമമാക്കാം.
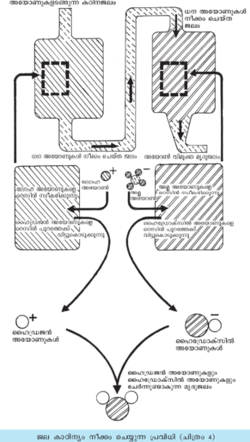
അയോണ് എക്സ്ചേഞ്ച് മുഖേനയും കാഠിന്യം ഉണ്ടാക്കുന്ന അയോണുകള് മാറ്റാന് കഴിയും (ചിത്രം 4). ഇതിനായി കഠിനജലം ആദ്യം ധന അയോണ് വിനിമയ റെസിന് (ഉദാ. പോളി ഹൈഡ്രോക്സി ഫീനോള് ഫോര്മാല്ഡിഹൈഡ് റെസിന്) അടങ്ങുന്ന കണികാമയമായ ഒരു മെത്തയിലൂടെ കടത്തിവിടുന്നു. അതിനുശേഷം ഋണ അയോണ് വിനിമയ റെസിന് (ഉദാ. അമീന് ഫോര്മാല്ഡിഹൈഡ്) മെത്തയിലൂടെ ഒഴുക്കിവിടുന്നു. ഫീനോള് ഫോര്മാല്ഡിഹൈഡ് ജലത്തിലെ ധനഅയോണുകളെ H+ അയോണ് കൊണ്ടു പ്രതിസ്ഥാപിക്കുന്നു. പിന്നീട് രണ്ടാം ഘട്ടത്തില് ഋണ അയോണ് വിനിമയ റെസിന് ജലത്തിലെ ഋണ അയോണുകളെ വലിച്ചെടുത്ത് OH- അയോണുകള് വിട്ടുകൊടുക്കുന്നു. ഇങ്ങനെ ജലത്തിലെത്തുന്ന H+, OH- എന്നീ അയോണുകള് സംയോജിച്ച് ജലതന്മാത്രകളാകുന്നു. ഈ പ്രക്രിയ വഴി ലഭിക്കുന്ന ജലം എല്ലാ അയോണുകളില് നിന്നും വിമുക്തമായിരിക്കും (Deionised water).
ഘനജലം
ശുദ്ധജലതടാകങ്ങളില് നിന്നും മറ്റും ലഭിക്കുന്ന ജലത്തില് ഹൈഡ്രജനും ഹൈഡ്രജന്റെ സമസ്ഥാനീയമായ ഡ്യൂട്ടീറിയവും 6900:1 എന്ന അനുപാതത്തിലാണ് ഉള്ളത്. വൈദ്യുതവിശ്ലേണം വഴി ജലത്തിലെ ഡ്യൂട്ടീറിയത്തിന്റെ അളവ് വര്ധിപ്പിക്കുന്നു. നൂറ് ഗ്യാലന് വെള്ളം ഒരു മി.ലി. ആകുന്നിടത്തോളം വൈദ്യുത വിഘടനം നടത്തിയാല് ശുദ്ധമായ ഘനജലം ലഭിക്കും. നോ. ഘനജലം
ജലവിശ്ലേഷണം
രാസപരവും ഭൗതികവും ജൈവപരവുമായ എല്ലാവിധ പരിശോധനകളും ഇതില് ഉള്പ്പെടുന്നു. ശുദ്ധമായ സ്വേദിതജലം (distilled water) മുതല് ഏറ്റവും മലിനമായ പാഴ്ജലം വരെ ഇത്തരം പരിശോധനകള്ക്കു വിധേയമാക്കാം. കുടിവെള്ളത്തില് രോഗാണുക്കളുടെയും മാരകമായ രാസപദാര്ഥങ്ങളുടെയും സാന്നിധ്യമാണ് പ്രധാനമായും പരിശോധിക്കുന്നത്. ജലത്തിന്റെ സ്വാദ്, നിറം എന്നിവയും പ്രധാന പരിശോധനാവിഷയങ്ങളാണ്. ജലവിശ്ലേഷണം സംബന്ധിച്ച് ദേശീയവും അന്തര്ദേശീയവുമായ പല നിയമങ്ങളും നിലവിലുണ്ട്. 1905-ലാണ് ആദ്യമായി ചില ജലവിശ്ലേഷണ വിധികള് പ്രമാണവത്കരിച്ചത്.
രാസപരിശോധന
ജലത്തിലടങ്ങിയിരിക്കുന്ന ധാതുക്കള്, ലവണങ്ങള്, അയോണുകള്, ജൈവവും നിര്ജീവവുമായ പദാര്ഥങ്ങള് എന്നിവയൊക്കെ രാസപരിശോധനയിലൂടെ നിര്ണയിക്കാം. അറ്റോമിക് അബ്സോര്പ്ഷന് സ്പെക്ട്രോഫോട്ടോമീറ്റര് (എ.എ.എസ്), ഗ്യാസ്-ലിക്വിഡ് ക്രൊമാറ്റോഗ്രാഫ് എന്നീ ഉപകരണങ്ങളാണ് രാസപരിശോധനയ്ക്ക് പ്രധാനമായും ഉപയോഗിക്കുന്നത്. എ.എ.എസ് ഉപയോഗിച്ച് മെര്ക്കുറി, അലൂമിനിയം, ലെഡ്, സിങ്ക്, ബെറിലിയം, കാഡ്മിയം, സില്വര് എന്നീ ലോഹങ്ങളുടെ അളവ് നിര്ണയിക്കാം. ക്ഷാരതയും അമ്ലതയും ടൈട്രേഷന് മുഖേന നിര്ണയിക്കാം. കളറിമെട്രി, പോളറോഗ്രാഫി, ആംപിയറോമെട്രി എന്നിവയാണ് മറ്റ് രാസപരിശോധനാമാര്ഗങ്ങള്.
ഭൗതിക വിശ്ലേഷണം
നിറം, രുചി, വൈദ്യുത ചാലകത, അലേയമായ അവശിഷ്ടങ്ങള് എന്നിവ പ്രമാണ മാര്ഗങ്ങള് ഉപയോഗിച്ചു നിര്ണയിക്കുന്നു.
ജൈവ വിശകലനം
ജലത്തിലടങ്ങിയിരിക്കുന്ന സൂക്ഷ്മാണുക്കളെ നിര്ണയിക്കുന്നത് സൂക്ഷ്മദര്ശിനി ഉപയോഗിച്ചാണ്. സൂക്ഷ്മജീവി വിജ്ഞാന പരിശോധനകള് മുഖേന ജലം ഉപയോഗപ്രദമാണോ എന്നു പരിശോധിക്കുന്നു. ഇങ്ങനെ കോളിഫോം ബാക്റ്റീരിയ, ഫീക്കല് കോളിഫോം ബാക്ടീരിയ, വൈറസുകള്, പകര്ച്ചവ്യാധികളുണ്ടാക്കുന്ന രോഗാണുക്കള് എന്നിവയുടെ സാന്നിധ്യം നിര്ണയിക്കാം.
ജലത്തിന്റെ ഗുണനിലവാരം
ജലത്തിന്റെ ഗുണനിലവാരം നിശ്ചയിക്കുന്ന മാനദണ്ഡങ്ങള് ദേശീയതലത്തിലും സംസ്ഥാനതലത്തിലും നിലവിലുണ്ട്. കുടിവെള്ളത്തിനും പാഴ്ജലത്തിനും പ്രത്യേകം പ്രത്യേകം മാനദണ്ഡങ്ങള് നിശ്ചയിക്കപ്പെട്ടിട്ടുണ്ട്. ബയോ കെമിക്കല് ഓക്സിജന് ഡിമാന്ഡ് (ബി.ഒ.ഡി.), നിലംബന പദാര്ഥങ്ങള്, എണ്ണ, ഗ്രീസ് എന്നിവയുടെ അളവാണ് പാഴ്ജലത്തിന്റെ നിലവാരം നിശ്ചയിക്കുന്നത്. കുടിവെള്ളത്തില് മാലിന്യങ്ങളുടെ പരമാവധി അളവ് (Maximum Contamination Level-MCL) നിശ്ചയിക്കുന്ന പല നിയന്ത്രണങ്ങളുമുണ്ട്. ഈ നിയന്ത്രണങ്ങള്ക്കനുസൃതമായ ജലത്തിന്റെ ഉപയോഗം രോഗബാധയ്ക്കുള്ള സാധ്യത കുറയ്ക്കുന്നു.
ഭൂമുഖത്തെ ജലസമ്പത്ത്
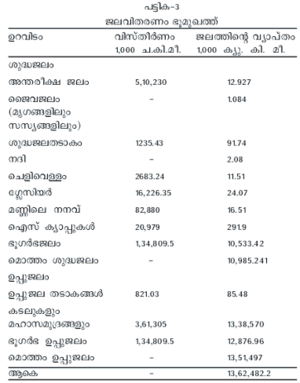
ഭൂമുഖത്താകമാനമുള്ള ജലസമ്പത്ത് അതിബൃഹത്താണ്. ഏകദേശം 350 x 1018 ഗാലന് (1.4 ആയിരം കോടി ക്യുബിക് കി.മീ.). നോ. പട്ടിക-3. 97 ശ.മാ.-ത്തിലധികം ജലനിക്ഷേപം കടലുകളിലെയും മഹാസമുദ്രങ്ങളിലെയും ഉപ്പുവെള്ളം ആണ്. 3 ശ.മാ. മാത്രമാണ് ശുദ്ധജലം. അതിന്റെ 70 ശ.മാ.-ത്തോളം അഭിഗമ്യമല്ലാത്ത ഐസ് ക്യാപ്പുകളായും ഗ്ലേസിയറുകളായും അന്റാര്ട്ടിക്ക മുതലായ പ്രദേശങ്ങളിലെ മഞ്ഞുപടലങ്ങളായും ആണ് സ്ഥിതിചെയ്യുന്നത്. ശുദ്ധജലത്തിന്റെ രണ്ടാമത്തെ ഏറ്റവും വലിയ ഉറവിടം ഭൂഗര്ഭജലസംഭരണികളാണ്. ഇത് ഏകദേശം 10.5 ദശലക്ഷം ക്യു.കി.മീ. വരും. തടാകങ്ങളിലെയും അരുവികളിലെയും ശുദ്ധജലത്തിന്റെ അളവ് താരതമ്യേന വളരെ കുറവാണ് (2,100 ക്യു. കി.മീ.). ജനജീവിതത്തിനും കൃഷിക്കും വ്യവസായത്തിനും ഏറ്റവും ലഭ്യമായ ജല-ഉറവിടം നദികളും അരുവികളും തന്നെയാണ്.
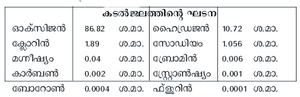
കടല്ജലം
ലേയലവണങ്ങളുടെ കലവറയാണ് കടല്ജലം. ലവണാംശത്തെ തിട്ടപ്പെടുത്തിയാണ് കടലിന്റെ പഴക്കം കണക്കാക്കുന്നത്. കടല്ജലത്തിന്റെ 3.5 ശ.മാ. സാധാരണ ഉപ്പാണ്. കടല്ജലത്തില് മനുഷ്യന് ആവശ്യമായ ക്ലോറിന്, ബ്രോമിന്, അയഡിന് എന്നിവ ധാരാളമായുണ്ട്. പായലുകളാണ് അയഡിന്റെ പ്രഭവസ്ഥാനം. കടല്പ്പായലുകള് ചുട്ടുകരിച്ച് വ്യാവസായികാടിസ്ഥാനത്തില് അയഡിന് ഉണ്ടാക്കുന്നു. കടല്സസ്യങ്ങള് നശിക്കുമ്പോള് അവയിലെ അയഡിന് അടിഭാഗത്തേക്ക് താഴ്ന്ന്, പാറകള്ക്കിടയില്പ്പെട്ടു കിടക്കും. ഭൂഗര്ഭജലത്തില് അയഡിന് അടങ്ങിയിട്ടുണ്ടെങ്കില് അതിനുകാരണം ഇങ്ങനെ അയഡിന് നിക്ഷേപിക്കപ്പെടുന്നതാണ്.
ശുദ്ധജലം
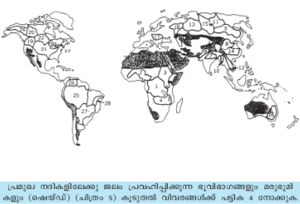
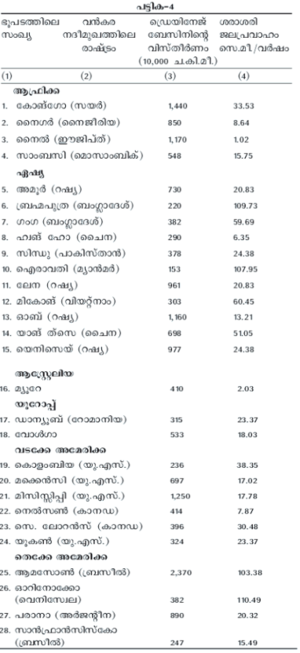
ലോകത്തിലെ പ്രമുഖ നദികളിലേക്കു ജലം പ്രവഹിപ്പിക്കുന്ന ഭൂവിഭാഗങ്ങള് (drainage basins), മരുഭൂമികള് എന്നിവ ഭൂപടത്തില് കാണിച്ചിരിക്കുന്നു. ഓരോ ഡ്രെയിനേജ് ബേസിനിലൂടെയും ഒഴുകുന്ന ജലവിഭവങ്ങളുടെ കണക്കും നദീമുഖത്തു ലഭ്യമാകുന്ന ജലത്തിന്റെ കണക്കും പട്ടിക-4-ല് കൊടുത്തിരിക്കുന്നു.
തെ. അമേരിക്കയിലെ ആമസോണ് നദിയിലാണ് ലോകത്തിലെ ഏറ്റവും വലിയ നദീജലസമ്പത്തുള്ളത്. ആ നദിയില് ഇന്ത്യയെക്കാള് നീളത്തില് കപ്പല് ഗതാഗതം സാധ്യമാകുന്നു. ഗംഗാനദിയുടെ ഗാംഭീര്യമുള്ള എട്ടു പോഷകനദികള് അതിനുണ്ട്. ഇത്രയധികം ശുദ്ധജലം ആമസോണ് നദി കടലില് നിക്ഷേപിക്കുന്നതു വഴി ഈ നദീമുഖത്തില് 320 കി.മീ. വിസ്താരത്തില് കടല്ജലത്തിന് ഉപ്പുരസമില്ലാതായിരിക്കുന്നു; 160 കി.മീ. ദൂരം കടല്ജലം കലങ്ങിയിരിക്കുകയും ചെയ്യുന്നു.
ഭൂഗര്ഭജലാശയങ്ങള്.
ഭൂഗര്ഭജലാശയങ്ങളിലാണ് ഏറ്റവും വിപുലമായ ശുദ്ധജലശേഖരമുള്ളത്. കിണര് മാര്ഗം ലഭ്യമാകുന്ന വിധത്തില് ഈ ശുദ്ധജലസംഭരണികള് ഭൂഗോളത്തിന്റെ എല്ലാ ഭാഗത്തുമുണ്ട്.
ജലഭൃതങ്ങള്
ജലഭൃതങ്ങള് (Aquifer). മണല്, ചരല്, സുഷിരങ്ങളുള്ള ചുണ്ണാമ്പുകല്ലുകളും കൃഷ്ണശിലകളും ഭൂഗര്ഭ ജലഭൃതങ്ങളായി വര്ത്തിക്കുന്നു. ഇത്തരം ജലഭൃതങ്ങള് സമര്ഥമായി ചൂഷണം ചെയ്താല് ഒരു നിമിഷത്തില് നൂറില്പ്പരം ഗാലന് എന്ന കണക്കിനു വെള്ളം ലഭ്യമാകും.
ജലപീഠങ്ങള്
ജലപീഠങ്ങള് (Water table). ഭൂഗര്ഭജലംകൊണ്ടു സാന്ദ്രമായിരിക്കുന്ന ഒരു മേഖലയുടെ ഉപരിതലത്തെ 'ജലപീഠം' എന്നു പറയുന്നു. സുഷിരങ്ങളില്ലാത്ത പാറകള്ക്കു മുകളിലായി കെട്ടിക്കിടക്കുന്ന ജലത്തിനെയും ജലപീഠം എന്നു പറയുന്നു. ഭൂഗര്ഭജലം അരുവികളിലേക്കു പ്രവഹിക്കുന്ന ജലപ്രവാഹത്തിനെ അടിയൊഴുക്ക് (base flow) എന്നു പറയുന്നു. അരുവികളില് 20 മുതല് 50 ശ.മാ. വരെ ജലത്തിന്റെ ഉറവിടം ഇത്തരം അടിയൊഴുക്കുകളാണ്. ദീര്ഘനാളത്തെ വരള്ച്ച ബാധിക്കുമ്പോള് അരുവികളിലേക്കുള്ള മുഖ്യ ഉറവ അടിയൊഴുക്കുകള് തന്നെയാകുന്നു. സമ്മര്ദിതാവസ്ഥയില് ഇരിക്കുന്ന ഭൂഗര്ഭജലാശയങ്ങളെ 'ആര്ടീഷ്യന് ജലം' (artesian water) എന്നു പറയുന്നു.
ജല ഉപഭോഗം
അരുവികള്, നദികള്, കിണറുകള് എന്നിവയില് നിന്നും ലഭിക്കുന്ന ജലത്തിന്റെ മൂന്നില് രണ്ടുഭാഗവും ജലസേചനാവശ്യങ്ങള്ക്കാണ് ഉപയോഗിക്കപ്പെടുന്നത്. ജലസേചനത്തിന് ഉപയോഗിക്കുന്ന ജലത്തിന്റെ 55 ശ.മാ. ബാഷ്പീകൃതമായി പോകുന്നു. ഈ 55 ശ.മാ. നേരിട്ട് അരുവികളിലേക്കും ജലഭൃതങ്ങളിലേക്കും തിരിച്ചുവരാത്തതിനാല് ഉപയോഗിച്ചു തീര്ന്നതായി കണക്കാക്കപ്പെടുന്നു. വ്യക്തിപരവും വ്യാവസായികവുമായി ഉപയോഗിക്കപ്പെടുന്ന ജലത്തിന്റെ ഭൂരിഭാഗവും വീണ്ടും ഉപയോഗത്തിനു ലഭ്യമാകുന്നു. വ്യാവസായിക-കാര്ഷിക പുരോഗതിയും നാഗരിക ജീവിതക്രമവുംമൂലം ജലത്തിന്റെ ഉപഭോഗം വളരെ വര്ധിച്ചിട്ടുണ്ട്.
ലോകത്താകമാനമുള്ള ശുദ്ധജലസമ്പത്ത് ഇനിയും ഏറെക്കാലം ജീവസന്ധാരണത്തിനാവശ്യമായതില് കൂടുതല് ഉണ്ടെങ്കിലും എല്ലാ സ്ഥലങ്ങളിലും എല്ലാ കാലങ്ങളിലും ജലവിതരണം സന്തുലിതമല്ലാത്തതിനാല് ചിലപ്പോള് ചിലയിടങ്ങളില് രൂക്ഷമായ ജലക്ഷാമം ഉണ്ടാകാറുണ്ട്. ആഫ്രിക്കന് വന്കരയിലെ ചില രാജ്യങ്ങളില് അനവരതമായ വരള്ച്ചയും ക്ഷാമവും അനുഭവപ്പെടുന്നുണ്ട്. ജലത്തിന്റെ ഉപഭോഗം ശരിയായി ക്രമീകരിച്ചാല് വരള്ച്ചകളും ക്ഷാമങ്ങളും ഒരു പരിധിയോളം തടയാനാകും.
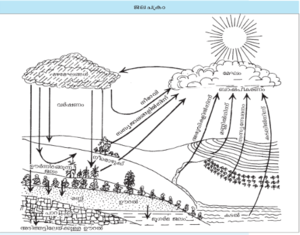
ജലചക്രം
ഭൂമിയിലെ ജലത്തിന്റെ അനുസ്യൂതമായ ചംക്രമണത്തെയാണ് ജലചക്രം എന്ന സംജ്ഞകൊണ്ടു വിശേഷിപ്പിക്കുന്നത്. അതായത് വെള്ളം → നീരാവി → മേഘം; തുഷാരം → മൂടല്മഞ്ഞ് → വെള്ളം എന്നീ ചാക്രികക്രമത്തില് വെള്ളം ചൂടുകൊണ്ടു നീരാവിയാകുന്നു; നീരാവി തണുത്ത് വീണ്ടും വെള്ളം ആകുന്നു. സൂര്യരശ്മികളാണ് ഈ ജലചക്രത്തിനാവശ്യമായ ഊര്ജം പ്രദാനം ചെയ്യുന്നത്. സൂര്യതാപം ഒരേ അളവിലല്ല ഭൂമിയുടെ പ്രതലത്തെ ചൂടാക്കുന്നത്. അതിനാല് വ്യത്യസ്ത ഊഷ്മാവിലും മര്ദത്തിലുമുള്ള വായുപ്രവാഹങ്ങള് രൂപംകൊള്ളുന്നു. ചൂടുള്ള വായു വന്കടലുകളില് നിന്ന് ഈര്പ്പം ആഗിരണം ചെയ്യുന്നു. ഈ വായു തണുക്കുമ്പോള് അതിന് ഈര്പ്പം ഉള്ക്കൊള്ളനാവാതെ വരുന്നു. അങ്ങനെ നീരാവി കൊണ്ട് അന്തരീക്ഷം സാന്ദ്രമാകുന്നു. അന്തരീക്ഷത്തിന്റെ ഈ താപനിലയെ തുഷാരാങ്കം (dew point) എന്നു പറയുന്നു. തുഷാരാങ്കത്തിനു താഴെ വായു തണുക്കുമ്പോള് അത് മഴ, മഞ്ഞ്, ആലിപ്പഴം എന്നീ രൂപങ്ങളില് താഴേക്കു പതിക്കുന്നു. വായുപ്രവാഹങ്ങളുടെ ഉദ്ഭവം, താപമര്ദ പ്രവണത എന്നിവയാണ് അവക്ഷിപ്തത്തിന്റെ രൂപം, തീവ്രത, കാലയളവ് എന്നിവ നിര്ണയിക്കുന്നത്. ധ്രുവങ്ങളിലും ഗിരിനിരകളിലും വീഴുന്ന മഞ്ഞ് അവിടെ അടിഞ്ഞുകൂടി ഹിമനദി (glacier), ഹിമ പുതപ്പ് (ice sheet), ഹിമരേഖ (snow line) എന്നീ രൂപങ്ങളില് സ്ഥിതിചെയ്യുന്നു. എന്നാല് മറ്റു രൂപത്തിലുള്ള അവക്ഷിപ്തങ്ങളില് ഏറിയപങ്കും വീണ്ടും ബാഷ്പീകൃതമാകുന്നു. കുറേഭാഗം മണ്ണില് നിന്നു ചെടികള് വലിച്ചെടുക്കുന്നു. സസ്യസ്വേദനം വഴി ഈ ജലം സസ്യങ്ങളില് നിന്നു തിരികെ അന്തരീക്ഷത്തില് എത്തിച്ചേരുന്നു. മറ്റൊരു ഭാഗം മണ്ണിനടിയിലൂടെ ഊര്ന്നിറങ്ങി ഭൂഗര്ഭജലമായി ശേഖരിക്കപ്പെടുന്നു. ഇനിയും ഒരു ഭാഗം നീരൊഴുക്കായി തടാകങ്ങളിലേക്കും അരുവികളിലേക്കും ഒഴുകുന്നു. ബാഷ്പീകൃതമാവാതിരിക്കുന്ന നീരൊഴുക്ക് ഗുരുത്വാകര്ഷണംമൂലം ഒടുവില് കടലില് എത്തിച്ചേര്ന്ന് ജലചക്രം പൂര്ണമാക്കുന്നു. ഓരോ പരിതഃസ്ഥിതിയിലും ജലം നിലകൊള്ളുന്ന സമയം അതായത് വാസസമയം (residence time) വ്യത്യസ്തമാണ്. അവക്ഷിപ്തമായി നിലംപതിക്കുന്നതിനുമുമ്പ് അന്തരീക്ഷത്തില് ജലം ഏതാണ്ട് പത്തുദിവസത്തോളം നിലകൊള്ളുന്നു. എന്നാല് സമുദ്രങ്ങളിലെ വാസസമയം അനേകായിരം വര്ഷങ്ങളാണ്.
ജലചക്രത്തിലൂടെ ഭൂപ്രദേശങ്ങള്ക്കു നിരന്തരമായി ലഭ്യമാകുന്ന ശുദ്ധജലമാണ് ഭൂമിയില് സസ്യ-ജന്തുജീവിതം സാധ്യമാക്കുന്നത്.