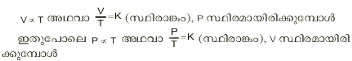This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ചാള്സ് നിയമം
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
ചാള്സ് നിയമം
വാതകത്തിന്റെ വ്യാപ്തം, മര്ദം, താപനില എന്നിവയെ ബന്ധപ്പെടുത്തുന്ന ഒരു താപഗതിക നിയമം. 'ഗേ-ലുസാക് നിയമം' എന്ന പേരിലും ഇതറിയപ്പെടുന്നു. സ്ഥിരമര്ദത്തിലുള്ള ഒരു നിശ്ചിത ദ്രവ്യമാനം വാതകത്തിന്റെ വ്യാപ്തം അതിന്റെ കേവല താപനിലയ്ക്ക് നേര് ആനുപാതികമായിരിക്കും എന്നതാണ് ചാള്സ് നിയമം. അതായത് വാതകത്തിന്റെ വ്യാപ്തം V, മര്ദം P, കേവല താപനില T എന്നെടുത്താല്
മര്ദം സ്ഥിരമായി നിര്ത്തിക്കൊണ്ട് ഒരു നിശ്ചിത അളവ് വാതകത്തിന്റെ താപനില ഇരട്ടിപ്പിച്ചാല് അതിന്റെ വ്യാപ്തം ഇരട്ടിക്കുമെന്ന് ഇതില്നിന്നു മനസ്സിലാക്കാം. മാതൃകാവാതക(ideal gas)ങ്ങളെന്ന കാല്പനിക വാതകങ്ങളുടെ കാര്യത്തില് മാത്രമേ ഈ നിയമം പൂര്ണമായും ശരിയാകുകയുള്ളൂ. യഥാര്ഥ വാതകങ്ങള് പ്രായോഗികമായി ചാള്സ് നിയമം കൃത്യമായി അനുസരിക്കുന്നില്ല എന്നു തെളിഞ്ഞിട്ടുണ്ട്.
സ്ഥിര മര്ദത്തിലുള്ള ഒരു വാതകത്തില് ഓരോ 1oC താപനിലാവര്ധനയ്ക്കും വാതകത്തിന്റെ വ്യാപ്തം oC-ലുള്ള അതിന്റെ വ്യാപ്തത്തിന്റെ ഭാഗം 1/273 വര്ധിക്കുന്നു എന്ന് ചാള്സ് 1787-ല് നിരീക്ഷിച്ചു. ഇതില്നിന്നും T താപനിലയിലെ വാതകവ്യാപ്തം V എന്നും 0oC-ലെ വ്യാപ്തം Vo എന്നും എടുത്താല്
സാധാരണ താപനിലകളിലും മര്ദത്തിലും ഉള്ള വാതകങ്ങള്ക്കു മാത്രമേ ചാള്സ് നിയമം ബാധകമാകുകയുള്ളൂ. ദ്രവീകരണത്തോട് അടുത്ത അവസ്ഥകളില്, അതായത് വളരെ താണ താപനിലകളിലും ഉയര്ന്ന മര്ദങ്ങളിലും വാതകങ്ങള് ഈ നിയമത്തില്നിന്ന് വ്യതിചലിക്കുന്നതായി കാണാം.