This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
കോപ്പര്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
കോപ്പര്
Copper
മനുഷ്യന് ആദ്യം കണ്ടെത്തി ഉപയോഗപ്പെടുത്തിയ ലോഹമൂലകങ്ങളില് ഒന്ന്. സിംബല് ഈ. അറ്റോമിക സംഖ്യ: 29; അറ്റോമിക ഭാരം: 63.54. കുപ്രം എന്ന ലാറ്റിന് പദത്തില് നിന്നാണ് കോപ്പര് എന്ന ഇംഗ്ലീഷ് പദത്തിന്റെ നിഷ്പത്തി. സാധാരണമായി ചെമ്പ് എന്ന് അറിയപ്പെടുന്നു. ഏറ്റവും അധികം അടിച്ചുപരത്താന് കഴിയുന്ന ലോഹമാണിത്.
ആമുഖം
ചെമ്പിനോളം തന്നെ പൗരാണികത സ്വര്ണത്തിനും വെള്ളിക്കുമുണ്ടെങ്കിലും, പ്രയോഗക്ഷമതയുള്ള ചെമ്പ് ഉപകരണങ്ങള് ആയിരുന്നു പുരാതനകാലത്ത് വ്യാപകമായി ഉപയോഗിച്ചിരുന്നത്. വടക്കന് ഇറാക്കില് നിന്നു കണ്ടെത്തിയ കോപ്പര് ഉപകരണങ്ങള്ക്ക് ഏകദേശം 10,000 വര്ഷത്തോളം പഴക്കമുണ്ട്. നവശിലായുഗ മനുഷ്യര് കോപ്പര്കൊണ്ട് ഉളികളും പിച്ചാത്തികളും മറ്റും ഉണ്ടാക്കിയിരുന്നു. നല്ല നിറം, വലിച്ചുനീട്ടാനും അടിച്ചു പരത്താനുമുള്ള സൗകര്യം, കല്ലിനോടൊപ്പമോ അതിനെക്കാളേറെയോ ഭാരം എന്നീ ഗുണങ്ങള് കോപ്പറിന് ആകര്ഷകത്വമേകി. പുതിയ നിക്ഷേപങ്ങള് കണ്ടെത്താനും ഈ നിക്ഷേപങ്ങളില് നിന്ന് പ്രാകൃതമാര്ഗങ്ങള് അവലംബിച്ചാണെങ്കിലും ലോഹത്തെ വേര്തിരിക്കാനും തുടങ്ങി. ക്രിസ്തുവിന് 6000 വര്ഷം മുമ്പുതന്നെ ചെമ്പ് ഉരുക്കാമെന്നും ആകൃതിപ്പെടുത്താമെന്നും മനുഷ്യന് മനസ്സിലാക്കി. ചെമ്പുധാതുക്കളും കരിയും ചേര്ത്തു ചുട്ട് (ആധുനിക നിരോക്സീകരണ പ്രക്രിയയുടെ പ്രാകൃതരൂപം) ലോഹം വേര്തിരിക്കാനും ആരംഭിച്ചു. ലോഹയുഗത്തിന്റെയും ലോഹനിഷ്കര്ഷണത്തിന്റെയും പ്രാരംഭമായിരുന്നു ഇക്കാലം.
കോപ്പറിന്റെ നിക്ഷേപങ്ങള് കണ്ടെത്തലും സംസ്കരിക്കലും ആദ്യകാലത്ത് ഏറ്റവും കൂടുതലായി നടന്നത് ഈജിപ്തിലാണ്. ബി.സി. 5000-ത്തില്ത്തന്നെ ചെമ്പുകൊണ്ടുള്ള ആയുധങ്ങളും മറ്റ് ഉപകരണങ്ങളും അവിടെ പ്രചാരത്തിലുണ്ടായിരുന്നു. സിനായി ഉപദ്വീപിലും കിഴക്കന് മരുപ്രദേശങ്ങളിലും സുലഭമായിരുന്ന കോപ്പര് ധാതുക്കളെ ഈജിപ്തുകാര് വ്യാപകമായി ഉപയോഗിച്ചിരുന്നു. കോപ്പറിനെ അടിച്ചുഷീറ്റുകളാക്കാനും ഷീറ്റുകള് ഉപയോഗിച്ചു പൈപ്പും മറ്റു വസ്തുക്കളും നിര്മിക്കാനും അവര് പഠിച്ചു. ഈ കാലഘട്ടത്തിലാണ് കോപ്പറിന്റെ ഒരു കൂട്ടുലോഹമായ വെങ്കലം അഥവാ വെള്ളോട് കണ്ടെത്തിയത്. ബി.സി. 3200-നും 2350-നും ഇടയിലാണ് വെങ്കലം കണ്ടെത്തിയതെന്നു കരുതപ്പെടുന്നു. പല തരത്തിലും വെന്നലത്തിനു കോപ്പറിനെക്കാള് ഉപയോഗക്ഷമത കൂടുതലായിരുന്നു. താഴ്ന്ന ഉരുകല്നില, കൂടുതല് കട്ടിയും ഉറപ്പും തുടങ്ങിയ പ്രത്യേകതകള് വെന്നലവും അതിന്റെ ഉത്പന്നങ്ങളും കാര്യമായി പ്രചരിക്കുന്നതിനും കാരണമായി. "വെന്നലയുഗം' എന്ന് ഈ കാലഘട്ടം അറിയപ്പെടുന്നു. ഈജിപ്തില് നിന്നാണ് വെങ്കലം മെഡിറ്ററേനിയന് പ്രദേശങ്ങളിലേക്ക് വ്യാപിച്ചത്. ഇതേ കാലത്തു സുമേറിയ, മെസൊപ്പൊട്ടേമിയ, സിന്ധു-ഗംഗാതടം തുടങ്ങിയ പ്രദേശങ്ങളിലും കോപ്പര് പ്രചാരത്തിലുണ്ടായിരുന്നു. ഗ്രീക്കുകാര്ക്കും റോമാക്കാര്ക്കും കോപ്പര് ലഭിച്ചിരുന്നത് സൈപ്രസില് നിന്നാണ്. തന്മൂലം ഇത് "ആയിസ് സിപ്രിയം' എന്ന് അറിയപ്പെട്ടു. സിപ്രിയം ലോഹം എന്നതിന്റെ ലാറ്റിന് പദമാണ് ആയിസ് സിപ്രിയം. പിന്നീടതു സിപ്രിയവും അവസാനം കുപ്രവുമായി മാറി.
കോപ്പറും വെന്നലവും ഏഷ്യയില് എന്നുമുതല് പ്രചാരത്തിലായി എന്നതിനു കൃത്യമായ രേഖകളില്ല. പക്ഷേ ബി.സി. 2500-ല് ഇവ ചൈനയില് പ്രചാരത്തിലുണ്ടായിരുന്നു. അമേരിക്കയില് കോപ്പര്യുഗം ആരംഭിക്കുന്നത് എ.ഡി. 100-നും 200-നും ഇടയ്ക്കാണ്.
ഇരുമ്പും ഉരുക്കും കണ്ടെത്തിയതോടെ താരതമ്യേന വിലകുറഞ്ഞ ഇവ കോപ്പറിനുപകരം ആയുധനിര്മാണത്തിനും മറ്റും ഉപയോഗിക്കുവാന് തുടങ്ങി. ഗൃഹോപകരണങ്ങള്, ക്ഷാരണപ്രതിരോധം അത്യാവശ്യമായ സാങ്കേതികോപകരണങ്ങള്, വൈദ്യുതവാഹികള് എന്നിവ നിര്മിക്കാന് കോപ്പര് ഉപയോഗിച്ചുവന്നു. വൈദ്യുതി കടത്തിവിടുന്നതിന് അസാധാരണ കഴിവുള്ളതിനാല് ഈ ലോഹത്തിന്റെ ഭൂരിഭാഗവും ഇന്ന് കമ്പികളും കേബിളുകളുമായി ഉപയോഗപ്പെടുത്തുന്നു.
ഉപസ്ഥിതി
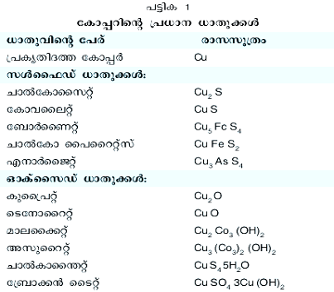
മൂലകാവസ്ഥയില് കാണപ്പെടുന്നുണ്ടെങ്കിലും മറ്റു മൂലകങ്ങളുമായിച്ചേര്ന്നു ഖനിജങ്ങളായാണ് കോപ്പര് അധികവും കണ്ടുവരുന്നത്. പ്രകൃതിദത്ത കോപ്പര്, പോര്ഫിറി കോപ്പര് (porphyry copper), മിശ്രിത ഖനിജങ്ങള് എന്നിങ്ങനെ കോപ്പര് ഖനിജങ്ങളെ വര്ഗീകരിക്കാം. മൂലകാവസ്ഥയില് പ്രകൃതിയില് കാണപ്പെടുന്ന ചെമ്പുലോഹമാണ് പ്രകൃതിദത്ത കോപ്പര്. 99.9 ശതമാനം ശുദ്ധമായ പ്രകൃതിദത്ത കോപ്പര് യു.എസ്സിലെ മിഷിഗണ് സംസ്ഥാനത്ത് ധാരാളമായി കാണപ്പെടുന്നു. സ്വീഡനിലും യൂറാള് പര്വതങ്ങളിലും അമേരിക്കയിലെ സുപ്പീരിയര് തടാകതീരത്തും ഇത്തരം കോപ്പര് ചെറിയ അളവില് കണ്ടുവരുന്നു. കോപ്പര് സുലഭമായി സ്ഥിതിചെയ്യുന്ന പാറകളാണ് പോര്ഫിറികോപ്പര് നിക്ഷേപങ്ങള്. ഇവയുടെ മുകള്ത്തട്ടിലെ കോപ്പര് ഖനിജങ്ങള് പൊതുവേ ഓക്സൈഡുകളും കീഴ്ത്തട്ടിലേതു സള്ഫൈഡുകളും ആയിരിക്കും. ഈ നിക്ഷേപങ്ങളില് ലോഹത്തിന്റെ അളവ് കൂടുതലാണെങ്കിലും ലഭ്യത താരതമ്യേന കുറവാണ്. മിശ്രിത ഖനിജങ്ങളില് നിക്കല്, സിന്ന്, ലെഡ് എന്നിവയും കോപ്പറിനോടൊപ്പം കലര്ന്നിരിക്കും. കോപ്പറിന്റെ പ്രധാനപ്പെട്ട ലോഹധാതുക്കള് പട്ടിക 1-ല് കൊടുത്തിരിക്കുന്നു.
പാറകളിലും മണ്ണിലും കടല്ച്ചെളിയിലും കടല്ച്ചെടികളുടെ ചാരത്തിലും മനുഷ്യന്റെ കരളിലും കടലിലെ മൊളസ്കുകള്, ആര്ത്രാപോഡുകള്, പവിഴപ്പുറ്റുകള് എന്നിവയിലും വ്യത്യസ്ത അളവുകളില് കോപ്പര് അടങ്ങിയിരിക്കുന്നു. ജീവികളില് മര്മപ്രധാനമായ ഒരു ധര്മമാണ് കോപ്പറിനുള്ളത്. സൂര്യനിലും കോപ്പറിന്റെ സാന്നിധ്യം ഉണ്ട്.
ആഫ്രിക്കയില് ദക്ഷിണാഫ്രിക്ക, കോങ്ഗോ ഡെമോക്രാറ്റിക് റിപ്പബ്ലിക്, സാംബിയ എന്നിവിടങ്ങളിലും ഏഷ്യയില് ചൈന, സൈപ്രസ്, ഇന്ത്യ, ജപ്പാന്, ഇസ്രയേല്, ഫിലിപ്പീന്സ്, ടര്ക്കി, മുന് സോവിയറ്റ് യൂണിയന് എന്നിവിടങ്ങളിലും യൂറോപ്പില് ആസ്ട്രിയ, ബള്ഗേറിയ, ഫിന്ലന്ഡ്, ഫ്രാന്സ്, ജര്മനി, ഇറ്റലി, നെതര്ലന്ഡ്സ്, നോര്വെ, പോളണ്ട്, സ്പെയിന്, സ്വീഡന്, എന്നിവിടങ്ങളിലും വടക്കേ അമേരിക്കയില് കാനഡ, മെക്സിക്കോ, യു.എസ്.എ. എന്നിവിടങ്ങളിലും തെക്കേ അമേരിക്കയില് അര്ജന്റീന, ബ്രസീല്, പെറു, ചിലി എന്നിവിടങ്ങളിലും ആസ്റ്റ്രേലിയയിലും കോപ്പര് നിക്ഷേപങ്ങള് ഉണ്ട്. ഇന്ത്യയിലെ ഖനിപ്രവര്ത്തനങ്ങള് നടത്തുന്നത് ഹിന്ദുസ്ഥാന് കോപ്പര് കോര്പ്പറേഷന് എന്ന പൊതുമേഖലാസ്ഥാപനമാണ്. ഏറ്റവും വലിയ ഖനി മധ്യപ്രദേശില് ബലാഘട്ട് ജില്ലയിലെ മലഞ്ച് ഘട്ട് ആണ്. പ്രധാന നിക്ഷേപങ്ങള് ബീഹാറിലെ സിങ്ഭും, ഗയ, ജാര്ഖണ്ഡിലെ ഹസാരിബാഗ്, രാജസ്ഥാനിലെ ഖേത്രി, ജയ്പൂര്, ഉദയ്പൂര്, ബലാഘട്ട് തുടങ്ങിയ ഇടങ്ങളിലാണ്.
നിഷ്കര്ഷണരീതി
നിഷ്കര്ണരീതി പ്രധാനമായും ധാതുവിന്റെ സ്വഭാവത്തെ ആശ്രയിച്ചിരിക്കുന്നു. എങ്കിലും താഴെപ്പറയുന്ന മൂന്നു ഘട്ടങ്ങള് മിക്ക നിഷ്കര്ണവിധികളിലും ഉണ്ട്.
(i) ഖനിജത്തില് നിന്ന് ധാതുവിനെ സാന്ദ്രീകരിക്കല്. (ii) മറ്റു മൂലകപദാര്ഥങ്ങളില് നിന്നു (ഉദാ. S,O മുതലായവ) കോപ്പറിനെ വേര്തിരിക്കല് (iii) നിഷ്കര്ഷണം ചെയ്ത ലോഹത്തില് നിന്നു മാലിന്യങ്ങളെ പരിപൂര്ണമായി നീക്കി ശുദ്ധലോഹം നിര്മിക്കല്.
ചാല്കോസൈറ്റ് അഥവാ കോപ്പര്ഗ്ലാന്സ് (Cu2S), കോപ്പര് പൈറൈറ്റ്സ് (CuFe S2) എന്നീ ഖനിജങ്ങളാണ് കോപ്പറിന്റെ നിഷ്കര്ഷണത്തിനു സാധാരണ ഉപയോഗിച്ചുവരുന്നത്. രണ്ടുരീതികള് നിഷ്കര്ഷണത്തിനു സ്വീകരിക്കുന്നുണ്ട്; ശുഷ്കപ്രക്രിയ(pyrometallurgy)യും ആര്ദ്രപ്രക്രിയ(hydrometallurgy)യും.
ശുഷ്കപ്രക്രിയ
ഈ പ്രക്രിയയ്ക്ക് അഞ്ചുഘട്ടങ്ങളുണ്ട്. (i) ലോഹധാതുവിന്റെ പ്ലവനം (ii) വറുക്കല് (iii) പുടംവയ്ക്കല് (iv മാറ്റെയില് നിന്നു ചെമ്പിന്റെ നിഷ്കര്ഷണം (v) ശുദ്ധീകരണം.
പ്ലവനം
പ്ലവനപ്രക്രിയയില് കോപ്പറിന്റെ അയിര്പൊടിച്ച് യൂക്കാലിപ്റ്റസ് തൈലം പോലെയുള്ള ഏതെങ്കിലും പദാര്ഥങ്ങള് ചേര്ത്തിട്ടുള്ള വെള്ളം നിറച്ച ടാന്നിലേക്കു നിക്ഷേപിക്കുന്നു. ഇതിലേക്കു ശക്തമായി വായു കടത്തിവിടുന്നു. അയിരില് അടങ്ങുന്ന കല്ലും മണ്ണും പാത്രത്തിനടിയിലേക്കു താഴും. അയിരിന്റെ കണങ്ങള് പാത്രത്തിനു മുകളില് പതയ്ക്കുള്ളില് തങ്ങും. ഇതു നീക്കം ചെയ്യാം. ഈ പ്രക്രിയയിലൂടെ അയിര് പൂര്ണമായി വേര്തിരിക്കാന് സാധ്യമല്ല. ഈ പ്രക്രിയ ആവര്ത്തിക്കുന്നതുമൂലം അയിരിന്റെ സാന്ദ്രത വര്ധിപ്പിക്കാന് കഴിയും. പത ഉണ്ടാക്കുന്നതിന് യൂക്കാലിപ്റ്റസിനു പകരം പെട്രോള്, ഫിനോള്, അമീനുകള് തുടങ്ങിയവയും ചേര്ക്കാറുണ്ട്.
വറുക്കല്(Roasting)
സാന്ദ്രീകരിച്ച അയിരിനെ ഒരു പരാവര്ത്തിച്ചൂളയില് (reverboratory furnace) വച്ച് വായുവിന്റെ സാന്നിധ്യത്തില് തപിപ്പിക്കുന്നു. താഴെപ്പറയുന്ന മാറ്റങ്ങളാണ് പ്രധാനമായും സംഭവിക്കുന്നത്.
(a) അയിരിലെ സള്ഫര് അപദ്രവ്യങ്ങളില് ഭൂരിഭാഗവും ഓക്സീകരിക്കുന്നു. (b) അയിരില് അടങ്ങിയിരിക്കുന്ന അ, ടെയ എന്നിവ ഓക്സീകരിക്കപ്പെടുന്നു. (c) പൈറൈറ്റ്സ് വിഘടിച്ചു കുപ്രസ് സള്ഫൈഡ്, ഫെറസ് സള്ഫൈഡ് എന്നിവ ഉണ്ടാകുന്നു.
2Cu Fe S2 + O2 → Cu2S + 2FeS + SO2
(b) കുപ്രസ് സള്ഫൈഡും ഫെറസ് സള്ഫൈഡും ഭാഗികമായി ഓക്സീകരിക്കപ്പെടുന്നു.
2 Cu2 S + 3O2 → 2 Cu2O + 2 SO2
2 Fe S + 3O2 → 2 FeO + 2SO2
വറുക്കലില് ഉണ്ടാകുന്ന ഉത്പന്നത്തെ കാല്സൈന് എന്നു പറയുന്നു. ഇരുമ്പ്, കോപ്പര് എന്നിവയുടെ സള്ഫൈഡുകളും ഓക്സൈഡുകളും ബാഷ്പശീലത കുറഞ്ഞ മാലിന്യങ്ങളും അടങ്ങിയ ഒരു മിശ്രിതമാണിത്.
പുടംവയ്ക്കല്
(Smelting). വറുത്ത അയിരിനോടു കോക്കും മണലും ചേര്ത്ത് ഒരു ബ്ലാസ്റ്റ് ചൂളയില് വച്ച് പുടംവയ്ക്കുന്നു. അകത്ത് ഇഷ്ടിക പാകിയ ഉരുക്കുനിര്മിതമായ ബ്ലാസ്റ്റ് ചൂളയാണ് ഇതിന് ഉപയോഗിക്കുന്നത്. മുകളില്ക്കൂടി ചൂളയ്ക്കകത്തേക്ക് വറുത്ത അയിരിന്റെ മിശ്രിതം തള്ളിവിടുന്നു. ബ്ലാസ്റ്റ് ചൂളയില് വച്ചു കോപ്പര്, ഇരുമ്പ് എന്നിവയുടെ സള്ഫൈഡുകള് ഉരുകിയ നിലയിലെത്തുന്നു. ഇതിനെ "മാറ്റെ' (matte) എന്നാണ് വിളിക്കുക. അയിരിലെ മുഴുവന് കോപ്പറും ഇതില് അടങ്ങിയിരിക്കും. അത്യാവശ്യമായ അളവില് ഇരുമ്പും ഉണ്ടാവും. ഉയര്ന്ന ആപേക്ഷികഘനത്വം ഉള്ളതിനാല് ഇത് നീക്കം ചെയ്യാനും എളുപ്പമുണ്ട്.
മാറ്റെയില്നിന്നും വേര്തിരിക്കല്
ബസ്സീമര് പ്രക്രിയ ഉപയോഗിച്ച് മാറ്റെയില്നിന്നു കോപ്പര് വേര്തിരിക്കാം. ബസ്സീമര് പരിവര്ത്തിത്രം (bassemer converter) എന്ന വിശേഷ ഉപകരണത്തില്വച്ച് ഉരുകിയ മാറ്റയെ, വായു പ്രവാഹത്തില് തപിപ്പിക്കുന്നു. "ഫ്ളക്സ്' ആയി കുറെ സിലിക്കയും മാറ്റെയിലേക്കു ചേര്ത്തിരിക്കണം. മുഴുവന് അപദ്രവ്യങ്ങളും ഈ പ്രക്രിയയില് ഓക്സീകരിക്കപ്പെടും. സള്ഫര്, സള്ഫര് ഡൈ ഓക്സൈഡായും അയണ്, അയണ് ഓക്സൈഡായും മാറുന്നു. ബാഷ്പശീലമുള്ള ഓക്സൈഡുകള് പരിവര്ത്തിത്രത്തില് നിന്നു ബഹിര്ഗമിക്കുന്നു. അയണ് ഓക്സൈഡ് ഫ്ളക്സുമായി ചേര്ന്ന് സ്ലാഗ് അഥവാ കിട്ടം രൂപം കൊള്ളുന്നു.
FeO + SiO2 → FeSiO3
കുപ്രസ് സള്ഫൈഡില് ഒരുഭാഗം കുപ്രസ് ഓക്സൈഡായും സള്ഫര് ഡൈ ഓക്സൈഡായും മാറുന്നു. ഈ കുപ്രസ് ഓക്സൈഡ് അവശേഷിക്കുന്ന കുപ്രസ് സള്ഫൈഡുമായി പ്രതിപ്രവര്ത്തിച്ച് കോപ്പറും സള്ഫര് ഡൈഓക്സൈഡും വേര്തിരിയുന്നു.
2Cu2 S + 3O2 → 2Cu2 O + 2SO2
Cu2 O + FeS → Cu2 S + FeO
Cu2 S + 2Cu2 O → 6Cu + SO2
സള്ഫര് ഡൈ ഓക്സൈഡു കുമിളകള് പുറത്തുവരുന്നതുമൂലം ബസ്സീമര് പ്രക്രിയ കഴിഞ്ഞു ലഭിക്കുന്ന കോപ്പറില് നിറയെ പോളങ്ങള് (blisters) ഉണ്ടായിരിക്കും. ഇതു ബ്ലിസ്റ്റര് കോപ്പര് അഥവാ പോളച്ചെമ്പ് എന്ന് അറിയപ്പെടുന്നു. ഇതില് 99 ശതമാനത്തോളം കോപ്പര് ഉണ്ട്. അല്പം കോപ്പര് ഓക്സൈഡും നേരിയ തോതില് സള്ഫര്, ആര്സെനിക്, അയണ് തുടങ്ങിയവയും അപദ്രവ്യങ്ങളായി ഇതില് കടന്നുപറ്റാന് ഇടയുണ്ട്. ബ്ലിസ്റ്റര് കോപ്പറിനെ പരാവര്ത്തി ചൂളയില് വച്ച് നല്ല വായുപ്രവാഹത്തില് ചൂടാക്കിയാല് ഈ അപദ്രവ്യങ്ങളില് നല്ലൊരു പങ്ക് ഓക്സീകരിക്കപ്പെടും. അയണ് അതിന്റെ ഓക്സൈഡായി ഉപരിതലത്തില് അടിഞ്ഞുകൂടും. ഇത് എളുപ്പം നീക്കം ചെയ്യാം.
ശുദ്ധീകരണം
കോപ്പറിന്റെ ശുദ്ധീകരണത്തിന് രണ്ടു പ്രക്രിയകള് ഉപയോഗിക്കുന്നു. ആദ്യത്തേതാണ് പോളിങ് (poling). കുപ്രസ് ഓക്സൈഡ് നീക്കം ചെയ്യുകയാണ് ഈ പ്രക്രിയയുടെ മുഖ്യലക്ഷ്യം. ഉരുകിയ, ചൂടുള്ള കോപ്പറിലേക്ക് പച്ചത്തടി മുക്കിവച്ചുകൊണ്ട് ഇളക്കുന്നു. തടിയുടെ ആംശിക സ്വേദനത്തിലൂടെ നിരോക്സീകരണ വാതകങ്ങള് ഉണ്ടാകുന്നു. ഇവ കോപ്പര് ഓക്സൈഡിനെ നിരോക്സീകരിച്ചു കോപ്പര് ആക്കുന്നു. വൈദ്യുത വിശ്ലേഷണത്തിലൂടെയാണ് കോപ്പറിന്റെ ആത്യന്തിക സംസ്കരണം നടത്തുന്നത്. മേല് സൂചിപ്പിച്ച വിവിധ പ്രക്രിയകളിലൂടെ രൂപപ്പെടുത്തിയ അസംസ്കൃത കോപ്പര് ദണ്ഡുകളുടെ രൂപത്തില് വിശ്ലേഷണ സെല്ലില് ആനോഡായി വയ്ക്കുന്നു; കനം കുറഞ്ഞ ശുദ്ധ ചെമ്പു തകിടുകള് കാഥോഡായും കോപ്പര് സള്ഫേറ്റ് ലായനി ഇലക്ട്രാലൈറ്റായും ഉപയോഗിക്കുന്നു. വൈദ്യുതവിശ്ലേഷണം നടക്കുമ്പോള് ലായനിയില്നിന്നു കോപ്പര് അയോണുകള് കാഥോഡിലേക്കു പ്രവഹിക്കുകയും ലോഹിക കോപ്പര് ആയി അതില് നിക്ഷേപിക്കുകയും ചെയ്യുന്നു. അതേസമയം ആനോഡിലെ കോപ്പര് കുറേശ്ശെയായി ലായനിയില് ലയിച്ചുചേരുന്നു. കാഥോഡില് ശേഖരിക്കപ്പെടുന്ന ഓരോ അയോണിനും പകരമായി ആനോഡില്നിന്നു മറ്റൊരു അയോണ് ലായനിയില് എത്തിച്ചേരും. ആനോഡിലെ അപദ്രവ്യങ്ങള് വേര്തിരിഞ്ഞു സെല്ലിന്റെ ചുവട്ടില് അടിയുന്നു. ഇങ്ങനെ അടിയുന്ന അപദ്രവ്യങ്ങളെ "ആനോഡ് ചെളി' എന്നുവിളിക്കുന്നു.
ആര്ദ്രപ്രക്രിയ
കോപ്പര് ധാതുവിലുള്ള കോപ്പര് യൗഗികത്തെ യുക്തമായൊരു ലായകത്തില് ലയിപ്പിക്കുന്നു. ഈ ലായനിയില്നിന്നു രാസമാര്ഗങ്ങളിലൂടെ കോപ്പര് വേര്തിരിക്കാം. ഓക്സൈഡ് അയിരുകളാണ് ഈ പ്രക്രിയയ്ക്ക് ഏറ്റവും അനുയോജ്യം. ഈ പ്രക്രിയയ്ക്ക് അയിരിന്റെ സാന്ദ്രീകരണം, കോപ്പര് യൗഗികത്തെ ലായനിയിലാക്കല്, കോപ്പറിന്റെ അവക്ഷേപണം, കോപ്പറിന്റെ ശുദ്ധീകരണം എന്നിങ്ങനെ വിവിധ ഘട്ടങ്ങളുണ്ട്.
അയിരിന്റെ സാന്ദ്രീകരണത്തിനു പ്ലവനപ്രക്രിയ തന്നെയാണ് ഇവിടെയും ഉപയോഗിക്കുന്നത്. ഈ പ്രക്രിയയിലൂടെ സാന്ദ്രമാക്കപ്പെട്ട അയിര് പരാവര്ത്തി ചൂളയില്വച്ച് താഴ്ന്ന താപനിലയില് ചൂടാക്കുമ്പോള് അയിരിലടങ്ങുന്ന സള്ഫൈഡ് ഓക്സീകരിച്ചു സള്ഫേറ്റായിത്തീരുന്നു:
2Cu2 S + 5O2 → 2 CuSO4 + 2CuO
Fe S2 + 3O2 → FeSO4 + SO2
4FeSO4 + O2 → 2Fe2O3 + 4SO3
CuO + SO3 → CuSO4
ഈ കോപ്പര് സള്ഫേറ്റിനെ ടാങ്കുകളില് വച്ചു ജലത്തില് അലിയിക്കുന്നു.
ജലലേയ സള്ഫേറ്റുകളല്ലാതെ ജലലേയ ക്ലോറൈഡുകളായും കോപ്പറിനെ മാറ്റിയെടുക്കാം.
സള്ഫൈഡുകളല്ലാത്ത അയിരുകളെ സള്ഫ്യൂരിക്കും നിക്ഷാളന പ്രക്രിയയിലൂടെ കോപ്പര് സള്ഫേറ്റാക്കിമാറ്റാം. പ്രബലിത കോണ്ക്രീറ്റുകൊണ്ടു നിര്മിച്ച ടാങ്കുകളില് അയിരും സള്ഫ്യൂരിക്കമ്ലവും ചേര്ത്ത് ഇളക്കി കോപ്പര് സള്ഫേറ്റ് ലായനി തയ്യാറാക്കാം. ഇങ്ങനെ ലായനിയിലാക്കിയ കോപ്പറിനെ അവക്ഷേപണം ചെയ്യുന്നതിന് രണ്ടു വിധികളുണ്ട്.
i. ലായനിയില് ഇരുമ്പുപൊടി ചേര്ത്തുള്ള നിരോക്സീകരണരീതി:
CuSO4 + Fe → Cu + FeSO4
ii. ലായനിയുടെ വൈദ്യുതവിശ്ലേഷണരീതി. കാഥോഡായി ചെമ്പ് ഉപയോഗിക്കുന്നു. ആനോഡായി ലെഡോ (ഏതെങ്കിലും അലേയ ലോഹമോ) ഉപയോഗിക്കാം. വൈദ്യുത വിശ്ലേഷണം നടത്തുമ്പോള് കാഥോഡില് ചെമ്പു നിക്ഷേപിക്കപ്പെടുന്നു. ആര്ദ്രപ്രക്രിയയിലും ലോഹശുദ്ധീകരണത്തിനു വൈദ്യുതവിശ്ലേഷണരീതി തന്നെയാണ് സ്വീകരിച്ചുവരുന്നത്. ഇലക്ട്രാളിറ്റിക കോപ്പറില് 99.92 മുതല് 99.96 ശതമാനം വരെ കോപ്പര് ഉണ്ടായിരിക്കും. ഏതാണ്ട് 0.03 ശതമാനം ഓക്സിജന് ഇതില് കാണും. ഈ നാമമാത്ര ഓക്സിജന് ലോഹത്തിന്റെ ചാലകതയും ഘനത്വവും വര്ധിപ്പിക്കുന്നു. നിരോക്സീകരണകാരികള് ഉപയോഗിച്ചു വേണ്ടിവന്നാല് ഓക്സിജനെ പൂര്ണമായി നീക്കം ചെയ്യാം.
ചെമ്പുകമ്പി ഉണ്ടാക്കുന്നതിനു ലോഹത്തെ ആദ്യം വയര് ബാറുകളായി (wire bars) കാസ്റ്റു ചെയ്യുന്നു. ഇതിനെ പിന്നീട് 700ºC മുതല് 850ºC വരെ തപിപ്പിച്ച് ഏകദേശം 9.4 മില്ലിമീറ്റര് വ്യാസമുള്ള ദണ്ഡുകളാക്കുന്നു. ഈ ദണ്ഡുകളെ ടങ്സ്റ്റണ് കാര്ബൈഡിന്റെയും വജ്രത്തിന്റെയും ഡൈകള് (dies) ഉപയോഗിച്ച് മുറിച്ച് ആവശ്യമായ കനത്തിലുള്ള കമ്പികളാക്കി മാറ്റാം.
ചെമ്പുകമ്പി അധികവും ചുരുളുകളായി (coils) മാറ്റുന്നു. തുണി, പ്ലാസ്റ്റിക്, റബ്ബര്, പേപ്പര് തുടങ്ങിയ ആവരണങ്ങളോടുകൂടിയ താപവാഹിനികളായും നല്ലൊരളവ് ചെമ്പ് ഉപയോഗിച്ചുവരുന്നു. കോപ്പര് കേബിളുകളെ പ്രത്യേക വിധിപ്രകാരം ജലരോധിതമാക്കുന്നു.
ഗുണധര്മങ്ങള്
ഇരുണ്ട ചുവപ്പുനിറമുള്ള ഒരു ലോഹമാണ് കോപ്പര്. ആവര്ത്തനപ്പട്ടികയില് പതിനൊന്നാം ഗ്രൂപ്പിലെ അംഗമാണിത്; സംക്രമണമൂലകങ്ങളില് (transition elements)ഒന്പതാമത്തേതും. ഇതിന്റെ മൂന്നാമത്തെ ഷെല് 18 ഇലക്ട്രാണുകളാല് പൂരിതമാണ്.
മൃദുവായ ലോഹമാണ് കോപ്പര്. വലിച്ചു നീട്ടുകയും അടിച്ചുപരത്തുകയും ചെയ്യാം. വളരെ കനംകുറഞ്ഞ കോപ്പര്പാളികള് അര്ധതാര്യവും (translucent) പച്ചകലര്ന്ന നീലപ്രകാശത്തെ കടത്തിവിടാന് പര്യാപ്തവുമാണ്. ശുഷ്കവായു കോപ്പറിനെ ആക്രമിക്കുകയില്ല. എന്നാല് CO2 അടങ്ങിയിട്ടുള്ള ഈര്പ്പവായു ലോഹത്തിനു പുറത്തു പച്ചനിറത്തിലുള്ള ഒരു സംരക്ഷണഫിലിം ഉണ്ടാക്കും. ബേസിക് കാര്ബണേറ്റിന്റെ ഫിലിമാണിത്. വിദ്യുത് ചാലകശ്രണിയില് ഹൈഡ്രജനു താഴെയാണ് കോപ്പറിന്റെ നില. അതുകൊണ്ടു ലായനികളില് നിന്ന് കോപ്പര് ഹൈഡ്രജനെ വിസ്താപനം ചെയ്യുകയില്ല. എന്നാല് കോപ്പറിനെ അതിന്റെ ലവണലായനിയില് നിന്ന് Fe, Zn, Pb എന്നിവ വിസ്താപനം ചെയ്യുന്നു. ഓക്സീകരണ അമ്ലങ്ങളിലും ഓക്സീകാരികളുടെ സാന്നിധ്യത്തില് മറ്റ് അമ്ലങ്ങളിലും കോപ്പര് ലയിക്കുന്നു. നൈട്രിക് അമ്ലം, ചൂടുള്ള സാന്ദ്രസള്ഫ്യൂരിക് അമ്ലം, സള്ഫ്യൂരിക് അമ്ലത്തിന്റെയും ഫെറിക് സള്ഫേറ്റിന്റെയും മിശ്രിതം എന്നിവ കോപ്പര് ലയിക്കുന്ന ചില ലായനികളാണ്. അമോണിയയിലും വായുസാന്നിധ്യത്തിലുള്ള അമോണിയം ലവണങ്ങളിലും സോഡിയം, പൊട്ടാസ്യം സയനൈഡുകളിലും കോപ്പര് ലയിക്കും.
ഓക്സിജന്, നൈട്രജന്, കാര്ബണ് ഡൈ ഓക്സൈഡ്, സള്ഫര് ഡൈ ഓക്സൈഡ് എന്നീ വാതകങ്ങള് ഉരുകിയ കോപ്പറില് ലയിക്കും. മൃദുവായ സാധാരണ കോപ്പര് 210 ന്യൂട്ടണ്/മി.മീ.2 മുതല് 250 ന്യൂട്ടണ് മി./മീ2 വരെ വലിവുബലം പ്രദര്ശിപ്പിക്കുന്നു. ഇതു ചില പ്രത്യേകവിധികളിലൂടെ 490 ന്യൂട്ടണ്/മി.മീ2 വരെയാക്കാം. കോപ്പറിന് അപരരൂപങ്ങളില്ല. കോപ്പറിനെ വെല്ഡനം ചെയ്യാനും വിളക്കാനും കഴിയും. ഇലക്ട്രിക് ആര്ക്കോ, ഓക്സി-അസെറ്റലിന് ജ്വാലയോ ഉപയോഗപ്പെടുത്തി ഈ പ്രക്രിയകള് നടത്താം.
കോപ്പറിലെ 3d, 4s എന്ന രണ്ട് ഊര്ജനിലകള് തമ്മില് വളരെ കുറഞ്ഞ ഊര്ജവ്യത്യാസം മാത്രമേ ഉള്ളൂ. അതിനാല് സംയുക്തങ്ങളില് കോപ്പര് Cu+ (കുപ്രസ്), Cu2+ (കുപ്രിക്) എന്നീ അയോണുകളെ സൃഷ്ടിക്കുന്നു. Cu2+ ന്റെ ജലയോജനതാപം (heat of hydration) Cu+ ന്റേതിനെക്കാള് അധികമായതിനാല് ജലലായനികളില് Cu2+ ആണു കൂടുതല് സുസ്ഥിരം. കുപ്രസ് അയോണ് ജലലായനിയില് ലോഹവും കുപ്രിക് ലവണവുമായി വേര്തിരിയുന്നു.
2Cu+ → Cu + Cu2+
ചില സന്ദര്ഭങ്ങളില് d ഇലക്ട്രാണുകള് ബന്ധനത്തില് (bunding) പങ്കെടുക്കുമ്പോള് ട്രൈപോസിറ്റീവ് കോപ്പര് Cu (111) ഉണ്ടാകുന്നു. ഇത് സങ്കരയൗഗികങ്ങളിലാണ് കാണുക. CuI പോലെയുള്ള അലേയലവണങ്ങളിലും CuCl2 –, Cu(CN)3 2– തുടങ്ങിയ സങ്കര അയോണുകളിലും കുപ്രസ് അവസ്ഥ നിലനില്ക്കുന്നുണ്ട്. നേര്പ്പിച്ച വെള്ളത്തില് കുപ്രിക് അയോണ് ജലയോജിതമായിരിക്കുന്നതിനാല് [Cu(H2 O)4 ]2+ കോംപ്ലസ്കിനു നീലനിറം ഉണ്ടായിരിക്കും. അമോണിയയുമായി ഇതു കടുത്ത നീലനിറത്തിലുള്ള [Cu(NH3 )4 ]2+ എന്ന സങ്കരം ഉണ്ടാക്കുന്നു.
ഓക്സൈഡുകള്
കോപ്പറിന് രണ്ട് ഓക്സൈഡുകളുണ്ട്: കുപ്രസ് ഓക്സൈഡും (Cu2O) കുപ്രിക് ഓക്സൈഡും (CuO). ചുവന്ന ക്രിസ്റ്റല് രൂപമുള്ള പദാര്ഥമാണ് കുപ്രസ് ഓക്സൈഡ്. അന്തരീക്ഷ താപനിലയില് Cu2O ആണ് CuO വിനെക്കാള് അസ്ഥിരം എന്നിരുന്നാലും ഇതു പ്രകൃതിയില് കുപ്രേറ്റ് ഖനിജമായി കാണപ്പെടുന്നു. ഇതിന്റെ ആപേക്ഷിക ഘനത്വം 6 ആണ്; ഉരുകല്നില: 1235ºC. കുപ്രിക് ഓക്സൈഡ് 900ºC-ല് ചൂടാക്കിയോ ഏതെങ്കിലും കുപ്രിക് ലവണലായനി, ഗ്ലൂക്കോസ് തുടങ്ങിയ നിരോക്സീകാരകങ്ങള് വഴി നിരോക്സീകരിച്ചോ കുപ്രസ് ഓക്സൈഡ് നിര്മിക്കാം.
Cu2O ജലത്തില് ലയിക്കുകയില്ല. നേര്ത്ത അമ്ലങ്ങളില് ലയിക്കുമ്പോള് കോപ്പര് അവക്ഷിപ്തപ്പെടുന്നു.
Cu2O + H2SO4 → CuSO4 + Cu + H2O
H2, CO, കരി, അയണ് എന്നിവ Cu2O വിനെ നിരോക്സീകരിച്ച് കോപ്പര് ആക്കുന്നു. ഗ്ലാസിന് ഈ പദാര്ഥം ചുവപ്പുനിറം കൊടുക്കുന്നു. ഗ്ലാസിനും മണ്പാത്രങ്ങള്ക്കും നിറം കൊടുക്കാനും ഇനാമല് നിര്മിക്കാനും Cu2O ഉപയോഗിക്കുന്നു.
ഒരു കറുത്ത പൊടിയാണ് കുപ്രിക് ഓക്സൈഡ് (CuO). കോപ്പറിന്റെ ചീളുകളോ കോപ്പര് ലവണങ്ങളോ (ഉദാ. കാര്ബണൈറ്റ്, നൈട്രേറ്റ്, ഹൈഡ്രാക്സൈഡ്) കുപ്രസ് ഓക്സൈഡോ വായുവില് തപിപ്പിച്ച് ഇതു നിര്മിക്കാം.
2Cu + O2 → 2CuO
2Cu (NO3)2 → 2CuO + 4NO2 + O2
ജലത്തില് അലേയമാണ്. അമ്ലങ്ങളിലും ആല്ക്കലി സയനൈഡുകളിലും അലിയുന്നു. അമ്ലത്തില് അലിഞ്ഞ് കുപ്രിക് ലവണം ഉണ്ടാകുന്നു.
CuO + H2SO4 → CuSO4 + H2O
കുപ്രിക് ഓക്സൈഡിന്റെ ഉരുകല്നില : 1326ºC ആണ്. ആപേക്ഷികഘനത്വം 6.4. 800ºCനു മുകളില് ഈ യൗഗികത്തിന്റെ സ്ഥിരത കുറയുന്നു. H2, CO മുതലായ നിരോക്സീകാരകങ്ങള് CuO വിനെ നിരോക്സീകരിക്കുന്നു.
CuO + H2 → H2O + Cu
കുപ്രിക് ഓക്സൈഡ് ഗ്ലാസിനു പച്ചനിറം നല്കുന്നു. ഇതിന്റെ മുഖ്യഉപയോഗവും ഇതുതന്നെ.
ഹാലൈഡുകള്
ക്ലോറിന്, ബ്രാമിന്, അയൊഡിന് എന്നിവയുമായി കോപ്പര് ചേര്ന്ന് കുപ്രസ് ഹാലൈഡുകള് ഉണ്ടാകുന്നുണ്ട്. ഉദാ. കുപ്രസ് ക്ലോറൈഡ്, കുപ്രസ് ബ്രാമൈഡ് എന്നിവ. കോപ്പര് (II) ഹാലൈഡുകളെ കോപ്പറിന്റെ പൊടിയോ സിങ്കോ, SO2 വോ ഉപയോഗിച്ചു നിരോക്സീകരിച്ചു നിര്മിക്കാം.
ഉദാ. CuCl2 + Cu → 2CuCl
ചൂടാക്കിയ ചെമ്പിനുമീതേകൂടി ഹൈഡ്രജന് ക്ലോറൈഡുവാതകം പ്രവഹിപ്പിച്ചും CuCl നിര്മിക്കാം.
2 Cu + 2HCl → 2CuCl + H2
ജലത്തില് അലേയമായ വെളുത്ത പൊടിയാണ് കുപ്രസ് ക്ലോറൈഡ്. ജലം, വായു എന്നിവയുടെ സാന്നിധ്യത്തില് അത് ഓക്സീകരിച്ച് ക്ഷാരീയ കുപ്രിക് ക്ലോറൈഡായി മാറുന്നു. അമോണിയാമിശ്രിത കുപ്രസ് ക്ലോറൈഡ് അസെറ്റലിന് വാതകത്തെ അവശോഷിച്ച് കടുംചുവപ്പുനിറത്തിലുള്ള കോപ്പര് അസറ്റൈലൈഡ് ഉണ്ടാകുന്നു.
2CuCl + C2 H2 → Cu2C2 + 2HCl
ശുഷ്കമായ Cu2C2 ഒരു വിസ്ഫോടകമാണ്. കുപ്രസ് ഓക്സൈഡിനെപ്പോലെ കുപ്രസ് ക്ലോറൈഡും സങ്കീര്ണയൗഗികങ്ങളെ ഉത്പാദിപ്പിക്കുന്നു. കുപ്രസ് ക്ലോറൈഡിന്റെ ഹൈഡ്രാക്ലോറിക് അമ്ലലായനി CO, O2, H2 എന്നിവയെ അവശോഷണം ചെയ്യാന് ഉപയോഗപ്പെടുത്തുന്നു.
കോപ്പറിന്റെ സ്ഥിരമായ ഏക അയൊഡൈഡാണ് കുപ്രസ് അയൊഡൈഡ് (Cul).CuSO4 ലായനിയോടു KI ലായനി ചേര്ത്ത് Cul നിര്മിക്കാം. ആദ്യം അവക്ഷിപ്തമാകുന്ന പച്ചനിറത്തിലുള്ള കുപ്രിക് അയൊഡൈഡ് പിന്നീട് വിഘടിച്ച് വെളുത്ത കുപ്രസ് അയൊഡൈഡ് ആയി മാറും.
CuSO4 + 2KI → K2 SO4 + Cul2
2Cul2 → 2Cul + l2
CuSO4-ല് ഫെറസ് സള്ഫേറ്റോ സോഡിയം തയോസള്ഫേറ്റോ ചേര്ത്ത് അയൊഡിന്റെ ഉത്പാദനം തടയാം. ജലത്തില് ലയിക്കാത്ത വെളുത്ത പൊടിയാണ് Cul. അമോണിയ, സോഡിയംതയോസള്ഫേറ്റ് എന്നിവയില് ലയിക്കും. ചൂടാക്കുമ്പോള് ആദ്യം ചുവക്കുകയും പിന്നീടു കറുക്കുകയും ചെയ്യും. തണുപ്പിക്കുമ്പോള് വീണ്ടും വെള്ളനിറം ലഭിക്കും.
കുപ്രിക് ഹാലൈഡുകള് എല്ലാംതന്നെ കണ്ടെത്തിയിട്ടുണ്ട്. കുപ്രിക് ഓക്സൈഡും ഹൈഡ്രാഫ്ളൂറിക്കമ്ലവും തമ്മില് 400ºC-ല് പ്രതിപ്രവര്ത്തിപ്പിച്ച് കുപ്രിക് ഫ്ളൂറൈഡ് (CuF2). കുപ്രിക് ഓക്സൈഡോ കാര്ബണേറ്റോ ഹൈഡ്രാക്ലോറിക്കമ്ലത്തില് ലയിപ്പിച്ച് കുപ്രിക് ക്ലോറൈഡ് (CuCl2) ഉത്പാദിപ്പിക്കാം. ഹൈഡ്രേറ്റിത കുപ്രിക് ക്ലോറൈഡിനു (CuCl2. 2H2O) നീലനിറമാണ്. എന്നാല് നിര്ജലീയ കുപ്രിക് ക്ലോറൈഡിന് ഇരുണ്ട തവിട്ടുനിറമാണ്. CuCl2 ചായങ്ങളുടെ നിര്മാണത്തിന് ഉപയോഗിക്കുന്നു. കോപ്പറും ബ്രാമിന്ജലവും തമ്മില് പ്രതിപ്രവര്ത്തിപ്പിച്ച് കുപ്രിക് ബ്രാമൈഡ് (CuBr2) നിര്മിക്കാം. കോപ്പറും അയൊഡിനും നേരിട്ട് സംയോജിച്ച് കുപ്രിക് അയൊഡൈഡ് (Cul2) ഉണ്ടാകുന്നു. എന്നാല് അത് അന്തരീക്ഷ താപനിലയില്പ്പോലും അസ്ഥിരമാണ്. അമോണിയം ലവണങ്ങളിലോ സങ്കരകാര്ബണിക യൗഗികങ്ങളിലോ മാത്രമേ Cul2 സ്ഥിതിചെയ്യുന്നുള്ളൂ. CuCl2, CuBr2 എന്നിവ ജലലേയങ്ങളും അയോണികവുമാണ്. CuF2 അല്പമാത്രമായേ ജലത്തില് ലയിക്കൂ.
കുപ്രസിന്റെയും കുപ്രിക്കിന്റെയും സങ്കര ഹാലൈഡുകള് നിര്മിക്കപ്പെട്ടിട്ടുണ്ട്. കുപ്രസ് സങ്കരഹാലൈഡുകളുടെ പൊതുസൂത്രമാണ് MCuX2. ഇവിടെ X ഹാലജന് അണുവും M സാധാരണയായി ഒരു ക്ഷാരലോഹവും ആയിരിക്കും. ഉദാ. Cs2CuCl3. കുപ്രിക് സങ്കര ഹാലൈഡുകളുടെ സംഘടനം മൗലികമായും Cu Br2- 4 അല്ലെങ്കില് എന്നിവ ഉള്ക്കൊള്ളുന്ന തരത്തിലുള്ളതായിരിക്കും. വ്യത്യസ്ത സംഘടനത്തിലുള്ള നിരവധി ഓക്സി ഹാലൈഡുകളും വേര്തിരിക്കപ്പെട്ടിട്ടുണ്ട്. Cu(OH) Cl, Cu2 (OH)2 Cl2 , Cu Br2, 2Cu (OH)2 തുടങ്ങിയ യൗഗികങ്ങളുടെ സംഘടനങ്ങള് ഇതിനകം സ്ഥിരീകരിച്ചിട്ടുണ്ട്.
സള്ഫൈഡുകള്
ചാല്കോസൈറ്റ് എന്ന ഖനിജരൂപത്തില് Cu2 S പ്രകൃതിയില് സ്ഥിതിചെയ്യുന്നു. ഉയര്ന്ന താപനിലയില് കോപ്പറും സള്ഫറും തമ്മില് സംയോജിച്ച് കുപ്രസ് സള്ഫൈഡ് ഉണ്ടാകുന്നു. നീലക്കറുപ്പു നിറമുള്ള, സ്ഥിരതയുള്ള ഒരു യൗഗികമാണിത്.
കോവെലൈറ്റ് (Covellite) എന്ന ഖനിജരൂപത്തില് കുപ്രിക് സള്ഫൈഡ് (CuS) പ്രകൃതിയിലുണ്ട്. കോപ്പര് ലവണലായനിയിലൂടെ H2 S കടത്തിവിട്ട് CuS നിര്മിക്കാം.
Cu (NO3)2 + H2S → Cu S + 2 HNO3
കറുത്ത പൊടിയാണ് കുപ്രിക് സള്ഫൈഡ്. തപിപ്പിക്കുമ്പോള് Cu2S, S എന്നീ ഘടകങ്ങളായി വിഘടിക്കുന്നു.
സള്ഫേറ്റുകള്
ജലത്തില് വിഘടിച്ചു പോകുന്ന ഒരു പദാര്ഥമാണ് കുപ്രസ് സള്ഫേറ്റ് (Cu2 SO4). അതിനാല് ജലാംശമില്ലാത്ത അന്തരീക്ഷത്തില് മാത്രമേ ഇതിന്റെ നിര്മാണം സാധ്യമാവൂ. കുപ്രിക് ഓക്സൈഡിനോടു ഡൈമീഥൈല് സള്ഫേറ്റ് ചേര്ത്ത് 160ºC വരെ ചൂടാക്കി ഇതു നിര്മിക്കാം.
Cu2 O + (CH3)2 SO4 → Cu2SO4 + (CH3)2 O
ഇളം ചാരനിറമുള്ള ഈ പൊടി അസ്ഥിരമാണ്. ഈര്പ്പമുള്ള വായുവില് ഇതു വിഘടിക്കുന്നു.
Cu2 SO4 → CuSO4 + Cu
"ബ്ലൂ വിട്രിയോള്' എന്നറിയപ്പെടുന്ന കുപ്രിക് സള്ഫേറ്റ് കോപ്പറിന്റെ പ്രധാനപ്പെട്ട ഒരു ലവണമാണ്. ശുദ്ധനീലനിറത്തില് CuSO4. 5H2O ആയി ഇത് ക്രിസ്റ്റലീകരിക്കുന്നു. കോപ്പറിനെ വായു സാന്നിധ്യത്തില് ചൂടാക്കിയ നേര്ത്ത സള്ഫ്യൂരിക്കമ്ലവുമായി പ്രതിപ്രവര്ത്തിപ്പിച്ചോ കോപ്പര് പൈറൈറ്റീസിനെ വറുത്തോ ഇതു നിര്മിക്കാം.
Cu2 + H2 SO4 + ½ O2 → CuSO4 + H2O
വെള്ളത്തില് ലയിക്കും. ആല്ക്കഹോളില് അലേയമാണ്. ബ്ലൂ വിട്രിയോള് ചൂടാക്കിയാല് 230ºC -ല് ജലം നഷ്ടപ്പെട്ട് വെളുത്ത നിര്ജല കോപ്പര് സള്ഫേറ്റായി മാറുന്നു. കുപ്രിക് സള്ഫേറ്റിനെ ചൂടാക്കുമ്പോള് സംഭവിക്കുന്ന മാറ്റങ്ങളെ താഴെ ചേര്ക്കുന്നു.
ആല്ക്കലി സള്ഫേറ്റുകളോടു സംയോജിച്ച് കോപ്പര് സള്ഫേറ്റ് ഇരട്ട ലവണങ്ങള് ഉത്പാദിപ്പിക്കുന്നു.
ഉദാ. K2SO4, CuSO4, 6H2O.
കോപ്പറിന്റെ ശുദ്ധീകരണത്തിലെ ഇലക്ട്രാലൈറ്റായി കോപ്പര്സള്ഫേറ്റ് ലായനിയാണ് ഉപയോഗിക്കുന്നത്. കീടനാശിനി, രോഗാണുനാശിനി എന്നിവയിലും കാലിക്കോമുദ്രണത്തിലും മറ്റു കോപ്പര് ലവണങ്ങളുടെ നിര്മാണത്തിലും കോപ്പര് സള്ഫേറ്റ് ഉപയോഗിക്കുന്നു.
കാര്ബണേറ്റുകള്
Cu CO3. Cu (OH)2. കോപ്പര് ഏതാനും ബേസിക് കാര്ബണേറ്റുകളെ ഉത്പാദിപ്പിക്കുന്നു. ഹൈഡ്രാക്സൈഡുകളുമായി ചേര്ന്നു മാത്രമേ ഇവ സ്ഥിതിചെയ്യുന്നുള്ളൂ. അസുറൈറ്റ്, മാലക്കൈറ്റ് എന്നീ ഖനിജങ്ങള് കോപ്പര് കാര്ബണേറ്റുകളാണ്. ഒരു ക്ഷാരീയ കാര്ബണേറ്റ് കോപ്പര് ലവണലായനിയുമായി കലര്ത്തി ഈ യൗഗികം നിര്മിക്കാം. ഇവയ്ക്ക് ഇരുണ്ട പച്ച നിറത്തിലുള്ള ക്രിസ്റ്റലുകളാണ് ഉള്ളത്. ജലത്തില് അലേയം. ചൂടുവെള്ളത്തില് വിഘടിക്കും. പൊട്ടാസ്യം സയനൈഡില് ലയിക്കുന്നു. ഈ യൗഗികത്തെ സംസ്കരിച്ചു ചായമാക്കി ഉപയോഗിച്ചുവരുന്നു.
കുപ്രിക് അസറ്റേറ്റ്
Cu (C2 H3 O2)2. H2O. വ്യാവസായിക പ്രാധാന്യമുള്ള ഒരു കോപ്പര് യൗഗികമാണിത്. കുപ്രിക് ഓക്സൈഡിനെ അസെറ്റിക്കമ്ലത്തില് ലയിപ്പിച്ച് ഇത് ഉണ്ടാക്കാം. കറുത്തിരുണ്ട പച്ച നിറമുള്ള പൊടിയാണിത്. ആപേക്ഷികഘനത്വം 1.88. ഉരുകല്നില 115ºC. 240ºC-ല് വിഘടിക്കുന്നു. തണുത്ത ജലത്തിലും ചാരായത്തിലും അല്പം മാത്രം ലയിക്കും. എന്നാല് ചൂടുവെള്ളത്തിലും ഈഥറിലും നന്നായി ലയിക്കുന്നു. പെയിന്റ്, കീടനാശിനികള് എന്നിവയുടെ നിര്മാണത്തിന് ഇത് ഉപയോഗിക്കുന്നു.
കുപ്രിക് നൈട്രേറ്റ്
Cu (NO3)2, 2H2O. കോപ്പറോ കോപ്പര് ഓക്സൈഡോ കോപ്പര് കാര്ബണേറ്റോ നേര്ത്ത നൈട്രിക് അമ്ലത്തില് ലയിക്കുമ്പോള് ഈ ലവണം ഉണ്ടാകുന്നു. നീല നിറമുള്ള ആര്ദ്രീഭാവ ക്രിസ്റ്റലുകളാണ് ഇതിനുള്ളത്. ചൂടാക്കുമ്പോള് വിഘടിക്കുന്നു. ശക്തിയേറിയ ഒരു ഓക്സീകാരകമാണിത്.
കുപ്രിക് ഹൈഡ്രോക്സൈഡ്
Cu (OH)2 നീലനിറമുള്ള ജലാറ്റിന ക്രിസ്റ്റലുകളാണ് കുപ്രിക് ഹൈഡ്രോക്സൈഡ്. തണുത്ത വെള്ളത്തില് അലേയം. ചൂടുവെള്ളത്തില് വിഘടിക്കും. ആല്ക്കഹോള്, NH4OH, K C N എന്നിവയില് ലയിക്കും. വര്ണകമായി ഈ യൗഗികം ഉപയോഗിക്കുന്നു.
ആര്സെനിക്കുമായി ചേര്ന്ന് ഒട്ടധികം യൗഗികങ്ങള് കോപ്പര് ഉണ്ടാക്കുന്നുണ്ട്. തിളങ്ങുന്ന പച്ച നിറമുള്ള ഈ യൗഗികങ്ങളെല്ലാം വിഷകരങ്ങളാണ്. കീടനാശിനികളായി ഇവ ഉപയോഗിക്കുന്നു. കുപ്രിക് അസെറ്റോ ആര്സെനൈറ്റ് [പാരിസ് ഗ്രീന്-(Cu O As2 O3)3. Cu (C2 H3 O2)2], കുപ്രിക് ആസിഡ് ഓര്ഥോ ആര്സെനൈറ്റ് [ഷീലേസ് ഗ്രീന് Cu HAs O3] തുടങ്ങിയവ വ്യാവസായിക പ്രാധാന്യമുള്ളവയാണ്.
സങ്കരസംയുക്തങ്ങള്
കോപ്പറിനു നിരവധി സങ്കരസംയുക്തങ്ങളുണ്ട്. സങ്കരകുപ്രസ് യൗഗികങ്ങളില് പ്രധാനപ്പെട്ടവയാണ് കുപ്രമീന് ക്ലോറൈഡ് [Cu (NH3)3 Cl], പൊട്ടാസ്യം കുപ്രാ സയനൈഡ് [K2Cu (CN)3] എന്നിവ. ആദ്യത്തേതില് കോപ്പര് [Cu (NH3)2]+ എന്ന സങ്കരധന അയോണിലും രണ്ടാമത്തേതില് [Cu (CN)3]-2 എന്ന ഋണഅയോണിലും അടങ്ങുന്നു. കുപ്രമോണിയം അയോണ് [Cu (NH3)4]2+ ആണ് കോപ്പര്(II)ന്റെ പ്രധാനപ്പെട്ട ഒരു സങ്കര അയോണ്.
കൂട്ടുലോഹങ്ങള്
കോപ്പറിന് ഗുണമേന്മയുള്ള നിരവധി കൂട്ടുലോഹങ്ങളുണ്ട്. Zn, Sn, Ni, Al, Pb, Mn തുടങ്ങി നിരവധി ലോഹങ്ങളുമായി വ്യത്യസ്ത അളവുകളില് ചേര്ന്നു കോപ്പര് കൂട്ടുലോഹങ്ങള് ഉണ്ടാക്കുന്നു. ഉദാ. പിത്തള (brass), വെങ്കലം (Bronze).
പിത്തള
കോപ്പറിന്റെയും സിന്നിന്റെയും കൂട്ടുലോഹമാണ് പിത്തള. ആഘാതവര്ധ്യത (malleability) യെ അടിസ്ഥാനമാക്കിയാല് ഏകദേശം 55 ശതമാനം കോപ്പറും 45 ശതമാനം സിന്നും ചേര്ന്ന പിത്തളയും വ്യത്യസ്താനുപാതത്തിലുള്ള പിത്തളയും ഉണ്ട്. കോപ്പറിന്റെ അളവു കൂടുതലുള്ള പിത്തളയെ ഉയര്ന്ന താപനിലയിലും അതിശൈത്യത്തിലും പരുവപ്പെടുത്തുവാന് കഴിയും. മറ്റുള്ളവ അങ്ങനെയല്ല. ഇവയെ വെള്ളപ്പിത്തള (white brass)എന്നു പറയുന്നു. ഇതിനുകാര്യമായ വ്യാവസായികോപയോഗമില്ല. കോപ്പറിന്റെയും സിന്നിന്റെയും അനുപാതം പിത്തളയുടെ യാന്ത്രികഗുണധര്മങ്ങളെയും ക്ഷാരണ പ്രതിരോധനശേഷിയെയും സ്വാധീനിക്കുന്നു. പരമാവധി ആഘാതവര്ധ്യത 55 ശതമാനം കോപ്പറിലും പരമാവധി തന്യത (ductility) 70 ശതമാനം കോപ്പറിലും ദൃശ്യമാകുന്നു. ലോഹനിഷ്കര്ഷണശാസ്ത്രമനുസരിച്ച് മൂന്നുതരം പിത്തളയുണ്ട്. (i) ആല്ഫാപിത്തള: ഇതില് സിന്നിന്റെ അളവ് 35 ശതമാനത്തില് കുറവായിരിക്കും. സിങ്ക് കോപ്പറില് ലയിച്ച കോപ്പറിന്റെ മൗലികഘടനയായിരിക്കും കൂട്ടുലോഹത്തിനും. (ii) ബീറ്റാ പിത്തള: ഇതില് സിന്നിന്റെ അളവ് 36 ശതമാനം മുതല് 45 ശതമാനം വരെയാണ്. ഈ കൂട്ടുലോഹത്തില് ഈ ദി യൗഗികരൂപത്തില് നിലനില്ക്കും. ഉയര്ന്ന താപനിലയില് ഇതിനെ എളുപ്പം പരുവപ്പെടുത്താം. (iii) ഗാമാപിത്തള: ഇതില് സിന്നിന്റെ അളവ് 45 ശതമാനത്തില് അധികമാണ്. Cu3 Zn2 ക്രിസ്റ്റലുകള് കൂട്ടുലോഹത്തില് ഉണ്ടായിരിക്കും. പിത്തള തികച്ചും കോപ്പറിന്റെയും സിന്നിന്റെയും കൂട്ടുലോഹം ആണെങ്കിലും ചില പ്രത്യേക ഗുണവിശേഷങ്ങള് കൈവരുത്തുന്നതിനായി ലെഡ്, അയേണ് തുടങ്ങിയവ നാമമാത്രമായ അളവില് ചേര്ക്കാറുണ്ട്. വ്യാവസായികമായി അറിയപ്പെടുന്ന ഏതാനും പിത്തളയിനങ്ങള് പരാമര്ശിക്കുന്നു.
1. ഗില്ഡിങ് പിത്തള (Cu 95 ശ.മാ.; Zn 5 ശ.മാ.; Pb 0.003 ശ.മാ.; Fe 0.05 ശ.മാ.)
2. ചുവന്ന പിത്തള (Cu 85 ശ.മാ.; Zn 15 ശ.മാ.; Pb 0.06 ശ.മാ.; Fe 0.05 ശ.മാ.)
3. കാട്രിഡ്ജ് പിത്തള (Cu 70 ശ.മാ.; Zn 29 ശ.മാ.; Pb 0.07 ശ.മാ.; Fe 0.05 ശ.മാ.)
4. മഞ്ഞപ്പിത്തള (Cu 65 ശ.മാ.; Zn 34 ശ.മാ.; Pb 0.15 ശ.മാ.; Fe 0.05 ശ.മാ.)
5. മണ്ട്സ് മെറ്റല് (Cu 60 ശ.മാ.; Zn 39 ശ.മാ.; Pb 0.03 ശ.മാ.; Fe 0.07 ശ.മാ.)
കോപ്പറിനെ അപേക്ഷിച്ച് ഗുണധര്മങ്ങളില് ഒട്ടധികം വ്യത്യാസങ്ങള് പിത്തളയ്ക്കുണ്ട്. വലിച്ചുനീട്ടല്, അടിച്ചു പരത്തല്, ഉറപ്പിനു വ്യത്യാസം വരാതിരിക്കല് തുടങ്ങിയവയാണ് പിത്തളയുടെ നേട്ടങ്ങള്. നേര്ത്ത കമ്പികളായോ കട്ടികുറഞ്ഞ തകിടുകളായോ കുഴലുകളായോ ദണ്ഡുകളായോ പിത്തളയെ പരുവപ്പെടുത്താം.
വെങ്കലം അഥവാ വെള്ളോട് (bronze)
കോപ്പര്, ടിന് എന്നിവയുടെ കൂട്ടുലോഹമാണ് വെങ്കലം. കോപ്പറിനെക്കാള് ഉറപ്പുള്ളതും അത്രകണ്ടു വലിച്ചുനീട്ടാന് ആവാത്തതുമാണ് ഈ കൂട്ടുലോഹം. സാധാരണയായി 88 ശതമാനം കോപ്പറും 12 ശതമാനം ടിന്നും ചേര്ന്നതാണ് വെങ്കലം. നാണയങ്ങള്, സ്പ്രിങ്ങുകള്, മെഡലുകള്, ടര്ബൈനുകള്, ബ്ലെയ്ഡുകള്, പ്രാപ്പല്ലറുകള്, പ്രതിമകള് തുടങ്ങി നിരവധി വസ്തുക്കളുടെ നിര്മാണത്തിന് വെങ്കലം പ്രയോജനപ്പെടുത്തുന്നു. ഒരു മൃദുവായ കൂട്ടുലോഹമാണ് ഗണ്മെറ്റല്. ഇതില് കോപ്പറും ടിന്നും സിന്നും വ്യത്യസ്ത അളവില് അടങ്ങിയിരിക്കും. തോക്കുകള് നിര്മിക്കുവാനാണ് ഇവ പ്രധാനമായും ഉപയോഗിക്കുന്നത്.
ഫോസ്ഫറസുകൂടി ചേര്ത്തു നിര്മിക്കുന്ന വെന്നലങ്ങളെ ഫോസ്ഫര് ബ്രാണ്സുകള് എന്നു പറയുന്നു. ഇവയില് ഫോസ്ഫറസിന്റെ അളവ് പൊതുവേ ഒരു ശതമാനത്തില് താഴെയാണെങ്കിലും അതു കൂട്ടുലോഹത്തിന്റെ ഗുണധര്മങ്ങളെ കാര്യമായി സ്വാധീനിക്കുന്നു. പമ്പ്, വാല്വ്, ബെയറിങ് തുടങ്ങിയവയുടെ നിര്മാണത്തിന് ഈ കൂട്ടുലോഹം ഉത്തമമാണ്. ചെറിയ തോതില് മാങ്ഗനീസ് ചേര്ത്തും വെന്നലത്തിന്റെ ഗുണമേന്മ വര്ധിപ്പിക്കാം. പലതരത്തിലുള്ള മാങ്ഗനീസ് വെങ്കലങ്ങള് (manganese bronzes)ഇന്നു ലഭ്യമാണ്. ചിലതില് ടിന് നാമമാത്രമായിരിക്കും. ചിലതില് സിന്നും ചേര്ത്തിരിക്കും. മാങ്ഗനീസ് ബ്രാണ്സുകള് പല ഗ്രഡുകളില് ഉണ്ട്. ഒരു ഗ്രഡിലുള്ളതില് 0.5 ശതമാനത്തില് കുറവുമാത്രമേ മാങ്ഗനീസുള്ളൂ. മാങ്ഗനീസും (2-5 ശ.മാ.) അയേണും (2-4 ശ.മാ.) അലുമിനിയവും (3-75 ശ.മാ.) കലര്ന്നിട്ടുള്ള ഒരു തരം മാങ്ഗനീസ് ബ്രാണ്സുണ്ട്. ഉയര്ന്ന ബലമുള്ള ഈ കൂട്ടുലോഹത്തെ ഉന്നത ബല മാങ്ഗനീസ് ബ്രാണ്സ് എന്നും മാങ്ഗനീസ്-അലുമിനിയം ബ്രാണ്സ് എന്നും വിളിക്കുന്നു.
കോപ്പറും നിക്കലും പൂര്ണമായി മിശ്രിതപ്പെടുത്താനാവും. ഒരു ശ്രണി ഖരലായനികള്ക്ക് ഇതു രൂപംനല്കുന്നു. രണ്ടു മുതല് 45 ശതമാനം വരെ നിക്കല് കോപ്പറിനോടുചേര്ത്ത് കൂട്ടുലോഹങ്ങള് ഉണ്ടാക്കുന്നു. ഇവ കുപ്രാനിക്കലുകള് എന്ന് അറിയപ്പെടുന്നു. കോപ്പറിനെക്കാള് ഉറപ്പും ഓക്സീകരണ പ്രതിരോധശേഷിയും ഇവയ്ക്കുണ്ട്. നീരാവി സാന്ദ്രീകരണ ട്യൂബുകളുടെ നിര്മാണത്തിന് ഇവ സൗകര്യപ്രദമാണ്. 40 മുതല് 45 ശതമാനം വരെ നിക്കല് അടങ്ങിയിട്ടുള്ള കൂട്ടുലോഹമാണ് കോണ്സ്റ്റാന്റന്. ഉയര്ന്ന വിദ്യുത്-പ്രതിരോധശേഷി ഈ കൂട്ടുലോഹത്തിനുണ്ട്. താപയുഗ്മകങ്ങള്, പ്രതിരോധകങ്ങള് എന്നിവ നിര്മിക്കാന് ഇതുപയോഗിക്കുന്നു. കോപ്പര്, സിന്ന്, നിക്കല് എന്നീ ലോഹങ്ങള് പല അളവുകളില് ചേര്ത്ത് ജര്മന് സില്വര് ഉണ്ടാക്കുന്നു.
കോപ്പര്-നിക്കല് ധാതുവിന്റെ നിരോക്സീകരണത്തില് ഉണ്ടാകുന്ന ഒരു കൂട്ടുലോഹമാണ് മോണല് മെറ്റല്. കോപ്പറിനോടൊപ്പം 65 ശതമാനം നിക്കലും ചെറിയ അളവില് അയേണ് മാങ്ഗനീസ് എന്നിവയും ഇതില് അടങ്ങിയിരിക്കും. എന്ജിനീയറിങ് വ്യവസായത്തിലും ആഭരണനിര്മാണത്തിലും ഇതിനു വമ്പിച്ച പ്രാധാന്യമുണ്ട്.
ബെറിലിയം കോപ്പറില് ബെറിലിയവും കോപ്പറും കൂടാതെ ചെറിയ അളവില് നിക്കലോ കോബാള്ട്ടോ കൂടിചേര്ന്നിരിക്കും. 800ºC വരെ ഇതിനെ ചൂടാക്കി ചൂടുവെള്ളത്തില് പെട്ടെന്നു മുക്കിയതിനുശേഷം വീണ്ടും 275ºC വരെ ചൂടാക്കിയാല് ഉരുക്കിനെപ്പോലെ വലിവുബലം പ്രദര്ശിപ്പിക്കും.
അലുമിനിയവുമായി ചേര്ന്നുള്ള ഒട്ടധികം കൂട്ടുലോഹങ്ങള് കോപ്പറിനുണ്ട്. ഇവയെ പൊതുവേ അലുമിനിയം ബ്രാണ്സുകള് എന്നുവിളിക്കുന്നു. ഇവയില് 7.5 ശതമാനം വരെ അലുമിനിയം അടങ്ങിയിട്ടുള്ളവ അങ്ങേയറ്റം അടിച്ചു പരത്താവുന്നവയാണ്. 8 മുതല് 11 ശതമാനം വരെ അലുമിനിയം ഉള്ളവയ്ക്ക് വലിവുബലം ഏറും.
96 ശതമാനം കോപ്പറും ബാക്കി സിലിക്കണും അടങ്ങിയ കൂട്ടുലോഹമാണ് സിലിക്കണ് ബ്രാണ്സ്. മാങ്ഗനീസ്, ഇരുമ്പ്, സിങ്ക് തുടങ്ങിയവയും ചില പ്രത്യേക ഗുണധര്മങ്ങള്ക്കായി ചേര്ക്കാറുണ്ട്. പ്രബലങ്ങളായ ക്ഷാരണരോധികളെന്നതാണ് ഇവയ്ക്കുള്ള വ്യാവസായിക പ്രാധാന്യം.
ഇവ കൂടാതെ വിവിധ അളവുകളില് കോപ്പര് അടങ്ങിയിട്ടുള്ള ധാരാളം കൂട്ടുലോഹങ്ങള് നിര്മിക്കപ്പെട്ടിട്ടുണ്ട്. ഇവയെല്ലാം വ്യാവസായിക പ്രാധാന്യമുള്ളവയാണ്.
സവിശേഷതകള്. കോപ്പറിനെ മറ്റു ലോഹങ്ങളില് നിന്നു വ്യത്യസ്തമാക്കുന്ന നിരവധി സവിശേഷതകളുണ്ട്. (i) ഉയര്ന്ന വിദ്യുത്ചാലകതയും താപചാലകതയും, (ii) പരുവപ്പെടുത്താന് സൗകര്യം, (iii) ക്ഷാരണപ്രതിരോധശേഷി, (iv) കോപ്പറിനും അതിന്റെ ഏതാനും യൗഗികങ്ങള്ക്കുമുളള രാസത്വരകശേഷി, (v) വിശിഷ്ട സ്വഭാവങ്ങളുള്ള കൂട്ടുലോഹങ്ങള് നിര്മിക്കാനുള്ള കഴിവ്, (vi) അകാന്തികസ്വഭാവം, (vii) മറ്റു ലോഹങ്ങളെ അപേക്ഷിച്ച് സ്ഫുലിംഗങ്ങള് (spark) ഉണ്ടാകാതിരിക്കല്.
നിദര്ശനം
ബുണ്സണ് ജ്വാലയ്ക്ക് കോപ്പര് പച്ചനിറം നല്കും. കുപ്രിക് ലവണങ്ങളുടെ നേര്ത്ത ലായനിയില് പൊട്ടാസ്യം ഫെറോസയനൈഡ് ലായനി ചേര്ക്കുമ്പോള് തവിട്ടുനിറം ഉണ്ടാകും. കുപ്രിക് ലവണ ലായനികള് അധികം അമോണിയയില് കടുത്ത നീലനിറം സൃഷ്ടിക്കുന്നു. സ്പെക്ട്രാഗ്രാഫിലൂടെ വളരെ ചെറിയ അളവിലുള്ള കോപ്പറിനെപ്പോലും നിദര്ശനം ചെയ്യാം. പരിമാണാത്മകനിര്ണയത്തിനു വൈദ്യുതവിശ്ലേഷണ രീതിയും പൊട്ടാസ്യം അയോഡൈഡ് അനുമാപനവും ഉപയോഗിച്ചുവരുന്നു.
കോപ്പറും ജീവശാസ്ത്രവും
സസ്യങ്ങളില് ക്ലോറോഫില് സംശ്ലേഷണത്തിലും എന്സൈമുകളുടെ പ്രവര്ത്തനത്തിലും കോപ്പര് അതിസൂക്ഷ്മമായ അളവില് നിര്ണായക പങ്ക് വഹിക്കുന്നു. ചെറിയ സസ്യരൂപങ്ങളുടെ വളര്ച്ചയ്ക്കും പ്രത്യുത്പാദനത്തിനും നേരിയ അളവില് കോപ്പര് ആവശ്യമാണ് ആവശ്യമായത്ര കോപ്പര് ഇല്ലെങ്കില് സസ്യങ്ങളില് പ്രകാശസംശ്ലേഷണം മന്ദീഭവിക്കുക, വിത്ത് ഉത്പാദിപ്പിക്കാനുള്ള കഴിവ് നശിക്കുക തുടങ്ങിയ ദോഷങ്ങള് ഉണ്ടാകും. മണ്ണില് കോപ്പര് അധികമായാല് അത് മണ്ണിനെ വിഷകരമാക്കും. ഇത് സസ്യങ്ങള്ക്കും നല്ലതല്ല. കോപ്പര് അടങ്ങിയിട്ടുള്ള കീടനാശിനികള് തളിക്കുമ്പോള് ഇക്കാര്യം ഓര്ക്കേണ്ടതുണ്ട്.
ജന്തുക്കളിലെ ഉപാപചയ പ്രവര്ത്തനങ്ങള്ക്കും കോപ്പര് ആവശ്യമുണ്ട്. പ്രായപൂര്ത്തിയായ ഒരാളുടെ ശരീരത്തില് ശരാശരി 100-150 മില്ലി ഗ്രാം കോപ്പര് ഉണ്ടായിരിക്കും. ഒരു മനുഷ്യനു പ്രതിദിനം ശരാശരി 2 മില്ലിഗ്രാം കോപ്പര് ആവശ്യമാണ്. ശരീരത്തില് കോപ്പര് അധികവും കരളിലും എല്ലിലുമാണ് ശേഖരിക്കുന്നത്. രക്തത്തില് ധാരാളം കോപ്പര് പ്രോട്ടീനുകള് അടങ്ങിയിട്ടുണ്ട്. ഹീമോഗ്ലോബിനില് കോപ്പര് ഇല്ലെങ്കിലും അതിന്റെ സംശ്ലേഷണത്തില് കോപ്പറിനു പങ്കുണ്ട്. കോപ്പറിന്റെ അളവ് ശരീരത്തില് കുറവുള്ളവരില് വിളര്ച്ച വേഗം പിടിപെടാന് സാധ്യതയുണ്ട്. കോപ്പര് യൗഗികങ്ങള് പൊതുവേ വിഷകരങ്ങളാണ്. കോപ്പറിന്റെ ആധിക്യം വളര്ച്ച മന്ദീഭവിക്കാനും മഞ്ഞപ്പിത്തം, കരളിലെ സിറോസിസ് തുടങ്ങിയ രോഗങ്ങള് ഉണ്ടാകാനും കാരണമാകും.
(ചുനക്കര ഗോപാലകൃഷ്ണന്, ജെ.കെ. അനിത)