This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
കൊളോയ്ഡ്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
കൊളോയ്ഡ്
Colloid
കണങ്ങളുടെ വലുപ്പത്തെ അടിസ്ഥാനമാക്കിയുള്ള പദാര്ഥത്തിന്റെ പ്രത്യേകമായ ഒരു അവസ്ഥ. പശ എന്നര്ഥമുള്ള കൊള (Kolla) എന്ന ഗ്രീക്ക് പദത്തില് നിന്നാണ് കൊളോയ്ഡ് എന്ന പദം 1861-ല് തോമസ് ഗ്രഹാം എന്ന ശാസ്ത്രകാരന് രൂപീകരിച്ചത്. നഗ്നനേത്രങ്ങള്കൊണ്ട് കാണാന് കഴിയുന്നതില് ചെറുതും ലഘുതന്മാത്രീയമായ വിമ(dimension)കളെക്കാള് വലുതും ആയ കണങ്ങള് മാത്രം അടങ്ങിയ ഒരു പദാര്ഥത്തെ കൊളോയ്ഡ് എന്നു വിളിക്കാം. ലീനം കൊളോയ്ഡ് അവസ്ഥയില് സ്ഥിതിചെയ്യുന്ന ലായനിയെ കൊളോയ്ഡ് ലായനി എന്നു പറയുന്നു. കൊളോയ്ഡുകള് ലായനിയില് വളരെ സാവധാനത്തിലേ വിസരിക്കുകയുള്ളൂ. അവയ്ക്ക് ജന്തുചര്മങ്ങളില്ക്കൂടി കടക്കാനും കഴിവില്ല. ഈ സ്വഭാവമുള്ള പദാര്ഥങ്ങളെ കുറിക്കുന്നതിനാണ് തോമസ് ഗ്രഹാം ആദ്യമായി കൊളോയ്ഡ് എന്ന പദം പ്രയോഗിച്ചത് സാധാരണ ലായനികളും കൊളോയ്ഡീയ ലായനികളും തമ്മിലുള്ള വ്യത്യാസം കൊളോയ്ഡീയ ലായനികളില് ലേയകണങ്ങള് വളരെ വലുതാണെന്നതാണ്. കൊളോയ്ഡ് കണങ്ങളുടെ വ്യാസം 107 സെന്റിമീറ്ററിനും 104 സെന്റിമീറ്ററിനും ഇടയ്ക്കാണെന്ന് ഏകദേശമായി കണക്കാക്കിയിരിക്കുന്നു. കണങ്ങളുടെ വ്യാസം 107 സെന്റിമീറ്ററില് കുറവാണെങ്കില് ലായനി ക്രിസ്റ്റലോയ്ഡ് ആയിരിക്കും; ഇവ ലായനിയില് അതിവേഗം വിസരിക്കുന്നവയും സസ്യ, ജന്തു ചര്മങ്ങളില്ക്കൂടി കടക്കുന്നവയുമാണ്. കണങ്ങളുടെ വ്യാസം 104 സെന്റിമീറ്ററില് കൂടുതലാണെങ്കില് നിലംബനങ്ങളും. നിലംബനങ്ങള്ക്കും സാധാരണ ലായനികള്ക്കും ഇടയ്ക്കുകിടക്കുന്ന ഒരു മാധ്യമികാവസ്ഥയാണ് കൊളോയ്ഡീയാവസ്ഥ എന്നു പറയാം.
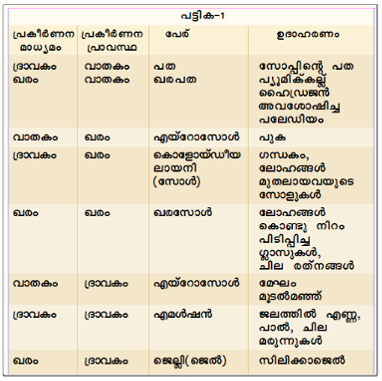
കൊളോയ്ഡീയ ലായനി ഭിന്നാത്മകമാണ്. ഇതില് രണ്ടു പ്രാവസ്ഥകളുണ്ട്; 'ലേയകണങ്ങള്' എന്ന പ്രകീര്ണനപ്രാവസ്ഥയും (dispersed phase) 'ലായക'മെന്ന പ്രകീര്ണനമാധ്യമവും (dispersion medium). സോഡിയം ഒലിയേറ്റ് ജലലായനി ഒരു കൊളോയ്ഡ് ലായനിയാണ്. ഇതില് സോഡിയം ഒലിയേറ്റ് പ്രകീര്ണനപ്രാവസ്ഥയും ജലം പ്രകീര്ണനമാധ്യമവുമാണ്. പ്രകീര്ണനപ്രാവസ്ഥ ഖരമോ ദ്രവമോ വാതകമോ ആകാം. പ്രകീര്ണനമാധ്യമവും ഈ അവസ്ഥകളില്പെടാം. അങ്ങനെ എട്ടുതരം കൊളോയ്ഡ് ലാനികള് സാധ്യമാണ്. ഇവ താഴെ പട്ടികയായി കൊടുത്തിരിക്കുന്നു.
കൊളോയ്ഡുകള് രണ്ടു തരമുണ്ട്; തന്മാത്രീയ കൊളോയ്ഡുകളും സംഗുണന കൊളോയ്ഡുകളും. തന്മാത്രീയ കൊളോയ്ഡുകളുടെ തന്മാത്രകള് സ്വതേതന്നെ വലുപ്പമേറിയവയാണ്. അവ എല്ലാ ലായനികളിലും കൊളോയ്ഡുകളായിരിക്കും. ആല്ബുമിന്, സ്റ്റാര്ച്, സെല്ലുലോസ് മുതലായവ ഈ വിഭാഗത്തില്പ്പെടുന്നു. എന്നാല് അനേകം തന്മാത്രകള് ഒന്നുചേര്ന്നതാണ് സംഗുണന കൊളോയ്ഡുകള്. ഇവയുടെ ക്രിസ്റ്റലോയ്ഡ് ലായനികള് നിര്മിക്കാന് സാധിക്കും.
ചില പൊതുസ്വഭാവങ്ങള് ഉള്ളതിനാലും താപനില തുടങ്ങിയ ഘടകങ്ങളെ ആശ്രയിച്ചുള്ള നിലനില്പ്പുള്ളതിനാലും കൊളോയ്ഡുകളെ ദ്രവ്യത്തിന്റെ ഒരു പ്രത്യേക അവസ്ഥയായി മുന്കാലങ്ങളില് പരിഗണിച്ചിരുന്നു. ഈ സിദ്ധാന്തം ഇന്നു പാടെ ഉപേക്ഷിക്കപ്പെട്ട നിലയിലാണ്. ജീവശാസ്ത്രത്തില് വളരെ പ്രധാന്യമുള്ളവയാണ് കൊളോയ്ഡുകള്. ജീവന് എന്ന പ്രതിഭാസം ശരീരത്തിലെ കൊളോയ്ഡുകള്ക്ക് ജലത്തെ ഉള്ക്കൊള്ളുന്നതിനും പിടിച്ചുനിര്ത്തുന്നതിനുമുള്ള കഴിവിനെ അടിസ്ഥാനമാക്കിയിരിക്കുന്നു. നിത്യജീവിതത്തിലും ഇവയ്ക്ക് പ്രാധാന്യമുണ്ട്. വെണ്ണ, മഷി, പെയിന്റ്, സില്ക്ക്, രോമം, പ്ലാസ്റ്റിക്, ജലാറ്റിന്, പ്രോട്ടീന് തുടങ്ങിയവ ഉപകാരപ്രദങ്ങളായ കൊളോയ്ഡുകളില് ചിലവയാണ്. ആല്ബുമിന്, പശ തുടങ്ങിയവയെ ഡയാലിസിസ് (dialysis) ചെയ്യുമ്പോള് പാര്ച്ചുമെന്റ് പേപ്പറില് തങ്ങിനില്ക്കുന്ന പദാര്ഥങ്ങളെ കുറിക്കുന്നതിനാണ് കൊളോയ്ഡ് എന്ന പദം ആദ്യം ഇപയോഗിച്ചിരുന്നത്. ഇന്ന് കൊളോയ്ഡ് ലായനി സോള് (sol) എന്ന പേരിലും അറിയപ്പെടുന്നു.
ചരിത്രം. അതിപ്രാചീനകാലം മുതല് തന്നെ കൊളോയ്ഡുകളുടെ നിര്മാണത്തിനുള്ള പദ്ധതികള് ആവിര്ഭവിച്ചിരുന്നു. ഉണങ്ങിയ മരയാപ്പുകള് പാറകള്ക്കിടയില് തല്ലിക്കയറ്റി നനച്ച് പാറപൊട്ടിക്കുന്ന സമ്പ്രദായം പണ്ടുകാലത്ത് നിലവിലിരുന്നു. ഈ പ്രക്രിയ കൊളോയ്ഡുകളുടെ ചീര്ക്കല്മര്ദത്തിന്റെ പ്രായോഗിക പ്രയോജനമാണെന്ന ശാസ്ത്രീയവശം ഒരു പക്ഷേ, അന്ന് അറിഞ്ഞിരിക്കാനിടയില്ല. മധ്യകാലഘട്ടത്തിലെ ആല്കെമിസ്റ്റുകള് സ്വര്ണത്തിന്റെ കൊളോയ്ഡ് രൂപം മരുന്നുകള്ക്കും മറ്റുമായി ഉപയോഗിച്ചിരുന്നു. സ്വര്ണലവണങ്ങളെ ടിന് ലായനികളുപയോഗിച്ച് നിരോക്സീകരിച്ച് കൊളോയ്ഡ് നിര്മിക്കുന്ന രീതി 1685 മുതല് നിലവിലിരുന്നു.
കൊളോയ്ഡുകളെപ്പറ്റിയുള്ള ശാസ്ത്രീയപഠനം ആരംഭിക്കുന്നത് 19-ാം ശ. മുതല്ക്കാണ്, എഫ്.റ്യൂസ്, റോബര്ട്ട്, ബ്രൗണ്, ഫ്രാന്സസ്കൊ സെല്മി, എഫ്.എം. ആഷര്സണ് തുടങ്ങിയവരാണ് ആദ്യത്തെ കൊളോയ്ഡ് ഗവേഷകര്, കൊളോയ്ഡ് കണങ്ങള്ക്ക് വിദ്യുത്മണ്ഡലത്തിലുണ്ടാകുന്ന ചലനങ്ങളെപ്പറ്റിയാണ് റ്യൂസ് പഠനം നടത്തിയത് (1809). ഒരു 'U' കുഴലില് കളിമണ്പ്ലഗ് ഘടിപ്പിച്ച ശേഷം അദ്ദേഹം അതില് വെള്ളം നിറച്ചു. കുഴലിന്റെ രണ്ടു വശങ്ങളിലായി വൈദ്യുത പൊട്ടന്ഷ്യലിന് വ്യത്യാസം വരുത്തിയപ്പോള് ജലം ഋണ-ഇലക്ട്രോഡിന്റെ ഭാഗത്തേക്കു നീങ്ങി; കളിമണ് കണങ്ങള് ധന-ഇലക്ട്രോഡിലേക്കും. ഒരു വിദ്യുത്മണ്ഡലത്തില് ഇപ്രകാരം നിലംബിത കൊളോയ്ഡ് കണങ്ങളും ദ്രാവകങ്ങളും ചലിക്കുന്ന പ്രക്രിയ ഇലക്ട്രോഫോറസിസ് (Electrophoresis) എന്ന് അറിയപ്പെടുന്നു. മറ്റൊരു പ്രധാനപ്പെട്ട കണ്ടെത്താലാണ് ബ്രൌണിയന്ചലനം. നിലംബനത്തിലെ കൊളോയ്ഡ് കണങ്ങള് നിതാന്തമായ, ക്രമരഹിതമായ ചലനത്തിലാണ് എന്നതാണ് ഈ കണ്ടെത്തല്. പൂമ്പൊടിയുടെ ജലീയനിലംബനത്തെപ്പറ്റി പഠിച്ചുകൊണ്ടിരിക്കവേ 1827-ല് റോബര്ട്ട് ബ്രൌണ് എന്ന സസ്യശാസ്ത്രജ്ഞനാണ് കൊളോയ്ഡുകളുടെ ഈ സ്വഭാവം പ്രഖ്യാപിച്ചത്. കൊളോയ്ഡീയ കണങ്ങളും ലായനികളിലെ തന്മാത്രകളും തമ്മിലുള്ള സംഘടനത്തിന്റെ ഫലമായി ബ്രൗണിയന്ചലനം ഉണ്ടാകുന്നുവെന്നതാണ് ഇപ്പോഴത്തെ നിഗമനം. ജര്മന് വൈദ്യശാസ്ത്രജ്ഞനായ ആഷര്സണ് ജീവശാസ്ത്രപ്രധാനങ്ങളായ കൊളോയ്ഡുകളെപ്പറ്റി പഠനം നടത്തി. രക്തത്തിലെ സിറം, മുട്ടയിലെ വെള്ളക്കരു തുടങ്ങിയവയിലായിരുന്നു ഇദ്ദേഹം ഗവേഷണം നടത്തിയത്. ഫ്രാന്സസ്കൊ സെല്മി എന്ന ഇറ്റാലിയന് രസതന്ത്രജ്ഞന് അകാര്ബണിക കൊളോയ്ഡുകളെ വിശദമായി പഠിക്കുകയും വിലപ്പെട്ട റിപ്പോര്ട്ടുകള് തയ്യാറാക്കി പ്രസിദ്ധീകരിക്കുകയും (1845-50) ചെയ്തു. സില്വര് ക്ലോറൈഡ്, പ്രഷ്യന് ബ്ലൂ, സള്ഫര് എന്നിവയെയാണ് ഇദ്ദേഹം മുഖ്യമായും പഠനവിധേയമാക്കിയത്. ലവണങ്ങള് ചേര്ത്താല് ഈ കൊളോയ്ഡുകള് കൊയാഗുലീകരിക്കും (coagulate) എന്ന് സെല്മി പ്രസ്താവിച്ചു. വിവിധ ലവണങ്ങളുടെ കൊയാഗുലനശേഷി വ്യത്യസ്തമാണെന്നും ഇദ്ദേഹം കണ്ടു. കൊളോയ്ഡ് ലായനിയില് കേവലം ലഘു തന്മാത്രകളായല്ല, തന്മാത്രകളുടെ സംയോജിത രൂപമായിട്ടാണ് കണങ്ങള് സ്ഥിതിചെയ്യുന്നതെന്നും ഇദ്ദേഹം വെളിപ്പെടുത്തി. ആധുനിക കൊളോയ്ഡ് ശാസ്ത്രത്തിന്റെ സ്ഥാപകനായാണ് സ്കോട്ടിഷ് രസതന്ത്രജ്ഞനായ തോമസ് ഗ്രഹാം (1805-69) അറിയപ്പെടുന്നത്. കൊളോയ്ഡുകളുടെ വിവിധ ഗുണധര്മങ്ങളെ ഇദ്ദേഹം കണ്ടെത്തി. ക്രിസ്റ്റലീയതയുടെ അഭാവം, താഴ്ന്ന വിസരണനിരക്ക് തുടങ്ങിയവ ഈ കൂട്ടത്തില്പ്പെടുന്നു. കൊളോയ്ഡുകളുടെ ജീവശാസ്ത്രപരമായ പ്രാധാന്യങ്ങളും ഗ്രഹാം മനസ്സിലാക്കി. സോള് (sol), ജെല് (gel), പെപ്റ്റീകരണം (peptisation), സിനറിസിസ് (syneresis) തുടങ്ങി കൊളോയ്ഡ് ശാസ്ത്രവുമായി ബന്ധപ്പെട്ട പല പദങ്ങളും ആ പദങ്ങള്ക്കു പിന്നിലുള്ള ശാസ്ത്രവും ഗ്രഹാമിന് അവകാശപ്പെട്ടതാണ്. ഖരവസ്തുക്കള് ചെറുകണികകളായി പ്രകീര്ണനം ചെയ്തുണ്ടാകുന്നതാണ് സോള്. പ്രകീര്ണനമാധ്യമത്തിന്റെ പേരിനെ അടിസ്ഥാനമാക്കി സോളിന്റെ പേരും വ്യത്യാസപ്പെടുന്നു. ഉദാ. ഹൈഡ്രോസോള് (ജലത്തിലുള്ള സോള്), എയ്റോസോള് (വായുവിലുള്ള സോള്), ആല്ക്കോസോള് (ചാരായത്തിലുള്ള സോള്) മുതലായവ. ഖര കണികകള് അന്യോന്യം ബന്ധിച്ച് യാന്ത്രികബലത്തോടുകൂടിയ ഏതെങ്കിലും പ്രത്യേകമായ ആകൃതിയില് സ്ഥിതിചെയ്യുന്നതാണ് ജെല്. അവക്ഷിപ്തം (precipitate) സ്വയം പ്രകീര്ണനം ചെയ്യപ്പെട്ട് കൊളോയ്ഡ് ലായനി സൃഷ്ടിക്കുന്ന പ്രക്രിയയ്ക്ക് പെപ്റ്റീകരണം എന്നു പേരു നല്കി. പ്രകീര്ണനമാധ്യമത്തിന്റെ സ്രവണത്തോടുകൂടി ജെല് സങ്കോചിക്കുന്നതിനെയാണ് സിനറസിസ് എന്നു പറയുന്നത്. 17-ാം ശതകത്തിലെ ആല്ക്കെമിസ്റ്റുകള് സ്വര്ണത്തിന്റെ ക്ളോറൈഡുകളെ നിരോക്സീകരിച്ച് ആകര്ഷണീയമായ നിറത്തിലുള്ള സ്വര്ണസോളുകള് നിര്മിച്ചിരുന്നു. എന്നാല് ഈ സോളുകളുടെ നിര്മാണത്തിന്റെയും ഗുണധര്മങ്ങളുടെയും ശാസ്ത്രീയവശത്തെപ്പറ്റി പഠിച്ചത് മൈക്കല് ഫാരഡെ (1857) ആണ്. ലവണങ്ങള് ചേരുമ്പോള് സോളുകളുടെ നിറം മാറുന്നുവെന്ന് ഇദ്ദേഹം കണ്ടു. സോളിലൂടെ പ്രകാശപുഞ്ജത്തെ കടത്തിവിട്ട്, പ്രകാശത്തിന്റെ ദിശയ്ക്ക് 90° എതിരെ വീക്ഷിച്ചാല് പ്രകാശപുഞ്ജത്തെ കാണാന് കഴിയുമെന്നും ഫാരഡെ പ്രസ്താവിച്ചു. ഈ പ്രഭാവത്തെ ജോണ് ടിന്ഡാള് എന്ന ശാസ്ത്രജ്ഞന് പില്ക്കാലത്ത് വിശദീകരിക്കുകയും ഇത് ടിന്ഡാള് പ്രഭാവം (Tyndall effect) എന്ന് അറിയപ്പെടുകയും ചെയ്തു. അമേരിക്കയിലെ കാരേ ലീ (1823-97) വെള്ളിയുടെ സോളുകളെപ്പറ്റി പഠനം നടത്തി. വിദ്യുത്ഡയലസനം (electrodialysis), ആള്ട്രാഫില്ട്രേഷന് (Ultrafiltration) തുടങ്ങിയ പ്രക്രിയകള് കൊളോയ്ഡുകളുടെ നിര്മാണത്തിനും ശുദ്ധീകരണത്തിനുമായി ഏര്പ്പെടുത്തിയത് ഇദ്ദേഹമാണ്. ഹാന്സ് ഷൂള്സ്, ഡബ്ല്യു .ബി. ഹാര്ഡി, ഹോഫ്മൈസ്റ്റര് എന്നിവരും 19-ാം ശതകത്തിലെ കൊളോയ്ഡ് ശാസ്ത്രകാരന്മാരുടെ മുമ്പന്തിയില് നില്ക്കുന്നു.
എച്ച്. സിഡന്റോഫ്, ആര്. സിഗ്മോണ്ടി എന്നിവര് ചേര്ന്ന് അള്ട്രാമൈക്രോസ്കോപ്പ് കണ്ടുപിടിച്ചതോടെ (1903) കൊളോയ്ഡ് ഗവേഷണത്തില് വമ്പിച്ച പുരോഗതി ഉണ്ടായി. അതിസൂക്ഷ്മകണങ്ങളെപ്പോലും നിദര്ശിക്കാന് ഈ ഉപകരണത്തിനു കഴിയും. സാധാരണ മൈക്രോസ്കോപ്പുകളിലൂടെ 2000 ആംങ്സ്ട്രം വലുപ്പത്തിലുള്ള കണങ്ങളെവരെ മാത്രമേ കാണാന് കഴിയൂ. [ആംങ്സ്ട്രം (A°)=108 സെ.മീ. അഥവാ 3.9370079 x 19 ഇഞ്ച്] എന്നാല് അള്ട്രാ മൈക്രോസ്കോപ്പിലൂടെ 100 അീ വരെ വലുപ്പത്തിലുള്ള കണങ്ങളെ നിദര്ശിക്കാനാവും. 20-ാം ശതകത്തില് പുതിയ പല പഠനരീതികളും ഉപകരണങ്ങളും കൊളോയ്ഡ് ശാസ്ത്രത്തില് ആവിര്ഭവിക്കുകയുണ്ടായി. ഊര്ജതന്ത്രത്തിലും രസതന്ത്രത്തിലും ഉണ്ടായ പുരോഗതികളെല്ലാം തന്നെ കൊളോയ്ഡ് രസതന്ത്രത്തെയും സ്വാധീനിച്ചിട്ടുണ്ട്.
വര്ഗീകരണം. സോളുകള് രണ്ടു തരമുണ്ട്; ദ്രാവകസ്നേഹികളും (lyophilic colloids) ദ്രാവകവിരോധികളും (lyophobic colloids). പ്രകീര്ണനമാധ്യമം ജലമാണെങ്കില് അവ യഥാക്രമം ജലസ്നേഹിസോളുകളെന്നും (hydrophilic colloids) ജല വിരോധി സോളുകളെന്നും (hydrophobic colloids) അറിയപ്പെടുന്നു. പ്രോട്ടീനുകള്, ജെല്ലുകള്, എമള്ഷന് തുടങ്ങിയവ ദ്രാവകസ്നേഹി സോളുകള്ക്ക് ഉദാഹരണമാണ്. ദ്രാവകസ്നേഹി സോളില് നിന്ന് പ്രകീര്ണനപ്രാവസ്ഥയെ അവക്ഷേപിച്ചശേഷം വീണ്ടും പ്രകീര്ണനമാധ്യമം ചേര്ത്താല് വീണ്ടും സോള് ലഭിക്കും. അതിനാല് ദ്രാവകസ്നേഹി സോളുകളെ ഉഭയദിശീയകൊളോയ്ഡുകള് (reversible colloids) എന്നും വര്ഗീകരിച്ചിരിക്കുന്നു. ദ്രാവകവിരോധി ളുകള് വളരെ വേഗം അവക്ഷേപിക്കപ്പെടുന്നു. പ്രകീര്ണനമാധ്യമം ചേര്ത്താല് അവ വീണ്ടും കൊളോയ്ഡ് അവസ്ഥ കൈവരിക്കുന്നില്ല. അതിനാല് ഇവ ഉഭയദിശീയമല്ലെന്നു പറയാം. അര്സിനിയസ് സള്ഫൈഡ്, സ്വര്ണം, ഫെറിക് ഹൈഡ്രോക്സൈഡ് മുതലായവ ദ്രാവകവിരോധി സോളുകള്ക്ക് ഉദാഹരണങ്ങളാണ്. ദ്രാവകവിരോധി സോളുകളും ദ്രാവകസ്നേഹിസോളുകളും തമ്മിലുള്ള ഏതാനും വ്യത്യാസങ്ങള് കൂടി പട്ടിക2-ല് കൊടുത്തിരിക്കുന്നു.
കൊളോയ്ഡുകളുടെ നിര്മാണം. ദ്രാവകസ്നേഹി സോളുകള് (ഉഭയദിശീയ കൊളോയ്ഡുകള്) നിര്മിക്കുക എളുപ്പമാണ്. പ്രകീര്ണനപ്രാവസ്ഥ ഈ മാധ്യമത്തോടു ചേര്ത്താല് മതി. ജലാറ്റിന്, സ്റ്റാര്ച് മുതലായവ വെള്ളത്തില് ചേര്ത്ത് അവയുടെ സോളുകള് നിര്മിക്കാം. എന്നാല് ദ്രാവകവിരോധി സോളുകള് നിര്മിക്കാന് പ്രത്യേക ക്രീയാവിധികള് ആവശ്യമാണ്. ഈ വിധികളെ പ്രധാനമായും രണ്ടായി തിരിക്കാം: (i) സംഘനനവിധി (condensation method). ഈ വിധിയില് ചെറിയകണങ്ങളെ തമ്മില് ചേര്ത്ത് കൊളോയ്ഡ് വലുപ്പത്തിലാക്കുന്നു; (ii) പ്രകീര്ണനവിധി (dispersion method) വലിയ കണങ്ങളെ പ്രകീര്ണനം ചെയ്ത് കൊളോയ്ഡ് വലുപ്പത്തിലാക്കുന്നു, രണ്ടു പ്രരൂപത്തിലുംപെട്ട ഏതാനും ക്രിയാവിധികള് ഇനി പരാമര്ശിക്കുന്നു.
സംഘനനവിധികളില് നിരോക്സീകരണം, ഓക്സീകരണം, ലായകവിനിമയം, ജല-അപഘടനം, ദ്വിവിഘടനം തുടങ്ങിയ രാസ മാര്ഗങ്ങള് ഉപയോഗിച്ചുവരുന്നു.
ലോഹസോളുകളുടെ നിര്മാണത്തിന് പ്രധാനമായും നിരോക്സീകരണരീതി ഉപയോഗിക്കുന്നു. ഉദാ.
1. ഓറിക് ക്ലോറൈഡു ലായനി ഫോര്മാല്ഡിഹൈഡ്, ഗ്ലൂക്കോസ്, ഹൈഡ്രസീന്, ടാനിന് മുതലായവകൊണ്ടു നിരോക്സീകരിച്ച് സ്വര്ണസോള് നിര്മിക്കാം.
2. ഹൈഡ്രജന് സള്ഫൈഡിന്റെ ഓക്സീകരണത്തിലൂടെ കൊളായ്ഡീയ സള്ഫര് നിര്മിക്കുന്നു.
3. ആല്ക്കഹോളിലുള്ള സള്ഫറിന്റെ പൂരിതലായനി ജലത്തിലേക്ക് ഒഴിച്ച് ലായകവിനിമയത്തിലൂടെ സള്ഫര്സോള് തയ്യാറാക്കാം.
4. ഓക്സൈഡ്, ഹൈഡ്രോക്സൈഡ് സോളുകളുടെ മുഖ്യ നിര്മാണരീതിയാണ് ജല-അപഘടനം. സാന്ദ്രഫെറിക് ക്ലോറൈഡ് ലായനി ധാരാളം വെള്ളത്തില് കലര്ത്തി ഫെറിക് ഹൈഡ്രോക്സൈഡ് സോള് നിര്മിക്കാം.
FeCl3 + 3H2 O Fe(OH)3+3HCl
5. ആര്സെനിക് ഓക്സൈഡും ഹൈഡ്രജന് സള്ഫൈഡും തമ്മില് നേര്ത്തലായനിയില് പ്രതിപ്രവര്ത്തിച്ച് ആര്സെനിക് സള്ഫൈഡ് സോള് നിര്മിക്കാം.
AS2O3+3H2S⇌ AS2S3+3H2O
സംഘനനപ്രക്രിയകളില് ചെറിയ കണങ്ങള് തമ്മില് ചേര്ന്ന് വലിയ കണങ്ങളാകുന്നു. ഇങ്ങനെ രൂപം കൊള്ളുന്ന കണങ്ങളുടെ വലുപ്പം ന്യൂക്ലിയേഷനും (nucleation) ക്രിസ്റ്റല്വളര്ച്ചയും തമ്മിലുള്ള അനുപാതത്തെ ആശ്രയിച്ചായിരിക്കും. ചെറിയ കണങ്ങളുടെ രൂപവത്കരണത്തിന് ഉയര്ന്ന ന്യുക്ളിയീകരണം ആവശ്യമാണ്.
പ്രകീര്ണനനിര്മാണവിധികളില് ബ്രെഡിഗ്ഗ് ആര്ക്ക് പ്രക്രിയ, മെക്കാനിക്കല് പ്രകീര്ണനം, പെപ്റ്റീകരണം തുടങ്ങിയവയാണ് പ്രധാനപ്പെട്ടവ. ലോഹങ്ങളുടെ കൊളോയ്ഡീയ ലായനി നിര്മിക്കാന് ബ്രെഡിഗ്ഗ് ആര്ക്ക് പ്രക്രിയ ഉപയോഗിക്കാം. ഏതു ലോഹത്തിന്റെ സോളാണോ തയ്യാറാക്കേണ്ടത്, അതിന്റെ രണ്ട് ഇലക്ട്രോഡുകള് ജലത്തില് മുക്കിവച്ച് അവയ്ക്കിടയില് വിദ്യുത് ആര്ക്ക് (arc) സൃഷ്ടിക്കുകയെന്നതാണ് ഇവിടെ സ്വീകരിച്ചിരിക്കുന്ന തത്ത്വം. ആര്ക്കിന്റെ തീവ്രമായ ചൂടുമൂലം ലോഹം ബാഷ്പീഭവിക്കുകയും ജലം ബാഷ്പത്തെ അപ്പോള്ത്തന്നെ സംഘനിപ്പിച്ച് കൊളോയ്ഡീയ കണങ്ങളാക്കുകയും ചെയ്യുന്നു. മെക്കാനിക്കല് പ്രകീര്ണനരീതിയില് കൊളോയ്ഡ് മില്ലുകള് ഉപയോഗിച്ച് പദാര്ഥത്തെ കൊളോയ്ഡുകളുടെ വലുപ്പത്തില് പൊടിക്കുന്നു. അവക്ഷേപരൂപത്തില് പ്രകീര്ണനമാധ്യമത്തില് നിലംബനം ചെയ്യപ്പെട്ട 'പദാര്ഥ'ത്തെ ഉന്നതമായ ആവൃത്തികളില് വിപരീതദിശകളില് ചുറ്റിക്കൊണ്ടിരിക്കുന്ന ബ്ലേഡുകള്ക്കിടയിലൂടെ കടത്തിവിടുക എന്നതാണ് കൊളോയ്ഡ് മില്ലിന്റെ തത്ത്വം ഏകദേശമായി പറഞ്ഞാല്. ബ്ലേഡുകള് തമ്മിലുള്ള അകലം കണ വലുപ്പത്തിന് ആവശ്യമായ രീതിയില് സജ്ജീകരിച്ചിരിക്കും. അവക്ഷേപണത്തില് (precipitate) കൂടുതല് ലായകം ചേര്ത്ത് വീണ്ടും സോളുകള് നിര്മിക്കുന്ന രീതിയാണ് പെപ്റ്റീകരണം.
കൊളോയ്ഡ് ലായനികളില് ചിലപ്പോള് നാമമാത്രമായ അളവിലെങ്കിലും ക്രിസ്റ്റലോയ്ഡുകള് അടങ്ങിയിരിക്കാം. ക്രിസ്റ്റലോയ്ഡുകള്നീക്കം ചെയ്യാന് പ്രധാനമായും ഡയലസന (dialysis) പ്രക്രിയ ഉപയോഗിക്കുന്നു. കൊളോയ്ഡ് കണങ്ങള് ചര്മപത്രത്തില്ക്കൂടി (parchment) കടക്കുകയില്ല. എന്നാല് ക്രിസ്റ്റലോയ്ഡുകള് അപ്രകാരം ചെയ്യും. ഈ സൗകര്യമാണ് ഡയലസനത്തില് പ്രയോജനപ്പെടുത്തുന്നത്. ഡയലസനത്തിന് ഉപയോഗിക്കുന്ന ഉപകരണത്തെ ഡയലസകം (dialyser) എന്നു വിളിക്കുന്നു.
കൊളോയ്ഡുകളുടെ ഗുണധര്മങ്ങള്
നിറം. ഒരു സോളിന്റെ നിറം അതിലെ കണങ്ങളുടെ വലുപ്പത്തെ ആശ്രയിച്ചിരിക്കുന്നു. സൂര്യാസ്തമയത്തിലെ നിറം പോലെ, സോളിന്റെ നിറവും പ്രകാശപ്രകീര്ണനം (light scattering) മൂലം രൂപപ്പെടുന്നതാണ്. പ്രകീര്ണപ്രകാശത്തിന്റെ തരംഗദൈര്ഘ്യം പ്രകീര്ണനംചെയ്യുന്ന കണികകളുടെ വലുപ്പത്തെ ആശ്രയിച്ചായിരിക്കുന്നതിനാല് ലായനികളുടെ നിറത്തില് നിന്ന് കൊളോയ്ഡീയ കണങ്ങളുടെ ആകൃതിയും സോളിന്റെ നിറത്തെ സ്വാധീനിക്കുന്നുവെന്ന് തെളിയിച്ചിട്ടുണ്ട്.
ബ്രൗണിയന് ചലനം. ജലത്തില് നിലംബനം ചെയ്യപ്പെട്ട പരാഗകണങ്ങളെപ്പോലെ അവിരതം ക്രമരഹിതമായി വളഞ്ഞുപുളഞ്ഞ് കൊളോയ്ഡീയ കണികകള് ചലിക്കുന്നു. ഈ പ്രത്യേകതരം ചലനമാണ് ബ്രൗണിയന് ചലനം. റോബര്ട്ട് ബ്രൗണ് എന്ന സസ്യശാസ്ത്രജ്ഞന് 1827-ല് ഈ പ്രതിഭാസം കണ്ടുപിടിച്ചു. ബ്രൗണിയന് ചലനം കൊളോയ്ഡിന്റെ പ്രകൃതത്തെ ആശ്രയിച്ചിരിക്കുന്നില്ല. എന്നാല് കണികകള് ചെറുതാവുകയും പ്രകീര്ണനമാധ്യമത്തിന്റെ ശ്യാനത കുറയുകയും ചെയ്താല് ചലനവേഗത വര്ധിക്കുന്നു. മാധ്യമതന്മാത്രകള് കൊളോയ്ഡ് കണങ്ങളില് ചെന്ന് ഇടിക്കുന്നത്മൂലമാണ് ബ്രൌണിയന് ചലനം ഉണ്ടാകുന്നത്.
ടിന്ഡാള് പ്രഭാവം. സൂക്ഷ്മദര്ശിനിയില് കൊളോയ്ഡ് കണങ്ങള് ദൃശ്യമല്ല. എന്നാല് കൊളോയ്ഡീയ കണങ്ങള് പ്രകാശത്തെ പ്രകീര്ണനം ചെയ്യുന്നു. പക്ഷേ ഇപ്രകാരം പ്രകീര്ണിതമായ പ്രകാശപുഞ്ജത്തെ സൂക്ഷ്മദര്ശിനിയിലൂടെയോ ചിലപ്പോള് നഗ്നനേത്രങ്ങള് കൊണ്ടോ കാണാന് കഴിയും. ജോണ് ടിന്ഡാള് (1820-93) എന്ന ശാസ്ത്രജ്ഞനാണ് ഇതു കണ്ടുപിടിച്ചത്. അതുകൊണ്ട് ഇത് ടിന്ഡാള് പ്രഭാവം എന്ന് അറിയപ്പെടുന്നു. ഈ തത്ത്വം സിഡന്റോഫും സിഗ്മോണ്ടിയും ചേര്ന്നു നിര്മിച്ച അതിസൂക്ഷ്മദര്ശിനിയില് (ultramicroscope) ഉപയോഗിക്കുന്നു. ഒരു ആര്ക്കുലാമ്പില് (arc lamb) നിന്നോ മറ്റ് ഏതെങ്കിലും ശക്തമായ പ്രകാശസ്രോതസ്സില്നിന്നോ (L) ഉള്ള ഒരു പ്രബലപ്രകാശപുഞ്ജം S എന്ന സ്ലീറ്റില് കൂടി കടക്കുന്നു. L2,L3 എന്നീ ലെന്സുകള് പുഞ്ജത്തെ അഭിസാരണം (converge) ചെയ്ത് കൊളോയ്ഡ് ലായനിയിലേക്കു കേന്ദ്രീകരിക്കുന്നു. കൊളോയ്ഡ് ലായനിയെ സൂക്ഷ്മദര്ശിനിയിലൂടെ നോക്കുമ്പോള് കണങ്ങള് ഇരുണ്ട പശ്ചാത്തലത്തില് തിളങ്ങുന്ന ബിന്ദുക്കളായി കാണപ്പെടുന്നു. വാസ്തവത്തില് ഈ ബിന്ദുക്കള് കണങ്ങളല്ല, പ്രകീര്ണനം ചെയ്യപ്പെട്ട പ്രകാശം മാത്രമാണ്. കൊളോയ്ഡ് പഠനത്തില് അതിസൂക്ഷ്മദര്ശിനി കാര്യമായ പങ്കുവഹിച്ചിട്ടുണ്ട്. കണങ്ങളുടെ ചലനം നിരീക്ഷിക്കാനും ആകെയുള്ള കണങ്ങളെ എണ്ണി തിട്ടപ്പെടുത്താനും ഈ ഉപകരണംകൊണ്ടു കഴിഞ്ഞു. അതിസൂക്ഷ്മദര്ശിനിയിലെ ക്രമീകരണം ലളിതമാണ്. ഈ ഉപകരണം ഉപയോഗിച്ച് കൊളോയ്ഡ് കണങ്ങളെ കാണണമെങ്കില് അവയുടെ അപവര്ത്തനാങ്കം (refractive index) മാധ്യമത്തിന്റേതിനെക്കാള് വ്യത്യാസപ്പെട്ടിരിക്കണം. ലോഹിക കൊളോയ്ഡുകളുടെ കാര്യത്തില് ഈ വ്യത്യാസം തികച്ചും പ്രകടമാണ്. 40A° വ്യാസമുള്ള കണങ്ങളെപ്പോലും ലോഹിക കൊളോയ്ഡുകളില് ഇങ്ങനെ നിദര്ശിക്കാമെന്നു കണ്ടിട്ടുണ്ട്. അതിസൂക്ഷ്മദര്ശിനിയിലൂടെ ദൃശ്യമാകാത്തത്ര ചെറിയ കണങ്ങളെ പൊതുവേ അമൈക്രോണ്സ് (amicrons) എന്നുപറയുന്നു. ഇലക്ട്രോണ് സൂക്ഷ്മദര്ശിനി ഉപയോഗിച്ച് കൊളോയ്ഡീയ വലുപ്പത്തിലുള്ള മിക്ക കണങ്ങളെയും നിദര്ശിക്കാം.
ഘനത്വം. ദ്രാവകവിരോധി സോളുകളുടെ ഘനത്വം മിശ്രണനിയമത്തെ അനുസരിക്കുന്നു. അതുകൊണ്ട് പ്രകീര്ണനമാധ്യമത്തിന്റെയും പ്രകീര്ണനപ്രാവസ്ഥയുടെയും ഘനത്വങ്ങളില് നിന്ന് സോളിന്റെ ഘനത്വം നിര്ണയിക്കാം. എന്നാല് ദ്രാവകസ്നേഹി സോളുകളുടെ ഘനത്വം മിശ്രണനിയമത്തെ അനുസരിക്കുന്നില്ല. ഇത്തരം സോളുകള് നിര്മിക്കുമ്പോള് സോളിന്റെ വ്യാപ്തത്തില് കുറവുവരുന്നതായി കണ്ടിട്ടുണ്ട്. ഉദാ. 100 മില്ലിലിറ്റര് ജലത്തില് 10 ഗ്രാം ജലാറ്റിന് അലിഞ്ഞുചേര്ന്ന് സോള് രൂപംകൊള്ളുമ്പോള് വ്യാപ്തം 96.1 മില്ലിലിറ്റര് ആയി ചുരുങ്ങുന്നു.
വിദ്യുത്ചാര്ജ്. കൊളോയ്ഡീയ കണങ്ങള്ക്ക് വിദ്യുത്ചാര്ജ് ഉണ്ട്. അയോണുകളുടെ കണങ്ങള് അവയുടെ ഉപരിതലത്തില് അവശോഷണം ചെയ്യുന്നതാണ് ഇത്തരം ചാര്ജിനു കാരണമെന്നു കരുതപ്പെടുന്നു. അയോണീകരണക്ഷമമായ കാര്ബോക്സില് അമിനോഗ്രൂപ്പുകള് പ്രോട്ടീനുകള്ക്ക് വിദ്യുത്ചാര്ജ് നല്കുന്നു. വിദ്യുത്ചാര്ജ് വഹിക്കുന്ന ഒരു കൊളോയ്ഡ്വ്യൂഹത്തില് വൈദ്യുതി കടത്തിവിട്ടാല് ചാര്ജിത കൊളോയ്ഡുകള് ആനോഡിലേക്കോ കാഥോഡിലേക്കോ ചലിക്കുന്നു; ഋണചാര്ജുള്ളവ ആനോഡിലേക്കും ധനചാര്ജുള്ളവ കാഥോഡിലേക്കും വിദ്യുത്ക്ഷേത്രത്തിലെ അയോണ് ചലനത്തിനു സമാനമായ ഈ 'കൊളോയ്ഡ് കണചലനം' ഇലക്ട്രോഫോറസിസ് എന്ന പേരിലറിയപ്പെടുന്നു. ചിലപ്പോള് ഇതിനെ കാറ്റഫോറസിസ് (cataphoresis) എന്നും വിശേഷിപ്പിക്കാറുണ്ട്. ചില കൊളോയ്ഡുകള് ധനചാര്ജിതങ്ങളാണ്; വേറെ ചിലവ ഋണചാര്ജിതങ്ങളും. ഋണചാര്ജുള്ള കൊളോയ്ഡുകളാണ് താരതമ്യേന കൂടുതല്. താഴെ കൊടുത്തിരിക്കുന്ന പട്ടികയില് ഏതാനും കൊളോയ്ഡുകളുടെ ചാര്ജ് സ്വഭാവം കൊടുത്തിരിക്കുന്നു.
ഇലക്ട്രോഫോറസിസ് കൂടാതെ മറ്റ് ഏതാനും വിദ്യുത്സ്വഭാവങ്ങളും കൊളോയ്ഡുകള്ക്കുണ്ട്. അവയിലൊന്നാണ് ഇലക്ട്രോ ഓസ്മോസിസ് (electro osmosis). കൊളോയ്ഡ് കണങ്ങളെ സ്തരമായോ പ്ലഗ്ഗാ(plug)യോ ഒരു നിശ്ചിത സ്ഥാനത്തു നിര്ത്തുകയും വ്യൂഹത്തെ വൈദ്യുതചാര്ജിനു വിധേയമാക്കുകയും ചെയ്യുമ്പോള് സ്തരത്തിലൂടെയോ പ്ലഗ്ഗിലൂടെയോ പ്രകീര്ണനമാധ്യമം സഞ്ചരിക്കുന്നു. ഇതാണ് ഇലക്ട്രോ ഓസ്മോസിസ്. വിദ്യുത് മണ്ഡലത്തില് കൊളോയ്ഡ് കണം സഞ്ചരിക്കാവുന്നതിന്റെ എതിര്ദിശയിലാവും ലായകം അഥവാ മാധ്യമം സഞ്ചരിക്കുക. ചാര്ജിതകണങ്ങളുടെ അവസാദനം(sedimentation) മൂലമുണ്ടാകുന്ന അവസാദന പൊട്ടന്ഷ്യല് (sedimentation potential) സരന്ധ്രസ്തരത്തിലൂടെയും പ്ലഗ്ഗിലൂടെയും ദ്രവം ഒഴുകുന്നതുമൂലം ഉണ്ടാകുന്ന ധാരാപൊട്ടന്ഷ്യല് (streaming potential) എന്നിവയാണ് കൊളോയ്ഡുകളുമായി ബന്ധപ്പെട്ട മറ്റു രണ്ട് വിദ്യുദ്ഗതിക(electrokinetic) പ്രഭാവങ്ങള്.
കൊയാഗുലനം. ദ്രാവകസ്നേഹി സോളുകള് താരതമ്യേന സ്ഥിരങ്ങളാണ്. ദ്രാവകവിരോധി സോളുകള് അങ്ങനെയല്ല. വിദ്യുത്-അപഘട്യങ്ങള് (electrolytes) ചേര്ക്കുമ്പോള് ഈ സോളുകള് കൊയാഗുലീകരിക്കുന്നു. കൊയാഗുലനംമൂലം താരതമ്യേന ചെറിയ കൊളോയ്ഡ് കണങ്ങള് സംയോജിച്ച് നഗ്നനേത്രങ്ങള്ക്കു ദൃശ്യമായത്ര വലിയ കണങ്ങളായിത്തീരുന്നു. കൊളോയ്ഡ് കണങ്ങളുടെ ചാര്ജിന് എതിരായ ചാര്ജുകള് സംഭാവന ചെയ്യാന് കഴിയുന്ന വിദ്യുത്-അപഘട്യങ്ങള് ചേര്ക്കുമ്പോഴാണ് കൊയാഗുലനം സംഭവിക്കുന്നത്. എല്ലാ വിദ്യുത്-അപഘട്യങ്ങളുടെയും കൊയാഗുലനശേഷി ഒരുപോലെയല്ല. ഒരു വിദ്യുത്-അപഘട്യത്തിന്റെ കൊയാഗുലനശേഷി അതിലെ കൊയാഗുലനകാരിയായ അയോണിന്റെ സംയോജകതയെ (valancy) ആശ്രയിച്ചിരിക്കും. ഇതാണ് ഹാര്ഡി-ഷൂള്സ് നിയമം (Hardy-Schultz Law). അതായത്, ഋണചാര്ജിതമായ അര്സീനിയസ് സള്ഫൈഡ് സോളിനെ കൊയാഗുലീകരിക്കാന് ഏക സംയോജകമായ സോഡിയം അയോണ് അടങ്ങുന്ന സോഡിയം ക്ലോറൈഡിനെക്കാള് ദ്വിസംയോജകമായ ബേരിയം അയോണ് അടങ്ങുന്ന ബേരിയം ക്ലോറൈഡിന് കഴിവുണ്ടായിരിക്കും. വിദ്യുത്-അപഘട്യം ചേര്ക്കുന്നതിനു പകരം എതിരായ ചാര്ജുകളെ അന്യോന്യം ഉദാസീനീകരിക്കുന്നതുമൂലമാണ് ഇവിടെ കൊയാഗുലനം നടക്കുന്നത്. ഇനി കൊയാഗുലനത്തിന്റെ ക്രിയാവിധി എന്താണെന്നു ചുരുക്കത്തില് പ്രതിപാദിക്കാം. സോളിലെ കണങ്ങള്ക്കെല്ലാം ഒരേ ചാര്ജായിരിക്കും. തുല്യചാര്ജുകള് വികര്ഷിക്കപ്പെടുമെന്ന തത്ത്വമനുസരിച്ച് സോളിലെ കണങ്ങള് തമ്മില് അടുക്കാനോ കൂടിച്ചേര്ന്ന് ഒന്നാകനോ കഴിയാത്ത നിലയിലാവും സ്ഥിതിചെയ്യുക. എന്നാല് കണത്തിന്റെ ചാര്ജിന് എതിരായ മറ്റൊരു കണത്തെ തന്നിലേക്ക് ആകര്ഷിക്കാന് സോളിലെ കണത്തിനു കഴിയും. പുതിയ അയോണിനെ സ്വന്തം പ്രതലത്തില് അത് അവശോഷണം ചെയ്യുന്നു. ചാര്ജുകള് അന്യോന്യം ഉദാസീനീകരിക്കപ്പെടുകയും ചെയ്യുന്നു. ചാര്ജ് നഷ്ടപ്പെട്ട കണങ്ങള് തമ്മില് അടുക്കുകയും സംയോജിച്ച് വലിയ കണങ്ങളായി അവക്ഷിപ്തമാവുകയും ചെയ്യുന്നു.
ഉന്നത സാന്ദ്രതയുള്ള ലവണങ്ങള്ക്കു മാത്രമേ പ്രോട്ടീനുകളെപ്പോലെയുള്ള ദ്രാവകസ്നേഹി കൊളോയ്ഡുകളെ കൊയാഗുലീകരിക്കാനാവൂ. ഇത്തരം കൊയാഗുലീകരണം കൊളോയ്ഡിന്റെ നിര്ജലീകരണം (dehydration) മൂലമാണ് നടക്കുന്നതെന്നും കരുതപ്പെടുന്നു. എഫ്. ഹോഫ്മൈസ്റ്റര് (F. Hofmeister -1888) ഈ വിധത്തിലുള്ള കൊയാഗുലീകരണത്തിനു സമര്ഥങ്ങളായ അയോണുകളുടെ ശ്രേണികള് (ഉദാ. Li+ > Na+ > K +...) പ്രഖ്യാപിച്ചിട്ടുണ്ട്. ഇവ ഹോഫ്മൈസ്റ്റര് ശ്രേണികളെന്നോ ലയോട്രോപ്പിക് (liotropic) ശ്രേണികളെന്നോ അറിയപ്പെടുന്നു.
ദ്രാവകസ്നേഹി കൊളോയ്ഡുകള്ക്ക് ദ്രാവകവിരോധി കൊളോയ്ഡുകളുടെ കൊയാഗുലനത്തെ തടഞ്ഞ് അവയെ സ്ഥിരമാക്കി നിര്ത്താനുള്ള കഴിവുണ്ട്. എല്ലാ ദ്രാവകസ്നേഹി കൊളോയ്ഡുകളുടെയും സംരക്ഷണപ്രവര്ത്തനം തുല്യമല്ല. വിവിധ സോളുകളുടെ സംരക്ഷണശേഷി (protective power) താരതമ്യം ചെയ്യുന്നതിന് സിഗ്മോണ്ടി ആവിഷ്കരിച്ച തത്ത്വമാണ് സ്വര്ണസംഖ്യ അഥവാ ഗോള്ഡ് നമ്പര്. 10 മില്ലിലിറ്റര് ചുവന്ന സ്വര്ണസോളിലേക്ക് (ലിറ്ററില് 0.5 മുതല് 0.06 ഗ്രാം സ്വര്ണം വരെ) 1 മില്ലിലിറ്ററില് 10 ശതമാനം സോഡിയം ക്ലോറൈഡ് ലായനി ചേര്ക്കുമ്പോള് സംഭവിക്കാവുന്ന കൊയാഗുലനത്തെ തടയുന്നതിനാവശ്യമായ സംരക്ഷണകൊളോയ്ഡിന്റെ മില്ലിഗ്രാം അളവാണ് ഗോള്ഡ് നമ്പര്. ചില ദ്രാവകസ്നേഹിസോളുകളുടെ ഗോള്ഡ് നമ്പര് ഇപ്രകാരമാണ്. ജലാറ്റിന് 0.005→0.01, ആല്ബുമിന് 0.1→0.2, ഹീമോഗ്ലോബിന് 0.03→0.07. ഐസ്ക്രീം ഉണ്ടാക്കുമ്പോള് അല്പം ജലാറ്റിന് ചേര്ക്കുന്നത് സംരക്ഷണപ്രവര്ത്തനത്തെ ഉദ്ദേശിച്ചാണ്. ഐസ്ക്രീമില് ഹിമകണങ്ങളും ലാക്ട്രോസ് തരികളും ക്രിസ്റ്റലീകരിക്കുന്നതിനെ ജലാറ്റിന് തടയുന്നു.
ഓസ്മോസികമര്ദം (Osmotic pressure). വളരെ താഴ്ന്ന ഓസ്മോസികമര്ദമേ കൊളോയ്ഡുകള്ക്കുള്ളൂ. ഓരോ കൊളോയ്ഡും അനേകം തന്മാത്രകളുടെ സഞ്ചയമായതിനാല് ലായനിയില് കണങ്ങളുടെ എണ്ണം കുറവായിരിക്കും. അതുകൊണ്ടാണ് ഓസ്മോസികമര്ദത്തില് കാര്യമായ കുറവ് അനുഭവപ്പെടുന്നത്. വിദ്യുത്-അപഘട്യ-അശുദ്ധത ദ്രാവകവിരോധി സോളുകളില്നിന്നു പൂര്ണമായി നീക്കംചെയ്യുക എളുപ്പമല്ല. അതിനാല് അത്തരം സോളുകളുടെ ഓസ്മോസികമര്ദം കൃത്യമായി നിര്ണയിക്കുക വിഷമമാണ്. പ്രോട്ടീനുകള്, സെല്ലുലോസ് മുതലായവയുടെ സോളുകളുടെ ഓസ്മോസികമര്ദങ്ങളില്നിന്ന് അവയുടെ തന്മാത്രാഭാരങ്ങള് നിര്ണയിക്കാം. ബ്രൗണിയന് ചലനം, ശ്യാനത, അവസാദനം എന്നീ ഗുണധര്മങ്ങളില് നിന്നും കൊളോയ്ഡുകളുടെ തന്മാത്രാഭാരം കണക്കാക്കാം.
എമള്ഷനുകള്. പ്രകീര്ണനമാധ്യമവും പ്രകീര്ണന പ്രാവസ്ഥയും ദ്രാവകാവസ്ഥയിലുള്ള കൊളോയ്ഡീയ ലായനിയാണ് എമള്ഷന്. എമള്ഷനുകള് രണ്ടുതരത്തിലുണ്ട്. (1) ജല-തൈല എമള്ഷന് (Oil in water). ജലത്തില് കൊഴുപ്പു(എണ്ണ) കണങ്ങള് പ്രകീര്ണനം ചെയ്തതാണ് ഇത്. പാല് ഇത്തരത്തിലുള്ള ഒരു എമള്ഷനാണ്. (2) തൈല-ജല എമള്ഷന് (water in oil). ജലം പ്രകീര്ണനപ്രാവസ്ഥയും എണ്ണ (അല്ലെങ്കില് മറ്റേതെങ്കിലും ദ്രാവകം) പ്രകീര്ണനമാധ്യവുമായാല് അതിനെ ജല-തൈല എമള്ഷന് എന്നു പറയാം. എണ്ണയിലെ ജല എമള്ഷനാണ് വെണ്ണ. ഇവിടത്തെ പ്രകീര്ണനമാധ്യമം കൊഴുപ്പും പ്രകീര്ണനപ്രാവസ്ഥ ജലവുമാണ്.
വെറുതെ രണ്ടു ദ്രാവകങ്ങള് കൂട്ടിച്ചേര്ത്താല് എമള്സീകരണം നടക്കില്ല. ദ്രാവകങ്ങള് അല്പസമയത്തിനുശേഷം വേര്തിരിയാം. ഇതു സംഭവിക്കാതിരിക്കുന്നതിന് എമള്സീകാരകങ്ങള് (emulsifying agents) എന്നു വിളിക്കുന്ന ചില പദാര്ഥങ്ങള് ചേര്ക്കുന്നു. പ്രോട്ടീനുകള്, കാര്ബോ ഹൈഡ്രേറ്റുകള്, സോപ്പുകള്, സിലിക്ക തുടങ്ങിയവ ആദ്യവിഭാഗത്തിലും കൊഴുപ്പമ്ലങ്ങളുടെ ഘനലോഹലവണങ്ങള്, ഗ്രാഫൈറ്റ്, ഗ്ലിസറോള്, മോണോ-ഒലിയേറ്റ് തുടങ്ങിയവ രണ്ടാം വിഭാഗത്തിലും ഉപയോഗിക്കുന്ന എമള്സീകാരകങ്ങളാണ്. രണ്ട് പ്രാവസ്ഥകള് തമ്മില് സംയോജിക്കാതെ നോക്കുകയാണ് എമള്സീകാരകങ്ങളുടെ ജോലി. സാധാരണസോപ്പ് ഉപയോഗിച്ചുള്ള ശുചീകരണം നല്ലൊരു പരിധിവരെ തൈല-ജല എമള്ഷന് രൂപവത്കരണത്തെ ആശ്രയിച്ചിരിക്കുന്നു. ധാരാളം മരുന്നുകളും എമള്ഷന് രൂപത്തില് നിര്മിക്കുന്നുണ്ട്. തണുപ്പിച്ചും അപകേന്ദ്രണം (സെന്ട്രിഫ്യൂഗ്) ചെയ്തും അവക്ഷിപ്തപ്പെടുത്തിയും എമള്ഷനുകളുടെ രൂപമാറ്റം നടത്താം. പാലില്നിന്ന് അപകേന്ദ്രണം വഴി ക്രീം വേര്തിരിക്കുന്നു.
ജെല്ലുകള്. പ്രകീര്ണനമാധ്യമം ഖരവും പ്രകീര്ണനപ്രാവസ്ഥ ദ്രാവകവുമായ കൊളോയ്ഡാണ് ജെല്. സോപ്പുകള്, ചെരുപ്പുപോളിഷ് മുതലായവ ജെല്ലുകള്ക്ക് ഉദാഹരണങ്ങളാണ്. ജെല്ലുകള് രണ്ടുതരമുണ്ട്; ഇലാസ്തിക ജെല്ലുകളും (ജലാറ്റിന്, അഗര് അഗര്), ദൃഢജെല്ലുകളും (സിലിസിക് അമ്ല ജെല്). ദ്രാവക സമ്പന്നമായ, ഒരു അര്ധ-ഏകാത്മക (quasi homogenous) ഖരരൂപത്തിലുള്ള സിസ്റ്റമാണ് ജെല് എന്നു സാമാന്യമായി പറയാം. ഖര പ്രകീര്ണനമാധ്യമത്തിന്റെ ജാലവ്യൂഹത്തിന് ഇടയ്ക്കുള്ള സ്ഥലങ്ങളില് ദ്രാവകകണികകള് അകപ്പെട്ടിരിക്കുന്നതായ ഘടനയാണ് ജെല്ലുകള്ക്കുള്ളത്. ജെല്ലുകള് പലരൂപത്തില് നിര്മിക്കാം. ഉദാ. ജലാറ്റിനിന്റെ രണ്ടു ശതമാനം ലായനിയെ ചൂടുവെള്ളത്തില് ലയിപ്പിച്ചശേഷം തണുപ്പിച്ചാല് അതൊരു സുതാര്യജെല്ലായി മാറുന്നു. അവക്ഷേപണത്തിലൂടെയും ജെല്ലുകള് നിര്മിക്കാം. സിലിസിക് അമ്ല ജെല് ഇങ്ങനെ നിര്മിക്കുന്നുണ്ട്. ഹൈഡ്രോക്ലോറിക് അമ്ലവും സോഡിയം സിലിക്കേറ്റു ലായനിയും തമ്മില് മിശ്രിതപ്പെടുത്തിയാണ് ഇതു സാധിക്കുന്നത്. മിശ്രിതം ജെല്ലായി മാറുന്നതിനെടുക്കുന്ന സമയം ലായനികളുടെ സാന്ദ്രതകളെ ആശ്രയിച്ചിരിക്കും. സിലിസിക് അമ്ലം ജെല് ഉണക്കിയെടുക്കുന്നതാണ് സിലിക്കാ ജെല്. ധാരാളം രന്ധ്രങ്ങളും വലിയ പ്രതല വിസ്തീര്ണവുമുള്ള ഈ പദാര്ഥം വാതകങ്ങളുടെ അധിശോഷണത്തിന് (adsorption) ഉപയോഗിക്കുന്നു. കുറേനേരം വച്ചിരുന്നാല് ദ്രാവകത്തിന്റെ ബഹിര്വേധനം (extrusion) നടന്ന് ജെല്ലിന്റെ വ്യാപ്തം ചുരുങ്ങുന്നു. ഈ പ്രതിഭാസത്തിന് സിനറസിസ് (syneresis) എന്നു പറയുന്നു. ജെല്ലിന്റെ വ്യാപ്തത്തിന്റെ ചെറിയൊരു അംശം മാത്രമേ അതില്നിന്ന് ഉണ്ടാകുന്ന ഖരത്തിന് കാണുകയുള്ളൂ. സോള് ജെല്ലായി മാറുന്ന പ്രക്രിയയെ ജെല്ലീകരണം എന്നാണ് പറയുന്നത്.
ദ്രാവകത്തില് വാതകം പ്രകീര്ണനം ചെയ്യപ്പെട്ട സോളാണ് പത (foam). ശുദ്ധദ്രാവകങ്ങള് സുസ്ഥിരമായ പത സൃഷ്ടിക്കുകയില്ല. പത ഉണ്ടാക്കാന് മിക്കപ്പോഴും 'പത സഹായി'കള് (foaming agents) ആവശ്യമാണ്. സോപ്പ്, ജലാറ്റിന്, ചിലതരം പോളിമറുകള് തുടങ്ങിയവ ഇത്തരം 'സഹായി'കള്ക്ക് ഉദാഹരണങ്ങളാണ്. സോപ്പുകളും മറ്റ് അപമാര്ജകങ്ങളും (detergents) സംയോജന കൊളോയ്ഡുകള് (association colloids) എന്ന് അറിയപ്പെടുന്നു. താരതമ്യേന ചെറിയ തന്മാത്രാഭാരമുള്ള പദാര്ഥങ്ങള് ചില നിശ്ചിത സാന്ദ്രതകളില് സ്വയം മിസെലുകളായി (micelles) സംയോജിച്ച് കൊളോയ്ഡ് വലുപ്പം കൈവരിക്കുന്നവയാണ് സംയോജനകൊളോയ്ഡുകള്. പേസ്റ്റുകള്, പോളിമറുകള്, പ്രോട്ടീനുകള്, വര്ണകങ്ങള് തുടങ്ങിയവ കൊളോയ്ഡുകളില്പ്പെടുന്നു. നമ്മുടെ ഭക്ഷണങ്ങള് മിക്കവയും കൊളോയ്ഡുകളാണ്. വമ്പിച്ച വ്യാവസായിക പ്രാധാന്യവും കൊളോയ്ഡുകള്ക്കുണ്ട്. മണ്ണിന്റെ പഠനം, പെയിന്റുകളുടെ നിര്മാണം, തോല് ഊറയ്ക്കിടല്, ഭക്ഷണം പാകംചെയ്യല്, മലിനജലത്തിന്റെ ശുദ്ധീകരണം തുടങ്ങിയവയിലെല്ലാം കൊളോയ്ഡ് ശാസ്ത്രം ഉപയോഗിച്ചുവരുന്നു. പെട്ടെന്നു ദഹിക്കുന്നവയും വേഗത്തില് ശരീരത്തിന് ആഗിരണം ചെയ്യാവുന്നവയുമാണ് കൊളോയ്ഡ് മരുന്നുകള്. പ്രകൃതിയിലെ കൊളോയ്ഡ് പ്രതിഭാസങ്ങള് നിരവധിയാണ്. ആകാശത്തിന്റെയും സമുദ്രത്തിന്റെയും നീലനിറം കൊളോയ്ഡിന്റെ സ്വഭാവമായ ടിന്ഡാള് പ്രഭാവമാണ്. സൂര്യാസ്തമയ സമയത്തുള്ള ശോഭയ്ക്കുകാരണം അന്തരീക്ഷത്തിലെ ചില നിലംബിത കണങ്ങളാണ്. മേഘം, മൂടല്മഞ്ഞ്, പുക മുതലായവ കൊളോയ്ഡുകളാണ്. വായുവില് പ്രകീര്ണനം ചെയ്യപ്പെട്ട ജലകണങ്ങളാണ് മഴയായി ഭൂമിയിലേക്കു പതിക്കുന്നത്. കളിമണ്ണിന്റെ കൊളോയ്ഡീയ സ്വഭാവങ്ങള്ക്ക് കളിമണ് വ്യവസായത്തില് വമ്പിച്ച സ്വാധീനതയുണ്ട്. ആല്ബുമിനോയ്സ് പദാര്ഥത്തിന്റെ കൊളോയ്ഡ് ലായനിയാണ് രക്തമെന്നു പറയാം. പാല് ഒരു എമള്ഷനാണ്. ഓന്ത് മുതലായ ചില ജന്തുക്കള് പെട്ടെന്നു നിറം മാറ്റുന്നത് അവയുടെ ചര്മത്തിലെ ചില കൊളോയ്ഡ് കണികകളുടെ പ്രകീര്ണനത്തെ നിയന്ത്രിക്കുന്നതുമൂലമാണെന്നു കരുതപ്പെടുന്നു.
(ചുനക്കര ഗോപാലകൃഷ്ണന്)