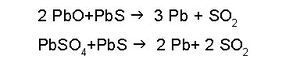This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
കാരീയം
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
കാരീയം
Lead
നീലച്ഛായ കലര്ന്ന, ചാരനിറമുള്ള ഒരു മൃദുലോഹം. അണുസംഖ്യ 82. സിംബല്. Pb. ആവര്ത്തനപ്പട്ടികയില് ആറാം പീരിയഡിലെ നാലാം ഗ്രൂപ്പിലാണ് ഈ മൂലകത്തിന്റെ സ്ഥാനം. ഭാരമുള്ള ഈ ലോഹത്തിന്റെ അണുഭാരം: 207.21; ആപേക്ഷിക ഘനത്വം: 11.34; ഉരുകല് നില: 327.4oC; തിളനില: 1740oC. കടലാസ്സില് വരകള് വീഴ്ത്തുവാന് ഇതിനു കഴിയും.
കാരീയത്തിന് ലത്തീന് ഭാഷയിലുള്ള വാക്കാണ് പ്ലംബം (Plumbum). ഇതില്നിന്നാണ് ചിഹ്നത്തിന് Pb എന്ന അക്ഷരങ്ങള് കിട്ടിയത്. രണ്ടും നാലും സംയോജകതകള് പുലര്ത്തുന്ന, യഥാക്രമം പ്ലംബസ് എന്നും പ്ലംബിക് എന്നും അറിയപ്പെടുന്ന രണ്ടുതരം യൗഗികങ്ങള് കാരീയത്തിനുണ്ട്. കാരീയത്തിന് മുഖകേന്ദ്രിത ക്യൂബിക് ഘടനയാണുള്ളത്.
ചരിത്രം. പ്രാചീന കാലത്ത് അറിയപ്പെട്ടിരുന്ന ഏഴുലോഹങ്ങളില് ഒന്നാണ് കാരീയം. ബി.സി. 6000നു മുമ്പുതന്നെ ഈജിപ്ത്, മെസൊപ്പൊട്ടേമിയ എന്നീ നാടുകളില് കാരീയം പ്രചാരത്തില് ഉണ്ടായിരുന്നുവെന്ന് ചരിത്രരേഖകള് സൂചിപ്പിക്കുന്നു. റോമാക്കാര് ജലവിതരണക്കുഴലുകള്ക്കു കാരീയമാണ് ഉപയോഗിച്ചിരുന്നത്. പുരാതന ഗ്രീക്കുകാരും റോമാക്കാരും കാരീയ ഭസ്മവും (ലെഡ് മോണോക്സൈഡ്, PbO) വൈറ്റ് ലെഡും ഔഷധത്തിനും ചായത്തിനും ഉപയോഗിച്ചിരുന്നുവത്ര. കാരീയത്തിന്റെ വിഷസ്വഭാവത്തെപ്പറ്റി എ.ഡി. ഒന്നാം ശതകത്തില്ത്തന്നെ ഗ്രീക് ഭിഷഗ്വരനായ ഡിയോസ്കോറിഡസ് രേഖപ്പെടുത്തിയിട്ടുണ്ട്. അല്ക്കെമിസ്റ്റുകള് കാരീയത്തിന് ശനിയുടെ ചിഹ്നമാണ് നല്കിയിരുന്നത്. വെടിമരുന്ന് കണ്ടുപിടിച്ചതോടെ വെടിയുണ്ട നിര്മിക്കാന് കാരീയം ഉപയോഗിച്ചുതുടങ്ങി.
ഉപസ്ഥിതി. ഭൂപടലത്തിന്റെ 0.16 ശതമാനം കാരീയം ആണെന്നു കണക്കാക്കിയിരിക്കുന്നു. കാരീയത്തിന്റെ ലോകോത്പാദനം ഒരു വര്ഷത്തില് 20,00,000 ടണ് ആണ്. കാരീയത്തിന്റെ ഖനനത്തിലും ഉത്പാദനത്തിലും മുന്നണിയില് നില്ക്കുന്ന രാജ്യങ്ങള് യു.എസ്., റഷ്യ, ആസ്റ്റ്രലിയ എന്നിവയാണ്. ലോകോത്പാദനത്തിന്റെ 50 ശതമാനത്തോളം യു.എസ്. മാത്രമാണ് ഉപയോഗിക്കുന്നത്. മെക്സിക്കോ, കാനഡ, പെറു, യുഗോസ്ളാവിയ, ജര്മനി, ഫ്രാന്സ്, മൊറോക്കോ, സ്പെയിന് എന്നിവിടങ്ങളിലും കാരീയം ഖനനം ചെയ്യുന്നുണ്ട്. ഇന്ത്യയില് രാജസ്ഥാനിലും ബിഹാറിലും ചെറിയ തോതില് കാരീയ നിക്ഷേപങ്ങള് ഉണ്ട്.
അപൂര്വമായി മാത്രമേ തികച്ചും മൂലകാവസ്ഥയിലുള്ള കാരീയം പ്രകൃതിയില് കാണപ്പെടുന്നുള്ളൂ. കാരീയത്തിന്റെ ഏറ്റവും പ്രധാനപ്പെട്ട ഖനിജം സള്ഫൈഡ് ആണ്. ഇതിനെ ഗലീന (PbS) എന്നു പറയുന്നു. കാരീയത്തിന്റെ വാണിജ്യപ്രാധാന്യമുള്ള മറ്റു ഖനിജങ്ങളാണ് സെറുസൈറ്റ് (PbCO3), ആന്ഗ്ളെസൈറ്റ് (PbSO4) എന്നിവ. വെള്ളി, സിങ്ക് മുതലായവയുമായി കലര്ന്നാണ് കാരീയത്തിന്റെ ധാതുക്കള് കാണപ്പെട്ടുവരുന്നത്. അതുകൊണ്ട് ആദ്യകാലത്ത് വെള്ളി ഖനനത്തിലെ ഒരു ഉപോത്പന്നമായാണ് കാരീയത്തെ കണക്കാക്കിയിരുന്നത്. ചെമ്പ്, ആര്സെനിക്, ആന്റിമണി, ബിസ്മത് തുടങ്ങിയവയാണ് കാരീയധാതുക്കളുമായി കലര്ന്നു കാണപ്പെടുന്ന മറ്റു ലോഹങ്ങള്.
ലോഹനിഷ്കര്ഷണം. ഗലീനയില് നിന്നാണ് കാരീയം സാധാരണയായി നിഷ്കര്ഷണം ചെയ്യുന്നത്. ഇതിനു പല ക്രിയാവിധികള് ഉപയോഗിച്ചുവരുന്നു.
1. വായുനിരോക്സീകരണരീതി. ഇടിച്ചുപൊടിയാക്കിയ അയിര് നുരപ്ളവനരീതി ഉപയോഗിച്ച് സാന്ദ്രീകരിക്കുന്നു. സാന്ദ്രീകരിച്ച അയിര് താപപ്രതിഫലന ചൂളയില് (reverberatory furnace) നിയന്ത്രിതവായു പ്രവാഹത്തില് ചൂടാക്കുമ്പോള് ലെഡ് സള്ഫൈഡ് ഭാഗികമായി ഓക്സീകരിക്കപ്പെടുന്നു.
ഈ സമയത്ത് വായുപ്രവാഹം നിയന്ത്രിച്ച് കൂടുതല് ലെഡ് സള്ഫൈഡ് ചേര്ത്ത് ഉയര്ന്ന താപനിലയില് വീണ്ടും ചൂടാക്കുന്നു. അപ്പോള് ലെഡ് മോണോക്സൈഡും ലെഡ് സള്ഫേറ്റും ലെഡ് സള്ഫൈഡുമായി പ്രതിപ്രവര്ത്തിച്ച് കാരീയം ഉണ്ടാകുന്നു.
ദ്രാവകാവസ്ഥയിലുള്ള കാരീയം നീക്കം ചെയ്യുന്നു. ഈ അസംസ്കൃത കാരീയം പിന്നീട് ശുദ്ധിചെയ്തെടുക്കുന്നു.
2. കാര്ബണ് നിരോക്സീകരണരീതി. ഇതിനെ ബ്ലാസ്റ്റ് ഫര്ണസ് പ്രക്രിയയെന്നും പറയുന്നു (നോ. ഇരുമ്പ്). മാലിന്യങ്ങള് വേര്തിരിച്ച് സാന്ദ്രമാക്കപ്പെട്ട ഗലീന, നല്ലതുപോലെ വറുത്തതിനുശേഷം കോക്കും മണലും ചുണ്ണാമ്പുകല്ലും അല്പം അയണ്ഓക്സൈഡും ചേര്ത്ത് ബ്ലാസ്റ്റ് ഫര്ണസില് ഉരുക്കുന്നു. ഗലീനയെ വറുക്കുമ്പോള് PbS ല് അടങ്ങിയിരിക്കുന്ന സള്ഫര്, സള്ഫര് ഡൈഓക്സൈഡ് (SO2) ആയി മാറുന്നു. Pb, PbO യും PbSO4ഉം ആയിത്തീരുന്നു.
ഈ മിശ്രിതത്തെ ബ്ലാസ്റ്റ് ഫര്ണസില്വച്ച് കാര്ബണ് നിരോക്സീകരണത്തിനു വിധേയമാക്കുന്നു. അപ്പോള് താഴെപ്പറയുന്ന പ്രക്രിയവഴി കാരീയം വേര്തിരിയുന്നു.
FeS, FeSiO3, CasiO3 ഇവ സ്ളാഗായി വേര്തിരിയുന്നു. ഉരുകിയ കാരീയം ബ്ലാസ്റ്റ് ഫര്ണസിന്റെ പ്രത്യേക അറയില് ശേഖരിക്കപ്പെടുന്നു.
ശുദ്ധീകരണം. അസംസ്കൃത കാരീയത്തില് ചെമ്പ്, വെളുത്തീയം, ആന്റിമണി, ഇരുമ്പ്, ബിസ്മത്, വെള്ളി തുടങ്ങിയ ലോഹങ്ങള് അപദ്രവ്യങ്ങളായി ഉണ്ടായിരിക്കും. ഇവയുടെ സാന്നിധ്യം കാരീയത്തിനു കടുപ്പവും ഭംഗുരതയും നല്കുന്നു. അതിനാല് ഈ അപദ്രവ്യങ്ങള് നീക്കേണ്ടത് ആവശ്യമാണ്. താഴെപ്പറയുന്ന മാര്ഗങ്ങളാണ് ലോഹശുദ്ധീകരണത്തിന് സാധാരണയായി ഉപയോഗിച്ചുവരുന്നത്.
i. മൃദുലീകരണം. അസംസ്കൃത കാരീയം പരന്ന പ്രതിഫലന ചൂളയില് വച്ച് ഉരുക്കുന്നു. ഉരുകിയ ദ്രാവകലോഹത്തിനു മുകളിലൂടെ വായു പ്രവഹിപ്പിക്കുമ്പോള് അപദ്രവ്യങ്ങള് ഓക്സീകരിക്കപ്പെടുന്നു. അവ ദ്രാവകോപരിതലത്തില് പാടയായി അടിയുന്നു. ഇത് നീക്കം ചെയ്ത് കാരീയം മൃദുലീകരിക്കുന്നു.
ii. വെള്ളി നീക്കല്. കാരീയത്തില് വെള്ളിയുടെ അംശം 2.25 ശതമാനത്തില് കുറവാണെങ്കില്, കാരീയവെള്ളിലോഹസങ്കരത്തിന്റെ ഉരുകല്നില ശുദ്ധകാരീയത്തിന്റെ ഉരുകല് നിലയെക്കാള് കുറവായിരിക്കും. ഉരുക്കിയ ഈ ലോഹസങ്കരം തണുപ്പിച്ചാല് ആദ്യം വേര്തിരിയുന്നത് കാരീയം ആണ്. ഈ രീതി (പാറ്റിന്സണ് രീതി) ഉപയോഗിച്ച് കാരീയത്തില് നിന്ന് വെള്ളി നീക്കം ചെയ്യുന്നു.
iii. വൈദ്യുത വിശ്ലേഷണം. ഈ രീതി ഉപയോഗിച്ച് ഏറ്റവും ശുദ്ധമായ കാരീയം ഉണ്ടാക്കുന്നു. ഇവിടെ 812 ശതമാനം വരെ ഹൈഡ്രാഫ്ളുവോ സിലിസിക് അമ്ലം (H2SiF6) ചേര്ത്ത ലെഡ് സിലിക്കോ ഫ്ളൂറൈഡ് ആണ് ഇലക്ട്രാളൈറ്റ്. അസംസ്കൃത കാരീയം ആനോഡും ശുദ്ധകാരീയം കാഥോഡും ആണ്. വൈദ്യുതി പ്രവഹിപ്പിക്കുമ്പോള് കാരീയം ആനോഡില് നിന്ന് ലായനിയില് ലയിക്കുകയും കാഥോഡില് നിക്ഷേപിക്കപ്പെടുകയും ചെയ്യുന്നു.
ഗുണധര്മങ്ങള്. റേഡിയോ ആക്റ്റീവ് അപക്ഷയ പ്രക്രിയയിലെ അന്ത്യ ഉത്പന്നമാണ് കാരീയം. കാരീയത്തിന് Pb208, Pb206, Pb207, Pb204 എന്നിങ്ങനെ പ്രകൃതിദത്തമായ നാലു ഐസോടോപ്പുകളുണ്ട്. ഇവയുടെ അണുഭാരം 200-203, 205, 209-214 എന്നിങ്ങനെയാണ്. അസ്ഥിരങ്ങളായ പത്ത് ഐസോടോപ്പുകള് വേറെയുമുണ്ട്. തോറിയം അപക്ഷയ ശ്രണിയിലെ അന്ത്യഉത്പന്നം Pb208 ആണ്. ആക്ടിനിയം, റേഡിയം അപക്ഷയശ്രണിയിലെ അന്ത്യഉത്പന്നങ്ങള് യഥാക്രമം Pb207, Pb206 എന്നിവയാണ്. ഇലക്ട്രാണിക് വിന്യാസക്രമം I S2, 2 So, 2 P6, 3 d So, 3P6, 3d10, 4 So, 4 P6, 4d10, 4f14, 5 So, 5P6, 5d10, 6So, 6 P2 എന്നിങ്ങനെയാണ്. അയോണിക ത്രിജ്യ (Pb2+) 1.18Å. (Pb4+) 0.70Å. ലോഹിതത്രിജ്യ, 1.7502Å. പ്രഥമ അയോണീകരണ പൊട്ടന്ഷ്യല് 7.415 ഇലക്ട്രാണ് വോള്ട്ട്. ദ്വിതീയ അയോണീകരണ പൊട്ടന്ഷ്യല് 14.97 ഇലക്ട്രാണ് വോള്ട്ട്. ഓക്സീകരണ പൊട്ടന്ഷ്യലുകള് ![]()
![]() സാധാരണ താപനിലയില് ശുഷ്കവായുവുമായി കാരീയത്തിനു പ്രതിപ്രവര്ത്തനം ഇല്ല. ഈര്പ്പമുള്ള വായുവില് കാരീയം ജലവും ഓക്സിജനുമായി പ്രതിപ്രവര്ത്തിച്ച് ലെഡ് ഹൈഡ്രാക്സൈഡ് ഉണ്ടാക്കുന്നു.
സാധാരണ താപനിലയില് ശുഷ്കവായുവുമായി കാരീയത്തിനു പ്രതിപ്രവര്ത്തനം ഇല്ല. ഈര്പ്പമുള്ള വായുവില് കാരീയം ജലവും ഓക്സിജനുമായി പ്രതിപ്രവര്ത്തിച്ച് ലെഡ് ഹൈഡ്രാക്സൈഡ് ഉണ്ടാക്കുന്നു.
![]() . ഇത് കാര്ബണ്ഡൈഓക്സൈഡുമായി പ്രതിപ്രവര്ത്തിച്ച് കാര്ബണേറ്റായി മാറുന്നു. അങ്ങനെ തുടര്ന്നുള്ള പ്രതിപ്രവര്ത്തനത്തില് നിന്ന് കാരീയത്തിന്റെ ഉപരിതലത്തെ സംരക്ഷിക്കുന്നു. 400-500oC ല് കാരീയം വായുവില് ചൂടാക്കുമ്പോള് റെഡ് ലെഡ് (Pb3O4) എന്ന ചുവന്ന ഓക്സൈഡ് ഉണ്ടാകുന്നു.
വായു നീക്കം ചെയ്ത ജലവുമായി കാരീയത്തിന് പ്രതിപ്രവര്ത്തനമില്ല. വായുവിന്റെ സാന്നിധ്യത്തില് ജലവുമായി പ്രതിപ്രവര്ത്തിച്ച് ലെഡ് ഹൈഡ്രാക്സൈഡ് ഉണ്ടാകുന്നു. ഇത് വെള്ളത്തില് അല്പമായി ലയിക്കും. നൈട്രറ്റ് ലവണങ്ങളും അമോണിയം ലവണങ്ങളും ഈ ലേയത്വം വര്ധിപ്പിക്കും. ഇക്കാരണത്താല് ജലവിതരണത്തിന് കാരീയ പൈപ്പുകള് ഉപയോഗിക്കാന് പാടില്ല.
. ഇത് കാര്ബണ്ഡൈഓക്സൈഡുമായി പ്രതിപ്രവര്ത്തിച്ച് കാര്ബണേറ്റായി മാറുന്നു. അങ്ങനെ തുടര്ന്നുള്ള പ്രതിപ്രവര്ത്തനത്തില് നിന്ന് കാരീയത്തിന്റെ ഉപരിതലത്തെ സംരക്ഷിക്കുന്നു. 400-500oC ല് കാരീയം വായുവില് ചൂടാക്കുമ്പോള് റെഡ് ലെഡ് (Pb3O4) എന്ന ചുവന്ന ഓക്സൈഡ് ഉണ്ടാകുന്നു.
വായു നീക്കം ചെയ്ത ജലവുമായി കാരീയത്തിന് പ്രതിപ്രവര്ത്തനമില്ല. വായുവിന്റെ സാന്നിധ്യത്തില് ജലവുമായി പ്രതിപ്രവര്ത്തിച്ച് ലെഡ് ഹൈഡ്രാക്സൈഡ് ഉണ്ടാകുന്നു. ഇത് വെള്ളത്തില് അല്പമായി ലയിക്കും. നൈട്രറ്റ് ലവണങ്ങളും അമോണിയം ലവണങ്ങളും ഈ ലേയത്വം വര്ധിപ്പിക്കും. ഇക്കാരണത്താല് ജലവിതരണത്തിന് കാരീയ പൈപ്പുകള് ഉപയോഗിക്കാന് പാടില്ല.
നേര്പ്പിച്ച ഹൈഡ്രാക്ലോറിക് അമ്ലവും സള്ഫ്യൂറിക് അമ്ലവും കാരീയവുമായി പ്രതിപ്രവര്ത്തിക്കുമെങ്കിലും ലെഡ് ക്ലോറൈഡ്, ലെഡ് സള്ഫേറ്റ് എന്നീ അലേയ ലവണങ്ങള് കാരീയത്തിന്റെ ഉപരിതലത്തെ മൂടുന്നതിനാല് വേഗത്തില് പ്രവര്ത്തനം നിലയ്ക്കുന്നു. നേര്പ്പിച്ച നൈട്രിക് അമ്ലത്തില് കാരീയം ലയിച്ച് ലെഡ് നൈട്രറ്റ് ഉണ്ടാകുന്നു. വായുവിന്റെ സാന്നിധ്യത്തില് കാരീയം അസറ്റിക് അമ്ലവുമായി പ്രതിപ്രവര്ത്തിച്ച് ലെഡ് അസറ്റേറ്റ് ഉണ്ടാകുന്നു. പ്ലംബൈറ്റുകള് കാരീയം ക്ഷാരങ്ങളില് ലയിച്ച് ഉണ്ടാകുന്ന യൗഗികങ്ങളാണ്.
ഉപയോഗം. ബാറ്ററി നിര്മാണം, കേബിള് വ്യവസായം എന്നിവയില് കാരീയം ധാരാളം ഉപയോഗിക്കുന്നു. രാസവ്യവസായത്തില് പ്രതിപ്രവര്ത്തന പാത്രങ്ങളുടെ ഉള്ളില് പൂശാന് കാരീയം ഉപയോഗിക്കുന്നു. പെയിന്റ് നിര്മാണത്തില് കാരീയ യൗഗികങ്ങള് ആയ റെഡ് ലെഡ്, വൈറ്റ് ലെഡ്, ക്രാം മഞ്ഞ, ക്രാം ചുവപ്പ് തുടങ്ങിയ പിഗ്മെന്റുകള്ക്ക് നല്ല സ്ഥാനമുണ്ട്. കാരീയത്തിനു ഗാമാരശ്മികളെ ആഗിരണം ചെയ്യാനുള്ള കഴിവുണ്ട്. അതിനാല് ഗാമാരശ്മികളില്നിന്നുള്ള സുരക്ഷിത കവചമായി കാരീയം ഉപയോഗിക്കുന്നുണ്ട്.
ലോഹയൗഗികങ്ങള്. കാരീയത്തിനു രണ്ടുതരം യൗഗികങ്ങളുണ്ട്. പ്ലംബസ് യൗഗികങ്ങളും പ്ലംബിക് യൗഗികങ്ങളും. പ്ലംബസ് യൗഗികങ്ങളാണ് സ്ഥിരത കൂടുതല് ഉള്ളവ. കാരീയമോ ഗലീനയോ ഉയര്ന്ന താപനിലയില് ചൂടാക്കിയാല് കിട്ടുന്ന യൗഗികമാണ് ലെഡ് മോണോക്സൈഡ്. ലിഥാര്ജ് എന്നും ഇതിനെ വിളിക്കുന്നു. ![]() ലെഡ് നൈട്രറ്റ്, കാര്ബണേറ്റ്, ഹൈഡ്രാക്സൈഡ് എന്നിവ തപിപ്പിക്കുമ്പോഴും PbO ഉണ്ടാകുന്നു. ഇതിനെ CO (110oC), H2 (310oC), C (550oC) എന്നീ താപനിലകളില് നിരോക്സീകരിച്ച് ലോഹമാക്കാം. അമ്ലങ്ങളും ക്ഷാരങ്ങളുമായി പ്രതിപ്രവര്ത്തിക്കുന്നതിനാല് ഇത് ഒരു ഉഭയധര്മി (anphoterac) ഓക്സൈഡാണെന്നു പറയാം.
ലെഡ് നൈട്രറ്റ്, കാര്ബണേറ്റ്, ഹൈഡ്രാക്സൈഡ് എന്നിവ തപിപ്പിക്കുമ്പോഴും PbO ഉണ്ടാകുന്നു. ഇതിനെ CO (110oC), H2 (310oC), C (550oC) എന്നീ താപനിലകളില് നിരോക്സീകരിച്ച് ലോഹമാക്കാം. അമ്ലങ്ങളും ക്ഷാരങ്ങളുമായി പ്രതിപ്രവര്ത്തിക്കുന്നതിനാല് ഇത് ഒരു ഉഭയധര്മി (anphoterac) ഓക്സൈഡാണെന്നു പറയാം.
ലെഡ് അസറ്റേറ്റിന്റെയും സോഡിയം ഹൈഡ്രാക്സൈഡിന്റെയും മിശ്രിതത്തിലേക്ക് ബ്ലീച്ചിങ് പൗഡര് ലായനി ചേര്ക്കുമ്പോള് ലെഡ് ഡൈ ഓക്സൈഡ് (PbO2) ഉണ്ടാകുന്നു. ചോക്കലേറ്റ് നിറമുള്ള ഒരു പൊടിയാണിത്. ചൂടാക്കിയാല് ഓക്സിജന് നഷ്ടപ്പെട്ട് മോണോക്സൈഡായി മാറും. ആല്ക്കലി ഹൈഡ്രാക്സൈഡുകളുടെ സാന്നിധ്യത്തില് PbO2 ക്രാമിക് ഹൈഡ്രാക്സൈഡിനെ ഓക്സീകരിച്ച് ആല്ക്കലി ക്രാമേറ്റ് ഉണ്ടാകുന്നു. 2 ![]() തീപ്പെട്ടി നിര്മാണത്തിലും സംഭരണസെല്ലുകളിലും ഇത് ഉപയോഗിക്കുന്നു.
തീപ്പെട്ടി നിര്മാണത്തിലും സംഭരണസെല്ലുകളിലും ഇത് ഉപയോഗിക്കുന്നു.
ലെഡ് ഓക്സലേറ്റിനെ വായുസമ്പര്ക്കം ഇല്ലാതെ തപിപ്പിക്കുമ്പോള് ലെഡ് സബ് ഓക്സൈഡ് (Pb2O) ഉണ്ടാകുന്നു. കാരീയത്തിന്റെ മറ്റൊരു ഓക്സൈഡ് ആണ് റെഡ് ലെഡ് Pb3O4 അല്ലെങ്കില് PbO2. 2 PbO. ലെഡ് മോണോക്സൈഡ് 450-470oC വരെ ചൂടാക്കിയും വൈറ്റ് ലെഡ് ധക്ഷാരീയ ലെഡ് കാര്ബണേറ്റ് 2PbCO3. 2PbCO3. Pb(OH)2] 425-430oC വരെ ചൂടാക്കിയും ഇതു നിര്മിക്കുന്നു. ചുവന്ന പൊടിയാണിത്. ചൂടാക്കുമ്പോള് ആദ്യം വയലറ്റും പിന്നീട് കറുപ്പുമായിത്തീരുന്നു. തണുപ്പിക്കുമ്പോള് വീണ്ടും ചുവക്കുന്നു. വര്ണകമായും ഓക്സീകാരകമായും മറ്റും ഇത് ഉപയോഗിക്കുന്നു. ലെഡ് സെസ്കി ഓക്സൈഡ് (Pb2O3) എന്ന മറ്റൊരു ഓക്സൈഡും കാരീയത്തിനുണ്ട്. ലെഡ് മോണോക്സൈഡ് ലായനിയോടു സോഡിയം ഹൈപ്പോക്ലോറൈറ്റ് ചേര്ക്കുമ്പോള് ഈ യൗഗികം ഉണ്ടാകുന്നു.
ഹാലൈഡുകള്. പ്രധാനപ്പെട്ട നാലു ഹാലജനുകളുമായും Pb പ്രതിപ്രവര്ത്തിച്ച് ഡൈഹാലൈഡുകളും ടെട്രാഹാലൈഡുകളും ഉണ്ടാകുന്നു. നിര്ജലീയ അവസ്ഥയില് ഡൈഹാലൈഡുകള് തികച്ചും അയോണീകരിക്കപ്പെടുന്നില്ല. എന്നാല് ഇവ ചൂടുവെള്ളത്തില് ലയിച്ച് Pb2+ അയോണുകള് ഉണ്ടാകുന്നു.
വൈറ്റ്ലെഡ് എന്നു അറിയപ്പെടുന്ന യൗഗികമാണ് ക്ഷാരീയ ലെഡ് കാര്ബണേറ്റ്, 2 PbCO3. Pb(OH)2. പുരാതനകാലം മുതല്ക്കുതന്നെ ഇത് വര്ണകമായി ഉപയോഗിച്ചുവരുന്നുണ്ട്. അസറ്റിക് അമ്ലവും ഓക്സിജനും ചേര്ത്തു കാരീയത്തെ ഓക്സീകരിച്ച് ഇതു നിര്മിക്കാം.
ലെഡ് അസറ്റേറ്റിന് ലെഡ് പഞ്ചസാര എന്നും പേരുണ്ട്. ലെഡ് മോണോക്സൈഡിനെയും കാര്ബണേറ്റിനെയും നേര്ത്ത അസറ്റിക് അമ്ലത്തില് ലയിപ്പിച്ച് ബാഷ്പീകരിക്കുമ്പോള് ഈ യൗഗികം ലഭിക്കും. വിഷമുള്ള ഒരു പദാര്ഥമാണിത്. മോര്ഡന്റായി ഉപയോഗിക്കുന്നു.
ലെഡ് ലവണ ലായനിയിലൂടെ H2S പ്രവഹിക്കുമ്പോള് PbS (ഗലീന) ഉണ്ടാകുന്നു. ക്രാക്കോഡെറ്റ് ധാതുവില് ലെഡ് ക്രാമേറ്റ് സ്ഥിതിചെയ്യുന്നു. ഒരു ലെഡ് ലവണലായനിയും പൊട്ടാസിയം ക്രാമേറ്റ് ലായനിയും തമ്മില് മിശ്രിതപ്പെടുത്തി ഈ യൗഗികത്തെ (PbCrO4) നിര്മിക്കാം. ഹൈഡ്രാക്ലോറോ പ്ലംബിക് അമ്ലം ഇരുണ്ട തവിട്ടുനിറമുള്ള ലായനിയാണ്. ലെഡ് ഡൈഓക്സൈഡിനെ തണുത്ത ഗാഢഹൈഡ്രാക്ലോറിക്കമ്ലത്തില് ലയിപ്പിച്ചശേഷം അതിലേക്ക് ക്ലോറിന് പ്രവഹിപ്പിക്കുമ്പോള് ഈ അമ്ലം (H2PbCl6) ഉണ്ടാകുന്നു. കാരീയത്തിന്റെ ഏറ്റവും പ്രധാനപ്പെട്ട ഒരു യൗഗികമാണ് ടെട്രാ ഈഥൈല് ലെഡ്, (C2H5)4 Pb. കാരീയത്തിന്റെ മുഖ്യമായ ഉപയോഗങ്ങളിലൊന്ന് ഈ യൗഗികത്തിന്റെ നിര്മാണമാണ്. ആന്റിനോക്ക് ഏജന്റ് എന്ന നിലയില് പ്രമുഖമായ ഒരു ഉപയോഗം ഈ യൗഗികത്തിനുണ്ട്. ഈഥൈല് ക്ലോറൈഡും സോഡിയവും കാരീയവും ചേര്ന്ന ഒരു ലോഹസങ്കരവും തമ്മില് പ്രതിപ്രവര്ത്തിപ്പിച്ച് ഇത് നിര്മിക്കാം.
കാര്ബണ്, സിലിക്കണ് എന്നിവയെപ്പോലെ ലോഹങ്ങളുമായി ചേര്ന്ന് Na4Pb7, Na4Pb9 തുടങ്ങിയ ബൈനറി യൗഗികങ്ങളെ കാരീയം ഉത്പാദിപ്പിക്കുന്നു. ഇവ തികച്ചും ലവണസ്വഭാവമുള്ളവയാണ്. ഇവയില് പോളിപ്ലം ബൈഡ് ആനയോണുകളും അടങ്ങിയിരിക്കും.
ഏതാണ്ട് അഞ്ഞൂറിലധികം കാര്ബണിക ലോഹ യൗഗികങ്ങള് (organo metallic compunds) കാരീയത്തിന് ഉള്ളതായി അറിയപ്പെട്ടിട്ടുണ്ട്.
കാരീയത്തിന്റെ ലോഹസങ്കരങ്ങള്. കാരീയത്തിന്റെ പ്രധാന ലോഹസങ്കരങ്ങളും അവയുടെ ചേരുവയും താഴെ കൊടുക്കുന്നു.
കാരീയവും ജീവികളും. മണ്ണ്, ജലം, വായു എന്നിവയില് നിന്ന് ചെടികള്, കാരീയം ലവണരൂപത്തില് ആഗിരണം ചെയ്യുന്നു. ഭക്ഷണം, വെള്ളം, ധൂളി എന്നിവ വഴി മനുഷ്യശരീരത്തില് 0.4 മില്ലിഗ്രാമോളം കാരീയം പ്രവേശിക്കുന്നു. മനുഷ്യന് അനുവദനീയമായ കാരീയ സാന്ദ്രതാനിരക്ക് 0.2 മുതല് 2 മില്ലിഗ്രാം വരെയാണ്. കാരീയം ശരീരത്തില് നിന്നു പുറത്തുപോകുന്നത് മലമൂത്രവിസര്ജനത്തിലൂടെയാണ്. സാധാരണ മനുഷ്യശരീരത്തില് 2 മില്ലിഗ്രാം കാരീയം ഉണ്ടെന്നാണ് കണക്ക്. വന്കിട വ്യവസായ നഗരങ്ങളില് ഈ തോത് 200 മില്ലിഗ്രാം വരെ വര്ധിക്കുമത്ര.
കാരീയവിഷബാധ. കാരീയത്തിന്റെ നിഷ്കര്ഷണം, കേബിള് നിര്മാണം, അച്ചടി, പെയിന്റ് നിര്മാണം തുടങ്ങിയ വ്യവസായങ്ങളില് ഏര്പ്പെട്ടിരിക്കുന്ന തൊഴിലാളികളിലാണ് ഈ വിഷബാധ ഏറ്റവും കൂടുതല് കാണുന്നത്. ഈ വിഷബാധയുള്ളവരുടെ ഊനുകളില് നീലനിറമുള്ള രേഖ കാണാം. കാരീയം കൊളോയ്ഡീയ രൂപത്തിലുള്ള അല്ബുമിനേറ്റും ഫോസ്ഫേറ്റും ആയിട്ടാണ് രക്തചംക്രമണത്തില് പ്രവേശിക്കുന്നത്. കാര്ബോഹൈഡ്രറ്റ് ഉപാപചയം, നാഡീവ്യൂഹം എന്നിവയെ കാരീയവിഷം ബാധിക്കുന്നു; B1, C എന്നീ ജീവകങ്ങളുടെ അഭാവത്തിന് ഇത് ഇടയാക്കുകയും ചെയ്യുന്നു.
(ഡോ: പി.എം. മധുസൂദനന്; സ.പ.)