This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
കാത്സ്യം
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
കാത്സ്യം
Calcium
ക്ഷാരമൃത്തുലോഹങ്ങളില്(Alkaline Earth metals)പ്പെട്ട ഒരു രാസമൂലകം. സിംബല് ഇമ. ആവര്ത്തനപ്പട്ടികയിലെ രണ്ടാമത്തെ ഗ്രൂപ്പില്, നാലാം പീരിയഡില് സ്ഥിതി ചെയ്യുന്നു. ആപേക്ഷിക സാന്ദ്രത 20. അണുഭാരം 40.08. ഇലക്ട്രാണികവിന്യാസം2S2 2P6 3S2 3P6 4S2.
1808ല് ഹംഫ്രി ഡേവി എന്ന ശാസ്ത്രജ്ഞന് കാത്സ്യം ആദ്യമായി വേര്തിരിച്ചെടുത്തു. കാത്സ്യം, മണ്ണുലോഹങ്ങള് എന്നു വിളിക്കുന്നു. കാത്സ്യത്തിന് ആറു സ്ഥിരഐസോടോപ്പുകള് ഉണ്ട്. സമൃദ്ധിയനുസരിച്ച് ഇവയുടെ പിണ്ഡസംഖ്യ 40, 44, 42, 43, 48, 46 എന്നിങ്ങനെയാണ്. കൂടാതെ 37, 38, 39, 41, 45, 47, 49, 50 എന്നീ പ്രകാരം പിണ്ഡസംഖ്യയുള്ള റേഡിയോ ആക്ടീവതയോടുകൂടിയ ഐസോടോപ്പുകളും കണ്ടുപിടിക്കപ്പെട്ടിട്ടുണ്ട്. സംയോജകത 2. ലോഹിക വ്യാസാര്ധം 1.874°- , അയോണിക വ്യാസാര്ധം (Ca++) 1.06A° ആണ്.
ഉപസ്ഥിതി. നല്ല രാസപ്രവര്ത്തനക്ഷമതയുള്ളതുകാരണം കാത്സ്യം സ്വതന്ത്രാവസ്ഥയില് കാണപ്പെടുന്നില്ല. യൗഗികങ്ങള് വിപുലമായതോതില് സര്വവ-്യാപകമായി കണ്ടുവരുന്നു (3.64 ശ.മാ.). സമൃദ്ധിയുടെ കാര്യത്തില് മൂലകങ്ങളില് അഞ്ചാംസ്ഥാനവും ലോഹങ്ങളില് മൂന്നാംസ്ഥാനവും കാത്സ്യത്തിനുണ്ട്. ജന്തുക്കളുടെ എല്ല്, പല്ല് എന്നിവയിലെ പ്രധാന ഘടകങ്ങള് കാത്സ്യം ഫോസ്ഫേറ്റും കാത്സ്യം കാര്ബണേറ്റും (CaCO3) ആണ്. മുത്ത്, പവിഴം, മാര്ബിള്, മുട്ടത്തോട് എന്നിവയില് കാത്സ്യം കാര്ബണേറ്റും ആസ്ബെസ്റ്റോസില് കാത്സ്യംമഗ്നീഷ്യം സിലിക്കേറ്റും (CaMg3(SiO3)4) ആണ് ഉള്ളത്. മാര്ബിള് ഒരുവിധം ശുദ്ധമായ കാത്സ്യം കാര്ബണേറ്റാണ്. ചുണ്ണാമ്പുകല്ല്, ചോക്ക്, ഐസ്ലന്ഡ്സ്പാര്, ഡോളോമൈറ്റ് (MgCO3.CaCO3) എന്നിവയാണ് കാത്സ്യം കാര്ബണേറ്റ് അടങ്ങുന്ന മറ്റു ചില യൗഗികങ്ങള്. കക്കയിലും, പ്രധാനമായും കാത്സ്യം കാര്ബണേറ്റാണുള്ളത്. സള്ഫേറ്റ് രൂപത്തില് ജിപ്സം (Ca SO4. 2H2O), അന്ഹൈഡ്രറ്റ് (CaSO4), എന്നിവയിലും; ഫോസ്ഫേറ്റ് രൂപത്തില് ഫോസ്ഫോറൈറ്റ് [Ca3(PO4)2], ഫ്ളൂറപ്പറ്റെറ്റ് [Ca3(PO4)CaF2], ക്ലോറപ്പറ്റൈറ്റ് [Ca5(PO4)3Cl] എന്നിവയിലും, ഫ്ളൂറൈഡ് രൂപത്തില് ഫ്ളൂര്സ്പാര് (CaF2)ലും കാല്സിയം കണ്ടുവരുന്നു. ബോറേറ്റ് രൂപത്തില് കോളമനൈറ്റ് (Ca2B6O11. 5H2O), ബോറോകാല്സൈറ്റ് [Ca B4 O7. 4H2O] എന്നീ ഖനിജങ്ങളിലും കാത്സ്യം സ്ഥിതിചെയ്യുന്നു. സമുദ്രജലത്തില് നല്ലൊരു ശതമാനം കാത്സ്യം സള്ഫേറ്റും, കാല്സിയം ക്ലോറൈഡും (CaCl2), ലയിച്ചുകിടപ്പുണ്ട്.
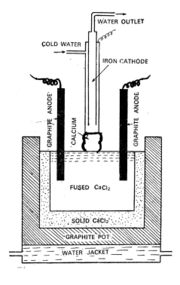
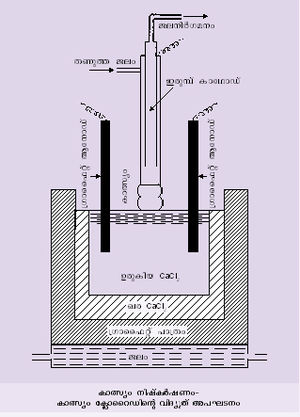
നിഷ്കര്ഷണം. ഉരുകിയ കാത്സ്യം ക്ലോറൈഡിനെ വിദ്യുത് അപഘടനം നടത്തിയാണ് കാത്സ്യം ലോഹം നിഷ്കര്ഷണം ചെയ്യുന്നത്. ഗ്രാഫൈറ്റ് ലൈനോടുകൂടിയ ഒരു പാത്രത്തില് 16 ശതമാനം കാത്സ്യം ഫ്ളൂറൈഡ് അടങ്ങുന്ന നിര്ജല കാത്സ്യം ക്ലോറൈഡ് ചൂടാക്കി ഉരുക്കിയതിനുശേഷം (664ºC) വിദ്യുത് അപഘടനം ചെയ്യുന്നു. പാത്രം തന്നെയാണ് ആനോഡ്. ഉരുകിയ വിദ്യുത് അപഘട-്യത്തിന്റെ പ്രതലത്തെ സ്പര്ശിക്കുന്ന ഒരു ഇരുമ്പു ദണ്ഡാണ് കാഥോഡ്. വിദ്യുത് അപഘടനം നടക്കുമ്പോള് ആനോഡില് ക്ലോറിനും, ഇരുമ്പുകാഥോഡില് കാത്സ്യവും നിക്ഷേപിക്കപ്പെടുന്നു. കാത്സ്യം നിക്ഷേപിക്കപ്പെടുന്ന ക്രമമനുസരിച്ച് കാഥോഡ് ഉയര്ത്തിക്കൊണ്ടിരുന്നാല് ഏതാണ്ടൊരു ദണ്ഡുരൂപത്തില് കാത്സ്യംലോഹം ലഭ്യമാകുന്നു. കാത്സ്യം ക്ലോറൈഡുകൊണ്ടുള്ള ഒരു ആവരണമുള്ളതിനാല്, ചുറ്റുമുള്ള വായു, ക്ലോറിന് എന്നിവയുമായി കാത്സ്യം ലോഹം പ്രതിപ്രവര്ത്തിക്കുന്നില്ല.
ഭൗതിക ഗുണധര്മങ്ങള്. രജതശ്വേതമായ ലഘുലോഹമാണ് കാത്സ്യം. ജലാംശമുള്ള വായുവില് ഓക്സീകരണം മൂലം അതിന്റെ നിറം മങ്ങുന്നു. ഉരുകല്നില 850°C, തിളനില 1440°C. ഘനത്വം താരതമ്യേന കുറവാണ് (1.55). കാഠിന്യം കുറവാകയാല് ഒരു കത്തികൊണ്ട് മുറിച്ചെടുക്കാം. സാമാന്യം അടിച്ചുപരത്താവുന്ന ഒരു ലോഹമാണിത്. ഇതിന്റെ വലിവുബലം 8700 psi ആണ്.
രാസ ഗുണധര്മങ്ങള്. ക്ഷാരലോഹങ്ങളെക്കാളും മറ്റു ക്ഷാരമൃത്തു ലോഹങ്ങളെക്കാളും രാസികമായി ക്രിയാശേഷി കുറഞ്ഞ മൂലകമാണ് കാത്സ്യം. വായുവില് ചൂടാക്കിയാല് ഇഷ്ടികച്ചുവപ്പുനിറത്തിലുള്ള ജ്വാലയോടുകൂടി കത്തുകയും, ഓക്സിജനും നൈട്രജനുമായി സംയോജിച്ച്, കാത്സ്യം ഓക്സൈഡും കാത്സ്യം നൈട്രഡും ആയി രൂപാന്തരപ്പെടുകയും ചെയ്യുന്നു. ഈ ലോഹത്തിന്റെ ഇലക്ട്രാണിക പൊട്ടന്ഷ്യല് 2.87 v ആണ്. ഇത് ഹൈഡ്രജന്, നൈട്രജന്, ഓക്സിജന്, ക്ലോറിന്, സള്ഫര്, ഫോസ്ഫറസ്, കാര്ബണ് മുതലായ അലോഹങ്ങളുമായി സംയോജിച്ച് യഥാക്രമം ഹൈഡ്രഡ്, നൈട്രഡ്, ഓക്സൈഡ്, ക്ലോറൈഡ്, സള്ഫൈഡ്, ഫോസ്ഫൈഡ്, കാര്ബൈഡ് എന്നീ യൗഗികങ്ങള് തരുന്നു.
ജലവുമായുള്ള ഇതിന്റെ പ്രതിപ്രവര്ത്തനം മന്ദഗതിയിലാണ്; കാത്സ്യം ഹൈഡ്രാക്സൈഡും ഹൈഡ്രജനുമാണ് ലഭിക്കുന്നത്.
കാര്ബണ് ഡൈഓക്സൈഡ് വാതകത്തില് ചൂടാക്കിയാല് കാത്സ്യം കാര്ബൈഡ്, കാത്സ്യം ഓക്സൈഡ് എന്നിവ ലഭിക്കുന്നു.
ഇത് മിക്ക അമ്ലങ്ങളുമായി പ്രതിപ്രവര്ത്തിച്ചു കാത്സ്യം ലവണങ്ങളും ഹൈഡ്രജനും ഉത്പാദിപ്പിക്കുന്നു;
മറ്റു ലോഹങ്ങളുടെ ഓക്സൈഡ്, ക്ലോറൈഡ് എന്നിവയുമായി പ്രതിപ്രവര്ത്തിച്ച്, ഓക്സിജനും ക്ലോറൈഡും നീക്കി ശുദ്ധമായ ലോഹങ്ങളെ ഉത്പാദിപ്പിക്കുന്നു.
ഉപയോഗങ്ങള്. ആല്ക്കഹോളില്നിന്ന് അല്പമാത്രമായ ജലാംശം നീക്കം ചെയ്യുവാനും, പെട്രാളിയത്തില്നിന്ന് സള്ഫര് നീക്കം ചെയ്യാനും, ലെഡിന്റെ ദൃഢത കൂട്ടുവാനും, പരീക്ഷണശാലയില് ഒരു നിരോക്സീകാരകമായും, ശുഷ്കകമായും, കാത്സ്യം ഉപയോഗിച്ചുവരുന്നു. ബെറിലിയം, ക്രാമിയം, തോറിയം, യുറേനിയം മുതലായ അപൂര്വലോഹങ്ങള് അവയുടെ ഓക്സൈഡില്നിന്ന് ഉത്പാദിപ്പിക്കുവാന് കാത്സ്യം ഉപകരിക്കുന്നു. ദ്രവീകൃതലോഹങ്ങളില് അലിഞ്ഞുചേര്ന്നിട്ടുള്ള ഓക്സിജന്, നൈട്രജന്, സള്ഫര് എന്നിവ എളുപ്പം നീക്കം ചെയ്യുവാന് കാത്സ്യം സഹായിക്കുന്നു. തെര്മയോണിക ട്യൂബ്, റേഡിയോ, ടെലിവിഷന് എന്നിവയുടെ ഭാഗങ്ങള് തുടങ്ങിയവ ശൂന്യമാക്കുവാനുള്ള വായുബഹിഷ്കരിണിയായും അലുമിനിയം, മഗ്നീഷ്യം, ലെഡ്, ചെമ്പ് മുതലായവയുടെ കൂട്ടുലോഹങ്ങള് നിര്മിക്കുവാന് ഒരു ലോഹമിശ്രകാരിണിയായും കാത്സ്യം ഉപയോഗപ്പെടുന്നു.
കാത്സ്യത്തിന്റെ യൗഗികങ്ങള്. കാത്സ്യത്തിന്റെ യൗഗികങ്ങള് സ്ട്രാണ്ഷിയം, ബേരിയം എന്നിവയുടെ യൗഗികങ്ങളോട് സമാനമായവയാണ്. കാത്സ്യത്തിന്റെ ലവണങ്ങള് ഗാഢഹൈഡ്രാക്ലോറിക് അമ്ലവുമായി കുഴച്ച് ബുണ്സണ് ജ്വാലയില് ചൂടാക്കിയാല് ജ്വാലയ്ക്ക് ഇഷ്ടികച്ചുവപ്പുനിറം കാണാം. പ്രധാന യൗഗികങ്ങള് താഴെ കൊടുത്തിരിക്കുന്നവയാണ്.
1. കാത്സ്യം ഹൈഡ്രഡ് (ഹൈഡ്രാലിത്ത് CaH2). നിര്ജല ഹൈഡ്രജന് വാതകപ്രവാഹത്തില് 400ºC ല് കാത്സ്യം ചൂടാക്കുമ്പോള് ഇത് കിട്ടുന്നു.
ഖരപദാര്ഥമാണ്. ജലവുമായി പ്രതിപ്രവര്ത്തിക്കുമ്പോള് താരതമ്യേന വളരെയധികം ഹൈഡ്രജന് ലഭിക്കുന്നു.
ഇത് പ്രധാനമായും ഹൈഡ്രജന് നിര്മാണത്തിനാണ് ഉപയോഗിക്കുന്നത്. കാര്ബണ്ഡൈ ഓക്സൈഡ് ആഗിരണം ചെയ്ത് കാത്സ്യം ഫോര്മേറ്റായി മാറുന്നു.
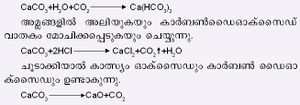
2. കാത്സ്യം ഓക്സൈഡ് (കുമ്മായംCaO). കാത്സ്യം കാര്ബണേറ്റ് തപ്താരുണമാകുന്നതുവരെ ചൂടാക്കുമ്പോള് കാത്സ്യം ഓക്സൈഡും കാര്ബണ്ഡൈ ഓക്സൈഡും ആയി വിഘടിക്കുന്നു.
ഒരു ഉഭയ ദിശീയപ്രവര്ത്തനമാകയാല് ഇതിന്റെ പുരോഗതിക്ക് കാര്ബണ് ഡൈ ഓക്സൈഡ് നീക്കം ചെയ്യേണ്ടത് ആവശ്യമാണ്.
വ്യാവസായികമായി ചുണ്ണാമ്പുകല്ല്, കക്ക, മാര്ബിള്, ചോക്ക് മുതലായ രൂപങ്ങളിലുള്ള കാത്സ്യം കാര്ബണേറ്റ്, ചുണ്ണാമ്പുചൂളയില് ചൂടാക്കിയാണ് കുമ്മായം നിര്മിക്കുന്നത്. നമ്മുടെ നാട്ടില് കക്കയാണ് പ്രധാനമായും ഉപയോഗിച്ചുവരുന്നത്. ഏറ്റവും അപരിഷ്കൃതമായ ചുണ്ണാമ്പുചൂളയില് വിറകാണ് ഇന്ധനമായി ഉപയോഗിക്കുന്നത്. ചുണ്ണാമ്പുകല്ലും (അല്ലെങ്കില് ചോക്കോ കക്കയോ) വിറകും ഇടവിട്ട് മീതേക്കുമീതെ അട്ടിവച്ച് അടിഭാഗത്തായി തീ കൊളുത്തുന്നു. ഏതാനും ദിവസംകൊണ്ട് വിറകെല്ലാം കത്തിയെരിഞ്ഞു തീരുമ്പോള് കാത്സ്യം ഓക്സൈഡ് അഥവാ നീറ്റുകക്ക (കുമ്മായം) ലഭിക്കുന്നു. തുടര്ച്ചയായി പ്രവര്ത്തിപ്പിക്കാവുന്ന ആധുനിക ചുണ്ണാമ്പുചൂളകള് ഇന്നു പ്രചാരത്തിലുണ്ട്. വിറകിനുപകരം കല്ക്കരിപ്പൊടിയോ പ്രാഡ്യുസര് വാതകമോ ഉപയോഗിക്കുന്നു. ശുദ്ധമായ കാത്സ്യം ഓക്സൈഡ് നിര്മിക്കുവാന്വേണ്ടി വായുപ്രവാഹത്തില്, ഒരു പ്ലാറ്റിനം ക്രൂസിബിളില് ഐസ്ലന്ഡ്സ്പാര് ചൂടാക്കുകയാണ് ചെയ്യുന്നത്.
ഗുണധര്മങ്ങള്. വെളുത്തതും വളരെ ഉയര്ന്ന ഉരുകല്നിലയോടു കൂടിയതുമായ ഒരു അക്രിസ്റ്റലീയ പദാര്ഥമാണ് കാത്സ്യം ഓക്സൈഡ്. ഉരുകല്നില2570°C. ആര്ക് ചൂളയില് അത് ഉത്പതിക്കുകയും ബാഷ്പം തണുപ്പിക്കുമ്പോള് ക്രിസ്റ്റലീയ കാത്സ്യം ഓക്സൈഡ് ഉണ്ടാകുകയും ചെയ്യുന്നു. ക്ലോറിന് വാതകത്തിന്റെ സാന്നിധ്യത്തില് 300°C വരെ ചൂടാക്കുമ്പോള് കാത്സ്യം ക്ലോറൈഡ് ലഭിക്കുന്നു.
വെള്ളം ചേര്ത്താല് ധാരാളം ചൂടുണ്ടാകുന്ന രാസപ്രവര്ത്തനം നടന്ന് കാത്സ്യം ഹൈഡ്രാക്സൈഡ് ഉണ്ടാകുന്നു.
അന്തരീക്ഷത്തിലെ ഈര്പ്പവും കാര്ബണ് ഡൈഓക്സൈഡുമായി പ്രവര്ത്തിച്ച് കാത്സ്യം ഓക്സൈഡ് കുറേക്കാലം കഴിയുമ്പോള് കാത്സ്യം ഹൈഡ്രാക്സൈഡോ, കാര്ബണേറ്റോ ആയി രൂപാന്തരപ്പെടുന്നു. ഒരു ക്ഷാരീയ ഓക്സൈഡായതിനാല് അമ്ലങ്ങളുമായി പ്രതിപ്രവര്ത്തിച്ച് ലവണങ്ങളുണ്ടാകുന്നു.
ഉപയോഗങ്ങള്. കാത്സ്യം ഓക്സൈഡ് ഏറ്റവും വില കുറഞ്ഞ ക്ഷാരമാകയാല് പല ആവശ്യങ്ങള്ക്കും ഉപയോഗിക്കപ്പെടുന്നു. കാത്സ്യം ഹൈഡ്രാക്സൈഡ് അഥവാ നീറ്റുചുണ്ണാമ്പു നിര്മിക്കാനും, കാത്സ്യം കാര്ബൈഡ്, കാസ്റ്റിക് സോഡ, ബ്ലീച്ചിങ് പൗഡര്, സോഡിയം കാര്ബണേറ്റ്, ഗ്ലാസ്, സിമന്റ്, കടലാസ്, ചായങ്ങള്, രാസവളങ്ങള്, രഞ്ജകദ്രവ്യങ്ങള് മുതലായവയുടെ നിര്മാണത്തിലും പഞ്ചസാരയുടെ സംസ്കരണത്തിലും ജലം മൃദുവാക്കുന്നതിലും കല്ക്കരി വാതകശുദ്ധീകരണത്തിലും ചര്മശോധന വ്യവസായത്തിലും ഒരു രോഗാണുനാശിനിയായും കീടനാശിനിയായും ഒരു ശുഷ്കകമായും ഇത് ഉപയോഗിക്കുന്നു.
3. കാത്സ്യം ഹൈഡ്രാക്സൈഡ് [നീറ്റുചുണ്ണാമ്പ് Ca(OH)2. ഇത് കാത്സ്യം ഓക്സൈഡും, വേണ്ടത്ര ജലവും ചേര്ത്ത് ഉണ്ടാക്കുന്ന ഒരു വെളുത്തപൊടി ആണ്. കൂടുതല് ജലം ഒഴിച്ചാല് ഒരു പേസ്റ്റോ കുഴമ്പോ ഉണ്ടാകുന്നു.
കാത്സ്യം ക്ലോറൈഡ് ലായനിയോട് ആല്ക്കലി ഹൈഡ്രാക്സൈഡ് ചേര്ക്കുമ്പോള് ഇത് അവക്ഷേപിക്കപ്പെടുന്നു.
ഗുണധര്മങ്ങള്. ഒരു വെളുത്ത പൊടിയാണ്. ജലത്തില് അല്പംമാത്രം ലയിച്ച് ചുണ്ണാമ്പുവെള്ളമുണ്ടാകും. ക്ഷാരഗുണമുണ്ട്. ചുവന്ന ലിറ്റ്മസ് കടലാസ് നീലയായി മാറ്റുന്നു. തെളിഞ്ഞ ലായനിയിലൂടെ കാര്ബണ് ഡൈഓക്സൈഡ് കുമിളിപ്പിച്ചാല് അലേയമായ കാത്സ്യം കാര്ബണേറ്റ് അവക്ഷേപിക്കപ്പെടുന്നതു കാരണം അതു ക്ഷീരനിറമുള്ളതായിത്തീരുന്നു.
കാര്ബണ് ഡൈഓക്സൈഡിന്റെ നിദര്ശനത്തിനുള്ള ഒരു പരീക്ഷണമാണിത്. അമ്ലങ്ങളും അമ്ലവാതകങ്ങളുമായി പ്രതിപ്രവര്ത്തിച്ച് കാത്സ്യം ലവണങ്ങളുണ്ടാകുന്നു.
ഉപയോഗങ്ങള്. നീറ്റുചുണ്ണാമ്പ് വെറ്റില മുറുക്കുന്നതിനും, ചുണ്ണാമ്പുവെള്ളം പരീക്ഷണശാലയില് റീയേജന്റായും ഉപയോഗിച്ചുവരുന്നു. കാത്സ്യം നൈട്രറ്റ് തുടങ്ങിയ രാസവളങ്ങളുടെ നിര്മാണത്തിനും, കൃഷിഭൂമിയുടെ അമ്ലത കുറയ്ക്കുന്നതിനും ഫലപുഷ്ടി വര്ധിപ്പിക്കുന്നതിനും നീറ്റുചുണ്ണാമ്പ് ഉപയോഗിക്കുന്നു. ബ്ലീച്ചിങ് പൗഡര്, കാസ്റ്റിക്സോഡ എന്നിവയുടെ ഉത്പാദനത്തിനും ഇത് വന്തോതില് ഉപയോഗിച്ചുവരുന്നു. സോഡാതൈലം (കാത്സ്യം ഹൈഡ്രാക്സൈഡ്സോഡിയം ഹൈഡ്രാക്സൈഡ് മിശ്രിതം) കാര്ബണ് ഡൈഓക്സൈഡ് നീക്കം ചെയ്യുവാന് ഉപയോഗിക്കാറുണ്ട്. കല്ക്കുമ്മായം ഉണ്ടാക്കുവാന് ഇത് ധാരാളം ഉപയോഗിക്കുന്നു.
4. കാത്സ്യം കാര്ബണേറ്റ് (CaCO3). ചുണ്ണാമ്പുകല്ല്, ചോക്ക്, മാര്ബിള്, ഐസ്ലന്ഡ് സ്പാര്, കക്ക മുതലായ രൂപങ്ങളിലാണ് കാത്സ്യം കാര്ബണേറ്റ് പ്രകൃതിയില് കണ്ടുവരുന്നത്. ഡോളോമൈറ്റിലും കാത്സ്യം കാര്ബണേറ്റടങ്ങുന്നു. മുട്ടത്തോടിലും പവിഴപ്പുറ്റിലും കാത്സ്യം കാര്ബണേറ്റ് ഒരു ഘടകമാണ്. ഇന്ത്യയില് വിന്ധ്യപര്വതത്തിന്റെ ചെരുവുകളിലും രാജസ്ഥാനിലും ചുണ്ണാമ്പുകല്ലു നിക്ഷേപങ്ങളുണ്ട്. ജോഡ്പൂര്, ജബല്പൂര്, കോയമ്പത്തൂര് എന്നിവിടങ്ങളില് മാര്ബിള് കണ്ടുവരുന്നു. ചെറിയ അളവില് മറ്റു ചില വസ്തുക്കള് ചേര്ന്നിരിക്കുന്നതുകൊണ്ട് ചിലയിനം മാര്ബിളുകള്ക്ക് പ്രത്യേകനിറം കാണുന്നു.
കാത്സ്യം ലവണലായനിയില് സോഡിയം കാര്ബണേറ്റ് ചേര്ത്താല് കാത്സ്യം കാര്ബണേറ്റ് അവക്ഷിപ്തമായി ലഭിക്കും.
ചുണ്ണാമ്പുവെള്ളത്തിലൂടെ കാര്ബണ് ഡൈ ഓക്സൈഡ് പ്രവഹിപ്പിക്കുമ്പോള് ഇത് ഉണ്ടാകുന്നു.
ഗുണധര്മങ്ങള്. ഇതിനു രണ്ടു ക്രിസ്റ്റലീയരൂപാന്തരങ്ങളുണ്ട്. ഷഡ്ഭുജകാരികളായ കാല്സൈറ്റും സമചതുര്ഭുജമായ ആരാഗൊണൈറ്റും. സാധാരണ താപനിലയിലും മര്ദത്തിലും കാല്സൈറ്റ് ആണ് സ്ഥിരമായരൂപം. ഇത് ജലത്തില് അലേയമാണ്. എന്നാല് കാര്ബണ് ഡൈ ഓക്സൈഡിന്റെ സാന്നിധ്യത്തില് കാല്സിയം ബൈകാര്ബണേറ്റായി രൂപാന്തരപ്പെടുകയാല് ലയിക്കുന്നു.
ഉപയോഗങ്ങള്. കുമ്മായം, സിമെന്റ്, കാരം, ഗ്ലാസ്, വളങ്ങള് തുടങ്ങിയവയുടെ നിര്മാണത്തിന് ചുണ്ണാമ്പുകല്ലും; ഭവനനിര്മാണത്തിനും, പരീക്ഷണശാലകളിലും മറ്റും മാര്ബിളും; പെയിന്റ്, പല്പ്പൊടി തുടങ്ങിയവയുടെ നിര്മാണത്തിന് ചോക്കും; ഇരുമ്പു നിഷ്കര്ഷണത്തിനും മണ്ണിന്റെ അമ്ലത കുറയ്ക്കുന്നതിനും മറ്റും ചുണ്ണാമ്പുകല്ലും ഉപയോഗിച്ചുവരുന്നു.
5. കാത്സ്യം ബൈകാര്ബണേറ്റ് [Ca(HCO3)2]. കാല്സിയം കാര്ബണേറ്റ് ചേര്ത്ത ജലത്തില് കാര്ബണ്ഡൈഓക്സൈഡ് വാതകം കടത്തിവിടുമ്പോള് ഇത് ഉണ്ടാകുന്നു.
ജലത്തില് ലേയമാണ്.
6. കാത്സ്യം പെറോക്സൈഡ് (CaO2). പൂരിതമായ ചുണ്ണാമ്പുലായനിയില് ഹൈഡ്രജന് പെറോക്സൈഡ് ചേര്ക്കുമ്പോള് കാത്സ്യം ഹൈഡ്രറ്റ് (CaO2.8H2O) ലഭിക്കുന്നു. ഇത് 130°Cല് തപിപ്പിച്ച് നിര്ജലീകരിക്കുമ്പോള് ഇത് ഉണ്ടാകുന്നു; ബേരിയം പെറോക്സൈഡ് പോലെ സ്ഥിരമല്ല; ഒരു വിവര്ണകമായും പഴുപ്പുരോധകമായും ഉപയോഗിക്കുന്നു.
കാത്സ്യം പെറോക്സൈഡും 30 ശതമാനം ഹൈഡ്രജന് പെറോക്സൈഡും കൂട്ടിച്ചേര്ത്ത് ചൂടാക്കുമ്പോള് കാത്സ്യം ടെട്രാഓക്സൈഡ് (CaO4) എന്ന പേരിലറിയപ്പെടുന്ന ഒരു മഞ്ഞപ്പൊടി ലഭിക്കുന്നു. ഇത് അമ്ലങ്ങളുമായി പ്രതിപ്രവര്ത്തിപ്പിച്ചാല് ഹൈഡ്രജന് പെറോക്സൈഡും ഓക്സിജനും ലഭിക്കുന്നു.
7. കാത്സ്യം ഫ്ളൂറൈഡ് (CaF2). ഫ്ളൂര്സ്പാര് എന്ന ധാതുരൂപത്തില് പ്രകൃതിയില് കാണപ്പെടുന്നു. കാത്സ്യം ലവണലായനിയില് സോഡിയം ഫ്ളൂറൈഡ് ലായനി ചേര്ത്താല് കാത്സ്യം ഫ്ളൂറൈഡ് അവക്ഷേപിക്കപ്പെടുന്നു. ഇതിന്റെ ക്രിസ്റ്റലുകള് ചിലപ്പോള് നിറമുള്ളവയും സാധാരണയായി അര്ധതാര്യങ്ങളും, അപൂര്വമായി സുതാര്യങ്ങളുമാണ്. സുതാര്യങ്ങളായ ക്രിസ്റ്റലുകള് ദൂരദര്ശിനിയുടെയും സൂക്ഷ്മദര്ശിനിയുടെയും നിര്മാണത്തിന് ഉപയോഗിക്കുന്നു. ഇന്ഫ്രാറെഡ്, അള്ട്രാവയലറ്റ് പ്രകാശരശ്മികള്ക്ക് കാത്സ്യം ഫ്ളൂറൈഡ് സുതാര്യമാണ്. ഉപയോഗങ്ങള്. ഫ്ളൂറിന്റെ യൗഗികങ്ങള് നിര്മിക്കുവാന് ഫ്ളൂര്സ്പാര് ഉപയോഗിക്കുന്നു. സെറാമിക് വ്യവസായത്തിലും, ഒരു ഫ്ളക്സിന്റെ രൂപത്തില് ലോഹനിഷ്കര്ഷണത്തിലും ഉപയോഗിക്കുന്നു.
8. കാത്സ്യം ക്ലോറൈഡ് (CaCl2.6H2O). സമുദ്രജലത്തില് അല്പമായി സ്ഥിതിചെയ്യുന്നു. സോള്വേപ്രക്രിയയില് ഒരു ഉപോത്പന്നമായും ഇത് ലഭിക്കുന്നുണ്ട്. ചുണ്ണാമ്പുകല്ല്, മാര്ബിള്, കുമ്മായം മുതലായവ ഹൈഡ്രാക്ലോറിക് അമ്ലത്തില് ലയിപ്പിച്ചുകിട്ടുന്ന ലായനി ബാഷ്പീകരിച്ച് ഇത് ഉണ്ടാക്കുന്നു.
ഗുണധര്മങ്ങള്. ആര്ദ്രീഭാവമുള്ള പരലുകള് ആണ്. ഉരുകല്നില 772ºC, തിളനില 1600ºCല് ഉയര്ന്നും ആണ്. ചൂടാക്കുമ്പോള് 200ºCല് ഇത് വിഘടിച്ച് കാത്സ്യം ക്ലോറൈഡ് ഡൈഹൈഡ്രറ്റ് ആയി മാറുന്നു. തുടര്ന്ന് കൂടുതല് ചൂടാക്കിയാല് നിര്ജലലവണം CaCl2അവശേഷിക്കുന്നു.
ജലലേയത്വം വളരെ കൂടുതലാണ്. 325 ശതമാനം കാത്സ്യം ക്ലോറൈഡ് ജലലായനി 180ºCല് തിളയ്ക്കുന്നു. ഇത് താപനപാത്രത്തില് ദ്രാവകമായി ഉപയോഗിക്കാവുന്നതാണ്. അമോണിയയുമായി സംയോജിച്ചു CaCl2.8NH3 എന്ന യൗഗികമായി മാറുന്നതിനാല് അമോണിയാവാതകത്തെ നിര്ജലമാക്കുവാന് കാത്സ്യം ക്ലോറൈഡ് ഉപയുക്തമല്ല.നിര്ജല കാത്സ്യം ക്ലോറൈഡും, കാത്സ്യം ക്ലോറൈഡ് ഡൈ ഹൈഡ്രറ്റും ജലത്തിലലിയുമ്പോള് അത്യധികം താപം മോചിപ്പിക്കപ്പെടുന്നു.
ഉപയോഗങ്ങള്. പരീക്ഷണശാലയില് ശുഷ്കകമായും റോഡുകളില് പൊടി തടയാനുള്ള വസ്തുവായും ഉപയോഗിക്കുന്നു. കൂടാതെ ഇത് റഫ്രിജറേറ്ററുകളിലും ഹിമകാരി മിശ്രിതങ്ങളിലും സാന്ദ്രലായനി താപനപാത്രങ്ങളിലും ഉപയോഗിച്ചുവരുന്നു.
9. കാത്സ്യം നൈട്രഡ് (Ca3N2). നൈട്രജന് വാതകപ്രവാഹത്തില് കാത്സ്യം 400ബ്ബ500ബ്ബ ഇല് ചൂടാക്കുമ്പോള് ഇത് ലഭിക്കുന്നു.
10. കാത്സ്യം നൈട്രറ്റ് [Ca(NO3)2]. നൈട്രീകാരി ബാക്റ്റീരിയയുടെ പ്രവര്ത്തനംമൂലം ഇത് മണ്ണില് ഉത്പാദിക്കപ്പെടുന്നു. കാത്സ്യം കാര്ബണേറ്റ് അല്ലെങ്കില് കാത്സ്യം ഹൈഡ്രാക്സൈഡ് നൈട്രിക് അമ്ലത്തില് ലയിക്കുമ്പോള് ഇത് ഉണ്ടാകുന്നു.
കാത്സ്യം നൈട്രറ്റും കുമ്മായവും ചേര്ന്നുള്ള മിശ്രിതം ധബേസിക് കാത്സ്യം നൈട്രറ്റ് [Ca(NO3)2] CaO; നോര്വീജീയന് സാള്ട്ട് പീറ്റര് എന്നപേരില് അറിയപ്പെടുന്നു. ഇത് വന്തോതില് ഒരു രാസവളമായി ഉപയോഗിച്ചുവരുന്നു.
11. കാത്സ്യം കാര്ബൈഡ് (CaC2). കുമ്മായവും കോക്കും 2:3 അനുപാതത്തില് ഒരു വൈദ്യുതചൂളയില് 2000°Cനു മീതെ ചൂടാക്കുമ്പോള് ഇത് ഉണ്ടാകുന്നു. വ്യാവസായിക പ്രാധാന്യമുള്ളതിനാല് വന്തോതില് നിര്മിക്കപ്പെടുന്നു.
ഉപയോഗങ്ങള്. ഓക്സീ അസറ്റിലീന് ബ്ലോ പൈപ്പിലും അസറ്റിലീന് വിളക്കുകളിലും നിരവധി കാര്ബണിക യൗഗികങ്ങളുടെ നിര്മിതിയിലും ഉപയോഗപ്രദമായ അസറ്റിലീന് വാതകം ഉണ്ടാക്കുവാന് കാത്സ്യം കാര്ബൈഡ് ഉപകരിക്കുന്നു. രാസവളത്തിനും അമോണിയാഉത്പാദനത്തിനും പ്രയോജനപ്പെടുത്തുന്ന കാത്സ്യം സയനാമൈഡ് ഉണ്ടാക്കുവാന് കാത്സ്യം കാര്ബൈഡ് ഉപയോഗിക്കുന്നു.
12. കാത്സ്യം സയനാമൈഡ് (നൈട്രാളീംCaCN2). കാത്സ്യം കാര്ബൈഡ് പൊടിച്ചതും അല്പം കാത്സ്യം ഫ്ളൂറൈഡും കൂട്ടിച്ചേര്ത്ത് ഒരു വൈദ്യുതഫര്ണസില്, നൈട്രജന് വാതകപ്രവാഹത്തില് ചൂടാക്കുമ്പോള് ഇത് ഉണ്ടാകുന്നു.
ഉപയോഗം. ഒരു രാസവളമായി ധാരാളം ഉപയോഗിക്കുന്നു.
13. കാത്സ്യം സള്ഫൈഡ് (CaS). നീറ്റുചുണ്ണാമ്പ്, ഹൈഡ്രജന് സള്ഫൈഡ് വാതകപ്രവാഹത്തില് ചൂടാക്കിയും, ഉയര്ന്ന ഊഷ്മാവില് കുമ്മായവും സള്ഫറും പ്രതിപ്രവര്ത്തിപ്പിച്ചും, കാത്സ്യം സള്ഫേറ്റും കരിയും കൂടി 900°Cല് തപിപ്പിച്ചും ഇത് ഉണ്ടാക്കുന്നു.
സോഡിയം കാര്ബണേറ്റ് നിര്മാണത്തിനുള്ള ലെബ്ലാങ്ക് പ്രക്രിയയില് കാത്സ്യം സള്ഫൈഡ് ഒരു ഉപോത്പന്നമാണ്. ഗുണധര്മങ്ങള്. വെളുത്ത ക്രിസ്റ്റലീയ പൊടി. സ്ഫുരദീപ്തകമാണ്. എന്നാല് 100 ശതമാനം ശുദ്ധമായ കാത്സ്യം സള്ഫൈഡ് സ്ഫുരദീപ്തകമല്ല. ഇക്കാരണത്താല് സ്ഫുരദീപ്തനം കാത്സ്യം സള്ഫൈഡിലടങ്ങിയ (ബിസ്മഥ്, മാംഗനീസ്, ചെമ്പ്, ടങ്സ്റ്റണ് തുടങ്ങിയ) മാലിന്യങ്ങള് മൂലമാണെന്ന് വിശ്വസിക്കപ്പെടുന്നു.
ഉപയോഗങ്ങള്. ചര്മശോധന പ്രക്രിയയില് ചര്മത്തിലെ രോമങ്ങള് മാറ്റുവാന് ഉപയോഗിക്കുന്നു.
14. കാത്സ്യം സള്ഫേറ്റ് (CaSO4). ഇത് പ്രകൃതിയില് അന്ഹൈഡ്രറ്റ് (CaSO4) എന്ന ധാതുരൂപത്തില് കണ്ടുവരുന്നു. ഇതിനു പുറമേ ഡൈഹൈഡ്രറ്റ് (Ca SO4. 2H2O) (ജിപ്സം, അലബാസ്റ്റര്, സെലെനൈറ്റ് എന്നീ പേരുകളില് അറിയപ്പെടുന്നു.) സ്ഥിതിചെയ്യുന്നു. സമുദ്രജലത്തില് ലയിച്ചുചേര്ന്നിട്ടുളള ലവണങ്ങളില് ഒന്നാണിത്. കാത്സ്യം സള്ഫേറ്റ് പഞ്ചാബിലും ബിക്കാനൂരിലും ജോഡ്പൂരിലും ധാരാളമായി സ്ഥിതിചെയ്യുന്നുണ്ട്. ജലത്തില് അല്പമാത്രം ലേയമാകയാല് കാത്സ്യം ലവണലായനിയില് നേര്ത്ത സള്ഫ്യൂരിക്അമ്ലം ചേര്ത്ത് അവക്ഷിപ്തമായി ലഭിക്കാവുന്നതാണ്. സാന്ദ്രഅമോണിയം സള്ഫേറ്റുലായനിയില് ഇമ ടഛ4 Ca SO4 (NH4)2 SO4, H2O എന്ന ഇരട്ടലവണം ഉണ്ടാകുന്നു. ഇത് ജലത്തില് ലേയമാണ്.
ഗുണധര്മങ്ങള്. ജിപ്സം 120ºC130ºC ഊഷ്മാവില് ജലാംശം നഷ്ടപ്പെട്ട് CaSO4. 1/ H2O ഘടനയുള്ള പാരീസ് പ്ലാസ്റ്റര് എന്ന പേരിലറിയപ്പെടുന്ന സിമന്റായിത്തീര്ന്നു. ജലം ചേര്ത്താല് ഏതാനും നിമിഷങ്ങള്ക്കുള്ളില് അതുറച്ച് കാഠിന്യമുള്ളതും മിനുക്കാവുന്നതുമായ വസ്തുവായിത്തീരും. ഇക്കാരണത്താല് ഇത് പല വിധത്തിലും പ്രയോജനപ്പെടുത്തിവരുന്നുണ്ട്. ജിപ്സം 200ºCനുമേല് ചൂടാക്കിയാല് ഹൈഡ്രറ്റ് ജലം മുഴുവനും നഷ്ടപ്പെട്ട് നിര്ജലകാത്സ്യം സള്ഫേറ്റ് (അന്ഹൈഡ്രറ്റ് CaSO4) ആയി രൂപാന്തരപ്പെടുന്നു. ഇതിനോട് ജലം ചേര്ത്താല് പാരീസ് പ്ലാസ്റ്റര് പോലെ ഉറച്ചുകിട്ടുന്നതല്ല.
ജിപ്സം 400ºC വരെ ചൂടാക്കിയാല് കാത്സ്യം സള്ഫേറ്റില് ഒരു ഭാഗം വിഘടിച്ച് സള്ഫര് ഓക്സൈഡും കാത്സ്യം ഓക്സൈഡുമായിത്തീരുന്നതാണ്. ഇങ്ങനെ ലഭിക്കുന്ന പദാര്ഥം എസ്ട്രിച്ച് പ്ലാസ്റ്റര് എന്ന പേരിലറിയപ്പെടുന്നു. ഉപയോഗങ്ങള്. സിമെന്റ്, പാരീസ് പ്ലാസ്റ്റര് എന്നിവ നിര്മിക്കാനും കാര്ഷികമേഖലയിലും ജിപ്സം ഉപയോഗിക്കുന്നു. പാരീസ് പ്ലാസ്റ്ററാകട്ടെ മൂശകള് നിര്മിക്കുവാനും, ശസ്ത്രക്രിയയില് ഒടിഞ്ഞ എല്ലുകള് സ്ഥാനത്ത് ഉറപ്പിക്കാനും പ്രയോജനപ്പെടുത്തുന്നു. പാരീസ് പ്ലാസ്റ്ററും ആലവും ചേര്ത്തുണ്ടാക്കുന്ന മിശ്രിതം ലോഹങ്ങളെയും ഗ്ലാസ്സിനെയും കൂട്ടിച്ചേര്ക്കാനുപയോഗിക്കുന്നു. കടലാസുനിര്മാണത്തില് പ്രത്യേകം നിര്മിച്ച കാത്സ്യം സള്ഫേറ്റ് കടലാസ് മിനുക്കുവാനായി ഉപയോഗിക്കുന്നു.
15. കാത്സ്യം സള്ഫൈറ്റ് (Ca SO3). ചുണ്ണാമ്പുവെള്ളത്തില് സള്ഫര് ഡൈഓക്സൈഡ് അവശേഷിക്കുമ്പോള് ഇത് അവക്ഷേപിക്കപ്പെടുന്നു.
16. കാത്സ്യം ബൈസള്ഫൈറ്റ് [Ca (HSO3)2]. ചുണ്ണാമ്പുവെള്ളത്തില് കൂടുതല് സള്ഫര് ഡൈഓക്സൈഡ് കടത്തിവിട്ടാല് കാത്സ്യം സള്ഫൈറ്റ് അവക്ഷിപ്തം ലയിച്ച് കാത്സ്യം ബൈസള്ഫൈറ്റ് ഉണ്ടാകുന്നു. കടലാസു നിര്മാണത്തിനാണ് ഇത് ഉപയോഗിക്കുന്നത്. തടിക്കഷണങ്ങള് കാത്സ്യം ബൈസള്ഫൈറ്റ് ലായനിയില് തിളപ്പിക്കുമ്പോള് അവയിലെ ലിഗ്നിന് അലിഞ്ഞുപോകുന്നതുകാരണം കടലാസിനു വേണ്ട സെലുലോസ് വേര്തിരിച്ചെടുക്കാന് സാധിക്കുന്നു.
17. കാത്സ്യം ഫോസ്ഫൈഡ് (Ca3P2). കാത്സ്യം ലോഹത്തിനോട് ഫോസ്ഫറസ് ചേര്ത്ത് ഉരുക്കുമ്പോള് ഇതുണ്ടാകുന്നു. ജലവുമായി പ്രതിപ്രവര്ത്തിച്ച് ഇത് ഫോസ്ഫീന് വാതകം മോചിപ്പിക്കുന്നു.
18. കാത്സ്യം ഫോസ്ഫേറ്റ്. കാത്സ്യം ഫോസ്ഫേറ്റ്, മോണോ കാത്സ്യം ഫോസ്ഫേറ്റ് Ca (H2PO4)2 H2O ഡൈ കാത്സ്യം ഫോസ്ഫേറ്റ്, CaHPO4, ട്രകാത്സ്യം ഫോസ്ഫേറ്റ്, Ca3 (PO4)2 എന്നിങ്ങനെ മൂന്ന് ഇനമുണ്ട്.
ട്ര കാത്സ്യം ഫോസ്ഫേറ്റ് എല്ലുകളിലും ഫോസ്ഫോറൈറ്റ് എന്ന ഖനിജത്തിലും അടങ്ങിയിട്ടുണ്ട്. കാത്സ്യം ക്ലോറൈഡുമായിച്ചേര്ന്ന് പ്ലൂറപ്പറ്റൈറ്റിലും ഇത് സ്ഥിതിചെയ്യുന്നു. സസ്യങ്ങള് മണ്ണില് ക്ഷയിക്കുമ്പോള് ഇതുണ്ടാകുന്നുണ്ട്. അസ്ഥി ഭസ്മത്തിന്റെ 8085 ശതമാനം ട്രകാത്സ്യം ഫോസ്ഫേറ്റാണ്.
കാത്സ്യം ലവണലായനിയില് അമോണിയം ഫോസ്ഫേറ്റും അമോണിയയും ചേര്ക്കുമ്പോള് അവക്ഷേപിക്കപ്പെടുന്നത് ട്രകാത്സ്യം ഫോസ്ഫേറ്റാണ്. ജലത്തില് ലേയത്വം വളരെ കുറഞ്ഞ പദാര്ഥമാണിത്. എന്നാല് അസറ്റിക് അമ്ലം തുടങ്ങിയ വീര്യം കുറഞ്ഞ അമ്ലങ്ങളില് ഇതു ലയിക്കുന്നു. ഇപ്രകാരം കിട്ടുന്ന ലായനിയില് ആല്ക്കലി ചേര്ത്തു ട്രകാത്സ്യം അവക്ഷേപിക്കാന് സാധിക്കും.
കാത്സ്യം ലവണലായനിയില് ഡൈസോഡിയം ഹൈഡ്രജന് ഫോസ്ഫേറ്റ് ലായനി ചേര്ക്കുകയാണെങ്കില് ഡൈകാത്സ്യം ഫോസ്ഫേറ്റ് അവക്ഷേപിക്കപ്പെടും. ഇത് ജലീയഫോസ്ഫോറിക അമ്ലത്തില് ലയിപ്പിച്ചു കിട്ടുന്ന ലായനി ബാഷ്പീകരിച്ചാല്, മോണോ കാത്സ്യം ഫോസ്ഫേറ്റിന്റെ പരലുകള് കിട്ടുന്നതാണ്. ട്രകാത്സ്യം ഫോസ്ഫേറ്റും ഫോസ്ഫോറിക അമ്ലവും പ്രതിപ്രവര്ത്തിപ്പിച്ചും; മോണോ കാത്സ്യം ഫോസ്ഫേറ്റ് ഉണ്ടാക്കാവുന്നതാണ്. മറ്റു രണ്ടു ഫോസ്ഫേറ്റുകളെ അപേക്ഷിച്ച് ഇത് ജലത്തില് ലേയമാണ്.
ഉപയോഗങ്ങള്. ഫോസ്ഫേറ്റുകള് ചെടികളുടെ വളര്ച്ചയ്ക്ക് അത്യന്താപേക്ഷിതമാണ്. എന്നാല് ഫോസ്ഫോറൈറ്റ് എളുപ്പം ലയിക്കാത്ത രൂപത്തിലുള്ള ഒരു വസ്തുവാകയാല് ചെടികള്ക്കു വളമായി ഉപയോഗിക്കുവാന് പറ്റിയതല്ല. ശുദ്ധ കാത്സ്യം ഫോസ്ഫേറ്റ് ടൂത്ത്പേസ്റ്റിന്റെ നിര്മാണത്തില് ഉപയോഗിക്കുന്നു. മോണോ കാത്സ്യം ഫോസ്ഫേറ്റ് ബേക്കിങ് പൗഡറിന്റെ ഒരു ഘടകമാണ്.
19. കാത്സ്യം സൂപ്പര് ഫോസ്ഫേറ്റ് [Ca(H2PO4)2H2O+2CaSO4 2H2O]. വളമായി വളരെയധികം ഉപയോഗിച്ചുവരുന്ന വസ്തുവാണിത്. ഇതിന്റെ പ്രധാന ഘടകം മോണോ കാത്സ്യം ടെട്രാ ഹൈഡ്രജന് ഡൈ ഫോസ്ഫേറ്റ് എന്ന ലവണമാണ്.
ഫോസ്ഫേറ്റ് പാറ നല്ലപോലെ പൊടിച്ച് സള്ഫ്യൂറിക് അമ്ലം ക്രമീകൃതഅളവില് ഇളക്കി ഏകദേശം രണ്ടാഴ്ചയോളം, വശങ്ങളില് ഇഷ്ടിക പാകിയ അറകളില് സൂക്ഷിക്കുന്നു. മിശ്രിതത്തില്നിന്ന് ഹൈഡ്രജന് ഫ്ളൂറൈഡ്, സള്ഫര് ഡൈ ഓക്സൈഡ് മുതലായ വാതകങ്ങള് ബഹിര്ഗമിക്കുകയും മിശ്രിതം സരന്ധ്രമാകുകയും ചെയ്യുന്നു. ഇങ്ങനെ രാസപ്രവര്ത്തനംമൂലം ലഭിക്കുന്ന വസ്തുവിനെ കാത്സ്യം സൂപ്പര് ഫോസ്ഫേറ്റ് എന്നു വിളിക്കുന്നു. വെള്ളത്തില് ലേയത്വം കൂടുതലാകയാല് ചെടികള്ക്ക് എളുപ്പം ലഭ്യമാക്കാവുന്ന ഒരു ഫോസ്ഫേറ്റ് വളമാണ് ഇത്.
സള്ഫ്യൂറിക് അമ്ലത്തിനു പകരം ഓര്ഥോഫോസ് ഫോറിക് അമ്ലം ഉപയോഗിച്ച് ട്രിപ്പിള് സൂപ്പര് ഫോസ്ഫേറ്റ് എന്ന വളം നിര്മിക്കുന്നുണ്ട്. സൂപ്പര് ഫോസ്ഫേറ്റിലുള്ളതിലും അധികം ഫോസ്ഫറസ് അടങ്ങിയിട്ടുള്ളതിനാല് ഇത് കൂടുതല് നല്ല വളമായി ഉപയോഗിക്കുന്നു. കൂടാതെ ഇതില് കാത്സ്യം സള്ഫേറ്റ് കാണുന്നുമില്ല. സള്ഫ്യൂറിക് അമ്ലത്തിനു പകരം നൈട്രിക് അമ്ലം ഉപയോഗിക്കുകയാണെങ്കില് സൂപ്പര് ഫോസ്ഫേറ്റ്നൈട്രറ്റ് എന്ന വളം നിര്മിക്കാം. ഇതിലാകട്ടെ, ഫോസ്ഫറസിനു പുറമേ, നൈട്രജനും അടങ്ങിയിട്ടുണ്ടെന്നുള്ളതിനാല് ഇത് കൂടുതല് മെച്ചപ്പെട്ട വളമാണ്.
20. കാത്സ്യം സിലിക്കേറ്റ് (CaSiO3). കാത്സ്യം ഓക്സൈഡും മണലും കൂട്ടിച്ചേര്ത്ത് ശക്തമായി ചൂടാക്കി ഇതു നിര്മിക്കുന്നു. പല ലോഹനിഷ്കര്ഷണ പ്രക്രിയകളിലും ഇതുണ്ടാകുന്നുണ്ട്. സിമെന്റ്, ഗ്ലാസ് മുതലായവയില് ഇതൊരു പ്രധാനഘടകമാണ്.
21. കാത്സ്യം ഓക്സലേറ്റ് (CaC2O4H2O). കാല്സിയം ലവണലായനിയില് തിളയ്ക്കുന്ന അമേ-ാണിയം ഓക്സലേറ്റ് ചേര്ക്കുമ്പോള് കിട്ടുന്ന അവക്ഷിപ്തം ചൂടാക്കിയാല് വിഘടിച്ച് ആദ്യം കാത്സ്യം കാര്ബണേറ്റും പിന്നീട് കാത്സ്യം ഓക്സൈഡും ആയി മാറുന്നു.
22. കാത്സ്യം തയോസള്ഫേറ്റ് [(CaS2O3) 6H2O). കാത്സ്യം ക്ലോറൈഡിന്റെയും സോഡിയം തയോ സള്ഫേറ്റിന്റെയും പൂരിതലായനികള് ചേര്ത്തു തണുപ്പിക്കുമ്പോള് ഇതുണ്ടാകുന്നു.
23. കാത്സ്യം അസറ്റേറ്റ് [Ca(C2H3O2)2.H2O]. കാത്സ്യം കാര്ബണേറ്റോ, കാത്സ്യം ഹൈഡ്രാക്സൈഡോ അസറ്റിക് അമ്ലവുമായി പ്രതിപ്രവര്ത്തിച്ച് ഇത് ലഭ്യമാകുന്നു. ഇത് ഒരു വെളുത്ത ഖരപദാര്ഥമാണ്.
24. കാത്സ്യം ടാര്ട്ടറേറ്റ് (CaC4H4O6. H2O). കാത്സ്യത്തിന്റെ ലവണലായനിയും ഒരു ടാര്ട്ടറേറ്റ് ലായനിയും പ്രതിപ്രവര്ത്തിക്കുമ്പോഴും കാത്സ്യം ഹൈഡ്രാക്സൈഡ്, കാര്ബണേറ്റ് തുടങ്ങിയ കാത്സ്യം ലവണങ്ങള് ടാര്ട്ടാറിക് അമ്ലവുമായി പ്രതിപ്രവര്ത്തിക്കുമ്പോഴും ഇത് ലഭിക്കുന്നു. ഒരു വെളുത്ത ഖരപദാര്ഥമാണിത്.
25. കാത്സ്യം ആര്സനൈറ്റ് [Ca3 (AsO3)2]. കാത്സ്യത്തിന്റെ ലവണലായനിയും സോഡിയം ആര്സനൈറ്റ് ലായനിയും പ്രതിപ്രവര്ത്തിച്ച് കിട്ടുന്ന ഒരു ഖരപദാര്ഥം.
കീടനാശിനിയായും കുമിള്നാശിനിയായും ഉപയോഗിക്കുന്നു.
27. കാത്സ്യം അലുമിനേറ്റുകള്. ഇവ നാല് ഇനം തയ്യാറാക്കപ്പെട്ടിട്ടുണ്ട്.
(a) 3CaO. Al2O3. ഇത് ചൂടാക്കിയാല് ഉരുകുന്നതോടൊപ്പംതന്നെ വിഘടിക്കുന്നു.
(b) 5CaO. 3Al2O3. ഉരുകല്നില 1455ºC
(c) CaO. Al2O3. ഉരുകല്നില 1590ºC
(d) 3CaO. 5Al2O3 ഉരുകല്നില 1720ºC
28. കാത്സ്യം അലുമിനിയം സിലിക്കേറ്റുകള്. രണ്ടുതരം നിര്മിക്കപ്പെട്ടിട്ടുണ്ട്. അവയുടെ ഘടന 2CaO, Al2O3. SiO2 (ഗെലിനൈറ്റ്)°, CaO, Al2 O3. 2SiO2 (അനോര്ഥൈറ്റ്)ബ്ബ ആകുന്നു. കാത്സ്യം ഹൈപ്പോക്ലോറൈറ്റ് (ബ്ലീച്ചിങ് പൗഡര്CaOCl2). ശുഷ്കമായ നീറ്റുചുണ്ണാമ്പിനു മുകളില്ക്കൂടി ക്ലോറിന് പ്രവഹിപ്പിച്ച് നിര്മിക്കുന്നു.
ഗുണധര്മങ്ങള്. ക്ലോറിന്റെ മണമുള്ള വെളുത്തപൊടിയാണിത്. ഇതിനോട് നേര്ത്ത അമ്ലങ്ങളോ കാര്ബണ് ഡൈ ഓക്സൈഡോ ചേര്ക്കുമ്പോള് മോചിക്കപ്പെടുന്ന ക്ലോറിനെ "ലഭ്യ ക്ലോറിന്' എന്നു പറയുന്നു.
ബ്ലീച്ചിങ് പൗഡര് സ്വല്പം അമ്ലീയമാകുമ്പോള് നവജാത ഓക്സിജന് (Nascent Oxygen) മോചിക്കപ്പെടുന്നു. ഈ നവജാതഓക്സിജന് വര്ണകങ്ങളെ ഓക്സീകരിച്ച്, വര്ണരഹിതമാക്കുന്നതിനാല് ബ്ലീച്ചിങ് പൗഡര് ഒരു വിവര്ണകമാകുന്നു. കൂടാതെ, ഇതൊരു പ്രബല ഓക്സീകാരകവുമാണ്.
ഉപയോഗങ്ങള്. പരുത്തി, ലിനന്, മരപ്പള്പ്പ് മുതലായ പദാര്ഥങ്ങളെ വിവര്ണമാക്കുന്ന വസ്തുവായും ഒരു രോഗാണുനാശിനിയായും ഒരു ഓക്സീകാരകമായും ക്ലോറിന്, ക്ലോറോഫോം മുതലായവയുടെ നിര്മാണത്തിനായുള്ള വസ്തുവായും ബ്ലീച്ചിങ്പൗഡര് ഉപയോഗിക്കുന്നു.
കാത്സ്യത്തിന്റെ നിദര്ശനം. (i) കാത്സ്യത്തിന്റെ ലവണവും സാന്ദ്രഹൈഡ്രാക്ലോറിക് അമ്ലവും ചേര്ത്തുള്ള പേസ്റ്റ് ബുണ്സണ് ജ്വാലയില് ഇഷ്ടികച്ചുവപ്പുനിറം പകര്ന്നുകൊടുക്കുന്നു.
(ii) ഒരു കാത്സ്യം ലവണലായനിയില് അമോണിയം ക്ലോറൈഡും അമോണിയം ഹൈഡ്രാക്സൈഡും അമോണിയം കാര്ബണേറ്റും ചേര്ക്കുമ്പോള് കാത്സ്യം കാര്ബണേറ്റിന്റെ അവക്ഷിപ്തമുണ്ടാകുന്നു.
(iii) കാത്സ്യം ലവണലായനിയില് അമോണിയം ഓക്സലേറ്റ് ചേര്ത്താല് ജലത്തില് അലേയവും എന്നാല് നേര്ത്ത നൈട്രിക് അമ്ലത്തില് ലയിക്കുന്നതുമായ വെളുത്ത അവക്ഷിപ്തം ഉണ്ടാകുന്നു. ഇത് കാത്സ്യം ഓക്സലേറ്റാണ്. അസറ്റിക് അമ്ലത്തില് അലേയവുമാണ്.
കാത്സ്യം സോപ്പുകള്. ഉന്നതഫാറ്റി അമ്ലങ്ങളുടെ ക്ഷാരലവണങ്ങളാണ് സോപ്പുകള്. ഇവയെ രണ്ടായി തരംതിരിക്കാം. (i) സോഡിയം, പൊട്ടാസ്യം, അമോണിയം എന്നിവയുടെ സ്റ്റിയറേറ്റ്, പാല്മിറ്റേറ്റ് തുടങ്ങിയ ജലലേയങ്ങളായ ലവണങ്ങളും ട്ര ഇതനോളമീന്, ഐസോപ്രാപ്പെനോളമീന് തുടങ്ങിയ അമീനുകളും. ഇവ മുഖ്യമായും അപമാര്ജക(detergents)ങ്ങെളായി ഉപയോഗിക്കുന്നു. (ii) അലുമിനിയം, കാത്സ്യം, മഗ്നീഷ്യം, ബേരിയം, ലിഥിയം, സിങ്ക്, മാംഗനീസ്, ലെഡ്, കൊബാള്ട്ട്, കോപ്പര്, അയേണ്, സീറിയം മുതലായ ലോഹങ്ങളുടെ നാഫ്ഥനേറ്റുകള്, ഓക്ടോയേറ്റുകള്, റെസിനേറ്റുകള്, ലിനോളിയേറ്റുകള്, 2എഥില് ഹെക്സോയേറ്റുകള് തുടങ്ങിയ ലവണങ്ങള്. ഇവയെ ലോഹികസോപ്പുകള് എന്നു പറയുന്നു. ഇവയെ രണ്ടു പ്രക്രിയകളുപയോഗിച്ച് നിര്മിക്കാം. അവക്ഷേപണപ്രക്രിയയില് ലോഹികലവണലായനിയും ഒരു ജലലേയസോപ്പിന്റെ ലായനിയുംകൂടി പ്രതിപ്രവര്ത്തിക്കുമ്പോള് ലോഹികസോപ്പിന്റെ അവക്ഷിപ്തം ലഭിക്കുന്നു. എന്നാല് ഉരുകല് പ്രക്രിയയിലാകട്ടെ ലോഹികഹൈഡ്രാക്സൈഡിനെ തക്കതായ ഫാറ്റിഅമ്ലം ഉപയോഗിച്ച് ഉദാസീനമാക്കുകയാണ് ചെയ്യുക. ലോഹികസോപ്പുകളുടെ ഗുണധര്മങ്ങളും ഉപയോഗങ്ങളും അവയുടെ തന്മാത്രയിലെ കാറ്റയോണ്, ആനയോണ് എന്നിവയെ ആശ്രയിച്ചിരിക്കുന്നു. ഇവ ജലത്തില് അലേയങ്ങളാണ്. എന്നാല് ചില കാര്ബണിക ദ്രാവകങ്ങളില് പ്രകീര്ണനം ചെയ്യപ്പെടുകയോ ലയിക്കുകയോ ചെയ്യുന്നു.
കാത്സ്യം സോപ്പുകള് സാധാരണയായി ഉരുകല് പ്രക്രിയവഴി നിര്മിക്കുന്നു. ഈ പ്രക്രിയയില് പാര്ശ്വക്കുഴലില് കണ്ടന്സര് ഘടിപ്പിച്ച ഒരു കെറ്റിലില് മുന്പുതന്നെ ശുദ്ധീകരിച്ച നാഫ്ഥെനിക് അമ്ലം (855 കി.ഗ്രാം) എടുത്ത് 220°Fവരെ ചൂടാക്കുന്നു. കാത്സ്യം ഹൈഡ്രാക്സൈഡ് (108 കി.ഗ്രാം) ഒരു ധ്രുവീയലായനി (151 ഗാലന്) ചേര്ത്ത് കുഴമ്പുരൂപത്തിലാക്കിയശേഷം കുറേശ്ശയായി കെറ്റിലില് ഒഴിക്കുന്നു. തുടര്ന്ന് ആവി ഉപയോഗിച്ച് കെറ്റില് ചൂടാക്കുകയും ചെയ്യുന്നു. മിശ്രിതം ക്രമേണ ചൂടായി തിളയ്ക്കുകയും പ്രതിപ്രവര്ത്തനഫലമായി ഉണ്ടാകുന്ന ജലം പാര്ശ്വക്കുഴലിലൂടെ ബഹിര്ഗമിക്കുകയും ചെയ്യുന്നു. ധ്രുവീയലായനി ബാഷ്പീകരിക്കുമെങ്കിലും കണ്ടന്സര് ഘടിപ്പിച്ചിരിക്കുന്നതുകാരണം ദ്രവീകരിച്ചു തിരികെ കെറ്റിലില് വീഴുകയാണു ചെയ്യുന്നത്.
കാത്സ്യം ഹൈഡ്രാക്സൈഡ് ചേര്ത്തുകഴിഞ്ഞാല് പ്രതിപ്രവര്ത്തനം പൂര്ത്തീകരിക്കുവാനായി കെറ്റിലിന്റെ താപനില 300ബ്ബഎ വരെ ഉയര്ത്തുന്നു. ഈ പ്രക്രിയയില് ഉണ്ടാകുന്ന കാത്സ്യം നാഫ്ഥനേറ്റില് കാത്സ്യത്തിന്റെ അംശം നാലു ശതമാനമായി നിലനിര്ത്തുകയാണു പതിവ്. എന്നാല് കാത്സ്യത്തിന്റെ ശതമാനം ഇതിലുമുപരി വേണമെങ്കില് അവക്ഷേപണപ്രക്രിയ ഉപയോഗിക്കുന്നു. കാത്സ്യം റോസിനോലേറ്റ്, ഓക്ടോവേറ്റ് തുടങ്ങിയ സോപ്പുകള് നിര്മിക്കുവാനും മേല്വിവരിച്ച ഉരുകല് പ്രക്രിയതന്നെ കൈക്കൊള്ളുന്നു.
കാത്സ്യം സോപ്പുകളും മറ്റും ലോഹിക സോപ്പുകളെന്നപോലെ മുഖ്യമായും പെയിന്റുനിര്മാണത്തില് ഡ്രയര് സോപ്പായി ഉപയോഗിക്കുന്നു. ഉണക്കുതൈലങ്ങള് ചേര്ന്നിട്ടുള്ള പെയിന്റുകളില് ഉണക്കുപ്രക്രിയ ത്വരിതപ്പെടുത്തുവാനാണ് ഇവ ചേര്ക്കുന്നത്. ഓക്സീകാരകമായോ പോളിമറീകാരകമായോ പ്രവര്ത്തിച്ച് ഇവ ഉണക്കുപ്രക്രിയയില് ഉത്പ്രരകങ്ങളുടെ പങ്കുവഹിക്കുന്നു. ഇവയ്ക്കുപുറമേ സ്നേഹക(lubricants)ങ്ങെളായും കാര്ബണിക ജെല്ലിങ് പ്രരകങ്ങളായും എമള്ഷനുകളായും നിരവധി കാര്ബണിക രാസപ്രവര്ത്തനങ്ങളില് ഉത്പ്രരകങ്ങളായും വിനൈല് പ്ലാസ്റ്റിക്കുകളുടെ നിര്മാണത്തില് സ്ഥിരീകാരകങ്ങളായും ഈ സോപ്പുകള് ഉപയോഗിച്ചുവരുന്നു.
കാത്സ്യത്തിന്റെ ഉപാപചയം. ശരീരത്തിന്റെ വളര്ച്ചയ്ക്കും ബന്ധപ്പെട്ട പ്രവര്ത്തനത്തിന് ആവശ-്യമായ ഊര്ജ്ജം നല്കുന്നതിനും ഒരു മൂലകം എപ്രകാരം ഉപകരിക്കുന്നുവെന്നതിനെ ആ മൂലകത്തിന്റെ ഉപാപചയം (Metabolism)എന്നു പറയുന്നു.
മനുഷ്യശരീരത്തിലെ കാത്സ്യത്തിന്റെ 99 ശതമാനവും മുഖ്യമായ അംശം എല്ലുകളിലാണ് കേന്ദ്രീകരിച്ചിരിക്കുന്നത്. എല്ലിന്റെ പ്രധാനപ്പെട്ട ഉള്ളടക്കം കാത്സ്യം ഫോസ്ഫേറ്റാണ്. എല്ലിന്റെ വളര്ച്ചയ്ക്കും വികാസത്തിനും പ്രധാനപ്പെട്ട പ്രവര്ത്തനങ്ങള്ക്കും കാത്സ്യവും ഫോസ്ഫറസും അത്യന്താപേക്ഷിതമാണ്. ബാക്കി ഒരു ശതമാനം മൃദുകലകളിലും കോശാന്തരദ്രവങ്ങളിലും വ്യാപൃതമായിരിക്കുന്നു.
കാത്സ്യത്തിന്റെ ലഭ്യതയില് തകരാറുവന്നാല് എല്ലിന് വൈരൂപ്യം സംഭവിക്കുന്നു. കാത്സ്യത്തിന്റെ സാമാന്യ അവശോഷണത്തിനും ഉപാപചയത്തിനും സഹായകമായി ജീവകംഡി പ്രവര്ത്തിക്കുന്നു. ജീവകംഡിയുടെ കുറവുകൊണ്ട് ഇവയ്ക്കു തകരാറു സംഭവിക്കുന്നു. എല്ലുകള് വേണ്ടപോലെ ഉറയ്ക്കാതെ കുട്ടികള്ക്ക് കണ എന്ന രോഗമുണ്ടാകുന്നു. കണ ബാധിച്ച കുട്ടികള് പൊതുവേ അസ്വസ്ഥരും ക്ഷീണിതരും വിളര്ച്ച ബാധിച്ചവരും മാംസപേശികള്ക്ക് ദൃഢതയില്ലാത്തവരും ആയിരിക്കും. പല്ലുമുളയ്ക്കാന് താമസം നേരിടും. നടക്കുമ്പോള് കാലിലെ എല്ലുകള് വളയുകയും മുട്ടുകള് തമ്മില് തട്ടുകയും ചെയ്യും. കുട്ടികള്ക്ക് കണ എന്നപോലെ പ്രായമായവരില് ഉണ്ടാകുന്നതാണ് ഓസ്റ്റിയോമലേഷ്യ (Osteomalacia) എന്ന രോഗം. കാത്സ്യം അല്ലെങ്കില് ജീവകംഡി അല്ലെങ്കില് ഇവ രണ്ടും ശരീരത്തില് കുറയുന്നതിനാലാണ് ഇത് സംഭവിക്കുന്നത്. കാത്സ്യവും ജീവകംഡിയും ധാരാളം ലഭിക്കുന്നതായാല് ഈ രോഗങ്ങള് ബാധിക്കുന്നതല്ല.
രക്തത്തിലെ സെല്ലുകളെ അപേക്ഷിച്ച് പ്ലാസ്മയില് കൂടുതല് കാത്സ്യം കണ്ടുവരുന്നു. 100 മില്ലിലിറ്റര് രക്തത്തിലെ സിറത്തില് 10 മില്ലിഗ്രാം കാത്സ്യം വീതം ഉണ്ട്. നാഡീയ ഉത്തേജനശീലത (nervous irritability) തുടങ്ങിയ സ്ഥിതിവിശേഷത്തില് കാത്സ്യത്തിന്റെ മേല്കാണിച്ച അളവു കുറഞ്ഞും കാണുന്നു. കണയുണ്ടാകുമ്പോഴും രക്തസിറത്തില് കാത്സ്യം കുറഞ്ഞുകാണുന്നുണ്ട്.
പാരാതൈറോയിഡ് ഗ്രന്ഥിയുടെ പ്രവര്ത്തനവും രക്തത്തിലെ കാത്സ്യത്തിന്റെ അളവും തമ്മില് ബന്ധമുണ്ട്. ഈ ഗ്രന്ഥിയുടെ പ്രവര്ത്തനം ത്വരിതമാവുകയാണെങ്കില് എല്ലുകളിലെ കാത്സ്യം കുറഞ്ഞും രക്തത്തിലെ കാത്സ്യം വര്ധിച്ചും കാണും. എന്നാല് ഗ്രന്ഥിയുടെ പ്രവര്ത്തനം മന്ദഗതിയിലാണെങ്കില് രക്തത്തിലെ കാത്സ്യത്തിന്റെ മാത്ര വളരെ കുറഞ്ഞുകാണും. ഹൃദയത്തിന്റെ സുഗമമായ പ്രവര്ത്തനത്തിന് രക്തത്തിലെ സോഡിയം, കാത്സ്യം, പൊട്ടാസ്യം, ലവണങ്ങള് തമ്മില് അനുരൂപമമായ സമീകരണം പുലര്ത്തേണ്ടത് ഒഴിച്ചുകൂടാന് പാടില്ലാത്തതാണ്. രക്തം കട്ടപിടിക്കാനുതകുന്ന ഫൈബ്രിന്റെ (fibrin) നിര്മാണത്തിലും കാത്സ്യം ഒരു പ്രധാന പങ്കു വഹിക്കുന്നുണ്ട്.
നമ്മുടെ ആഹാരവിഭവങ്ങളില് കാത്സ്യം സാമാന്യമായി വ്യാപരിച്ചുകിടക്കുന്നുണ്ട്. മീനെണ്ണ, മുട്ട, കരള്, പാല് എന്നിവയില് ഇത് ധാരാളം അടങ്ങിയിട്ടുണ്ട്; ധാന്യങ്ങളിലും മാംസത്തിലും കുറവാണ്. കാത്സ്യം ഓക്സലേറ്റ് രൂപത്തില് ചില സസ്യങ്ങളില് കാത്സ്യം കാണുന്നുണ്ട്. പക്ഷേ ഈ ലവണം അലേയമാകയാല് ഈ സസ്യങ്ങള് ശരീരത്തിനു കാത്സ്യം പ്രദാനം ചെയ്യുന്നില്ല. പാലില് പല അകാര്ബണിക ലവണങ്ങളുടെ രൂപത്തിലും കസീനുമായി സംയോജിച്ചും ധാരാളം കാത്സ്യം സ്ഥിതിചെയ്യുന്നുണ്ട്.
പ്രായപൂര്ത്തിയായ ഒരു വ്യക്തിയുടെ ദിനംപ്രതി ആഹാരത്തില് 1.0 ഗ്രാം കാത്സ്യം അടങ്ങിയിരിക്കണം. ശിശുപ്രായത്തില് 1.02 ഗ്രാം വീതവും കൗമാരപ്രായത്തില് 11.4 ഗ്രാം വീതവും ദിനംപ്രതി ആവശ്യമുണ്ട്. കൂടുതല് പ്രസവിക്കുന്തോറും ശരീരത്തിലെ കാത്സ്യം ക്ഷയിച്ചുപോകുന്നു. ഗര്ഭകാലത്തും കുഞ്ഞുങ്ങളെ പാലൂട്ടുന്ന കാലങ്ങളിലും കാത്സ്യം കൂടുതല് അളവില് (ദിനംപ്രതി കുറഞ്ഞപക്ഷം 1.52 ഗ്രാം) വേണ്ടിവരും. മറ്റു ഭക്ഷണപദാര്ഥങ്ങള്ക്കു പുറമേ ഒരുകപ്പു പാല് ദിനംപ്രതി കുടിക്കുകയാണെങ്കില് നമുക്കാവശ്യമായ കാത്സ്യം ലഭ്യമാകുന്നതാണ്. 70 ശതമാനം മലത്തിലൂടെയും, 30 ശതമാനം കാത്സ്യം മൂത്രത്തിലൂടെയും അകാര്ബണിക ലവണങ്ങളുടെ രൂപത്തില് വിസര്ജിക്കപ്പെടുന്നുണ്ട്.
(പ്രാഫ. ആര്. രത്നാംബാള്)