This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
കലോറിമിതി രീതികള്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
കലോറിമിതി രീതികള്
(a) മിശ്രിതരീതി (Method of mixtures). താപത്തിന്റെ സംരക്ഷണമാണ് മിശ്രിതരീതിയുടെ അടിസ്ഥാന തത്ത്വം. അതായത്, തപ്തമായ ഒരു ദ്രവ്യത്തെ തണുത്ത മറ്റൊരു ദ്രവ്യവുമായി കലര്ത്തുമ്പോള് തപ്തമായ വസ്തുവിന് നഷ്ടപ്പെടുന്ന താപം മുഴുവന് തണുത്ത വസ്തു സ്വീകരിക്കുന്നു.
ഒരു ഖരദ്രവ്യത്തിന്റെ വിശിഷ്ടതാപം നിര്ണയിക്കുന്നതിന് അത് ചെറിയ അംശങ്ങളായി എടുക്കുന്നു. പിന്നീട് ഒരു സ്റ്റീം ഹീറ്ററില് നീരാവിയുമായി നേരിട്ടു സമ്പര്ക്കത്തില്പ്പെടാതെ 100°C വരെ ചൂടാക്കുന്നു. M1 ഗ്രാം ദ്രവ്യമാനമുള്ള ഒരു ചെമ്പുപാത്രത്തിലുള്ള M ഗ്രാം ജലത്തിന്റെ താപനില കൃത്യമായളന്നശേഷം അതിലേക്ക് ചൂടാക്കിയ ഖരദ്രവ്യം പെട്ടെന്ന് നിക്ഷേപിക്കുന്നു. ജലം നന്നായി ഇളക്കി, താപനില θ2 അളക്കുന്നു. കലോറി മീറ്റര് ഒന്നുകൂടി തൂക്കിനോക്കി നിക്ഷേപിച്ച ദ്രവ്യത്തിന്റെ ദ്രവ്യമാനം (m) കണ്ടുപിടിക്കുന്നു. കലോറിമീറ്റര് മറ്റൊരു പാത്രത്തിനകത്ത് അചാലകവസ്തു(non-conductor)വായ പഞ്ഞിയില് പൊതിഞ്ഞുവച്ചിരിക്കുന്നതിനാല് ചാലനംകൊണ്ടും സംവഹനം കൊണ്ടും വികിരണംകൊണ്ടും വരാവുന്ന താപനഷ്ടം കുറയുന്നു.
കലോറി മീറ്ററിന്റെ പുറവശവും പുറം പാത്രത്തിന്റെ ഉള്വശവും നല്ലവണ്ണം മിനുക്കി വച്ചിരിക്കും. തപിപ്പിച്ച ദ്രവ്യം നിക്ഷേപിച്ച ഉടനെ കലോറിമീറ്റര് അടച്ചുവയ്ക്കുകയും ചെയ്യുന്നു. നഷ്ടമാകുന്ന അല്പതാപത്തിനു പ്രതിവിധിയായി വികിരണസംശോധനം (radiation correction) പ്രയോഗിക്കുന്നു. സംശോധിത താപനില θ3 എങ്കില് ഖരവസ്തുവിനുണ്ടായ താപനഷ്ടം = ജലത്തിനും കലോറിമീറ്ററിനും ഉണ്ടായ താപലാഭം; (M1 S1 + M) ( θ3- θ1)- = m (100 - θ3 ) S. ഇവിടെ S1 കലോറിമീറ്റര് നിര്മിച്ച വസ്തുവിന്റെ വിശിഷ്ടതാപവും S ഖരവസ്തുവിന്റെ വിശിഷ്ടതാപവുമാണ്. ഇതില് നിന്ന് S കണ്ടുപിടിക്കാം.
b. ശീതളനസമ്പ്രദായം (Method of cooling). ഇത് ദ്രാവകങ്ങള്ക്കുമാത്രം അനുയോജ്യമായ സമ്പ്രദായമാണ്. ദ്രാവകത്തിനു മാത്രമേ ശീതളനം സ്ഥിരമായ പരിതഃസ്ഥിതിയില് നിര്ത്തുന്നതിനു കഴിയുകയുള്ളു.
ഒരു ആവൃതി (enclosure)യില് വച്ചിട്ടുള്ള തപ്തപദാര്ഥത്തിന്റെ ശീതളനനിരക്ക് പദാര്ഥത്തിന്റെ താപനിലയും ചുറ്റുപാടുമുള്ള താപനിലയും തമ്മിലുള്ള വ്യത്യാസത്തിന് ആനുപാതികമായിരിക്കും എന്ന് ന്യൂട്ടന്റെ ശീതളനനിയമം പറയുന്നു. അതായത്,
dθ/dt = (θ1 - θ2)/t =k∫(θ)
ഇവിടെ k എന്നത് ശീതളനത്തിനു വിധേയമാകുന്ന പ്രതലത്തിന്റെ പ്രകൃതിയെയും വിസ്തീര്ണത്തെയും ആശ്രയിച്ചു നില്ക്കുന്ന ഒരു സ്ഥിരാങ്കമാണ്. തപ്തനിലയിലുള്ള ദ്രവ്യത്തിന് ആവൃതിയെക്കാള് അധികമുള്ള താപനിലയാണ് θ. f (θ), θ യുടെ ഒരു ഫലനവും (function). ഒരു ദ്രാവകത്തിന്റെ വിശിഷ്ടതാപം നിര്ണയിക്കുന്നത് ഇപ്രകാരമാണ്: പുറവശം മണ്ണെണ്ണക്കരി തേച്ച് കറുപ്പിച്ച ഒരു ചെമ്പു കലോറിമീറ്ററില് ഒരു നിശ്ചിത നിരപ്പുവരെ 80°C ചൂടുള്ള ജലം എടുത്ത് ഒരു ആവൃതിക്കകത്ത് നൂലുകൊണ്ടു കെട്ടിത്തൂക്കി വയ്ക്കുന്നു. ദ്രാവകം ഇളക്കി 40°C താപനില എത്തുന്നതുവരെ ഓരോ മിനിട്ടിലും താപനില അളന്നു കുറിക്കുന്നു. ജലത്തിന്റെ ദ്രവ്യമാനം (M1) പിന്നീട് നിര്ണയിക്കുന്നു. അതേ കലോറി മീറ്ററില് പരീക്ഷണത്തിനു വിധേയമാക്കുന്ന ദ്രാവകം 80°C താപനിലയില് എടുത്ത് അതേ നിരപ്പു വരെ ഒഴിച്ച് പരീക്ഷണം ആവര്ത്തിക്കുന്നു. പിന്നീട് ദ്രാവകത്തിന്റെ ദ്രവ്യമാനം (M2) നിര്ണയിക്കുന്നു. രണ്ടു ശീതളനരേഖകള് (cooling curves)ഒരേ സ്കെയില് സ്വീകരിച്ചു വരയ്ക്കുന്നു. ഈ രേഖകള് പരിശോധിച്ചു θ1°C മുതല് θ2°C വരെ തണുക്കാന് ജലം എടുക്കുന്ന സമയം t1 മിനിട്ടും അതേ താപനില സീമയില് തണുക്കാന് ദ്രാവകം എടുക്കുന്ന സമയം t2 മേിനിട്ടും യഥാക്രമം കണ്ടുപിടിക്കാം. രണ്ടു പരീക്ഷണങ്ങളിലും പരിതഃസ്ഥിതികള് ഒന്നുതന്നെ ആയതിനാല് ശീതളനനിരക്കിന് വ്യത്യാസം വരാന് ഇടയില്ല.
(M1S1 + W) θ1 - θ2/t1 = (M2 S2 +W) (θ1 -(θ2/t2
ഇവിടെ S1 ജലത്തിന്റെ വിശിഷ്ടതാപവും S2 ദ്രാവകത്തിന്റെ വിശിഷ്ടതാപവും W കലോറിമീറ്ററിന്റെ ജലതുല്യാങ്കവുമാണ്. ഇതില് നിന്ന് S2 കണ്ടുപിടിക്കാം.
c. വൈദ്യുതരീതി (Electrical method). ഈ സമ്പ്രദായം Q = m S θ എന്ന ലഘുബന്ധത്തെ ആസ്പദമാക്കിയിട്ടുള്ളതാണ്. ഇവിടെ Q താപമായി രൂപാന്തരപ്പെട്ട (അളന്നു തിട്ടപ്പെടുത്തിയ) വൈദ്യുതോര്ജം,m പദാര്ഥത്തിന്റെ ദ്രവ്യമാനം, S അതിന്റെ വിശിഷ്ടതാപം,θ താപനിലയിലുണ്ടാകുന്ന വര്ധനവ്. R ഓം (ohm) രോധമുള്ള ഒരു കമ്പിച്ചുരുളില് കൂടി E വോള്ട്ട് (volt) പൊട്ടന്ഷ്യല് അന്തരത്താല് I ആംപിയര് പ്രവാഹം കൊണ്ട് താപോര്ജം ജനിക്കുന്നു എങ്കില്, സെക്കന്ഡില് ചെലവഴിച്ച വൈദ്യുതോര്ജം Elt അഥവാ I2Rt ജൂള് ആണ്. Q = -Elt/J = I2Rt/J കലോറിയാണ്; ഇവിടെ J യാന്ത്രികതുല്യാങ്കം (mechanical equivalent of heat).ഈ സമ്പ്രദായത്തിന് വികിരണശോധനം ആവശ്യമാണ്.
d. ലീനതാപരീതി. രണ്ടു തരത്തില് ഈ സമ്പ്രദായത്തെ വിഭജിക്കാം.
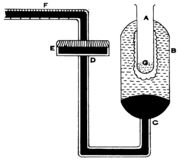
1. ഉരുകുന്ന ഐസ് സമ്പ്രദായം (Method of melting ice). തപ്തമായ ഒരു വസ്തുവിനു നഷ്ടപ്പെടുന്ന താപം M ഗ്രാം ഐസിനെ ഉരുക്കുന്നു. അതിനുവേണ്ട താപം M x L കലോറി ആണ്. വസ്തുവിന്റെ ദ്രവ്യമാനം m ഗ്രാം ആണെങ്കില് അത് θ0 താപനിലയില് നിന്ന് 0°C വരെ തണുക്കുമ്പോള് നഷ്ടപ്പെടുന്ന താപം M x S x θ കലോറിയായിരിക്കും. MSθ - M L. ഇവിടെ S ദ്രവ്യത്തിന്റെ വിശിഷ്ടതാപമാണ്; L ഐസിന്റെ ലീനതാപവും. ബുണ്സണ് ഐസ് കലോറിമീറ്റര് എന്ന ഉപകരണം ഉപയോഗിച്ച്, എത്രഗ്രാം ഐസ് ഉരുകുന്നുവെന്നു നിര്ണയിക്കാം. ഐസ് ജലമാകുമ്പോള് അതിനു വന്നുചേരുന്ന വ്യാപ്തവ്യത്യാസമാണ് യഥാര്ഥത്തില് കണ്ടുപിടിക്കുന്നത്.
ഉപകരണത്തിന്റെ പ്രധാന ഭാഗം A എന്ന ടെസ്റ്റ് ട്യൂബും അതിനു ചുറ്റുമുള്ള ബള്ബുമാണ്. ഈ ബള്ബിന്റെ (B) താഴ്ഭാഗത്ത് CD എന്ന ഗ്ലാസ്ട്യൂബ് ബന്ധിച്ചിട്ടുണ്ട്. ഇഉയുടെ സ്വതന്ത്ര അഗ്രത്തില് E എന്ന വിസ്താരമേറിയ ഒരു കുണ്ഡിക (reservoir) ഘടിപ്പിച്ചിട്ടുണ്ട്. അതിനെ ഒരു കോര്ക്കുകൊണ്ട് വായു പ്രവേശിക്കാത്തവിധം മൂടി വച്ചിരിക്കുന്നു. അങ്കനം ചെയ്തിട്ടുള്ള ഒരു കേശനാളി (capillary tube: F) ഈ കോര്ക്കില്ക്കൂടി കടത്തിയിട്ടുണ്ട്. അതിന്റെ നീളമുള്ള ഭാഗം ക്ഷൈതിജമായി (horizontal) നിര്ത്തിയിരിക്കും. കേശനാളി ഘടിപ്പിക്കുന്നതിനു മുമ്പ് വായു കലര്ന്നു ചേരാത്ത ജലം കുണ്ഡികയില് ഒഴിക്കുന്നു. പിന്നീട് രസവും (mercury); ജലം ബള്ബില് മിക്കവാറും നിറയുന്നതുവരെയും രസം ബള്ബിന്റെ കീഴ്ഭാഗത്തും കുണ്ഡികയിലും കേശനാളിയില് ഒരു നിശ്ചിത അടയാളം വരെയും. ഐസുകൊണ്ട് തണുപ്പിച്ച ആല്ക്കഹോളോ ഈതറോ (G) അല് ഒഴിച്ച് അതിന്റെ പുറകുവശത്ത് ഐസ് കട്ടിയായി രൂപം പ്രാപിക്കാന് അനുവദിക്കുന്നു. പരീക്ഷണം ആരംഭിക്കുന്നതിനു മുമ്പ് എ അങ്കനം ചെയ്തിട്ടുള്ള സ്കെയില് അംശാങ്കനം ചെയ്യുന്നു (calibrate). അളന്നു തിട്ടപ്പെടുത്തിയ θº താപനിലയുള്ള M ഗ്രാം ജലം A-ല് ഒഴിക്കുന്നു. അതിന് θº-ല് നിന്ന് 0ºC വരെ തണുക്കുമ്പോള് നഷ്ടപ്പെടുന്ന താപം Q = m x θ കലോറിയാണ്. ഇത്രയും താപം M ഗ്രാം ഐസ് ഉരുക്കുന്നു. അതോടുകൂടി അത്രയും ഐസിന്റെ വ്യാപ്തം അല്പം കുറയുന്നതിനാല് Fലെ x അങ്കനങ്ങള് പുറകോട്ടു നീങ്ങുന്നു. Q കലോറിക്ക് x ആനുപാതികമായിരിക്കും. ഇതില് നിന്ന് സ്കെയിലിലെ ഒരു അങ്കനം പുറകോട്ടു നീങ്ങുന്നതിന് ഐസിനു നല്കേണ്ട താപം q = Q/x ആണെന്നു ലഭിക്കുന്നു.
ഒരു ഖരപദാര്ഥത്തിന്റെ വിശിഷ്ടതാപം നിര്ണയിക്കാന് അത് ഒരു നിശ്ചിത താപനില t°C വരെ തപിപ്പിച്ച് A-ല് നിക്ഷേപിക്കുക. രസതന്തു പിന്വാങ്ങുന്ന അങ്കനങ്ങള് (y) നോക്കിക്കുറിക്കുക. അപ്പോള് ദ്രവ്യത്തിനു നഷ്ടപ്പെടുന്ന താപമാനം y Q/x = MSt. ഇവിടെ M പദാര്ഥത്തിന്റെ ദ്രവ്യമാനം, S അതിന്റെ വിശിഷ്ടതാപം.
ഈ രീതിയുടെ സൂക്ഷ്മത B-യിലുള്ള ജലത്തിന്റെ ശുദ്ധതയെ ആശ്രയിച്ചിരിക്കുന്നു. ഒരു സാമ്പിള് ജലം തന്നെ സാന്ദ്രതയ്ക്ക് അല്പാല്പം വ്യത്യാസമുള്ള ഐസായി രൂപാന്തരപ്പെടും എന്ന ചെറിയൊരു ന്യൂനതയും ഈ രീതിക്ക് ഉണ്ട്. പക്ഷേ അതുകൊണ്ടു വരുന്ന പിശക് 1000ന് ഒരംശത്തില് കൂടുതലില്ല. ദ്രവ്യം ദ്രാവകം ആയാലും ഈ ഉപകരണം ഉപയോഗിക്കാം.
2. നീരാവിസംഘനനരീതി (Method of condensation of steam). ഈ സമ്പ്രദായത്തില് പരീക്ഷണത്തിനു വിധേയമാകുന്ന m ഗ്രാം ദ്രവ്യം അതിന്റെ പ്രാരംഭ താപനിലയില് നിന്ന് നീരാവിയുടെ താപനില വരെ ഉയരുന്നതിനു വേണ്ട താപം എത്രഗ്രാം (M) നീരാവിയെ 100°C-ല് ജലമായി സംഘനനം ചെയ്യുന്നുവെന്നു തിട്ടപ്പെടുത്തുന്നു. Q = mSθ = ML എന്ന സമവാക്യം തന്നെയാണ് ഇവിടെയും പ്രായോഗികമാക്കുന്നത്; ഇവിടെ θ ദ്രവ്യത്തിന്റെ താപനിലയ്ക്കുണ്ടാകുന്ന വര്ധനവ്, L നീരാവിയുടെ ലീനതാപം. ഈ രീതി ഉപയോഗിച്ച് ഒരു ദ്രവ്യത്തിന്റെ വിശിഷ്ടതാപം നിര്ണയിക്കാന് ആദ്യമായി 1884ല് ജോളി എന്ന ശാസ്ത്രജ്ഞന് ജോളി സ്റ്റീം കലോറിമീറ്റര് എന്ന പേരില് ഒരു ഉപകരണം വിഭാവനം ചെയ്തു. 1889ല് ഈ ഉപകരണം ഭേദദര്ശക കലോറിമീറ്റര് (Differential steam calorimeter) ആയി പരിഷ്കരിച്ച് വാതകങ്ങളുടെ സ്ഥിരവ്യാപ്ത വിശിഷ്ടതാപം (specific heat at constant volume) കണ്ടുപിടിക്കുവാന് ഉപയോഗിക്കുകയുണ്ടായി.
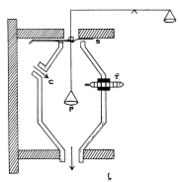
ജോളി സ്റ്റീം കലോറി മീറ്റര്. ഒരു ദ്രവ്യത്തെ (ഖരപദാര്ഥം) പരീക്ഷണശാലയിലെ താപനിലയില് നിന്ന് നീരാവിയുടെ താപനിലവരെ (100°C) തപിപ്പിക്കുന്നതിന് എത്രമാത്രം നീരാവി അതിന്റെ താപനില 100°Cല് സ്ഥിരമായി നിന്നുകൊണ്ട് ജലമായി സംഘനിക്കണം എന്നു നിര്ണയിക്കുന്ന രീതിയാണ് ഇതില് അവലംബിച്ചിട്ടുള്ളത്.
C എന്ന അറയില് നീരാവി പ്രവേശിക്കുന്നു. അറയില് തൂക്കിനിര്ത്തിയിട്ടുള്ള ഒരു ത്രാസിന്റെ ഇടത്തേ തട്ടില് നീരാവി പൊതിയുന്നു. നീരാവി പ്രവേശിക്കുന്നതിനു മുമ്പ് അറയുടെ താപനില θ1. നീരാവി പ്രവേശിച്ച ഉടനെ തുലനാവസ്ഥയില് ഇരുന്ന ത്രാസിന്റെ ഇടത്തേ തട്ട് താഴുന്നു, W1 ഗ്രാം നീരാവി സംഘനിക്കുന്നു. വലത്തേ തട്ടില് കട്ടികള് വച്ച് ത്രാസ് തുലനം ചെയ്ത് എത്ര ഗ്രാം നീരാവി സംഘനിക്കുന്നുവെന്നു മനസ്സിലാക്കാം. പിന്നീട് M ഗ്രാം ഖരപദാര്ഥം P-ല് വച്ച് പരീക്ഷണം ആവര്ത്തിക്കുന്നു. വീണ്ടും നീരാവി പ്രവേശിപ്പിച്ച് എത്ര ഗ്രാം നീരാവി സംഘനിക്കുന്നുവെന്നു കണ്ടുപിടിക്കുന്നു. W2 ഗ്രാം നീരാവി സംഘനിക്കുന്നുവെന്നിരിക്കട്ടെ; എങ്കില് mS (100 - θ1) = (W2 - W1) L. മേല് വിവരിച്ച സമവാക്യം ഉപയോഗിച്ച് ഖരപദാര്ഥത്തിന്റെ വിശിഷ്ടതാപം S കണക്കാക്കിയെടുക്കാം.
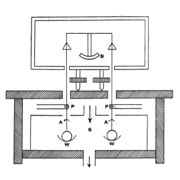
ജോളി ഭേദ ദര്ശക കലോറിമീറ്റര് (Differential calorimeter). ഈ ഉപകരണം കൊണ്ട് വാതകങ്ങളുടെ സ്ഥിരവ്യാപ്ത വിശിഷ്ടതാപം (Cv) കണ്ടുപിടിക്കാം. വാതകത്തിന്റെ വ്യാപ്തം സ്ഥിരമായി വച്ചുകൊണ്ട് അതിന്റെ താപനില θ1°ല് നിന്ന് 100°C വരെ ഉയര്ത്താന് എത്ര ഗ്രാം നീരാവി വേണം എന്നു നിര്ണയിക്കാന് കഴിയുന്ന ഒരു രീതി ജോളി വിഭാവനം ചെയ്തു പ്രയോഗത്തില് വരുത്തി. Sഎന്ന സ്റ്റീം ചേംബറില് പൊള്ളയായ രണ്ടു ചെമ്പു ഗോളങ്ങള് ഒരു ത്രാസിന്റെ (B) തട്ടുകളില് നിന്ന് നേരിയകമ്പികള്കൊണ്ട് (P) കെട്ടിത്തൂക്കിയിരിക്കുന്നു. ഈ ഗോളങ്ങളുടെ കീഴ്ഭാഗത്ത് W, W എന്ന രണ്ടു സമരൂപമുള്ള തട്ടുകളും ഘടിപ്പിച്ചിട്ടുണ്ട്. ഈ തട്ടുകള് ഗോളങ്ങളില് സംഘനിക്കുന്ന നീരാവി ശേഖരിക്കുന്നു. സ്റ്റീം ചേംബറിന്റെ ഭിത്തികളില് സംഘനിക്കുന്ന ജലബിന്ദുക്കള് ഗോളത്തിന്മേല് വീഴാതെ A,A എന്ന കവചങ്ങള് തടയുന്നു. വൈദ്യുതിപ്രവാഹം അയച്ച് തപിപ്പിച്ച ഓരോ കമ്പിച്ചുരുളുകള് ഗോളങ്ങള് തൂക്കിയിട്ടുള്ള കമ്പികള് കടന്നുപോകുന്ന ചേംബറിലെ സുഷിരങ്ങളില് നീരാവി സംഘനിക്കാതെ പരിരക്ഷിക്കുന്നു.
പരീക്ഷണം ആരംഭിക്കുന്നതിനു മുമ്പ് രണ്ടു ഗോളങ്ങളും നിര്വാതനം (evacuation) ചെയ്ത് ത്രാസില് കെട്ടിത്തൂക്കി ത്രാസ് തുലനാവസ്ഥയില് നിര്ത്തുന്നു. ഒരു ഗോളത്തില് ശുദ്ധമായ വാതകം ഒരു നിശ്ചിത മര്ദത്തില് അടക്കം ചെയ്തു കെട്ടിത്തൂക്കി ത്രാസ് വീണ്ടും തുലനം ചെയ്യുന്നു. അങ്ങനെ പരീക്ഷണത്തിനു വിധേയമാകുന്ന വാതകത്തിന്റെ ദ്രവ്യമാനം m അറിയാന് കഴിയുന്നു. വാതകത്തിന് ചേംബറിലെ താപനില പ്രാപിക്കാന് വേണ്ടത്ര സമയം നല്കിയതിനുശേഷം ആ താപനില θ1°C അളക്കുന്നു. നീരാവി ചേംബറില് പ്രവേശിപ്പിച്ച് ഗോളങ്ങളില് സംഘനിക്കാന് അനുവദിക്കുന്നു. ശൂന്യമായിരിക്കുന്ന ഗോളത്തില് സംഘനിക്കുന്ന നീരാവിയെക്കാള് കൂടുതല് നീരാവി മറ്റേ ഗോളത്തില് സംഘനിക്കുന്നു. അവയുടെ ദ്രവ്യമാന വ്യത്യാസം W, ത്രാസ് വീണ്ടും തുലനം ചെയ്ത് അറിയാവുന്നതാണ്. നീരാവിയുടെ താപനില θ1° ആണെങ്കില് mCv (θ2 - θ1) = WL; L= നീരാവിയുടെ ലീനതാപം, Cv= വാതകത്തിന്റെ സ്ഥിരവ്യാപ്ത വിശിഷ്ടതാപം.
സതതപ്രവാഹ കലോറിമീറ്റര് (Continuous flow method calorimeter). കാലണ്ടര്, ബാണ്സ് എന്നിവരുടെ സതത പ്രവാഹരീതി അവലംബിച്ച് ദ്രാവകങ്ങളുടെ വിശിഷ്ട താപം കണ്ടുപിടിക്കാം. പരീക്ഷണത്തിനു വിധേയമാകുന്ന ദ്രാവകം ഒരു ക്വാര്ട്ട്സ് കുഴലില്ക്കൂടി അഖണ്ഡമായി ഒരേ നിരക്കില് പ്രവഹിപ്പിക്കുന്നു. ഈ കുഴലില് ഒരറ്റം മുതല് മറ്റേ അറ്റംവരെ നീണ്ടുകിടക്കുന്ന ഒരു പ്ലാറ്റിനം കമ്പിച്ചുരുള് ഉണ്ട്. ദ്രാവകം അതിനെ ചുറ്റിയാണ് ഒഴുകുന്നത്. ഒരു വൈദ്യുതീപ്രവാഹം (I ആംപിയര്) കമ്പിച്ചുരുളില് കൂടി അയച്ച് സ്ഥിരമായ നിരക്കില് ഒഴുകുന്ന ദ്രാവകത്തെ ചൂടാക്കുന്നു. ചുരുളിന്റെ അഗ്രങ്ങള് തമ്മില് ഉള്ള പൊട്ടന്ഷ്യല് അന്തരവും (E വോള്ട്ട്) പ്രവാഹത്തിന്റെ തോതും (I ആംപിയര്) അളക്കുന്നു. കുഴലിലെ പ്രവേശനാഗ്രത്തിലും നിര്ഗമനാഗ്രത്തിലും പ്ലാറ്റിനം റെസിസ്റ്റന്സ് തെര്മോമീറ്റര് ഘടിപ്പിച്ച് അവിടങ്ങളില് സ്ഥിരമായി വര്ത്തിക്കുന്ന θ1°,θ2° താപനില യഥാക്രമം അളക്കുന്നു. ക്ലിപ്തസമയത്തില് (t സെ.) പുറത്ത് ഒഴുകിവരുന്ന ദ്രാവകത്തിന്റെ ദ്രവ്യമാനവും അളക്കുന്നു. ദ്രാവകം പ്രവഹിക്കുന്ന കുഴലിനെ ഒരു വാക്വംജാക്കറ്റുകൊണ്ടു പൊതിഞ്ഞു വച്ചിരിക്കുന്നതിനാല് വികിരണ സംശോധനം തീരെ ഇല്ലാതാക്കാന് സാധിക്കുന്നു. ഈ വാക്വംജാക്കറ്റ് തന്നെയും ഒരു സ്ഥിരതാപനിലയില് വര്ത്തിക്കുന്ന ശീതള ജലത്തില് കിടത്തിയിരിക്കും. താപമായി t സെക്കണ്ടില് രൂപാന്തരപ്പെടുന്ന വൈദ്യുതോര്ജം Elt/J കലോറിയാണ്. ദ്രാവകം അവശോഷണം ചെയ്യുന്ന താപവും ഇതുതന്നെയാണ്.
EIt/J- = mS (θ2 - θ1) + R ഇവിടെ m ഗ്രാം t സെക്കണ്ടില് ഒഴുകിവരുന്ന ദ്രാവകത്തിന്റെ ദ്രവ്യമാനം; S ദ്രാവകത്തിന്റെ വിശിഷ്ട താപം; R വികിരണത്താല് ഉണ്ടാകുന്ന താപനഷ്ടം. ദ്രാവകത്തിന്റെ പ്രവാഹനിരക്ക് വര്ധിപ്പിക്കുകയും (θ2 - θ1) നു വ്യത്യാസം വരാത്തവിധത്തില് വൈദ്യുതിയുടെ പ്രവാഹം ക്രമീകരിക്കുകയും ചെയ്ത് പരീക്ഷണം ആവര്ത്തിക്കുന്നു. ഇപ്പോള് t സമയത്തില്ത്തന്നെ ശേഖരിക്കുന്ന ദ്രാവകത്തിന്റെ ദ്രവ്യമാനം m1 ഗ്രാം, വൈദ്യുതീപ്രവാഹം I1 ആംപിയര്, പൊട്ടന്ഷ്യല് സ്ഥാനാന്തരം E1 വോള്ട്ട് ആണെന്നിരിക്കട്ടെ. എങ്കില്
E1 I1t | J = m1 S (θ2 - θ1 ) + R
വികിരണ നഷ്ടം രണ്ടു പരീക്ഷണങ്ങളിലും തുല്യമായിരിക്കാനേ വഴിയുള്ളു:
S = (E1 I1 - EI)t / J(m1-m)(θ2 - θ1)
മേല്പറഞ്ഞ രീതിയില് ചെറിയ വ്യത്യാസങ്ങള് വരുത്തി വാതകത്തിന്റെ സ്ഥിരമര്ദ വിശിഷ്ടതാപം (specific heat at constant pressure) നിര്ണയിക്കാവുന്നതാണ്.
വൈദ്യുതരീതി (Electrical method). ഈ രീതിയില് വിശിഷ്ട താപം അറിയേണ്ട ഖരപദാര്ഥം തന്നെ കലോറിമീറ്ററായി ഉപയോഗിക്കുന്നു. ഒരു താപകച്ചുരുള് (heater - coil) അതിനെ വലയം ചെയ്തിരിക്കും. ഒരു വാക്വം ഫ്ളാസ്കിനകത്താണ് (vaccum flask) അത് വച്ചിട്ടുള്ളത്. താപകച്ചുരുള് തന്നെയാണ് രോധതെര്മോമീറ്റര് (resistance thermometer) ആയി ഉപയോഗിച്ച് താപനില അളക്കുന്നത്. ആദ്യം ഖരപദാര്ഥത്തിന്റെ താപനില താഴ്ത്തി വയ്ക്കുന്നു. ഒരു വൈദ്യുതീപ്രവാഹം I ആംപിയര് E വോള്ട്ട് പ്രയോഗിച്ച് t സെക്കന്ഡ് നേരത്തേക്ക് ചുരുളില് കൂടി അയയ്ക്കുന്നു. അന്തിമമായി എത്തിച്ചേരുന്ന താപനില ചുരുളിന്റെ രോധം സൂചിപ്പിക്കുന്നു. കലോറിമീറ്ററിനെ തൊടാതെ ഒരു സ്ഥിരതാപനിലയുള്ള ആവൃതി അതിനെ ആവരണം ചെയ്തു വച്ചിരിക്കും.
EIt = Jm (θ1 + δθ) എന്ന സമവാക്യം ഉപയോഗിച്ച് വിശിഷ്ട താപം കണക്കാക്കപ്പെടുന്നു. ഇവിടെ J യാന്ത്രിക തുല്യാങ്കം,m ഖരപദാര്ഥത്തിന്റെ ദ്രവ്യമാനം ഗ്രാമില്, θ1 ഖരപദാര്ഥത്തിന്റെ ആദ്യവും ഒടുവിലും ഉള്ള താപനിലകളുടെ വ്യത്യാസം, δθ വികിരണ സംശോധനം. ലോഹങ്ങളുടെ വിശിഷ്ടതാപം 100°C മുതല് 160°C വരെ കണ്ടുപിടിക്കാന് ഈ പദ്ധതിയാണ് ഗ്രിഫിത്ത് ഉപയോഗിച്ചത്.
നിര്വാത താപമാപി (Vaccum calorimeter). വളരെ താഴ്ന്ന താപനിലയില് ഖരപദാര്ഥങ്ങളുടെ വിശിഷ്ട താപം നിര്ണയിക്കാന് ഈ ഉപകരണം കൊണ്ടു കഴിയുന്നു. വൈദ്യുതതാപനം കൊണ്ട് താപമാനം അല്പം ഉയര്ത്തിയാലേ നിശ്ചിതമായ ഒരു താഴ്ന്ന താപനിലയില് ദ്രവ്യത്തിന്റെ വിശിഷ്ടതാപം സൂക്ഷ്മമായി ലഭിക്കുകയുള്ളു. ഇതിനനുയോജ്യമായ ഒരു കലോറിമീറ്ററാണ് നേര്ണ്സ്റ്റ് (Nernst)വിഭാവനം ചെയ്തു നിര്മിച്ചത്. നല്ല താപവഹനമുള്ള ഖരപദാര്ഥമാണ് പരീക്ഷണത്തിനു വിധേയമാകുന്നതെങ്കില് അത് ഒരു സിലിന്ഡറിന്റെ ആകൃതിയില് എടുക്കുന്നു. ശുദ്ധമായ പ്ലാറ്റിനംകമ്പി അതിന്മേല് ചുരുളായി ചുറ്റുന്നു. നേര്മയുള്ള പാരഫിന് കടലാസ് ഉപയോഗിച്ച് കമ്പിയും സിലിണ്ടറും തമ്മില് വൈദ്യുതബന്ധം ഇല്ലാതാക്കുന്നു. ഈ കമ്പിച്ചുരുള് താപക (heater) മായും പ്രതിരോധതാപമാപിയായും ഉപയോഗിക്കുന്നു. ഇപ്രകാരം തയ്യാറാക്കിയ സിലിണ്ടറും ചുരുളും അതേ ദ്രവ്യത്തില് തീര്ത്തിട്ടുള്ള ഒരു പൊള്ള സിലിണ്ടറിനകത്ത്, അതുമായി സമ്പര്ക്കത്തില് ഏര്പ്പെടാതിരിക്കാന് ഇടയ്ക്കുള്ള വിടവില് പാരഫിന് വാക്സ് നിറച്ചുവയ്ക്കുന്നു. ഇവ രണ്ടും ഒരുമിച്ച് പ്ലാറ്റിനം ചുരുളിന്റെ ലീഡുകളില്ത്തന്നെ സൗകര്യപ്രദമായ ഒരു ഗ്ലാസ് ബള്ബില് കെട്ടിത്തൂക്കിവയ്ക്കുന്നു. ഏതു താഴ്ന്ന ചൂടുവരെയാണോ ദ്രവ്യം പരീക്ഷണത്തിനു വിധേയമാക്കേണ്ടത് അതുവരെ ദ്രവ്യത്തെ തണുപ്പിക്കാന് ഗ്ലാസ്ബള്ബ് ദ്രവവായുവിലോ ദ്രവഹൈഡ്രജനിലോ താഴ്ത്തി വയ്ക്കണം. ദ്രവ്യം വേഗം തണുക്കുന്നതിന് ബള്ബിനകത്ത് ഹൈഡ്രജന് വാതകം പരിസഞ്ചരണം (circulate) ചെയ്യിക്കുന്നു. ദ്രവ്യം വേണ്ടപോലെ തണുത്തു കഴിഞ്ഞാല് ബള്ബിലെ വാതകം അകറ്റി ശൂന്യമാക്കുന്നു. ഇപ്രകാരം ചാലനം, വികിരണം എന്നിവ കൊണ്ടുണ്ടാകുന്ന താപനഷ്ടം തുച്ഛമാക്കുന്നു. നിശ്ചിതമായ ഒരു താഴ്ന്ന താപനിലയില് ദ്രവ്യത്തിന്റെ വിശിഷ്ടതാപം കണ്ടുപിടിക്കാന് E വോള്ട്ട് പൊട്ടന്ഷ്യല് അന്തരം പ്രയോഗിച്ച് കമ്പിച്ചുരുളില്ക്കൂടി I ആംപിയര് പ്രവാഹം t സെക്കണ്ടുനേരം അയയ്ക്കുന്നു. പൊട്ടന്ഷ്യല് അന്തരം സ്ഥിരമായി വച്ചുകൊണ്ട് ദ്രവ്യത്തിന്റെ താപനില 1°C ഉയരാന് അനുവദിക്കുന്നു. താപനില ഉയര്ന്നു കഴിയുമ്പോള് ഉണ്ടാകുന്ന പ്രവാഹം I2 ആംപിയറും അളക്കുന്നു. ചുരുളിന്റെ ആദ്യവും അന്ത്യത്തിലും ഉള്ള രോധം R1, R2 ഓം ആണെങ്കില് R1 = E/I1; R2 = E/I2 ആയിരിക്കും.
വിവിധ താപനിലകളില് ചുരുളിന്റെ രോധം നേരത്തേ അളന്നു മനസ്സിലാക്കിയിട്ടുള്ളതിനാല് താപനിലയുടെ വര്ധനവ് δθ എളുപ്പം കണക്കാക്കി എടുക്കാം. അവശോഷണം ചെയ്ത താപമാനം E I t / J = m S δθ + h ഇവിടെ m പദാര്ഥത്തിന്റെ ദ്രവ്യമാനം, S അതിന്റെ വിശിഷ്ടതാപം, J താപത്തിന്റെ യാന്ത്രിക തുല്യാങ്കം, h വികിരണം മൂലം നഷ്ടം വന്ന താപം (ഇത് തുലോം ചെറുതായിരിക്കും).
ബോംബ് കലോറിമീറ്റര് (Bomb calorimeter). ജൈവയൗഗികങ്ങളുടെ ദഹനതാപം (heat of combustion) നിര്ണയിക്കാനാണ് ഇത് ഉപയോഗിക്കുന്നത്. കരള്ച്ച (erosion) ഏല്ക്കാത്ത കൂട്ടുലോഹത്തകിടുകൊണ്ടു നിര്മിച്ച ഒരു പാത്രമാണ് ഈ ഉപകരണം. വാല്വുള്ള ഒരു സ്ക്രൂഹെഡ് അതിനുണ്ട്. അതില്ക്കൂടി രണ്ടു വൈദ്യുത ലീഡുകള് (electric leads) കടത്തി, പാത്രത്തിനകത്തുള്ള ക്രൂസിബിളിനോടു (crucible) ഘടിപ്പിച്ചിട്ടുണ്ട്. ക്രൂസിബിളില് ഒരു നിശ്ചിത ദ്രവ്യമാനം ജൈവപദാര്ഥം വച്ചിരിക്കും. പാത്രത്തിനകത്ത് 30 അന്തരീക്ഷമര്ദത്തില് ഓക്സിജന് നിറയ്ക്കുന്നു. ഒരു കലോറിമീറ്ററിനകത്ത് 2.5 ലിറ്റര് ജലത്തില് ഉപകരണം താഴ്ത്തിവയ്ക്കുന്നു. ജലത്തിന്റെ താപനില അളക്കാന് പ്ലാറ്റിനം റെസിസ്റ്റന്സ് തെര്മോമീറ്റര് ഉപയോഗിക്കുന്നു. കലോറിമീറ്ററിന്റെ അടപ്പില്ക്കൂടിയാണ് ഈ തെര്മോമീറ്ററും വൈദ്യുതലീഡുകളും മറ്റും കടന്നുപോകുന്നത്. ലീഡുകളില്ക്കൂടി വൈദ്യുത പ്രവാഹം അയച്ച് ജൈവപദാര്ഥം ഓക്സിജനില് ജ്വലിപ്പിക്കുന്നു. കലോറിമീറ്ററിന്റെ താപധാരിത നേരത്തേ കണ്ടുപിടിച്ചിരിക്കും.
(പ്രാഫ. എസ്. ഗോപാലമേനോന്)