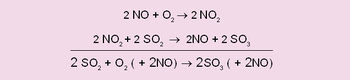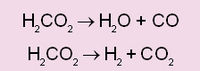This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
കറ്റാലിസിസ്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
കറ്റാലിസിസ്
Catalysis
ഒരു കാറ്റലിസ്റ്റ് അഥവാ രാസത്വരകം ഉപയോഗിച്ച് രാസ പ്രതിപ്രവര്ത്തനങ്ങളെ ത്വരിപ്പിക്കുന്ന പ്രക്രിയ. രാസത്വരകത്തിന് പ്രതിപ്രവര്ത്തനംമൂലം യാതൊരു നാശവും സംഭവിക്കുന്നില്ല. കറ്റാലിസിസ് എന്ന ഗ്രീക് പദത്തിനര്ഥം ലയിക്കുക അല്ലെങ്കില് അയയുക അഥവാ വേര്പെടുക (to loosen or breakup) എന്നാണ്. 1836ല് സ്വീഡന്കാരനായ ജെ.ജെ. ബെര്സിലിയസ് ആണ് ഇത് ആദ്യമായി രസതന്ത്രവിജ്ഞാനീയത്തില് ഉപയോഗിച്ചു തുടങ്ങിയത്. അഭികാരകങ്ങളിലെ രാസബന്ധങ്ങളില് അയവു വരുത്തിയാണ് രാസത്വരകങ്ങള് പ്രതിക്രിയാ വേഗത വര്ധിപ്പിക്കുന്നത് എന്ന ഇദ്ദേഹത്തിന്റെ നിഗമനമാണ് ഈ പേരിനാധാരം. ഒരു "അന്യ' വസ്തു ഉപയോഗിച്ച് രാസപ്രതിപ്രവര്ത്തനം ത്വരിപ്പിക്കുന്ന വിദ്യ മുമ്പേതന്നെ പ്രചാരത്തിലുണ്ടായിരുന്നു. സള്ഫ്യൂറിക് അമ്ല വ്യവസായം ഉദാഹരണമാണ്. 1746ല് തന്നെ ഈ അമ്ലനിര്മിതിക്കുള്ള ലെഡ് ചേംബര് വിധി പ്രാവര്ത്തികമാക്കിത്തുടങ്ങിയിരുന്നു. സള്ഫര് ഡൈഓക്സൈഡും ഓക്സിജനും ചേര്ന്ന് സള്ഫര് ട്രഓക്സൈഡ് ലഭ്യമാക്കുന്നതിന് ത്വരകമായി നൈട്രിക് ഓക്സൈഡ് വാതകം ഉപയോഗിക്കപ്പെട്ടിരുന്നു.
നിര്ണയിക്കാന് സാധിക്കാത്ത ഏതോ ഒരു "ത്വരകശക്തി'യുടെ പ്രരണയാണ് രാസത്വരക കാരണമെന്ന് ബെര്സിലിയസ് വിശ്വസിച്ചു. മന്ദവേഗത്തില് മാത്രം നടക്കുന്ന രാസപ്രതിപ്രവര്ത്തനത്തെ സ്വസാന്നിധ്യത്തില് കൂടുതല് സത്വരമായ ഒരു മാര്ഗത്തിലേക്കു തിരിച്ചുവിടുകയാണ് രാസത്വരകങ്ങള് ചെയ്യുന്നതെന്ന് ഇന്ന് വ്യക്തമാണ്. രാസത്വരകം യഥാര്ഥത്തില് പ്രവര്ത്തകങ്ങളുമായി (reactants) സംയോജിക്കുന്നുണ്ടെന്നും എന്നാല് പരിണാമദശയില് അത് മോചിപ്പിക്കപ്പെടുകയാണ് ചെയ്യുന്നതെന്നും അറിവായിട്ടുണ്ട്. സള്ഫ്യൂറിക് അമ്ല നിര്മാണത്തിലെ മുഖ്യമായ രാസപ്രവര്ത്തനങ്ങളെ താഴെ പറയുംവിധം രേഖപ്പെടുത്താം:
ത്വരകത്തിന് വ്യയം സംഭവിക്കാത്തതിനാല് ഓരോ ത്വരക തന്മാത്രയും പ്രതിപ്രവര്ത്തകങ്ങളുടെ അനേകം തന്മാത്രകളെ പരിണമിപ്പിക്കുന്നതിനു പര്യാപ്തമായിരിക്കും.
ചില രാസപ്രവര്ത്തനങ്ങള് ഉത്ക്രമണീയങ്ങളാണ്. അതായത് പ്രവര്ത്തകങ്ങള് പരസ്പരം പ്രതിപ്രവര്ത്തിച്ച് വ്യുത്പന്നങ്ങളുണ്ടാകുന്നതുപോലെ വ്യുത്പന്നങ്ങള് പരസ്പരം പ്രതിപ്രവര്ത്തിച്ച് പ്രവര്ത്തകങ്ങള് ലഭ്യമാക്കുന്നു എന്നര്ഥം. ഇത്തരം ഉത്ക്രമണീയ പ്രതിപ്രവര്ത്തനങ്ങളില് രാസത്വരകം എങ്ങനെ പ്രവര്ത്തിക്കുന്നു എന്നതിനെപ്പറ്റി പഠനം നടത്തിയിട്ടുണ്ട്. രാസത്വരകം മുമ്പോട്ടുള്ള പ്രതിപ്രവര്ത്തനത്തെ ത്വരിപ്പിക്കുന്നതുപോലെ പിമ്പോട്ടുള്ള പ്രതിപ്രവര്ത്തനത്തെയും ത്വരിപ്പിക്കുന്നു. തന്മൂലം സന്തുലിതാവസ്ഥ കൂടുതല് വേഗത്തില് സംജാതമാക്കുന്നു. സന്തുലിതാവസ്ഥയുടെ സ്ഥാനത്തിന് വ്യത്യാസം വരുത്തുവാന് ത്വരകത്തിന് കഴിവില്ല എന്നു സാരം. ഒരു വസ്തു വിഘടിക്കുകയോ മറ്റു വസ്തുക്കളുമായി പ്രതിപ്രവര്ത്തിക്കുകയോ ചെയ്യുന്നത് പരിതഃസ്ഥിതി അനുസരിച്ച് ഒന്നിലധികം രീതിയിലായെന്നുവരാം. അങ്ങനെ വരുമ്പോള് ഓരോ രീതിക്കും അതിന്റേതായ അനുകൂലത്വരകപദാര്ഥമുണ്ടായിരിക്കും. ഫോര്മിക് അമ്ലത്തിന്റെ താപീയ വിഘടനം ഉദാഹരണമാണ്.
അലുമിനിയം ഓക്സൈഡ് ആണ് രാസത്വരകമായി ഉപയോഗിക്കുന്നതെങ്കില് ആദ്യത്തെ പ്രതിപ്രവര്ത്തനവും സിങ്ക് ഓക്സൈഡ് ആണ് ഉപയോഗിക്കുന്നതെങ്കില് രണ്ടാമത്തേതും ത്വരിപ്പിക്കപ്പെടുന്നു. ഏതു വ്യുത്പന്നം കിട്ടണമോ അതിനനുസരിച്ചുള്ള ത്വരകം ഉപയോഗിച്ച് പ്രവര്ത്തനം നിയന്ത്രിക്കാവുന്നതാണ്. ത്വരകങ്ങളുടെ വരണാത്മകത്വം പ്രയോജനപ്പെടുത്തി അഭീഷ്ടവ്യുത്പന്നങ്ങള് മാത്രം ഉത്പാദിപ്പിക്കുന്ന സമ്പ്രദായം വലിയ വ്യവസായങ്ങളില് ഫലപ്രദമായി നടത്തിവരുന്നുണ്ട്. മറ്റു ചില സന്ദര്ഭങ്ങളില് വ്യുത്പന്നങ്ങളില്ത്തന്നെ ഏതെങ്കിലുമൊരു വസ്തു ആ പ്രവര്ത്തനത്തെ ത്വരിപ്പിക്കുന്നതായി കാണുന്നു. ഇതിന് "ആട്ടോകറ്റാലിസിസ്' (auto catalysis)എന്നാണ് പേര്. പൊട്ടാസിയം പെര്മാന്ഗനേറ്റ് സള്ഫ്യൂറിക്കമ്ലമാധ്യമത്തില് ഓക്സലേറ്റുമായി പ്രതിപ്രവര്ത്തിക്കുന്നത് ദൃഷ്ടാന്തമായെടുക്കാം. തുടക്കത്തില് ഈ പ്രതിപ്രവര്ത്തനം മന്ദമായി നടക്കുന്നു. എന്നാല് പ്രതിപ്രവര്ത്തനഫലമായി ഉണ്ടാകുന്ന ഇഛ2 പിന്നീടുള്ള പ്രവര്ത്തനത്തെ ത്വരിപ്പിക്കുകയും അത് വേഗം നടക്കുകയും ചെയ്യും.
കറ്റാലിസിസ് എന്നതുകൊണ്ട് രാസപ്രതിപ്രവര്ത്തനങ്ങളുടെ ത്വരണമാണ് ആദ്യം വിവക്ഷിച്ചതെങ്കിലും നേരെമറിച്ചും സംഭവിക്കുന്ന അനുഭവങ്ങളുണ്ട്. അന്യവസ്തുവിന്റെ സാന്നിധ്യം രാസപ്രക്രിയയുടെ വേഗം കുറയ്ക്കുന്ന രീതിയുമുണ്ട് എന്നര്ഥം. ഇതിനെ നെഗറ്റിവ് കറ്റാലിസിസ് എന്നു പറയുന്നു. ഹൈഡ്രജന് പെറോക്സൈഡ് വലിയ സ്ഥിരതയില്ലാത്ത യൗഗികമാണ്; അത് ജലവും ഓക്സിജനുമായി വിഘടിക്കും.
എന്നാല് അല്പം ഗ്ലിസറിന് ചേര്ത്താല് ഈ വിഘടനത്തിന്റെ വേഗത തടയാം. ഹൈഡ്രജന് പെറോക്സൈഡ് അല്പം ഗ്ലിസറിന് ചേര്ത്ത് സൂര്യരശ്മി കടക്കാത്ത കുപ്പികളില് സൂക്ഷിക്കാന് സാധിക്കുന്നത് ഇതു കൊണ്ടാണ്. വിഘടനം എളുപ്പത്തില് സംഭവിക്കാതിരിക്കുവാന് ക്ലോറഫോമിനും ഇതേമാതിരി ഒരു നെഗറ്റിവ് കാറ്റലിസ്റ്റി (ആല്ക്കഹോള്)ന്റെ സഹായം ആവശ്യമാണ്.
കാറ്റലിസ്റ്റിനെ ഇപ്രകാരം പോസിറ്റിവ് എന്നും നെഗറ്റിവ് എന്നും രണ്ടായി തിരിച്ചിട്ടുള്ളത് രാസപ്രക്രിയകളെ ത്വരിപ്പിക്കുന്നു, മന്ദീഭവിപ്പിക്കുന്നു എന്ന അടിസ്ഥാനത്തിലാണ്. പോസിറ്റിവ് കാറ്റലിസ്റ്റ് ഉപയോഗിച്ചാലും ചിലപ്പോള് ഈ കാറ്റലിസ്റ്റിന്റെ ചൈതന്യം കുറയ്ക്കുന്നതിന് അതിനോടു കലര്ന്നിട്ടുള്ള അപദ്രവ്യങ്ങള്ക്കു സാധിച്ചെന്നു വരും. കാറ്റലിസ്റ്റിന്റെ പ്രവര്ത്തനത്തെ തടസ്സപ്പെടുത്തുന്ന മറ്റു വസ്തുക്കള്ക്ക് രാസത്വരകവിഷം (catalyst poison) എന്നു പറയുന്നു. സള്ഫ്യൂറിക് അമ്ലം വന്തോതില് നിര്മിക്കുന്ന കോണ്ടാക്റ്റ് പ്രവിധിയില് സള്ഫര് ഡൈഓക്സൈഡ് ശുദ്ധമായിരിക്കണം. സാമാന്യമായി അതോടൊപ്പമാകാന് സാധ്യതയുള്ള ആഴ്സനിക് ഓക്സൈഡ് ആദ്യമേ നീക്കം ചെയ്യണം.
ഇല്ലെങ്കില് ഈ പ്രക്രിയയിലുപയോഗിക്കുന്ന (പ്ലാറ്റിനം) കാറ്റലിസ്റ്റിനെ ബാധിച്ച് വിഷബാധയാലെന്നപോലെ പ്രവര്ത്തനം സ്തംഭിപ്പിക്കുകയോ മന്ദീഭവിപ്പിക്കുകയോ ചെയ്യും. സള്ഫര് ഡൈഓക്സൈഡ് ഓക്സിജനുമായി കലര്ന്ന് സള്ഫര് ട്രഓക്സൈഡ് ആകുന്ന പ്രക്രിയ മന്ദമാവുകയും വ്യവസായം പരാജയപ്പെടുകയും ചെയ്യും. രാസത്വരകങ്ങളുടെ പ്രവര്ത്തനശേഷി മെച്ചപ്പെടുത്തുന്നതിന് ചില വസ്തുക്കള്ക്ക് സാധിക്കും. ത്വരകത്വരകങ്ങള് അഥവാ "പ്രാമോട്ടറുകള്' എന്ന് ഇവയെ വിളിക്കുന്നു. ഹേബര് പ്രവിധിയില് കാറ്റലിസ്റ്റായ ഇരുമ്പിനെ ത്വരിപ്പിക്കുന്നതിന് സിങ്ക് ഓക്സൈഡ് ഉപയോഗിക്കുന്നത് ഇതിനു ദൃഷ്ടാന്തമാണ്.
കറ്റാലിസിസിനെ മറ്റൊരു രീതിയിലും ശാസ്ത്രീയമായി വിഭജിക്കാറുണ്ട്: ഏക-ാത്മകം (ഹോമോജീനിയസ്), ഭിന്നാത്മകം (ഹെറ്ററോജീനിയസ്) എന്നിങ്ങനെ. സള്ഫ്യൂറിക് അമ്ലോത്പാദനത്തില് ലെഡ്ചേംബര് പ്രവിധിയില് പ്രവര്ത്തകങ്ങളായ സള്ഫര് ഡൈ ഓക്സൈഡും ഒക്സിജനും എന്നതുപോലെ കാറ്റലിസ്റ്റായ നൈട്രജന് പെറോക്സൈഡും വാതകാവസ്ഥയിലാണ്. ഇപ്രകാരം പ്രവര്ത്തകങ്ങളും കാറ്റലിസ്റ്റും ഉത്പന്നങ്ങളും തന്മാത്രകമായി ഒരേ ഭൗതികാവസ്ഥയിലാണെങ്കില് ഹോമോജീനിയസ് കറ്റാലിസിസ് ആയി. ഒട്ടുവളരെ കാര്ബണിക പ്രതിപ്രവര്ത്തനങ്ങള് ഇതിന് ഉദാഹരണങ്ങളായിട്ടുണ്ട്. അമ്ലം ഉപയോഗിച്ച് ത്വരിപ്പിക്കുന്ന എസ്റ്ററുകളുടെ ജലീയാപഘടനം ഒരു ഉദാഹരണമാണ്.
എന്നാല് പ്രവര്ത്തകങ്ങള് ഒരവസ്ഥയിലും കാറ്റലിസ്റ്റ് മറ്റൊരവസ്ഥയിലുമാണെങ്കില് ഹെറ്ററോജീനിയസ് ഇനത്തില് അത് ഉള്പ്പെടുന്നു. സള്ഫ്യൂറിക് അമ്ലോത്പാദനത്തിനുള്ള കോണ്ടാക്റ്റ് വിധി, അമോണിയ ഉത്പാദിപ്പിക്കുന്ന ഹേബര് വിധി, എണ്ണകളുടെ ഹൈഡ്രജനീകരണം (hydrogenation of oils)എന്നിങ്ങനെ ഒട്ടേറെ ദൃഷ്ടാന്തങ്ങള് പറയാവുന്നതാണ്. ആദ്യത്തെ രണ്ടിലും പ്രവര്ത്തകങ്ങള് വാതകാവസ്ഥയിലും കാറ്റലിസ്റ്റ് ഖരാവസ്ഥയിലുമാണെങ്കില് മൂന്നാമത്തേതില് പ്രവര്ത്തകം ദ്രവാവസ്ഥയിലും കാറ്റലിസ്റ്റ് ഖരാവസ്ഥയിലുമാണ്.
ശരീരത്തില് ആവശ്യാനുസരണം ഉത്പാദിപ്പിക്കപ്പെടുന്ന എന്സൈമുകള് സവിശേഷ പഠനമര്ഹിക്കുന്ന പ്രത്യേകതരം കാര്ബണിക കാറ്റലിസ്റ്റുകളാണ്. ആയിരക്കണക്കിന് എന്സൈമുകളുണ്ട്. ഓരോന്നും പ്രാട്ടീനാണ്. ശരീരത്തിനുള്ളില് നടക്കുന്ന ഒട്ടനേകം രാസപ്രക്രിയകള് ത്വരിപ്പിക്കുന്നതിന് ശരീരകോശങ്ങള് തന്നെ ഈ എന്സൈമുകളെ അപ്പപ്പോളുത്പാദിപ്പിക്കുന്നു. ഈ എന്സൈമുകളുടെ അഭാവത്തില് ശരീരയാത്രതന്നെ നിലച്ചുപോകുന്നു. എന്സൈമുകളുടെ സ്തംഭനം എന്നത് മരണത്തിന്റെ മറ്റൊരു പേരായി സ്വീകരിക്കാവുന്നതാണ്. (നോ: എന്സൈമുകള്)
പ്രാവസ്ഥാ സംക്രമണ കറ്റാലിസിസ് (phase transfer catalysis) പ്രക്രിയകളില് പ്രവര്ത്തകങ്ങള് വ്യത്യസ്ത പ്രാവസ്ഥകളിലായിരിക്കും. ഖരാവസ്ഥയിലോ ജലത്തില് ലേയമായ അവസ്ഥയിലോ ഉള്ള ഒരു ലവണം, ദ്രവാവസ്ഥയിലോ ബെന്സീന് പോലുള്ള കാര്ബണിക ലായകങ്ങളില് ലേയമായ അവസ്ഥയിലോ ഉള്ള ഒരു കാര്ബണിക സംയുക്തവും അടങ്ങുന്ന ഒരു വ്യവസ്ഥയെ ശക്തമായി ഇളക്കിയാല് പ്രതിപ്രവര്ത്തനം നടക്കുകയില്ല. എന്നാല് ക്രൗണ് ഈഥര് തുടങ്ങിയ പ്രാവസ്ഥാ സംക്രമണ കാറ്റലിസ്റ്റുകള് വ്യവസ്ഥയില് ഉള്പ്പെടുത്തുന്നതോടെ രാസപ്രവര്ത്തനം ത്വരിപ്പിക്കപ്പെടുന്നു. ഋണചാര്ജുള്ള ആനയോണിനെ ലേയത്വം കുറഞ്ഞ കാര്ബണിക പ്രാവസ്ഥയിലേക്ക് സംക്രമിപ്പിക്കുക വഴിയാണ് കാറ്റലിസ്റ്റ് ഈ രാസപ്രവര്ത്തനം ത്വരിപ്പിക്കുന്നത്. ബെന്സീനില് ലയിപ്പിച്ച ആല്ക്കൈല് ഹാലൈഡും ജലീയ പൊട്ടാസിയം സയനൈഡും തമ്മിലുള്ള പ്രതിപ്രവര്ത്തന ഫലമായി ആല്ക്കൈല് സയനൈഡ് ലഭ്യമാക്കുന്ന പ്രതിപ്രവര്ത്തനം ടെട്രാ ബ്യൂട്ടൈല് അമോണിയം ക്ലോറൈഡ് കാറ്റലിസ്റ്റിന്റെ സാന്നിധ്യത്തില് നടക്കുന്നത് പ്രാവസ്ഥാ സംക്രമണ കറ്റാലിസിസിനുദാഹരണമാണ്.
ഇലക്ട്രാ കെമിക്കല് പ്രക്രിയകളോടനുബന്ധിച്ചുണ്ടാകുന്ന അധിക വോള്ട്ടത കുറച്ച് അതു വഴി പ്രതിപ്രവര്ത്തന വേഗതയും വരിഷ്ഠത(selectivity)യും മെച്ചപ്പെടുത്തുന്നു. ഇത്തരം രാസത്വരക പ്രവണത സഹജമായുള്ള ഇലക്ട്രാഡുകളാണ് സാധാരണ ഇലക്ട്രാ കറ്റാലിസിസില് ഉപയോഗപ്പെടുത്തുന്നത്. ഏതെങ്കിലും അയോണിന്റെ നിക്ഷേപം വഴി ഇലക്ട്രാഡിന്റെ പ്രവര്ത്തന സ്വഭാവത്തില് മാറ്റം വരുത്തുന്നതും സാധാരണമാണ്. ഈ അയോണുകള് ഇലക്ട്രാഡ് പ്രവര്ത്തനത്തിന് പ്രാമോട്ടറുകളായോ ഇന്ഹിബിറ്റര് ആയോ വര്ത്തിക്കുന്നു.
പ്രകാശീയ കറ്റാലിസിസ് ആണ് മറ്റൊരു വിഭാഗം. വളരെ അവ്യക്തമായ ഒരു സംജ്ഞയാണിത്. ത്വരക ഉത്പാദനത്തിന് ഫോട്ടോണുകളെ ഉപയോഗിക്കുന്ന പ്രതിപ്രവര്ത്തനങ്ങള് ഈ വിഭാഗത്തില് പെടുന്നില്ല. ഉദാഹരണത്തിന് ലോഹ അയോണുകളുടെ പ്രകാശീയ അപചയം വഴി അനുയോജ്യമായ ഒരു അവലംബത്തില് കൊളോയിഡീയ ലോഹം നിക്ഷേപണം ചെയ്യുന്ന പ്രക്രിയ പ്രകാശീയ കറ്റാലിസിസ് ആയി പരിഗണിക്കാനാവില്ല. ജലത്തിലേക്ക് പ്രകാശ പ്രസരണം നടത്തുമ്പോള് പ്രകാശം ആഗിരണം ചെയ്യപ്പെടുന്നില്ല. തന്മൂലം യാതൊരു പ്രവര്ത്തനവും നടക്കുന്നുമില്ല. എന്നാല് ജലത്തില് ടൈറ്റാനിയം ഡൈ ഓക്സൈഡിന്റെ നേര്ത്ത തരികള് ലംബകമായി ചേര്ക്കുന്നതോടെ പ്രകാശത്തെ അധിശോഷണം ചെയ്യുകയും ജലം വിഘടിച്ച് ഹൈഡ്രജനും ഓക്സിജനും ഉണ്ടാവുകയും ചെയ്യുന്നു. ടൈറ്റാനിയം ഡൈ ഓക്സൈഡ് യാതൊരു നഷ്ടവും കൂടാതെ വീണ്ടെടുക്കുകയും ചെയ്യാം. ഈ പ്രക്രിയ പ്രകാശീയ കറ്റാലിസിസിനുദാഹരണമാണ്. ഈ പ്രക്രിയയില് പ്രകാശംഫോട്ടോണ് ഒരു അഭികാരകമാണ്. ബാഹ്യപ്രചോദനം കൂടാതെ അസംഭവ്യമായ പ്രതിപ്രവര്ത്തനങ്ങള് പ്രകാശീയ കറ്റാലിസിസ് വഴി സാധ്യമാക്കാനാവും. ബാഹ്യതാപം ഉള്ക്കൊണ്ട് സമതാപീയാവസ്ഥയില് നടക്കുന്ന സാധാരണ താപശോഷക കറ്റാലിസിസ് പ്രക്രിയകളില് നിന്നും തീര്ത്തും വ്യത്യസ്തമാണ് പ്രകാശീയ കറ്റാലിസിസ് പ്രക്രിയകള്.
കറ്റാലിസിസിന്റെ ക്രിയാതന്ത്രത്തെക്കുറിച്ച് സൂക്ഷ്മവും വിശദവുമായ പഠനങ്ങള് നടന്നിട്ടുണ്ട്. കാറ്റലിസ്റ്റുകള് രാസപ്രക്രിയകളെ ത്വരിപ്പിക്കുന്നതിനെക്കുറിച്ച് രണ്ടു സിദ്ധാന്തങ്ങള് നിലവിലുണ്ട്: അധിശോഷണസിദ്ധാന്തം (adsorption theory), മധ്യയൗഗികസിദ്ധാന്തം (intermediate compound theory). രാസപ്രവര്ത്തകങ്ങളുടെ തന്മാത്രകളെ സ്വപ്രതലത്തില് അവശോഷണം ചെയ്ത് അവയെ ഏറ്റവും കൂടുതല് അടുപ്പിച്ച്, എളുപ്പത്തില് പ്രവര്ത്തിക്കുവാനുള്ള സൗകര്യമുണ്ടാക്കുകയാണ് കാറ്റലിസ്റ്റുകള് ചെയ്യുന്നത് എന്ന് ആദ്യത്തെ സിദ്ധാന്തം പറയുന്നു. കാറ്റലിസ്റ്റ് ഒരു മധ്യസ്ഥന്റെ നിലയില് നിന്നുകൊണ്ട് രാസപ്രവര്ത്തനത്തില് സ്വയം പങ്കുചേരാതെ അധിശോഷണം വഴി അതിനെ ത്വരിപ്പിക്കുന്നു എന്നു സാരം. ഹെറ്ററോജീനിയസ് കറ്റാലിസിസിലാണ് ഈ സിദ്ധാന്തം സാധ്യമാകുന്നത്. രണ്ടാമത്തെ സിദ്ധാന്തമനുസരിച്ച് കാറ്റലിസ്റ്റ് പ്രവര്ത്തകവുമായി ആദ്യം രാസപരമായിത്തന്നെ പ്രവര്ത്തിച്ച് ഇടക്കാലയൗഗികം ലഭ്യമാക്കി വിനാവിളംബം വിഘടിച്ച് സ്വയം പൂര്വസ്ഥിതിയിലെത്തുകയും മുഖ്യമായ പ്രക്രിയയെ അങ്ങനെ ത്വരിതപ്പെടുത്തുകയും ചെയ്യുന്നു. ഹോമോജീനിയസ് കറ്റാലിസിസിന്റെ ക്രിയാതന്ത്രം ഇപ്രകാരമാണെന്നു സമര്ഥിക്കപ്പെട്ടിരിക്കുന്നു:
A + L → AL AL + B → AB + L
അയും ആയും ചേര്ന്ന് അആ എന്ന യൗഗികം ഘ എന്ന കാറ്റലിസ്റ്റിന്റെ സാന്നിധ്യത്തില് ഉണ്ടാകുന്ന പ്രക്രിയയാണ് ഇവിടെ ചിത്രീകരിച്ചിരിക്കുന്നത് അ എന്ന പ്രവര്ത്തകം ഘ എന്ന കാറ്റലിസ്റ്റുമായി ചേര്ന്ന് ആദ്യം അഘ എന്ന മധ്യയൗഗികമുണ്ടാകുന്നു. അഘ പിന്നീട് ആയുമായി പ്രവര്ത്തിക്കുമ്പോള് അആ എന്ന ഉദ്ദിഷ്ടയൗഗികം ഉണ്ടാവുകയും ഘ മോചിപ്പിക്കപ്പെട്ട് തിരിച്ചു ലഭിക്കുകയും ചെയ്യുന്നു. കറ്റാലിസിസ് മൊത്തം പരിശോധിച്ചാല് ഈ പ്രതിഭാസത്തിന്റെ നാലു പ്രധാന സ്വഭാവങ്ങള് ഇപ്രകാരം സംഗ്രഹിക്കാവുന്നതാണ്. 1.രാസപ്രക്രിയയുടെ അവസാനത്തില് കാറ്റലിസ്റ്റ് അതേപടിഅബാധിതമായ അവസ്ഥയില്തിരിച്ചു ലഭിക്കുന്നു.
2.താരതമ്യേന വലിയ തോതില് നടക്കുന്ന രാസപ്രക്രിയകളെ ത്വരിപ്പിക്കുവാന് കാറ്റലിസ്റ്റ് പ്രായേണ ചെറിയ അളവില് ഉപയോഗിച്ചാല് മതി.
3.ഉത്ക്രമണീയ പ്രതിപ്രവര്ത്തനങ്ങളില് സാമാന്യമായി കാറ്റലിസ്റ്റ് മുമ്പോട്ടുള്ള പ്രവര്ത്തനത്തെ എന്നപോലെ പിമ്പോട്ടുള്ള പ്രവര്ത്തനങ്ങളെയും ത്വരിപ്പിക്കുന്നു.
4.ഓരോ കാറ്റലിസ്റ്റിനും പ്രത്യേക നിര്ദിഷ്ടത്വം (specificity) ഉണ്ട്. പ്രത്യേക നിര്ദിഷ്ടമായ രാസപ്രവര്ത്തനത്തെ മാത്രമേ അത് ത്വരിപ്പിക്കുകയുള്ളു. അതായത് ഒരു രാസപ്രക്രിയയെ ത്വരിപ്പിക്കുന്ന കാറ്റലിസ്റ്റ് മറ്റൊരു രാസപ്രക്രിയയെ പ്രായേണ ത്വരിപ്പിക്കുകയില്ല. "ഒരു പൂട്ടിന് ഒരു താക്കോല്' എന്ന സിദ്ധാന്തം ഇവിടെ പാലിക്കപ്പെടുന്നു.
5.ഒരു രാസപ്രവര്ത്തനം ത്വരിപ്പിക്കാമെന്നല്ലാതെ ആരംഭിക്കുന്നതിന് കാറ്റലിസ്റ്റ് ശക്തമല്ല. ഈ അഭിപ്രായം എത്രമാത്രം ശരിയാണെന്ന് പറയാറായിട്ടില്ല. അമോണിയാവാതകവും ഹൈഡ്രജന് ക്ലോറൈഡ് വാതകവും ചേര്ന്ന് അമോണിയം ക്ലോറൈഡ് ഉണ്ടാകുന്ന പ്രവര്ത്തനം തുടങ്ങണമെങ്കില്ത്തന്നെ തുടങ്ങിയാല് സത്വരം പുരോഗമിക്കുന്നതിനുംജലബാഷ്പത്തിന്റെ സാന്നിധ്യം അത്യാവശ്യമാണെന്നു കണ്ടിരിക്കുന്നു. ആകയാല് ജലബാഷ്പം ഇവിടെ കേവലം ത്വരകമല്ല, രാസപ്രതിപ്രവര്ത്തനപ്രാരംഭകം കൂടിയാണെന്ന് കരുതേണ്ടിയിരിക്കുന്നു.
ബെര്സിലിയസ്, മിറ്റ്ഷര്ലിക്, ഓസ്വാള്ഡ്, യൗറി ലാങ്മൂര്, ബ്രൂണാര്, എമ്മെറ്റ്, ടെല്ലര് എന്നിവര് കറ്റാലിസിസിനെക്കുറിച്ച് വസ്തുനിഷ്ഠമായും വ്യാപകമായും ഗാഢമായും പഠനം നടത്തിയവരില് ഉള്പ്പെടുന്നു. ഇവരുടെ പഠനങ്ങള് വ്യാവസായികരംഗത്തെ അദ്ഭുതകരമായ രീതിയില് പുഷ്ടിപ്പെടുത്തുവാന് സഹായിച്ചിട്ടുണ്ട്. 2007ലെ രസതന്ത്രത്തിനുള്ള നോബല് സമ്മാനം നേടിയ ഗെര്ഹാര്ഡ് എര്ട്ല് (Gerhard Ertl) എന്ന ജര്മന് രസതന്ത്രജ്ഞന്റെ പ്രതല രസതന്ത്ര (surface chemistry) പഠനങ്ങള് രാസത്വരകങ്ങളുടെ പ്രവര്ത്തനങ്ങള് വ്യക്തമായി മനസ്സിലാക്കാന് സഹായകമായിട്ടുണ്ട്. രാസവളങ്ങളുടെ ഉത്പാദനത്തിലെ അടിസ്ഥാന പ്രക്രിയയായ ഹേബര്ബോഷ് പ്രക്രിയ വിശദമാക്കുക വഴി കറ്റാലിസിസ് പ്രക്രിയകളുടെ പഠനത്തിനു ഒരു രീതിശാസ്ത്രം ഉണ്ടാക്കുന്നതിനു എര്ട്ലിനു സാധിച്ചിട്ടുണ്ട്. ഈ പ്രക്രിയയിലെ രാസത്വരകമായ ഇരുമ്പിന്റെ നേര്ത്ത തരികളുടെ പ്രതലത്തില് ബന്ധിക്കപ്പെടുന്ന നൈട്രജനും ഹൈഡ്രജനും കൂടുതല് എളുപ്പത്തില് പ്രതിപ്രവര്ത്തിക്കുന്നു. രാസത്വരകത്തിന്റെ പ്രതലത്തില് നടക്കുന്ന എല്ലാ പ്രവര്ത്തനങ്ങളും പൂര്ണമായി എര്ട്ല് വ്യക്തമാക്കി. കാറുകളുടെ നിര്ഗമന പൈപ്പില് നടക്കുന്ന കറ്റാലിസിസ് പ്രക്രിയ പ്ലാറ്റിനത്തിന്റെ പ്രതലത്തില് കാര്ബണ് മോണോക്സൈഡ് ഓക്സീകരിക്കുന്ന പ്രക്രിയ വിശദീകരിച്ചതും എര്ട്ലിന്റെ പ്രധാന നേട്ടമാണ്. ഇതും കറ്റാലിസിസ് പഠനത്തിന് മുതല്കൂട്ടായിട്ടുണ്ട്. ചില രാസ പ്രക്രിയകള് അവയുടെ രാസസമവാക്യങ്ങള്, അവയില് ഉപയോഗിക്കുന്ന കാറ്റലിസ്റ്റ് എന്നിവ കാണിച്ചുകൊണ്ടുള്ള ഒരു പട്ടിക താഴെ കൊടുക്കുന്നു. കറ്റാലിസിസിന്റെ പ്രാധാന്യം മനസ്സിലാക്കുവാന് ഈ സാരണി സഹായകമായിരിക്കും.
കറ്റാലിസിസ് പ്രകൃതിയിലെ ഒരു പ്രതിഭാസമാണ്. സസ്യങ്ങളിലും മൃഗങ്ങളിലും നടക്കുന്ന ഉപാപചയത്തിന്റെ പിന്നില് ഈ പ്രതിഭാസമുണ്ട്. പ്രകൃതിയുടെ ഈ തന്ത്രത്തെ മനുഷ്യന് അനുകരിച്ച് അഭീഷ്ടങ്ങളായ ഒട്ടനേകം പ്രതിപ്രവര്ത്തനങ്ങളില് ഉപയോഗിച്ച് ഉദ്ദിഷ്ടമായ രീതിയില് ഫലം കൈവരിച്ചിരിക്കുന്നു.
(എ.വി. ശങ്കരന്, സ.പ.)