This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ഇലക്ട്രോ കെമിസ്ട്രി
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
ഇലക്ട്രോ കെമിസ്ട്രി
Electro Chemistry
വൈദ്യുതിയും രാസപരിണാമങ്ങളും തമ്മിലുള്ള ബന്ധം പഠനവിഷയമാക്കിയിട്ടുള്ള വിജ്ഞാനശാഖ. സാധാരണ പരിതഃസ്ഥിതികളില് ഒരു രാസപരിണാമം നടക്കുമ്പോള് താപോര്ജം ആഗിരണം ചെയ്യുകയോ മോചിതമാവുകയോ ചെയ്യാറുണ്ട്. അതുപോലെ വൈദ്യുതോര്ജം ഉത്പാദിപ്പിക്കുന്ന രാസപരിണാമങ്ങളും ഏറെയുണ്ട്. നേരേമറിച്ച്, വൈദ്യുതോര്ജമുപയോഗിച്ച് നടക്കുന്ന രാസപരിണാമങ്ങളുമുണ്ട്. ആദ്യത്തെ പ്രക്രിയയില് രാസോര്ജം നേരിട്ട് വൈദ്യുതോര്ജമായി പരിണമിക്കുന്നു. ഈ രീതിയില് വൈദ്യുതി ഉത്പാദിപ്പിക്കാനുള്ള ഉപകരണങ്ങളാണ് സെല്ലുകള് (ഉദാ. ഡാനിയല് സെല്). രണ്ടാമത്തെ പ്രക്രിയയില് വൈദ്യുതോര്ജം നേരിട്ടു രാസോര്ജമായി മാറുന്നു. ഈ പ്രക്രിയയ്ക്ക് വൈദ്യുതവിശ്ലേഷണം (electrolysis)എന്നു പറയുന്നു. സമുചിത സാഹചര്യത്തില് വൈദ്യുതവിശ്ലേഷണ ഫലമായുണ്ടാകുന്ന ഉത്പന്നങ്ങളെ വീണ്ടും രാസപരമായി പ്രവര്ത്തിപ്പിച്ച്, വിശ്ലേഷണാര്ഥം വ്യയംചെയ്യപ്പെട്ടിട്ടുള്ള വൈദ്യുതോര്ജത്തെ ഒരു വലിയ അനുപാതത്തോളം തിരിച്ചു ലഭ്യമാക്കുവാനും സാധിക്കും. ഈ തത്ത്വമാണ് സംഭരണ-സെല്ലുകളില് ഉപയോഗപ്പെടുത്തിയിട്ടുള്ളത്. ഇപ്പറഞ്ഞതെല്ലാം വിദ്യുത്-രാസപ്രക്രിയകളാണ്. വൈദ്യുതോര്ജം വഴി ആദ്യം താപോര്ജം ഉത്പാദിപ്പിച്ച് സാധാരണ താപനിലകളില് നടക്കാത്ത രാസപ്രവര്ത്തനങ്ങളെ സാധിപ്പിക്കുന്ന വിദ്യുത്-താപീയ പ്രക്രിയകളെയും ഇലക്ട്രോ കെമിസ്ട്രിയുടെ പഠന പരിധിയില്പ്പെടുത്തിയിട്ടുണ്ട്. വാതകങ്ങളിലൂടെ വൈദ്യുതി പ്രവഹിപ്പിക്കുമ്പോള് സാധാരണയായി രാസപരിണാമമുണ്ടാകുന്നു. ഈ പ്രവര്ത്തനങ്ങളുടെ പഠനം ഇലക്ട്രോ കെമിസ്ട്രിയുടെ ഒരു പ്രത്യേകശാഖയായി പരിഗണിക്കപ്പെട്ടുവരുന്നു.
ചരിത്രം. എ.ഡി. 1800-ല് ആണ് ഇലക്ട്രോ കെമിസ്ട്രി എന്ന വിജ്ഞാനശാഖയുടെ ആരംഭം. അലക്സാന്ദരോ വോള്ട്ട എന്ന ഇറ്റാലിയന് ശാസ്ത്രജ്ഞന് വിഖ്യാതമായ വോള്ട്ടായി-സെല് അക്കൊല്ലം കണ്ടുപിടിച്ചു. ചെമ്പ്, നാകം എന്നിവയുടെ തകിടുകള് ഇടവിട്ടടുക്കിവച്ച് ഇടകളില് ലവണ ലായനിയില് നനച്ചതോ കുതിര്ത്തതോ ആയ കടലാസ് കഷണങ്ങള് നിറച്ചശേഷം അദ്ദേഹം ചെമ്പുതകിടുകളെല്ലാംകൂടി ഒരു ലോഹക്കമ്പിയിലും നാകത്തകിടുകളെല്ലാംകൂടി മറ്റൊരു ലോഹക്കമ്പിയിലും തൊടുത്ത് പിന്നീട് ഈ ലോഹക്കമ്പികള് തമ്മില് സമ്പര്ക്കമുണ്ടാക്കി. അപ്പോള് ചെമ്പില്നിന്നു നാകത്തിലേക്ക് ഒരു വൈദ്യുതി ധാരയുണ്ടാകുന്നതായി അദ്ദേഹത്തിനു മനസ്സിലായി. അതേവര്ഷം തന്നെ നിക്കൊല്സണ്, കാര്ലൈല് എന്നിവര് മുന്പ്രസ്താവിച്ച രീതിയില് വൈദ്യുതിധാരയുണ്ടാക്കി, അല്പം ആല്ക്കലി ചേര്ത്ത ജലത്തിലൂടെ പ്രവഹിപ്പിച്ച് ഹൈഡ്രജനും ഓക്സിജനും ലഭ്യമാക്കി. വിജ്ഞാന ചരിത്രത്തില് ആദ്യം നടത്തപ്പെട്ട വൈദ്യുതവിശ്ലേഷണം ഇതായിരുന്നു. അതിനെത്തുടര്ന്ന് വൈദ്യുതവിശ്ലേഷണം ഒരു സര്വസാധാരണ പരീക്ഷണമായിത്തീര്ന്നു. ലവണലായനികളിലൂടെ വൈദ്യുതി പ്രവേശിപ്പിച്ച് അവയിലെ ലോഹഘടകങ്ങളെ നിക്ഷേപിപ്പിക്കാമെന്ന് ക്രൂക് ഷാങ്ഖ് കണ്ടുപിടിച്ചു. ലോഹങ്ങളിലൂടെ എന്ന പോലെതന്നെ ലവണങ്ങള്, അമ്ലങ്ങള്, ബേസുകള് എന്നിവയുടെ ലായനികളിലൂടെയും വൈദ്യുതിധാര പ്രവഹിക്കുമെന്നും എന്നാല് ലായനികളിലൂടെ ധാര കടന്നുപോകുമ്പോള് അവയ്ക്ക് വിശ്ലേഷണം ഉണ്ടാകുന്നു എന്നും അപ്പോള് അമ്ലങ്ങളും അലോഹങ്ങളും ലായനികളിലേക്ക് വൈദ്യുതിധാര പ്രവേശിക്കുന്ന ധന (positive) അഗ്രത്തിലും ഹൈഡ്രജന്, ലോഹങ്ങള്, ആല്ക്കലികള് എന്നിവ ലായനിയില് നിന്ന് വൈദ്യുതിധാര നിര്ഗമിക്കുന്ന ഋണ (negative) അഗ്രത്തിലും നിക്ഷേപിക്കപ്പെടുന്നതാണെന്നും 1803-ല് ബെര്സിലിയസ്, ഹിസിംഗര് എന്നിവര് കണ്ടുപിടിച്ചു. 1806-ല് ഹംഫ്രിഡേവി സോഡിയം, ബേരിയം മുതലായ അനേകം ലോഹങ്ങള് അവയുടെ യൗഗികങ്ങളെ വൈദ്യുതവിശ്ലേഷണത്തിനു വിധേയമാക്കി ഉത്പാദിപ്പിക്കുകയുണ്ടായി. തുടര്ന്ന്, ഇത്തരം വിശ്ലേഷണങ്ങളെപ്പറ്റി ഡേവിയുടെ ശിഷ്യനായ മൈക്കല് ഫാരഡേ സുദീര്ഘവും സുസൂക്ഷ്മവുമായ പാരിമാണിക-പഠനം നടത്തുകയും 1833-ല് "ഫാരഡേ-നിയമങ്ങള്' എന്നറിയപ്പെടുന്ന വിഖ്യാതങ്ങളായ രണ്ട് വൈദ്യുതവിശ്ലേഷണ നിയമങ്ങള് ആവിഷ്കരിക്കുകയും ചെയ്തു. i. വൈദ്യുതിധാരകൊണ്ടു നിക്ഷിപ്തമാകുന്ന പദാര്ഥത്തിന്റെ പരിമാണം പ്രയുക്തമായ വൈദ്യുതിയുടെ പരിമാണത്തിന് ആനുപാതികമായിരിക്കും; ii. ഒരു നിശ്ചിതപരിമാണം വൈദ്യുതി ഉപയോഗിച്ച് നിക്ഷിപ്തമാകുന്ന വിവിധ മൂലകങ്ങളുടെ പരിമാണങ്ങള് അവയുടെ രാസതുല്യാങ്കങ്ങള്ക്ക് ആനുപാതികമായിരിക്കും. ഏതു മൂലകത്തിന്റെയും ഗ്രാം-തുല്യാങ്കഭാരം (gram equivalent weight) നിക്ഷേപിക്കുന്നതിന് ഒരേ പരിമാണം വൈദ്യുതി ആവശ്യമാണെന്ന് ഇതില്നിന്നനുമാനിക്കാം. അനേകം പരീക്ഷണങ്ങളിലൂടെ ഇത് 96,490 കൂളും (Coulomb) ആണെന്ന് നിര്ണയിക്കപ്പെട്ടു. ഒരു ഗ്രാം-തുല്യാങ്കഭാരം മൂലകം നിക്ഷേപിക്കുന്നതിന് ആവശ്യമായ ഈ പരിമാണത്തെ ഒരു "ഫാരഡേ' എന്നാണ് ഇന്ന് വ്യവഹരിക്കുന്നത്. ഈ കണ്ടുപിടിത്തങ്ങളെത്തുടര്ന്ന് ഇല്കട്രോളൈറ്റ്, ഇലക്ട്രോഡ്, ആനോഡ്, കാഥോഡ്, അയോണ്, അനയോണ്, കറ്റയോണ് എന്നീ സംജ്ഞകള് നിഷ്പാദിതങ്ങളാവുകയും നിര്വചിക്കപ്പെടുകയും ചെയ്തു.
1834-ല് ഫാരഡേ പ്ലാറ്റിനം ഇലക്ട്രോഡുകളുപയോഗിച്ച്, ഉരുക്കിയ സോഡിയം ക്ലോറൈഡിലൂടെ വൈദ്യുതി പ്രവഹിപ്പിക്കുകയും സോഡിയം ലോഹവും ക്ലോറിന് വാതകവും രണ്ടിലക്ട്രോഡുകളില് നിന്നുമായി ലഭ്യമാക്കുകയും ചെയ്തു. എന്നാല് സോഡിയം ക്ലോറൈഡിന്റെ ലായനി വൈദ്യുതവിശ്ലേഷണവിധേയമാക്കിയാല് ആനോഡില് നിന്ന് ക്ലോറിന് ലഭിക്കുന്നതാണ്. പക്ഷേ, കാഥോഡില് ഉന്മോചിതമാകുന്ന സോഡിയം, ലായകമായ ജലവുമായി രാസപ്രവര്ത്തനത്തിലേര്പ്പെട്ട് സോഡിയം ഹൈഡ്രാേക്സൈഡും ഹൈഡ്രജനും ഉത്പാദിപ്പിക്കുന്നു. ഈ ഹൈഡ്രജനാണ് കാഥോഡില് നിന്നു കിട്ടുന്ന ഉത്പന്നം. ലായനിയില് സോഡിയം ഹൈഡ്രാേക്സൈഡിന്റെ അളവ് വര്ധിച്ചുവരികയും ചെയ്യും. ഇതില്നിന്നു മനസ്സിലാകുന്നത് ഓരോ വൈദ്യുതവിശ്ലേഷണ പരീക്ഷണത്തിലും കിട്ടുന്ന ഉത്പന്നങ്ങള്, ഇലക്ട്രോളൈറ്റിന്റെ സ്വഭാവം, അതിലെ അയോണുകളുടെ സ്വഭാവം, ഇലക്ട്രോഡുകളുടെയും ലായകത്തിന്റെയും സ്വഭാവം എന്നിവയെ ആശ്രയിച്ചിരിക്കുന്നു എന്നാണ്. ഇലക്ട്രോളിസിസിനെക്കുറിച്ച് ഫാരഡേ അനേകം വിശദപഠനങ്ങള് നടത്തുകയും വ്യാഖ്യാനങ്ങള് നല്കുകയും ചെയ്തു. പക്ഷേ, ഇലക്ട്രോളൈറ്റുകള് എന്തുകൊണ്ട് അയോണുകളായിത്തീരുന്നു എന്നോ ഇലക്ട്രോളൈറ്റ് ലായനികള്ക്ക് അവയുടെ ബാഷ്പമര്ദം (vapour pressure), ഓസ്മോട്ടികമര്ദം (osmotic pressure) തുടങ്ങിയ പല ഭൗതികഗുണധര്മങ്ങളിലും കാണപ്പെടുന്ന അസാധാരണത്വം എന്തുകൊണ്ടെന്നോ വിശദീകരിക്കുവാന് അദ്ദേഹത്തിനു സാധിച്ചില്ല. 1887-ല് അരേനീയസ് (Arrhenius)എന്ന ശാസ്ത്രജ്ഞനാണ് ശ്രദ്ധേയമായ ഒരു സിദ്ധാന്തത്തിലൂടെ (അരേനീയസ്-സിദ്ധാന്തം) ഇലക്ട്രോളൈറ്റുകളുടെ സ്വഭാവത്തെക്കുറിച്ചും അവയുടെ ലായനികളുടെ പ്രത്യേകതകളെക്കുറിച്ചും ന്യായയുക്തമായ ഒരു വ്യാഖ്യാനത്തിനുള്ള അടിത്തറ പാകിയത്. പ്രബല-ഇലക്ട്രോളൈറ്റുകളുടെ സവിശേഷതകളെ പൂര്ണമായും വിശദീകരിക്കുവാന് ഈ സിദ്ധാന്തത്തിന് സാധിച്ചില്ല. പിന്നീട് ഡിബൈ, ഹ്വിക്കല്, ഓണ്സാഗര് മുതലായവര് ആവിഷ്കരിച്ച സിദ്ധാന്തമാണ് ഈ പോരായ്മ പരിഹരിച്ചത്.
അരേനീയസിന്റെ അയോണീകരണ സിദ്ധാന്തം ആവിഷ്കൃതമായതിനുശേഷമാണ് ഇലക്ട്രോണ് കണ്ടുപിടിക്കപ്പെട്ടത് (1897). തുടര്ന്ന് 20-ാം ശതകത്തില് ആറ്റത്തിനെപ്പറ്റിയും അയോണുകളെപ്പറ്റിയും സംരചനാപരമായി അറിവ് ലഭിച്ചു. വൈദ്യുതിധാര ഇലക്ട്രോണുകളുടെ പ്രവാഹം മാത്രമാണെന്നും വ്യക്തമാക്കുകയും ചെയ്തു.
സെല്ലുകള്. രാസമാറ്റങ്ങളിലൂടെ വൈദ്യുതോര്ജം ഉത്പാദിപ്പിക്കുന്ന വിദ്യുത്-രാസ സെല്ലുകളുടെ വിദ്യുത്ചാലകബലം [electro motive force (emf)] അളന്ന് അവയിലെ രാസമാറ്റത്തെപ്പറ്റിയുള്ള പല സംഗതികളും കണക്കാക്കാവുന്നതാണ്. ഒരു ഇലക്ട്രോഡും അതിനനുയോജ്യമായ ഒരു ഇലക്ട്രോളൈറ്റും ചേര്ന്ന രണ്ട് അര്ധസെല്ലുകളുടെ സംഗമമാണ് ഒരു ഗാല്വനിക് സെല്. ഓരോ ഇലക്ട്രോഡിനും അതാതിന്റേതായ വൈദ്യുത-പൊട്ടന്ഷ്യല് ഉണ്ടായിരിക്കും. ഒന്നിന് ഓക്സീകരണ പൊട്ടന്ഷ്യലും മറ്റേതിന് നിരോക്സീകരണ പൊട്ടന്ഷ്യലുമാണുണ്ടാവുക. തന്മൂലം ഇലക്ട്രോഡുകള് തമ്മില് പൊട്ടന്ഷ്യല് വ്യത്യാസമുണ്ടാകും. ഇതാണ് സെല് പൊട്ടന്ഷ്യല്. ഉയര്ന്ന പൊട്ടന്ഷ്യലുള്ള ഇലക്ട്രോഡില്നിന്ന് മറ്റേതിലേക്ക് വൈദ്യുതിധാരയുണ്ടാകും; അതായത് പൊട്ടന്ഷ്യല് കുറഞ്ഞ ഇലക്ട്രോഡില് നിന്ന് കൂടിയ ഇലക്ട്രോഡിലേക്ക് ഇലക്ട്രോണ് പ്രവാഹമുണ്ടാകും.
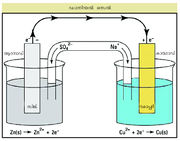
ഡാനിയല് സെല് ഒരു ഉത്തമോദാഹരണമാണ്. ഒരു കോപ്പര്ദണ്ഡ് കോപ്പര് സള്ഫേറ്റ് ലായനിയിലും സിങ്കുദണ്ഡ് സിങ്ക് സള്ഫേറ്റ് ലായനിയിലും ഇറക്കിവയ്ക്കുന്നു. ഇവയാണ് രണ്ട് ഇലക്ട്രോഡുകള്. ഇവയെ രണ്ടും ബാഹ്യമായി ഒരു ലോഹക്കമ്പികൊണ്ട് വോള്ട്ട് മീറ്ററിലേക്ക് ഘടിപ്പിച്ചിരിക്കുന്നു. ഈ ഇലക്ട്രോഡുകള് രണ്ടുംകൂടി വിപരീതമായി തൊടുക്കുമ്പോള് ഡാനിയല് സെല് കിട്ടുന്നു.
അഗര്-അഗര് ചൂര്ണം ജലത്തില് കലര്ത്തി പൊട്ടാസ്യം ക്ലോറൈഡ്, പൊട്ടാസ്യം സള്ഫേറ്റ്, അമോണിയം നൈട്രറ്റ് മുതലായവയില് ഏതെങ്കിലും ഒരു ഇലക്ട്രോളൈറ്റ് ചേര്ത്തു തിളപ്പിച്ചുകിട്ടുന്ന തെളിഞ്ഞ ലായനി ചൂടോടെ ഒരു U കുഴലില് ഒഴിച്ച് തണുപ്പിക്കുമ്പോള് ലായനി ഉറച്ച് ഹല്വാ പോലുള്ള ദൃഢമായ ഒരു അര്ധഖര-ജെല് ലഭിക്കുന്നതാണ്. കുഴല് കമഴ്ത്തി ഓരോ അഗ്രവും ഓരോ ലായനിയില് മുക്കി നിര്ത്തുക. സെല് പരിപഥത്തില് (cell circuit)ഒരു ഗാല്വനോമീറ്റര് കൂടി ഘടിപ്പിച്ചാല് വൈദ്യുതിധാര ദൃശ്യമാകും. ഇവിടെ കോപ്പര് ധന-ഇലക്ട്രോഡും സിങ്ക് ഋണ-ഇലക്ട്രോഡും ആയിരിക്കും.
സിങ്ക് ഇലക്ട്രോഡില് ഇലക്ട്രോണ്-ഉത്പാദനവും (ഓക്സീകരണം) കോപ്പര് ഇലക്ട്രോഡില് ഇലക്ട്രോണ്-ഉപഭോഗവും (നിരോക്സീകരണം) നടക്കുന്നു. അതിനാല് ബാഹ്യപഥത്തില്ക്കൂടി ഇലക്ട്രോണുകള് സിങ്കില് നിന്നു കോപ്പറിലേക്കും പ്രവഹിക്കുന്നു.
കോപ്പറിനെ അപേക്ഷിച്ച് സിങ്കിന് ഓക്സീകരണശേഷി കൂടുതലാകയാലാണ് പ്രസ്തുത ഡാനിയല് സെല്ലില് സിങ്ക് ഋണ-ഇലക്ട്രോഡും കോപ്പര് ധന-ഇലക്ട്രോഡും ആയത്. എന്നാല് സില്വര്-സില്വര്നൈട്രേറ്റ്-ഇലക്ട്രോഡും കോപ്പര്-കോപ്പര് സള്ഫേറ്റ്-ഇലക്ട്രോഡും തമ്മില് തൊടുക്കുമ്പോള് കോപ്പര് ആണ് ഋണ-ഇലക്ട്രോഡ് ആയിത്തീരുന്നത്. ഡാനിയല് സെല്ലിനെ ഇങ്ങനെ ചിത്രീകരിക്കാം.
ഇടയ്ക്കുള്ള ഇരട്ടവര ജെല്-ബന്ധമാണ്. രാസപ്രക്രിയകളെ ആസ്പദമാക്കി ഡാനിയല് സെല്ലിനു പുറമേ വേറെയും അനേകം സെല്ലുകള് സംവിധാനം ചെയ്യപ്പെട്ടിട്ടുണ്ട്. ആവശ്യങ്ങള്ക്കനുയോജ്യമായി വിവിധയിനം ഇലക്ട്രോഡുകളും നിര്മിക്കപ്പെട്ടിട്ടുണ്ട്. ഇലക്ട്രോകെമിസ്ട്രിയുടെ വികാസഫലമായി സ്റ്റോറേജ് സെല്ലുകളും പല വിധത്തില് നിര്മിക്കപ്പെട്ടു.
പ്രയോജനം. ഇലക്ട്രോകെമിസ്ട്രിയുടെ വികാസം ഒരു പരിധിവരെ ഇലക്ട്രോകെമിക്കല് വ്യവസായങ്ങളുടെ പ്രതിഷ്ഠയ്ക്കു കാരണമായിത്തീര്ന്നു. അലുമിനിയം, മഗ്നീഷ്യം, സോഡിയം, സിങ്ക്, നിക്കല് തുടങ്ങിയ ലോഹമൂലകങ്ങളെ അവയുടെ അയിരുകളില് നിഷ്കര്ഷണം ചെയ്യുന്നതിന് വൈദ്യുതവിശ്ലേഷണ പ്രക്രിയയാണ് സ്വീകരിക്കപ്പെട്ടിരിക്കുന്നത്. സ്വര്ണം, വെള്ളി, ചെമ്പ്, കാരീയം, വെളുത്തീയം (tin)മുതലായ ലോഹങ്ങളെ ശുദ്ധീകരിക്കുന്നതും ഈ പ്രക്രിയവഴിയാണ്. പലതരം ലോഹങ്ങളും സങ്കരലോഹങ്ങളുംകൊണ്ട് വിദ്യുല്ലേപനം (electroplating) നടത്തുന്നതിനും കാസ്റ്റിക് സോഡ, ഹൈപ്പോക്ലോറൈറ്റുകള്, ക്ലോറേറ്റുകള്, ഹൈഡ്രജന്, ഓക്സിജന് എന്നിങ്ങനെയുള്ള രാസവസ്തുക്കള് വന്തോതില് ഉത്പാദിപ്പിക്കുന്നതിനും വൈദ്യുതവിശ്ലേഷണത്തിന്റെ തത്ത്വംതന്നെയാണ് പ്രാവര്ത്തികമാക്കുന്നത്. ലോഹ-അയിരുകളുടെ പ്രഗളനം (smelting), ഫെറോ-അലോയ്കളുടെ നിര്മാണം, ഉരുക്കു ശുദ്ധീകരണം, കാത്സ്യം കാര്ബൈഡ്, കാര്ബൊറണ്ടം, ഫോസ്ഫറസ് എന്നിവയുടെ ഉത്പാദനം മുതലായ വ്യവസായങ്ങളില് ഇലക്ട്രോ തെര്മല്-കെമിക്കല് പ്രക്രിയകളാണ് പ്രയോഗിക്കപ്പെടുന്നത്.
വൈദ്യുതപ്രവാഹംമൂലമുളവാകുന്ന രാസപ്രവര്ത്തനങ്ങളില് വളരെ പ്രമുഖമായ ഒന്നാണ് ഇലക്ട്രോഡെപ്പോസിഷന്. നിക്ഷേപിക്കേണ്ട ലോഹത്തിന്റെ ലായനി ഇലക്ട്രോലൈറ്റായി എടുക്കുന്നു. വൈദ്യുത രാസപ്രവര്ത്തനത്തിലൂടെ ഇലക്ട്രോലൈറ്റില്നിന്നും ലോഹ അയോണുകള് കാഥോഡില് നിക്ഷേപിക്കപ്പെടുന്നു. പലരീതിയില് ഇലക്ട്രോഡെപ്പോസിഷനെ പ്രയോജനപ്പെടുത്താവുന്നതാണ്. ഇലക്ട്രോപ്ലേറ്റിങ് ഒരുദാഹരണമാണ്. സില്വര്, കാഡ്മിയം, നിക്കല്, ക്രാേമിയം തുടങ്ങിയ ലോഹങ്ങളെല്ലാം മറ്റു ലോഹങ്ങളില് സംരക്ഷണാര്ഥമോ സൗന്ദര്യാര്ഥമോ പ്ലേറ്റിങ് ചെയ്യാറുണ്ട്. മറ്റൊരു ഇലക്ട്രോഡെപ്പോസിഷന് പ്രക്രിയയായ ഇലക്ട്രോറിഫൈനിങ് വെള്ളി, ചെമ്പ്, ലെഡ് പോലുള്ള ലോഹങ്ങളുടെ ശുദ്ധീകരണ പ്രക്രിയയായി ഉപയോഗിക്കുന്നു. ഇവിടെ ശുദ്ധീകരിക്കേണ്ട ലോഹത്തിന്റെ തകിട് ആനോഡായി ഉപയോഗിക്കുന്നു. വൈദ്യുതവിശ്ലേഷണത്തിലൂടെ ശുദ്ധമായ ലോഹം കാഥോഡില് നിക്ഷേപിക്കപ്പെടുന്നു. ഇലക്ട്രോഡെപ്പോസിഷന് പ്രക്രിയ ക്രിയാശീലം ഉയര്ന്ന മൂലകങ്ങളായ അലുമിനിയം, മഗ്നീഷ്യം, സോഡിയം എന്നിവയെ അവയുടെ ഉരുകിയ ലായനിയില്നിന്നും കോപ്പര്, മാങ്നീസ്, ആന്റിമണി എന്നിവയെ അവയുടെ ജലീയലായനിയില്നിന്നും നിര്മിക്കുവാന് ഉപയുക്തമാണ്.
സംരക്ഷിക്കേണ്ട ലോഹത്തെ പെയിന്റടിച്ചോ, എണ്ണ, ഗ്രീസ് എന്നിവ പുരട്ടിയോ, സിങ്ക്, ക്രാമിയം, നിക്കല്, അലുമിനിയം തുടങ്ങിയ ക്രിയാശീലമൂലകങ്ങളുപയോഗിച്ച് ഇലക്ട്രോപ്ലേറ്റിങ് നടത്തിയോ സംക്ഷാരണത്തില്നിന്നും രക്ഷിക്കാം. വായുവില് നിന്ന് നൈട്രിക് ഓക്സൈഡിന്റെ ഉദ്ഗ്രഥനം, ഓസോണിന്റെ ഉത്പാദനം എന്നിവ സാധിപ്പിക്കുന്നതിന് വാതകങ്ങളിലൂടെ വൈദ്യുതി പ്രവഹിപ്പിക്കുന്നു.
ഇലക്ട്രോകെമിസ്ട്രിയിലെ ഗവേഷണപുരോഗതിമൂലമാണ് ലോഹങ്ങള്ക്ക് നൈസര്ഗികമായി വരുന്ന ക്ഷാരണത്തെപ്പറ്റി പഠിക്കാനും അതു ഫലപ്രദമാംവണ്ണം തടയുന്നതിനുള്ള മാര്ഗങ്ങള് ആസൂത്രണം ചെയ്യുവാനും സാധിച്ചിട്ടുള്ളത്. അനുനിമിഷം ലോകമെമ്പാടും ക്ഷാരണവിധേയമായിക്കൊണ്ടിരിക്കുന്ന ലോഹസമ്പത്തിന്റെ പരിമാണം വളരെ ഭീമമാണ്. ഈ വന്നഷ്ടം ഒഴിവാക്കുന്നതിന് പറ്റിയ മാര്ഗം ക്ഷാരണത്തിനാസ്പദമായ വിദ്യുത്-രാസ പ്രക്രിയയെ വിദ്യുത്-രാസപരമായിത്തന്നെ തടുത്തുനിര്ത്തുക എന്നതാണ്.
പലതരം ഇലക്ട്രോഡുകളുപയോഗിച്ച് അനേകം വിശ്ലേഷണ (analytical) വിധികള് ഇന്ന് പരീക്ഷണശാലകളില് പ്രയോജനപ്പെടുത്തുന്നുണ്ട്. പൊട്ടന്ഷ്യോമെട്രി, വോള്ട്ടാമെട്രി, കൂളോമെട്രി, ഇലക്ട്രോഗ്രാവിമെട്രി, പോളാരൊഗ്രാഫി എന്നിവ ചില ഉദാഹരണങ്ങളാണ്. നോ. ഇലക്ട്രിക് ഫര്ണസ്; ഇലക്ട്രോഡ്; ഇലക്ട്രോപ്ളേറ്റിങ്; വൈദ്യുതി
(ഡോ. കെ.പി. ധര്മരാജയ്യര്; ഡോ. വി.എസ്. പ്രസാദ്)