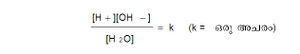This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ആസിഡുകളും ബേസുകളും
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
ആസിഡുകളും ബേസുകളും
Acids and Bases
പരസ്പരബന്ധമുള്ള രണ്ടിനം രാസയൗഗികങ്ങള്. പുളിയുള്ള എന്നർഥം വരുന്ന "അസിഡസ്' (acidus)എന്ന വാക്കിൽനിന്നാണ് ആസിഡ് എന്ന പദം നിഷ്പന്നമായിട്ടുള്ളത്. പുളിച്ച വിനാഗിരി(vinegar)യിൽ ആസിഡതയ്ക്കു കാരണമായ എന്തോ ഒരു വസ്തുവുണ്ടെന്നും ആവർത്തിച്ചു സ്വേദനവിധേയമാക്കിയാൽ (distilled) ഈ പുളിരസത്തിനാസ്പദമായ രാസവസ്തു-അസറ്റിക് ആസിഡ്-വേർതിരിച്ചെടുക്കാമെന്നും പണ്ടേ അഭിപ്രായമുണ്ടായിരുന്നു. എ.ഡി. 750-ൽ ഗെബർ എന്ന ശാസ്ത്രജ്ഞന് അസറ്റിക് ആസിഡിനെക്കുറിച്ച് പ്രസ്താവിച്ചിട്ടുണ്ട്.
മനുഷ്യന് ആദ്യമായി പരിചയിച്ച പല ആസിഡുകളും സസ്യജങ്ങള് (vegetable origin)ആയിരുന്നു. 18-ാം ശ. വരെ അവ ഒന്നും പൃഥക്കരിക്കപ്പെട്ടിരുന്നില്ല. 1770-ൽ ആണ് ആദ്യമായി ടാർടാറിക് ആസിഡ് ക്രിസ്റ്റൽ രൂപത്തിൽ വേർതിരിക്കപ്പെട്ടത്. മൂത്രസഞ്ചിയിലുണ്ടാകുന്ന കല്ലുകളിൽ (bladder stones) നിന്ന് ഷീലെ എന്ന ശാസ്ത്രജ്ഞന് (1742-86) യൂറിക് ആസിഡ് വേർതിരിച്ചെടുക്കുകയുണ്ടായി. 1780-ൽ പുളിച്ച പാലിൽനിന്നു ലാക്റ്റിക് ആസിഡും 1783-ൽ ചില തൈലങ്ങളിൽനിന്ന് ഓക്സാലിക് ആസിഡും 1784-ൽ നാരങ്ങനീരിൽനിന്നു സിറ്റ്രിക് ആസിഡും ക്രിസ്റ്റലുകളായി ലഭ്യമാക്കി. എന്നാൽ സസ്യങ്ങളിൽനിന്നു മാത്രമല്ല ഖനിജങ്ങളിൽ (minerals) നിന്നും ആസിഡുകള് ഉണ്ടാകുമെന്ന് ഗെബർ, ഗ്ലാബർ (Glauber, 1603-68) എന്നിവർക്ക് അറിയാമായിരുന്നു. എന്തുകൊണ്ടെന്നാൽ ആലം, ഗ്രീന് വിറ്റ്രിയോള് (green vitriol-Ferrous Sulphate, Fe SO4. 7 H2 O) എന്നിവ തപിപ്പിച്ചാൽ ആസിഡ്-ധൂമങ്ങള് ലഭിക്കുമെന്നും അവ ജലത്തിലലിഞ്ഞു ചേർന്നാൽ "ഓയിൽ ഒഫ് വിറ്റ്രിയോള്' (സൽഫൂരിക് ആസിഡ്, H2 SO4) ഉണ്ടാകുമെന്നും അവർ കണ്ടിരുന്നു. നൈറ്റർ എന്ന ഖനിജത്തെ ഓയിൽ ഒഫ് വിറ്റ്രിയോള് കൊണ്ട് പ്രവർത്തിച്ചു ചൂടാക്കി നൈട്രിക് ആസിഡും, കറിയുപ്പിനെ ഉപചരിച്ചുകിട്ടുന്ന ധൂമങ്ങള് ജലത്തിലലിയിച്ച് മറിയാറ്റിക് ആസിഡും അവർ ഉത്പാദിപ്പിച്ചിരുന്നു. ഈ ആസിഡുകള് സസ്യജങ്ങളായ ആസിഡുകളെപ്പോലെ നീലലിറ്റ്മസിനെ ചുവപ്പിക്കുമെന്നും രാസപരമായി കൂടുതൽ തീവ്രതയോടെ പ്രവർത്തിക്കുമെന്നും അവർ മനസ്സിലാക്കിയിരുന്നു.
ആസിഡുകള് പൊതുവേ പുളിപ്പു രുചിയുള്ളതും ലോഹങ്ങളെ അലിയിക്കുന്നതും നീലലിറ്റ്മസ്-ലായനിയെ ചുവപ്പിക്കുന്നതും ആൽക്കലികളുമായി അഥവാ ബേസുകളുമായി പ്രതിപ്രവർത്തിച്ച് ലവണങ്ങള് ഉത്പാദിപ്പിക്കുന്നതുമായ രാസവസ്തുക്കളാണ്. ഈ സാമാന്യ ഗുണധർമങ്ങളെ ആസ്പദമാക്കിയാണ്. ആദ്യകാലത്ത് ആസിഡ് നിർവചിക്കപ്പെട്ടത്. ആന്റണി ലവോസിയെ എന്ന ഫ്രഞ്ചു ശാസ്ത്രജ്ഞന് (1743-94) തന്റെ ചില നിരീക്ഷണങ്ങളുടെ ഫലമായി എല്ലാ ആസിഡുകളിലും അനിവാര്യമായ പൊതുമൂലകം ഒന്നുണ്ടെന്നും അത് ഓക്സിജന് ആണെന്നും പ്രസ്താവിക്കുകയുണ്ടായി. എന്നാൽ ഹംഫ്രി ഡേവി എന്ന ഇംഗ്ലീഷ് ശാസ്ത്രജ്ഞന് (1778-1829) ലവോസിയെയുടെ ആശയം നിരാസ്പദമാണെന്നു തെളിയിച്ചു. ആസിഡുകള്ക്ക് ഒരു പൊതുമൂലകം അപരിഹാര്യമായി ഉണ്ടെങ്കിൽ അതു ഹൈഡ്രജന് ആണെന്നു മനസ്സിലായി. ഈ അറിവിനെ അടിസ്ഥാനപ്പെടുത്തിയാണ് ജസ്റ്റസ് ഫൊണ് ലീബിഗ് 1840-ൽ ആസിഡിന് ഒരു പുതിയ നിർവചനം കൊടുത്തത്. അതനുസരിച്ച് ലോഹങ്ങളുമായി പ്രതിപ്രവർത്തിച്ച് ഹൈഡ്രജന് ലഭ്യമാക്കുന്ന, ഹൈഡ്രജന് അടങ്ങിയ ഒരു രാസവസ്തുവാണ് ആസിഡ്. അന്പതുവർഷക്കാലത്തോളം ഈ നിർവചനം ശാസ്ത്രലോകത്തിൽ തൃപ്തികരമായിത്തന്നെ നിലനിന്നുപോന്നു.
ബേസുകള് സാമാന്യേന ആസിഡുകളുമായി പ്രതിപ്രവർത്തിച്ച് ലവണങ്ങള് ലഭ്യമാക്കുന്നു. ഈ സ്വഭാവത്തെ ആസ്പദമാക്കിയാണ് ബേസ് നിർവചിക്കപ്പെട്ടിരുന്നത്. സോഡിയ(sodium) ത്തിന്റെയും പൊട്ടാസിയ(potassium)ത്തിന്റെയും ഹൈഡ്രാക്സൈഡുകളാണ് ഏറ്റവും പരിചിതങ്ങളായ രണ്ടു ബേസുകള്. ഇവയെ ആൽക്കലി എന്നും വ്യവഹരിക്കാറുണ്ട്. "ക്ഷാരം' (ചാരം) എന്നർഥമുള്ള "അൽകലായ്' എന്ന അറബി വാക്കിൽനിന്നാണ് ആൽക്കലി എന്ന പദം നിഷ്പാദിപ്പിക്കപ്പെട്ടിട്ടുള്ളത്. ഇവയുടെ ജലലായനികള് സോപ്പുപോലെ വഴുവഴുപ്പുള്ളവയും ചുവന്ന ലിറ്റ്മസ്സിനെ നീലമാക്കുന്നവയും ആണ്. സാധാരണയായി ആൽക്കലികളെ നിർമിക്കുന്നത് (1) മരങ്ങള് മുതലായവ ദഹിച്ചുകിട്ടുന്നതും (2) കടൽക്കരകളിലെ സസ്യങ്ങള് ദഹിച്ചുകിട്ടുന്നതുമായ ചാരങ്ങള് വെള്ളത്തിൽ കലക്കി നിഷ്കർഷം ഉണ്ടാക്കിയിട്ടാണ്. ആദ്യത്തെ ഇനം ലായനികളിൽനിന്ന് പൊട്ടാസിയം കാർബണേറ്റും രണ്ടാമത്തെ ഇനം ലായനികളിൽനിന്നു സോഡിയം കാർബണേറ്റും ലഭിക്കുന്നു. ഇവയെ പൊട്ടാഷ് എന്നും സോഡാ-ആഷ് എന്നും പറയുന്നു. സൗമ്യ-ആൽക്കലികള് (mild alkalies)എന്നാണ് ഇവയെ ആദ്യകാലത്ത് വിളിച്ചിരുന്നത്. ഈ ലായനികള്, പൊട്ടാസിയം ഹൈഡ്രാക്സൈഡ്, സോഡിയം ഹൈഡ്രാക്സൈഡ് എന്നിവയെപ്പോലെ ദാഹക സ്വഭാവമില്ലാത്തവയാണ് എന്ന വസ്തുത "സൗമ്യ' എന്ന വിശേഷണത്തിൽ സൂചിതമായിരിക്കുന്നു. സൗമ്യക്ഷാരലായനികളെ കാസ്റ്റിക് ലൈം (caustic lime) ചേർത്തു തിളപ്പിച്ചാൽ കാസ്റ്റിക്-ആൽക്കലികള് ഉണ്ടാക്കാമെന്ന് ഗെബർ പ്രസ്താവിച്ചിട്ടുണ്ട്. അദ്ദേഹം നിർദേശിച്ച മാർഗം ഇന്നും ആൽക്കലി വ്യവസായങ്ങളിൽ സ്വീകരിച്ചു വരുന്നു. ആൽക്കലൈന്(എർത്ത്)ലോഹങ്ങളായ കാൽസ്യം, ബേരിയം, സ്റ്റ്രാണ്ഷ്യം എന്നിവയുടെ ഓക്സൈഡുകളും ഹൈഡ്രാക്സൈഡുകള് ലഭ്യമാക്കുന്നു. ഇവയും ജലത്തിലലിഞ്ഞ് കാസ്റ്റിക് ആൽക്കലികള് ഉത്പാദിപ്പിക്കുന്നു. പക്ഷേ, സോഡിയം, പൊട്ടാസിയം, ലിഥിയം എന്നിവയുടെ ഹൈഡ്രാക്സൈഡുകളെ അപേക്ഷിച്ച് ഇവയുടെ ജലലേയത്വം കുറവാണ്. എങ്കിലും സോഡിയം, പൊട്ടാസിയം, ലിഥിയം എന്നിവയുടെ ഹൈഡ്രാക്സൈഡുകളെപ്പോലെ ഇവയും ആസിഡുകളുമായി പ്രതിപ്രവർത്തിക്കുകയും ലവണങ്ങള് ഉത്പാദിപ്പിക്കുകയും ചെയ്യും. ആകയാൽ ബേസുകളായി ഈ ഹൈഡ്രാക്സൈഡുകളേയും പരിഗണിക്കുന്നു. മൊത്തത്തിൽ പറഞ്ഞാൽ ആസിഡുകളുമായി പ്രതിപ്രവർത്തിച്ച് ലവണങ്ങള് ലഭ്യമാക്കുന്ന ലോഹ-ഹൈഡ്രാക്സൈഡുകളെ ബേസുകള് എന്നു പറയുന്നു. ജലത്തിൽ അനായാസ-ലേയങ്ങളായ ബേസുകളെ (സോഡിയം, പൊട്ടാസിയം, ലിഥിയം എന്നിവയുടെ ഹൈഡ്രാക്സൈഡുകള്) ആൽക്കലികള് എന്നും വ്യവഹരിക്കുന്നു. എല്ലാ ആൽക്കലികളും ബേസുകളാണ്; എന്നാൽ എല്ലാ ബേസുകളും ആൽക്കലികളല്ല.
മൃഗങ്ങളുടെ കൊമ്പുകള് ശേഖരിച്ച് സ്വേദനവിധേയമാക്കിയാൽ അല്ലെങ്കിൽ സാൽ അമോണിയാക് (NH4 Cl) എന്ന പദാർഥം കാസ്റ്റിക്-ലൈം ചേർത്തു സ്വേദനവിധേയമാക്കിയാൽ മൂക്കു തുളയ്ക്കുന്ന മണത്തോടുകൂടിയ ഒരു വാതകം ലഭിക്കുന്നതാണ്. ഈ വാതകം ജലത്തിലലിയുമ്പോള് ദാഹകസ്വഭാവമുള്ള ഒരു ലായനിയുണ്ടാകുന്നു. ഇന്ന് ഇതിന് അമോണിയം ഹൈഡ്രാക്സൈഡ് എന്നാണ് പേരെങ്കിലും അത് "സ്പിരിറ്റ് ഒഫ് ഹാർട്സ് ഹോണ്' (spirit of hart's-കലമാന് കൊമ്പിന്റെ സാരം) എന്നു വിളിക്കപ്പെട്ടിരുന്നു. ഇതും ഒരു ആൽക്കലിയാണ്. പക്ഷേ, അമോണിയം ഹൈഡ്രാക്സൈഡിൽനിന്നും അമോണിയാവാതകത്തെ തപിപ്പിക്കലിലൂടെ നിഷ്കാസനം ചെയ്യാവുന്നതിനാൽ മറ്റ് ആൽക്കലികളിൽനിന്നും വേർതിരിച്ചു കാണിക്കുന്നതിന് ഇത് ബാഷ്പശീലക്ഷാരം (volatile alkaly) എന്നു പ്രത്യേകമായി വ്യവഹരിക്കപ്പെട്ടിരുന്നു.
ആസിഡുകളും ബേസുകളും വ്യാവസായികമായി (commercially)നോക്കിയാൽ ഏറ്റവും പ്രധാനമായ രണ്ടിനം രാസവസ്തുക്കളാണ്. അകാർബണികാമ്ലങ്ങളെ (inorganic acids) ഖെനിജാമ്ലങ്ങള് (mineral acids)എന്നു പറയാറുണ്ട്. സൽഫൂരിക് (H2 SO4), നൈട്രിക് (HNO3), ഹൈഡ്രാക്ലോറിക് (H Cl), ഫോസ്ഫോറിക് (H3 PO4) എന്നീ ആസിഡുകള് അതിപ്രസിദ്ധങ്ങളും പ്രയോജനകരങ്ങളുമായ ഖനിജാമ്ലങ്ങളാണ്. അസറ്റിക്, ഓക്സാലിക്, ബെന്സോയിക്, സിറ്റ്രിക്, ഗാലിക്, ലാക്റ്റിക്, മാലിക്, പാൽമിറ്റിക്, സാലിസിലിക്, ടാർടാറിക്, ഫോർമിക്, സ്റ്റിയറിക് എന്നീ ആസിഡുകള് കാർബണിക്ലാമങ്ങളിൽ പ്രധാനപ്പെട്ട ചിലതാണ്. കാർബികാമ്ലങ്ങളിലെ (organic acid) ആസിഡ് ഗ്രൂപ് COOH ആണ്. അകാർബണികബേസുകളിൽ മുഖ്യം അമോണിയ, സോഡിയം ഹൈഡ്രാക്സൈഡ്, പൊട്ടാസിയം ഹൈഡ്രാക്സൈഡ്, കാൽസ്യം ഹൈഡ്രാക്സൈഡ്, സോഡിയം കാർബണേറ്റ് എന്നിവയാണ്. കാർബണികബേസുകളിൽ മുഖ്യം പിരിഡിന് (C5 H5 N) എഥിലമീന് (C2 H5 NH2) മുതലായവയും.
അരീനിയസ്-ഓസ്വാള്ഡ് സിദ്ധാന്തം. രാസവസ്തുക്കള്ക്ക് ജലലായനികളിൽ അയോണീകരണം (ionisation)സംഭവിക്കുന്നുണ്ട് എന്ന സിദ്ധാന്തം ശാസ്ത്രലോകത്തിൽ രൂഢമൂലമായതോടുകൂടി ആസിഡിന്റെയും ബേസിന്റെയും നിർവചനങ്ങള്ക്കു മാറ്റം വന്നു. ജലലായനികളിൽ ഹൈഡ്രജന്-അയോണ് (H+) ലഭ്യമാക്കുന്ന രാസവസ്തുക്കള് ആസിഡുകളാണെന്നും ഹൈഡ്രാക്സൈഡ് അയോണ് (OH -) ലഭ്യമാക്കുന്നവ ബേസുകളാണെന്നും പറയപ്പെട്ടു. അരീനിയസ്-ഓസ്വാള്ഡ് സിദ്ധാന്തമനുസരിച്ചാണ് ആസിഡുകളെയും ബേസുകളെയും ഈ രീതിയിൽ വീക്ഷിച്ചുതുടങ്ങിയത്. ഈ പുതിയ സിദ്ധാന്തം ആസിഡ്-ബേസ് സന്തുലനങ്ങളെ(acid-base-balance)പ്പറ്റി ചർച്ചചെയ്യുന്നതിനും ആസിഡുകളുടെയും ബേസുകളുടെയും ശക്തിയെ (strength) പ്രകാശിപ്പിക്കുന്നതിനും സഹായകരമായിത്തീർന്നു. ഒരു ആസിഡ് ലായനിയിൽ ആസിഡിന്റെ അയോണന പ്രക്രിയയെ HA-->H+ + A- എന്ന സമവാക്യംകൊണ്ട് പ്രകാശിപ്പിക്കാം. മേൽക്കാണിച്ച അയോണനം അധികമായ തോതിലാണെങ്കിൽ-അയോണന പ്രക്രിയ സമവാക്യത്തിന്റെ വലതുഭാഗത്തേക്കു കൂടുതലായി നീങ്ങുന്തോറും-ആസിഡിന്റെ ശക്തി കൂടുതലാണ്. അയോണനം കുറയുന്തോറും ആസിഡ്-ശക്തിയും കുറയുന്നു. അതായത് അയോണനത്തിന്റെ പരിമാണം ആസിഡിന്റെ ശക്തിയുടെ അളവാണ് എന്നു സാരം. തന്മൂലം ഒരു ആസിഡിന്റെ വിയോജന-അചരം (dissociation constant) പേരീക്ഷണംവഴി കണ്ടുപിടിച്ചാൽ അതിന്റെ മൂല്യം അധികമോ കുറവോ എന്നു പരിശോധിച്ച് ആ ആസിഡ് ശക്തിയുള്ളതോ ശക്തികുറഞ്ഞതോ എന്നു പറയുവാന് സാധിക്കും. ചില സാധാരണ ആസിഡുകളുടെ വിയോജന-അചരങ്ങള് താഴെ പട്ടികയിൽ ചേർത്തിരിക്കുന്നു. സൗകര്യത്തിനുവേണ്ടി ഈ അചരങ്ങള് ഒരു പ്രത്യേക രീതിയിലാണ് ഇവിടെ കണക്കാക്കപ്പെട്ടിരിക്കുന്നത്. (K Acid എന്നതിനുപകരം- log K Acid എന്ന രീതിയിൽ). ഇപ്രകാരം കിട്ടുന്ന മൂല്യങ്ങള് ശക്തികുറഞ്ഞ ആസിഡുകളുടെ വിഷയത്തിൽ അധികവും ശക്തികൂടിയ ആസിഡുകളുടെ വിഷയത്തിൽ കുറവുമായിരിക്കും. ആസിഡുകളുടെ വിയോജന-അചരങ്ങള് ഇപ്രകാരം കണക്കാക്കുക എന്നത് ഒരു നവീനരീതിയാണ്.
ശക്തികുറഞ്ഞ ആസിഡിന് ഒരു സാധാരണ ദൃഷ്ടാന്തമാണ് അസറ്റിക് ആസിഡ്; ശക്തികൂടിയതിന് സൽഫൂരിക് ആസിഡും. താപനില, ഉപയോഗിക്കുന്ന ലായകം എന്നിവയുടെ വ്യത്യാസമനുസരിച്ച് മുകളിൽ കൊടുത്ത അചരങ്ങളുടെ മൂല്യങ്ങള്ക്കും വ്യത്യാസമുണ്ടായിരിക്കും. അസറ്റിക് ആസിഡിൽ (CH3 COOH) അയോണനവിധേയമായി ഒരു ഹൈഡ്രജന് മാത്രമേ ഉള്ളു. ആകയാൽ ഇത് ഒരു മോണോബേസിക് ആസിഡ് ആണ്. സൽഫൂരിക് ആസിഡ് (H2 SO4), ഫോസ്ഫോറിക് ആസിഡ് (H3 PO4), കാർബോണിക് ആസിഡ് (H2 CO3), ഓക്സാലിക് ആസിഡ് (H2 C2 O4) എന്നിവയിൽ ഒന്നിലധികം ഹൈഡ്രജനണുക്കള് അയോണനവിധേയങ്ങളാണ്. ഇവ മൊത്തത്തിൽ പോളിബേസിക് ആസിഡുകള് ആണ്. ഇവ ഹൈഡ്രജനണുക്കളുടെ സംഖ്യയനുസരിച്ച് ഘട്ടങ്ങളായിട്ടാണ് വിയോജനവിധേയങ്ങളാകുന്നത്.
ബേസുകളുടെ കാര്യത്തിലും ഇത്തരം ചർച്ച പ്രസക്തമാണ്. ലായനികളിൽ ഹൈഡ്രാക്സിൽ അയോണുകളുടെ (OH-) അളവാണ് അവയുടെ ശക്തിയുടെ അളവായി എടുക്കുന്നത്.
ആസിഡുകളും ബേസുകളും ജലലായനികളിൽ അയോണനവിധേയങ്ങളാകുമ്പോള് ഹൈഡ്രജന് അയോണുകളും (H+) ഹൈഡ്രാക്സിൽ അയോണുകളും (OH-)ലഭിക്കുന്നു എന്നു പ്രസ്താവിച്ചുവല്ലോ. ഇവിടെ ഒരു സംഗതി ശ്രദ്ധേയമായിട്ടുണ്ട്. ഈ ഇനം യൗഗികങ്ങള്ക്ക് ജലലായനിയിൽ വിയോജനം സംഭവിക്കുമ്പോള് ഉണ്ടാകുന്ന ഒ+ന്റെയും ഛഒന്റെയും പരിമാണങ്ങള്ക്ക് ഒരു നിയന്ത്രണമുണ്ട്. എന്തുകൊണ്ടെന്നാൽ ലായകമായ ജലം തന്നെ ഒരു ദുർബല-ആഡിഡാണ്; ദുർബല-ബേസുമാണ്. അത് H20-->H+ + OH- എന്ന സമവാക്യമനുസരിച്ച് വിയോജിക്കുന്നുണ്ട്. രാസശുദ്ധമായ (chemically pure) ജലത്തിൽH+ അയോണുകളുടെയും ഛഒ അയോണുകളുടെയും സാന്ദ്രണം തുല്യമാണ്. സാധാരണ താപനിലകളിൽ 2x10-7 ശ.മാ. ജലം അയോണീകൃതാവസ്ഥയിലായിരിക്കും. തന്മൂലം ഈ അയോണുകളുടെ സാന്ദ്രണം (ionic concentration) താഴെപ്പറയുന്ന സമവാക്യമനുസരിച്ച് പരസ്പരം ബന്ധപ്പെട്ടിരിക്കുന്നു:
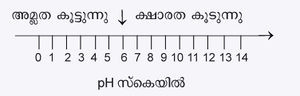
സ്ക്വയർ ബ്രാക്കറ്റുകൊണ്ട് അർഥമാക്കുന്നത് സാന്ദ്രണം (concentration) എന്നാണ്. ഈ ആവശ്യത്തിലേക്കായി അത് കണക്കാക്കപ്പെടുന്നത് ഗ്രാം തന്മാത്ര പ്രതിലിറ്റർ (gram molecule per litre) എന്ന രീതിയിലാണ്. ഈ വ്യവസ്ഥയനുസരിച്ച് 25ºC-ൽ [H+] x [OH-]ന്റെ മൂല്യം 1 x 10-14 ആണ്. അങ്ങനെ പരസ്പരാശ്രയം ഉള്ളതുമൂലം ഹൈഡ്രജന് അയോണിന്റെയോ ഹൈഡ്രാക്സിൽ അയോണിന്റെയോ-ഏതെങ്കിലും ഒന്നിന്റെ-സാന്ദ്രണം അളന്നറിഞ്ഞാൽ മറ്റേതിന്റെ സാന്ദ്രണം ഗണിച്ചുകണ്ടുപിടിക്കുവാന് പ്രയാസമില്ല. ഈ വസ്തുതകളുടെ അടിസ്ഥാനത്തിൽ 1909-ൽ സോറന്സന് എന്ന ശാസ്ത്രജ്ഞന് ജലലായനികളിൽ ഹൈഡ്രജന് അയോണുകളുടെ സാന്ദ്രണം അളക്കുവാന് ഒരു പ്രത്യേകസ്കെയിലിന്റെ ഉപയോഗം നിർദേശിച്ചു. ുഒ സ്കെയിൽ എന്നാണ് അതിന് പേര്. അതിൽ ഹൈഡ്രജന് അയോണിന്റെ സാന്ദ്രണം പൂജ്യം മുതൽ പതിനാലുവരെ(0-14)യുള്ള അക്കങ്ങള്കൊണ്ട് പ്രതിനിധാനം ചെയ്യുവാന് കഴിയും. pH എന്നത് ഹൈഡ്രജന് അയോണ് സാന്ദ്രണത്തിന്റെ ഋണ-ലോഗരിഥം ആണ് (pH = -log [H+]). ഏറ്റവും ശക്തമായ അമ്ലത്തിന്റെ അമ്ലത മുതൽ ഏറ്റവും ശക്തമായ ബേസിന്റെ ക്ഷാരതവരെ ുഒ സ്കെയിൽ ഉപയോഗിച്ച് നിർദേശിക്കുവാന് കഴിയും. സാധാരണ താപനിലകളിൽ സംപരിശുദ്ധജലത്തിന്റെ ുഒ, 7 ആണ്. 7-ന് താഴെയുള്ള അക്കങ്ങള് അമ്ലതയെയും മീതെയുള്ള അക്കങ്ങള് ക്ഷാരതയെയും സൂചിപ്പിക്കുന്നു. അതായത് ുഒ-ന്റെ മൂല്യം ചുരുങ്ങുന്തോറും ആസിഡിന്റെ ശക്തി കൂടുന്നു; അധികമാകുന്തോറും ചുരുങ്ങുകയും ചെയ്യുന്നു.
പല സന്ദർഭങ്ങളിലും ജലലായനികളിലെ H+ ന്റെയോ O- ന്റെയോ സാന്ദ്രണം താഴ്ന്ന അളവിൽ നിർത്തേണ്ടതായിവരും; ചിലപ്പോള് സ്ഥിരമായിത്തന്നെ നിർത്തേണ്ടതായുംവരും. അതിനു തക്കവച്ചം ചില പ്രത്യേക മിശ്രിതങ്ങള് അവയിലേക്കു ചേർക്കേണ്ടതായിട്ടുണ്ട്. ഈ മിശ്രിതങ്ങള്ക്ക് ബഫർ ലായനികള് (buffer solutions)എന്നു പറയുന്നു. സോഡിയം അസറ്റേറ്റ്-അസറ്റിക് ആസിഡ് മിശ്രിതം അത്തരത്തിലുള്ള ഒരു ബഫർ ലായനി ആണ്. ജന്തുക്കളുടെ ശരീരത്തിൽ രക്തം മുതലായ ദ്രവപദാർഥങ്ങളുടെ pH സ്ഥിരമായി നില്ക്കേണ്ടത് ഒരു ആവശ്യമാണ്. ശരീരത്തിനകത്തുതന്നെ അതിനുള്ള ഒരു ബഫർ-സംവിധാനം പ്രകൃതി കരുതിയിട്ടുണ്ട്. കൃഷിശാസ്ത്രം, ജീവശാസ്ത്രം, ചികിത്സാശാസ്ത്രം എന്നിങ്ങനെയുള്ള വിവിധരംഗങ്ങളിലും അനേകം വ്യവസായങ്ങളിലും pH-ന്റെ അറിവ് ചിലപ്പോള് അത്യാവശ്യവും മറ്റു ചിലപ്പോള് ആശാസ്യവുമായിരിക്കും.
ആസിഡുകളുടെയും ബേസുകളുടെയും pH കണ്ടുപിടിക്കുന്നതിനു പല മാർഗങ്ങളുണ്ട്. സൂചകങ്ങള് (indicators) ഉപയോഗിക്കുക എന്നതാണ് ഒരു മാർഗം. ആസിഡികങ്ങളും ബേസികങ്ങളുമായ ലായനികളുമായി സമ്പർക്കം പുലർത്തുമ്പോള് അവയുടെ ുഒ-ന് അനുസരിച്ച് നിറം മാറുന്നവയാണ് സൂചകങ്ങള്. നിറങ്ങളും pHകളും ബന്ധപ്പെടുത്തിക്കൊണ്ട് ചാർട്ടുകളുണ്ട്. അനേകം സൂചകങ്ങള് ഉപയോഗിച്ച് ഒരു ലായനിയുടെ pH ഒരുവിധം കൃത്യമായി കണ്ടുപിടിക്കുവാന് സാധിക്കും.
ബ്രാണ്സ്റ്റെഡ് സിദ്ധാന്തം. ആസിഡിന്റെയും ബേസിന്റെയും വ്യാഖ്യാനം ജല-സിദ്ധാന്തത്തിന്റെ അതായത്, അരീനിയസ്-ഓസ്വാള്ഡ് സിദ്ധാന്തത്തിന്റെ അടിസ്ഥാനത്തിൽ ഉണ്ടായത് വളരെ ആകർഷകമായിരുന്നു എങ്കിലും ചില പുതിയ പ്രശ്നങ്ങള് പരിഗണിക്കേണ്ട അവസരം പിന്നീടുണ്ടായി. ജലമല്ലാത്ത മറ്റു ചില ലായകങ്ങളും ആസിഡ്-ബേസ് ലായനികളുണ്ടാക്കുവാന് ഉപയോഗിക്കാവുന്നതാണ്. അവയെക്കുറിച്ചും പ്രത്യേകം പഠനം ആവശ്യമായിവന്നു. ഹൈഡ്രജനുള്ളതും ഇല്ലാത്തതുമായ ജലേതരലായകങ്ങളുണ്ട്. ദ്രവ-അമോണിയ മുതലായ ഹൈഡ്രജനുള്ള ലായകങ്ങള്ക്ക് ജലസിദ്ധാന്തം വ്യാപിപ്പിക്കുന്നതുകൊണ്ട് ദോഷമില്ല. ദ്രവ-അമോണിയയിൽ NH4+ എന്നത് ആസിഡ് അയോണായും NH2-എന്നത് ബേസ്-അയോണായും കരുതാം. ലായകതന്മാത്രയോട് ഒരു ഹൈഡ്രജന് അയോണ് ചേർന്ന് NH4+അയോണ് ഉണ്ടാവുന്നതായി പരിഗണിക്കുകയും ചെയ്യാം. എന്നാൽ ദ്രവ-സൽഫർ ഡൈ ഓക്സൈഡ് മുതലായ ലായകങ്ങളിൽ ഹൈഡ്രജന് ഇല്ലാത്തതുമൂലം ജലസിദ്ധാന്തം അപ്രസക്തമായിത്തീരുന്നു. ആയതുകൊണ്ട് ആസിഡിന് പുതിയ നിർവചനം വേണമെന്നായി. ലായകസ്വഭാവം അനുസരിച്ചുള്ള കാറ്റയോണ് (ധന-അയോണ്) ഉത്പാദിപ്പിക്കുന്ന രാസവസ്തുക്കളാണ് ആസിഡുകള്' എന്ന പുതിയ ആസിഡ്-നിർവചനമുണ്ടായത് അങ്ങനെയാണ്. പക്ഷേ, ഈ നിർവചനത്തിന് വലിയ അംഗീകാരം ലഭിച്ചില്ല. 1923-ൽ ജെ.എന്. ബ്രാണ്സ്റ്റൈഡ് എന്ന വൈജ്ഞാനികന് കുറേക്കൂടി വ്യാപകവും യുക്തിസഹവുമായ ഒരു നൂതന സിദ്ധാന്തം ആവിഷ്കരിച്ചതാണ് അതിനു കാരണം. ടി.എം. ലൗറി എന്ന ശാസ്ത്രജ്ഞനും സദൃശമായ ഒരു സിദ്ധാന്തം കൊണ്ടുവരികയുണ്ടായി. തന്മൂലം ഇതിനെ ബ്രാണ്സ്റ്റൈഡ്-ലൗറി സിദ്ധാന്തം എന്നും പറയാറുണ്ട്. അതനുസരിച്ച് പ്രോട്ടോണുകളുടെ പ്രഭവങ്ങള് (sources) ആണ് ആസിഡുകള്; പ്രോട്ടോണുകളെ സ്വീകരിക്കാന് കഴിവുള്ളവ ബേസുകളും. ജലസിദ്ധാന്തത്തെ അപേക്ഷിച്ച് ആസിഡിന്റെ നിർവചനത്തിന് ഇവിടെ അല്പം മാത്രമേ വ്യത്യാസമുള്ളൂ. എന്നാൽ ബേസിന്റെ അർഥവ്യാപ്തി വളരെ കൂടുകയും ചെയ്തു. അപ്പോള് ജലേതരലായകങ്ങളായ മെഥിൽ ആൽക്കഹോള്, ഫോർമിക് ആസിഡ്, ദ്രവ-അമോണിയ മുതലായവയെ ഈ പുതിയ സിദ്ധാന്തത്തിന്റെ വെളിച്ചത്തിൽ ശരിയായി വർഗീകരിക്കാമെന്നു വന്നു. ആസിഡ്-ബേസ്-ഉത്പ്രരണപ്രക്രിയകളെ (acid-base catalysis) കൂടുതൽ സമർഥമായി നിരൂപണം ചെയ്യുന്നതിന് ബ്രാണ്സ്റ്റെഡ്-ലൗറി സിദ്ധാന്തം സഹായകമായിത്തീർന്നു.
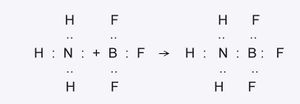
ലെവിസ് സിദ്ധാന്തം. ഉത്പ്രരണ പ്രക്രിയകളെ സംബന്ധിച്ച അവഗാഢമായ പഠനത്തിന്റെ ഫലമായി ആസിഡുകള്ക്കും ബേസുകള്ക്കും ഏറ്റവും പുതിയ ഒരു നിർവചനം നല്കാമെന്ന് 1938-ൽ ലെവിസ് സിദ്ധാന്തിച്ചു. ബേസിൽനിന്ന് ഒരു ഇലക്ട്രാണ്-ജോടി ആദാനം ചെയ്യുന്ന വസ്തുക്കളാണ് ആസിഡുകള് എന്നും തങ്ങളുടെ ഒരു ഇലക്ട്രാണ്-ജോടി പ്രദാനം ചെയ്യുന്ന വസ്തുക്കളാണ് ബേസുകള് എന്നും അദ്ദേഹം അവയ്ക്കു നിർവചനം നല്കി. ഇതനുസരിച്ച് പ്രോട്ടോണ് (പോലും) ഒരു ആസിഡ് ആണ്; എന്തുകൊണ്ടന്നാൽ അത് ഒരു ഇലക്ട്രാണ് സ്വീകരിക്കുന്നു. അലുമിനിയം ട്രക്ലോറൈഡ്, ബോറോണ് ട്രഫ്ളൂറൈഡ് എന്നിവയും ഇലക്ട്രാണ് സ്വീകരിക്കുന്നതുനിമിത്തം ആസിഡുകളാണ്. നേരെമറിച്ച് ജലം, OH- അയോണ് മുതലായവ ഇലക്ട്രാണ് പ്രദാനം ചെയ്യുന്നതുകൊണ്ട് ബേസുകളുമാണ്.
ഇവിടെ കാണിച്ചിരിക്കുന്ന സമവാക്യത്തിൽ അമോണിയ തന്റെ ഏകാന്ത-ഇലക്ട്രാണ് ജോടിയെ ബോറോണ് ട്രഫ്ളൂറൈഡിനു കൊടുത്തിട്ടാണ് പുതിയ യൗഗികമുണ്ടാകുന്നത്. ആകയാൽ അമോണിയ ബേസാണ്; ബോറോണ് ട്ര ഫ്ളൂറൈഡ് ആസിഡും. ലെവിസിന്റെ നവീനമായ ഈ സിദ്ധാന്തമനുസരിച്ച് ആസിഡിന് ഹൈഡ്രജന് അപരിഹാര്യമാണ് എന്ന ആശയം നിരർഥകമായി. ബ്രാണ്സ്റ്റൈഡ്-ലൗറി സിദ്ധാന്തത്തിനും ലെവിസ് സിദ്ധാന്തത്തിനും പലയിടത്തും ഐക്യമുള്ളതായികാണുന്നു. എല്ലാ ലായകവ്യൂഹങ്ങള്ക്കും (solvent systems)അവ പ്രോട്ടോണിക് ആയാലും അല്ലെങ്കിലും-ലെവിസ് സിദ്ധാന്തം സാധുവാണ്. ലായനികളില്ലാതെ ഖരവസ്തുക്കള്ക്കു തമ്മിലും ദ്രവവസ്തുക്കള്ക്കു തമ്മിലും നടക്കുന്ന രാസപ്രവർത്തനങ്ങളിലും ഇത് സാധുവായിത്തീരുന്നു. ലോഹനിഷ്കർഷണത്തിലും കളിമണ്പാത്രവ്യവസായങ്ങളിലും നടക്കുന്ന ഉച്ചതാപ-രാസപ്രവർത്തനങ്ങളെ സമർഥമായി വ്യാഖ്യാനിക്കുന്നതിനും ലെവിസ് സിദ്ധാന്തം സഹായകമാണ്.
ഉസനോവിച് സിദ്ധാന്തം. 1939-ൽ എം. ഉസനോവിച് ആസിഡിനും ബേസിനും മറ്റൊരു നിർവചനം നല്കുകയുണ്ടായി. അദ്ദേഹത്തിന്റെതന്നെ പോസിറ്റീവ്-നെഗറ്റീവ് സിദ്ധാന്തമാണ് ഇതിന് അടിസ്ഥാനം. ബേസുകളോടുചേർന്ന് ലവണങ്ങള് ലഭ്യമാക്കുന്നതും, ധന-അയോണുകള് വെടിയുന്നതും, ഋണ-അയോണുകളോടും സ്വതന്ത്ര-ഇലക്ട്രാണുകളോടും സ്വയം ചേരുന്നതുമായ വസ്തുക്കള് ഈ സിദ്ധാന്തമനുസരിച്ച് ആസിഡുകളാണ്. ഋണ-അയോണുകളെ അല്ലെങ്കിൽ ഇലക്ട്രാണുകളെ വെടിയുന്നതും ധന-അയോണുകളോടു സ്വയം ചേരുന്നതും ആയ വസ്തുക്കള് ബേസുകളുമാണ്.
എന്നീ പ്രവർത്തനങ്ങളിൽ ആദ്യത്തേതിൽ SO3 ഒരു ആസിഡ് ആണ്, എന്തെന്നാൽ അത് ഒരു ഋണ-അയോണ് (O--) സ്വീകരിച്ച് SO4- - ആയിത്തീരുന്നു. രണ്ടാമത്തേതിൽ Cl ഒരു ആസിഡ് ആണ്. എന്തെന്നാൽ അത് ഇലക്ട്രാണ് സ്വീകരിച്ച് Cl- ആയിത്തീരുന്നു. യഥാർഥത്തിൽ പഴയ രീതിയനുസരിച്ച് രണ്ടാമത്തേത് ഒരു ഓക്സിഡേഷന്-റിഡക്ഷന് പ്രവർത്തനമാണ്. ഉസനോവിച്ചിന്റെ പദ്ധതിയിൽ ഓക്സിഡേഷന്-റിഡക്ഷന്കൂടി ഉള്പ്പെടുന്നുണ്ട് എന്നത് അദ്ദേഹമുന്നയിച്ച സിദ്ധാന്തത്തിന്റെ വ്യാപ്തിയെ പ്രകടിപ്പിക്കുന്നു. ഇങ്ങനെയാണെങ്കിലും ഈ സിദ്ധാന്തത്തിന് വേണ്ടത്ര അംഗീകാരം ലഭിച്ചില്ല. അതിന്റെ മുഖ്യകാരണം വ്യാപ്തി കുറെ കൂടിപ്പോയി എന്നതുതന്നെ. ഇപ്രകാരം ആസിഡ്-ബേസ് സിദ്ധാന്തങ്ങള് പലതുണ്ടായിട്ടുണ്ട് എന്നിരിക്കിലും സാധാരണസാഹചര്യങ്ങളിൽ ബ്രാണ്സ്റ്റെഡ്-ലൗറി സിദ്ധാന്തത്തിനാണ് കൂടുതൽ പ്രസക്തിയും പ്രചാരവും കാണുന്നത്.
ആകലനം. ആസിഡുകളും ബേസുകളും ക്രിയാശീലയൗഗികങ്ങളാണ്. കൃത്യം അളവുകളിൽ ആസിഡും ബേസും ചേർത്താൽ പ്രതിപ്രവർത്തനം നടന്ന് ലവണവും ജലവും ഉണ്ടാവുന്നു. രണ്ടും പരസ്പരം ഉദാസീനീകരിക്കപ്പെടുകയും ചെയ്യുന്നു. ഉദാ.
ഈ തത്ത്വമുപയോഗിച്ചാണ് ആസിഡിന്റെയും ബേസിന്റെയും പരിമാണം ആകലനം (estimation) ചെയ്യപ്പെടുന്നത്. ഒരു ലായനിയിലുള്ള ആസിഡ് അല്ലെങ്കിൽ ബേസ് എത്രയാണെന്നു കണ്ടുപിടിക്കുന്നതിന് ശാസ്ത്രജ്ഞന്മാർ സ്വീകരിക്കുന്ന മാർഗമാണ് ടൈറ്റ്രഷന് (titration-അനുമാപനം). പരീക്ഷണശാലകളിൽ ആസിഡിന്റെയും ബേസിന്റെയും (ആൽക്കലി) മാനകലായനികള് (standard solutions) ഉണ്ടായിരിക്കും. സമുചിതമായ സൂചകങ്ങള് ഉപയോഗിച്ചുവേണം അനുമാപനം നടത്തുവാന്. ഒട്ടുവളരെ വ്യവസായശാലകളിൽ ആസിഡ്-ബേസ് അനുമാപനങ്ങള് അപരിഹാര്യങ്ങളാണ്. നോ: കെമിക്കൽ അനാലിസിസ്; നൈട്രിക് ആസിഡ്; സൽഫൂരിക് ആസിഡ്; ഹൈഡ്രാക്ളോറിക് ആസിഡ്.