This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
അമോണിയ
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
അമോണിയ
Ammonia
നൈട്രജനും ഹൈഡ്രജനും ചേര്ന്ന ഒരു യൗഗികം. ഫോര്മുല, NH3. അന്തരീക്ഷം, മഴവെള്ളം, വളക്കൂറുള്ള മണ്ണ്, കടല്വെള്ളം, സസ്യങ്ങളുടെയും ജന്തുക്കളുടെയും വിസര്ജ്യങ്ങള്, അഗ്നിപര്വതജന്യമായ ലാവയുടെ ബാഷ്പങ്ങള്, ഗര്ത്തവാതകങ്ങള് - അങ്ങനെ പല സ്ഥാനങ്ങളിലും അല്പാല്പമായി പ്രകൃത്യാ കാണപ്പെടുന്ന ഈ പദാര്ഥം സാധാരണ താപനിലയില് നിറമില്ലാത്ത ഒരു വാതകം ആണ്. അസുഖകരമായ ഒരു സവിശേഷഗന്ധം ഉള്ളതുകൊണ്ട് ഇതിനെ വേര്തിരിച്ചറിയുവാന് പ്രയാസമില്ല.
പ്രാധാന്യം. ആധുനികലോകത്തില് അത്യന്തം പ്രായോഗികപ്രാധാന്യമുള്ള ഒരു രാസവസ്തുവാണ് അമോണിയ. നൈട്രിക് അമ്ലം ഉണ്ടാക്കുവാനും അമോണിയം ക്ലോറൈഡ് മുതലായ ഒട്ടുവളരെ അമോണിയം ലവണങ്ങള് ഉണ്ടാക്കുവാനും യൂറിയ, പ്ലാസ്റ്റിക്കുകള്, ചായങ്ങള് എന്നിവയടക്കം പരശ്ശതം ഓര്ഗാനിക് യൌഗികങ്ങള് ഉണ്ടാക്കുവാനും അമോണിയ ആവശ്യമാണ്. ഒരു ശീതീകാരകദ്രവ്യം (refrigerent) എന്ന നിലയില് നിര്ജല-അമോണിയയുടെ പ്രയോജനം പ്രസിദ്ധമാണ്. അമോണിയയുടെ നേരിയ ജലലായനി ഗൃഹങ്ങളില് ഒരു ശുചീകാരകവസ്തു (cleansing agent) ആയി ഉപയോഗിക്കപ്പെടുന്നു. പരീക്ഷണശാലകളില് ഇതു പ്രധാനമായ ഒരു അഭികാരകമാണ്. അമോണിയം ലവണങ്ങള് രാസവളനിര്മാണത്തില് അത്യന്തം പ്രാധാന്യം വഹിക്കുന്നു. പ്രയോജനത്തില് വൈവിധ്യവും വൈപുല്യവും ഉള്ളതുകൊണ്ട് അമോണിയയുടെ ഉത്പാദനം വര്ധിപ്പിക്കുന്നതിന് എല്ലാ രാജ്യങ്ങളിലും തീവ്രയത്നം നടക്കുന്നുണ്ട്. ഇന്ന് സാര്വത്രികമായി പ്രചരിച്ചുവന്നിട്ടുള്ള അമോണിയാനിര്മാണരീതിക്കു 'ഹേബര് പദ്ധതി' എന്നാണു പേര്.
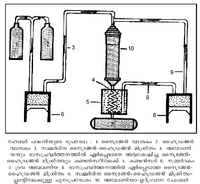
ഹേബര് പദ്ധതി. ശാസ്ത്രസാങ്കേതികവികാസചരിത്രത്തിന്റെ ഒരു നിര്ണായകഘട്ടത്തിലാണ് പ്രസിദ്ധ ജര്മന്-ജൂതശാസ്ത്രജ്ഞനായ ഫ്രിട്സ് ഹേബര് (Fritz Haber) 1904-ല് തന്റെ പേരില് പിന്നീടു പ്രശസ്തമായിത്തീര്ന്ന ഈ പദ്ധതി ആദ്യമായി അവതരിപ്പിച്ചത്. അന്തരീക്ഷത്തില് സ്വതന്ത്രനിലയില് വര്ത്തിക്കുന്ന നൈട്രജനെ ബന്ധിപ്പിക്കുക (fix) എന്നതാണ് ഇതിന്റെ ലക്ഷ്യം. നൈട്രജന് സ്വതവേ ക്രിയാശീലം കുറഞ്ഞ ഒരു മൂലകമാണെങ്കിലും മറ്റു ചില മൂലകങ്ങളോടു ചേര്ന്നാല് സക്രിയ യൌഗികങ്ങള് ലഭ്യമാക്കുന്നതാണ്. ആ യൗഗികങ്ങളില് പലതും രാസവളങ്ങളാണ്. അണുബോംബ് ഒഴിച്ചുള്ള മിക്ക സ്ഫോടകവസ്തുക്കളും നൈട്രജന് യൗഗികങ്ങളാണ്. ഇപ്രകാരം സ്ഫോടകവസ്തുക്കളുടെയും രാസവളങ്ങളുടെയും നിര്മാണത്തില് അത്യന്താപേക്ഷിതമായി കരുതപ്പെടുന്ന നൈട്രജന് യൗഗികങ്ങള് ആദ്യകാലത്തു സുലഭമായി ലഭിച്ചിരുന്നത് തെക്കേ അമേരിക്കയിലെ ചിലിയില് നിന്നായിരുന്നു-സോഡിയം നൈട്രേറ്റ് രൂപത്തില്. എന്നാല് 1914-ല് ജര്മനി എതിര്ശക്തികളുമായി യുദ്ധത്തിലേര്പ്പെട്ടപ്പോള് ചിലിയില്നിന്നു നൈട്രേറ്റിന്റെ ഇറക്കുമതി സ്തംഭിക്കുമെന്ന നിലവന്നു. സ്ഫോടകവസ്തുക്കളില്ലാതെ യുദ്ധം സാധ്യമല്ല. അത്തരം വസ്തുക്കളുണ്ടാക്കുവാന് നൈട്രജന് യൗഗികങ്ങള് ഇല്ലാതെയും തരമില്ല. 1904-ല് ഹേബര് തന്റെ അമോണിയാനിര്മാണപദ്ധതി ആവിഷ്കരിച്ചില്ലായിരുന്നു എങ്കില് ജര്മനി യുദ്ധത്തിലേര്പ്പെടാന് ശേഷിയില്ലാതെ പിന്വാങ്ങുമായിരുന്നു എന്നു സൂക്ഷ്മനിരീക്ഷകന്മാര് അഭിപ്രായപ്പെടുന്നു. ഹേബര് പദ്ധതിക്കു പ്രചാരവും പ്രശസ്തിയും ലഭിച്ചത് അന്നു മുതല്ക്കാണ്. ഇന്നു സ്ഫോടകവസ്തുനിര്മാണത്തെക്കാള് രാസവളനിര്മാണത്തിനാണ് നൈട്രജന് യൗഗികങ്ങള് കൂടുതലായി ഉപയോഗിക്കപ്പെടുന്നത്. ശാസ്ത്രജ്ഞന്മാരുടെയും സാങ്കേതികവിദഗ്ധരുടെയും മുന്പില് ഒരു വലിയ പ്രശ്നമായിത്തീരുമായിരുന്ന 'നൈട്രജന് ബന്ധനം' (nitrogen fixation) 1904-ല്ത്തന്നെ സാധിച്ച ഹേബര് ഈ കണ്ടുപിടിത്തത്തിന് 1918-ല് നോബല് സമ്മാനത്തിന് അര്ഹനായി.
നൈട്രജനും ഹൈഡ്രജനും 1 : 3 എന്ന അനുപാതത്തില് മിശ്രണം ചെയ്ത് ഉയര്ന്ന മര്ദത്തിനു വിധേയമാക്കി, അനുകൂലമായ താപനിലയില് വച്ചിരിക്കുന്ന ഉത്പ്രേരകത്തിന് മീതെ പ്രവഹിപ്പിക്കുമ്പോള് രണ്ടു വാതകങ്ങളും രാസപരമായി യോജിച്ച് അമോണിയ ലഭ്യമാകുന്നു.
സമവാക്യം പരിശോധിച്ചാല് ഉയര്ന്ന മര്ദവും താഴ്ന്ന താപവും കൂടുതല് അമോണിയ ലഭിക്കുവാന് സാഹയകങ്ങളാണെന്നു മനസ്സിലാക്കാം. അന്തരീക്ഷമര്ദത്തിന്റെ 1000 ഇരട്ടി മര്ദം വരെ വാതകമിശ്രിതത്തില് പ്രയോഗിക്കുന്നു. അനുകൂലതമമായ താപനില 450-500°C ആണെന്നും അനുഭവംകൊണ്ടു മനസ്സിലായിട്ടുണ്ട്. സൂക്ഷ്മചൂര്ണിതമായ ഇരുമ്പ് ആണ് ഉത്പ്രേരകമായി സാധാരണ ഉപയോഗിച്ചുവരുന്നത്. ഉത്പ്രേരകത്തെ ഉത്പ്രേരണം ചെയ്യുന്ന പ്രൊമോട്ടര് (promoter) ആയി മോളിബ്ഡിനം ഉപയോഗിക്കുന്നത് പദ്ധതിയുടെ വിജയത്തിനു സഹായകമാണ്. ഉത്പ്രേരകത്തിന്റെ പ്രവര്ത്തനം സുഗമമാക്കുന്നതിനുകൂടിയാണ് താപനില 500°C വരെ ഉയര്ത്തുന്നത്.
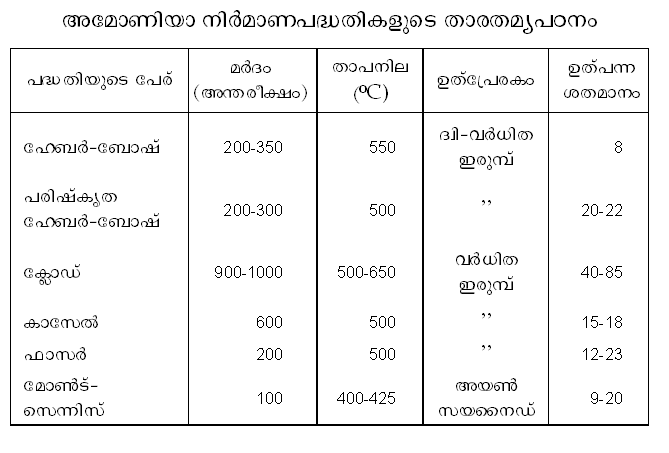
അടുത്തകാലത്തായി പുതിയ പേരുകളില് ചില പദ്ധതികള് രൂപംകൊണ്ടിട്ടുണ്ട്. ഹേബര്-ബോഷ് പദ്ധതി, പരിഷ്കൃത ഹേബര്-ബോഷ് പദ്ധതി, ക്ലോഡ് (Claude) പദ്ധതി, കാസേല് പദ്ധതി, ഫാസര് പദ്ധതി, മോണ്ട് സെന്നിസ് പദ്ധതി എന്നിവ ഉദാഹരണങ്ങള്. ഹേബര് പദ്ധതിയുടെ മൌലികതത്ത്വങ്ങള് അതേപടി സ്വീകരിച്ചുകൊണ്ടും യന്ത്രോപകരണങ്ങളുടെ സംവിധാനം, ഉത്പ്രേരകത്തിന്റെ ഘടന (composition), മര്ദം, താപനില എന്നിവയില് പരിഷ്കാരങ്ങള് വരുത്തിയും ആണ് ഈ പുതിയ രീതികളെ അതാതു ശാസ്ത്രജ്ഞന്മാര് ആവിഷ്കരിച്ചിട്ടുള്ളത്. സാഹചര്യങ്ങള്ക്കനുസരിച്ച് ഓരോ രാജ്യത്ത് ഓരോ രീതി സ്വീകരിച്ചിരിക്കുന്നതായിക്കാണാം. ഭക്ഷ്യപദാര്ഥങ്ങളുടെ ഉത്പാദനം വര്ധിപ്പിക്കുന്നതില് രാസവളങ്ങള്ക്ക് അതിപ്രധാനമായ പങ്ക് ഉള്ളതുമൂലം അമോണിയാനിര്മാണത്തില് ഓരോ രാഷ്ട്രവും അന്യാശ്രയം ഒഴിവാക്കുന്നതിനു മത്സരിച്ചു പ്രവര്ത്തിക്കുന്നുണ്ട്. മുകളില് സൂചിപ്പിച്ച പദ്ധതികളെ താരതമ്യപ്പെടുത്തുവാന് ഉപകരിക്കുന്ന പട്ടിക കൊടുത്തിട്ടുണ്ട്.
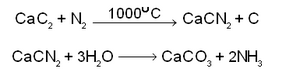
 സയനമൈഡ് പദ്ധതി (Cyanamide process). അമോണിയ വന്തോതില് ഉത്പാദിപ്പിക്കുന്നതിന് അംഗീകരിക്കപ്പെട്ടിട്ടുള്ള മറ്റൊരു മാര്ഗമാണ് സയനമൈഡ് പദ്ധതി. കാല്സിയം കാര്ബൈഡ്, നൈട്രജന് എന്നിവയെ 1000°C-ല് പരസ്പരം പ്രവര്ത്തിപ്പിച്ചു കിട്ടുന്ന കാല്സിയം സയനമൈഡില് നീരാവിയുടെ അഭിക്രിയവഴി അമോണിയ ലഭ്യമാക്കുന്നു. ഇതാണ് ഈ പദ്ധതിയുടെ തത്ത്വം:
സയനമൈഡ് പദ്ധതി (Cyanamide process). അമോണിയ വന്തോതില് ഉത്പാദിപ്പിക്കുന്നതിന് അംഗീകരിക്കപ്പെട്ടിട്ടുള്ള മറ്റൊരു മാര്ഗമാണ് സയനമൈഡ് പദ്ധതി. കാല്സിയം കാര്ബൈഡ്, നൈട്രജന് എന്നിവയെ 1000°C-ല് പരസ്പരം പ്രവര്ത്തിപ്പിച്ചു കിട്ടുന്ന കാല്സിയം സയനമൈഡില് നീരാവിയുടെ അഭിക്രിയവഴി അമോണിയ ലഭ്യമാക്കുന്നു. ഇതാണ് ഈ പദ്ധതിയുടെ തത്ത്വം:
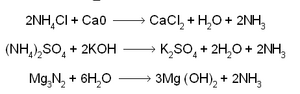
കല്ക്കരിയുടെ ഭഞ്ജനസ്വേദനം (destructive distillation) നടത്തുമ്പോള് ഉപോത്പന്നമായും ധാരാളം അമോണിയ ലഭിക്കുന്നു. ഇങ്ങനെയും അമോണിയ വന്തോതില് ലഭ്യമാക്കി വരുന്നുണ്ട്. അമോണിയം ലവണങ്ങളെ നിര്ജലാവസ്ഥയിലോ ലായനിരൂപത്തിലോ എടുത്ത് പ്രബല ബേസുകള് ചേര്ത്തു തപിപ്പിച്ചാണ് പരീക്ഷണശാലയില് അമോണിയ ലഭ്യമാക്കുന്നത്. വാസ്തവത്തില് 1774-ല്ത്തന്നെ ജോസഫ് പ്രീസ്റ്റ്ലി ഈ മാര്ഗത്തിലൂടെ അമോണിയാനിര്മാണം സാധിച്ചിട്ടുണ്ട്. അദ്ദേഹം അമോണിയയ്ക്ക് അന്നു കൊടുത്ത പേര് 'ആല്ക്കലൈന് എയര്' എന്നായിരുന്നു. ലോഹനൈട്രൈഡുകളെ ജലീയവിശ്ലേഷണം ചെയ്യിച്ചും അമോണിയ ഉണ്ടാക്കാം.
ചരിത്രപരമായി നോക്കിയാല് പ്രാചീന കാലത്തു തന്നെ അമോണിയ ഉണ്ടാക്കുന്നതിനുള്ള പരിശ്രമം നടന്നിട്ടുണ്ടെന്നു കാണാം. ബി.സി. 4-ാം ശ.-ത്തില് ഈജിപ്തില് അമ്മണ് ക്ഷേത്രത്തിലെ പൂജാരികള് നൈട്രജന് അടങ്ങിയ ഓര്ഗാനിക് വസ്തുക്കളില്നിന്ന് ഈ വാതകം ഉത്പാദിപ്പിച്ചിരുന്നു എന്നു പറയപ്പെടുന്നു. അമോണിയ എന്ന് ഈ വാതകവസ്തുവിനു പേര് ലഭിച്ചതിന്റെ നിദാനം ഇതാണ് എന്ന് ഒരു അഭിപ്രായമുണ്ട്. 1785-ല് സി.എല്. ബര്ഥോലറ്റ് എന്ന ശാസ്ത്രജ്ഞനാണ് അമോണിയയുടെ ശരിയായ സംരചന (composition) കണ്ടുപിടിച്ചത്.
സവിശേഷതകള്. ഉത്പ്രേരകസാന്നിധ്യത്തില് അമോണിയ താപീയവിഘടനത്തിനു പാത്രമാകുന്നതാണ്. നിശ്ശബ്ദവിദ്യുദ്വിസര്ജനം (silent electric discharge) കൊണ്ടും അമോണിയയെ വിഘടിപ്പിക്കാം. വിഘടിച്ചാല് കിട്ടുന്നത് നൈട്രജന്റെയും ഹൈഡ്രജന്റെയും ഒരു മിശ്രിതമാണ്. ഈ മിശ്രിതത്തില് വ്യാപ്തപരമായി 75 ശ.മാ. ഹൈഡ്രജനും ബാക്കി നൈട്രജനും ആയിരിക്കും. ഹൈഡ്രജന് ഉപയോഗിക്കേണ്ടിവരുന്ന സാധാരണ സന്ദര്ഭങ്ങളില് ഈ മിശ്രിതം തന്നെ ഉപയോഗിക്കാവുന്നതാണ്. ആകയാല് അമോണിയയെ ഹൈഡ്രജന്റെ ഒരു വാഹകമായി പ്രയോജനപ്പെടുത്താറുണ്ട്.
ഉച്ചതാപനിലയില് എത്തിച്ചിട്ടുള്ള പ്ലാറ്റിനത്തോട് വായുവിന്റെ സാന്നിധ്യത്തില് അമോണിയയ്ക്ക് സമ്പര്ക്കം ഉണ്ടാകുമ്പോള് നൈട്രിക് ഓക്സൈഡ് ലഭിക്കുന്നു. നൈട്രിക് അമ്ളം ഉത്പാദിപ്പിക്കുന്ന 'ഓസ്വാള്ഡ് പദ്ധതി'യുടെ പ്രാഥമികഘട്ടം ഇപ്രകാരം നൈട്രിക് ഓക്സൈഡിന്റെ നിര്മാണമാണ്.
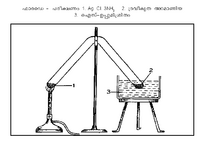
മര്ദം കൂട്ടിയും താപനില കുറച്ചും അമോണിയയെ ദ്രവീകരിക്കാം. മൈക്കല് ഫാരഡെ എന്ന ശാസ്ത്രജ്ഞനാണ് 1823-ല് ആദ്യമായി ദ്രവ-അമോണിയ നിര്മിച്ചത്. ചിത്രത്തില് കാണുന്നതുപോലെ സീലു ചെയ്ത കുഴലിന്റെ ഒരറ്റത്ത് AgCl. 3NH3 എടുത്തു ചൂടാക്കി മറ്റേ അറ്റം ഐസ്-ഉപ്പുമിശ്രിതത്തില് വച്ച് തണുപ്പിച്ചുകൊണ്ടിരുന്നു. അമോണിയയ്ക്ക് എളുപ്പത്തില് സംഘനനം സംഭവിക്കുവാന്വേണ്ടിയായിരുന്നു അത്. വാതകങ്ങളുടെ ദ്രവീകരണപ്രക്രിയാചരിത്രത്തില് ഈ പരീക്ഷണത്തിനു ഗണ്യമായ പ്രാധാന്യമുണ്ട്.
ദ്രവ-അമോണിയയ്ക്ക് ഭൗതികമായും രാസപരമായും പല സവിശേഷഗുണധര്മങ്ങളും കാണുന്നു. അക്കാരണത്താല് ചില പ്രത്യേക രാസപ്രവര്ത്തനങ്ങളില് ഇതു ലായകമായി ഉപയോഗിക്കപ്പെടുന്നുണ്ട്. എല്ലാ ആല്ക്കലി ലോഹങ്ങളും കാല്സിയം, ബേരിയം, സ്ട്രോണ്ഷ്യം എന്നീ ലോഹങ്ങളും ദ്രവ-അമോണിയയില് ലയിക്കുകയും നീലലായനികള് ലഭ്യമാക്കുകയും ചെയ്യുന്നു. [ദ്രവ-അമോണിയയ്ക്ക് ലായകം എന്ന നിലയില് ജലത്തിനോടു സാദൃശ്യമുണ്ട്. ജലം ജലീയവിശ്ലേഷണം സാധിപ്പിക്കുന്നതുപോലെ ദ്രവ-അമോണിയ അമോണീയവിശ്ലേഷണം (ammonolysis) സാധിപ്പിക്കുന്നു]. ഈ ലായനികളില് ഉച്ചവേഗത്തില് ചലിക്കുന്ന ഇലക്ട്രോണുകള് ഉണ്ടായിരിക്കും. താപഗതികപരമായി പ്രസ്തുത ലായനികള് അസ്ഥിരമായിരിക്കും. അവ സാവധാനത്തില് വിവര്ണമായിത്തീരുകയും ഹൈഡ്രജനെ മോചിപ്പിക്കുകയും മിക്കവാറും ലോഹങ്ങളുമായി അമൈഡുകള് ലഭ്യമാക്കുകയും ചെയ്യും. ഉത്പ്രേരകസാന്നിധ്യത്തില് ഈ പ്രക്രിയ ത്വരിതപ്പെടുന്നതായിക്കാണാം. അയോണികപദാര്ഥങ്ങളുടെ വിഷയത്തില് ദ്രവ-അമോണിയ ജലത്തെ അപേക്ഷിച്ച് മെച്ചം കുറഞ്ഞ ഒരു ലായകമാണ്. എങ്കിലും സഹസംയോജക പദാര്ഥങ്ങള്ക്ക് അതു താരതമ്യേന കൂടുതല് മെച്ചപ്പെട്ട ലായകമാണ്. ദ്രവ അമോണിയയെ വീണ്ടും തണുപ്പിച്ച് (-77.7°C) ഖരമാക്കാം.
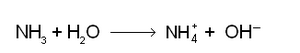
അമോണിയ ജലത്തില് അതിമാത്രം വിലേയമാണ്. സാധാരണ മര്ദത്തില് 20°C-ല് ഒരു വ്യാപ്തം ജലത്തില് 700 വ്യാപ്തം വീതം അമോണിയാവാതകം ലയിച്ചുചേരുന്നു. ഈ ജലലായനിയെ അമോണിയം ഹൈഡ്രോക്സൈഡ് എന്നു പറയുന്നു. പക്ഷേ, ലായനിയില് അമോണിയം ഹൈഡ്രോക്സൈഡ് എന്ന പദാര്ഥം താരതമ്യേന വിരളമാണ്. തന്മൂലം ആ പദാര്ഥത്തെ ശുദ്ധരൂപത്തില് പൃഥക്കരിച്ചെടുക്കുവാന് സാധിച്ചിട്ടില്ല. അമോണിയയും ജലവും തമ്മിലുള്ള പ്രവര്ത്തനത്തെ
എന്നു രേഖപ്പെടുത്താം. NH+4 എന്നത് അമോണിയം അയോണ് (ammonium ion) ആണ്. ഇത് ആല്ക്കലി-ലോഹ-അയോണുകള് പോലെ ഒരു ഏകസംയാജക റാഡിക്കല് (monovalent radical) ആകുന്നു. സ്വതന്ത്ര റാഡിക്കല് ഉത്പാദിപ്പിക്കുവാന് പരിശ്രമങ്ങള് നടത്തിയിട്ടുണ്ടെങ്കിലും പൂര്ണമായും വിജയിച്ചിട്ടില്ല. അമോണിയയുടെ ജലീയലായനി ചുവന്ന ലിറ്റ്മസ് പേപ്പറിനെ നീലയാക്കുന്നു. അമ്ളം ഉപയോഗിച്ച് ഈ ലായനിയെ ഉദാസീനീകരിക്കാം. ഉദാസീനീകരിച്ചു കിട്ടുന്ന ലായനി ബാഷ്പനം ചെയ്താണ് അമോണിയം ലവണങ്ങള് ലഭ്യമാകുന്നത്.
ശുദ്ധ-ഓക്സിജനില് അമോണിയ മഞ്ഞ ജ്വാലയോടു കൂടി കത്തുകയും നൈട്രജനും ജലവും ഉത്പാദിപ്പിക്കുകയും ചെയ്യുന്നു. ഉച്ചമര്ദത്തില് അമോണിയ-ഓക്സിജന് മിശ്രിതം ഒരു സ്ഫോടക വസ്തുവാണ്. അമോണിയയെ ജലീയലായനിയില് ഹൈഡ്രജന് പെര്ഓക്സൈഡ്, ക്രോമിക് അമ്ലം, പൊട്ടാസിയം പെര്മാന്ഗനേറ്റ് മുതലായ പ്രബല-ഓക്സിഡന്റുകളുപയോഗിച്ച് ഓക്സീകരിക്കാം. ക്ലോറിനും ബ്രോമിനും അമോണിയയുമായി തീവ്രതയോടുകൂടി പ്രതിപ്രവര്ത്തിക്കുന്നു.
3Cl2 + 2NH3 → N2 + 6HCl.
തപ്തമായ ചില ലോഹങ്ങളും (ഉദാ. മഗ്നീഷ്യം) ലോഹ-ഓക്സൈഡുകളും അമോണിയയെ വിഘടിപ്പിക്കുകയും അമോണിയയിലെ നൈട്രജന് ലോഹത്തോടു യോജിച്ച് നൈട്രൈഡ് ലഭ്യമാക്കുകയും ചെയ്യുന്നു. ആല്ക്കലി ലോഹങ്ങള്, ആല്ക്കലൈന് എര്ത്ത് ലോഹങ്ങള് എന്നിവ അമോണിയയിലെ ഒരു ഹൈഡ്രജന് അണുവിനെ ആദേശിച്ച് അമൈഡുകള് (amides) ഉണ്ടാക്കുന്നു. ഉദാ. സോഡിയം അമൈഡ്.
അമോണിയയ്ക്ക് മറ്റു പദാര്ഥങ്ങളോട് അതേപടി യോജിച്ച് അമോണിയേറ്റുകള് (അഥവാ അമ്മീനുകള്) ഉണ്ടാകുന്ന പ്രവണത കാണുന്നുണ്ട്. ഉദാ. ട്രൈ അമ്മീന് സില്വര് ക്ളോറൈഡ്.
AgCl + 3NH3 → AgCl.3NH3
അമോണിയ അമ്ലങ്ങളുമായി തീവ്രതയോടെ യോജിക്കുകയും ലവണങ്ങള് ഉണ്ടാകുകയും ചെയ്യുന്നു. ഈ ലവണങ്ങളില് അമോണിയം (NH4+ ) അയോണ് ഉണ്ടായിരിക്കും.
അമോണിയം ലവണങ്ങള്. അമോണിയ വിവിധ അമ്ലങ്ങളുമായി പ്രതിവര്ത്തിച്ചു അമോണിയം ലവണങ്ങള് ലഭ്യമാകുന്നു. സാമാന്യമായി
NH3+HX→NH4X
എന്ന സമവാക്യംകൊണ്ട് ഈ പ്രതിപ്രവര്ത്തനം പ്രതിനിധാനം ചെയ്യാം. അമോണിയം ക്ളോറൈഡ്, അമോണിയം നൈട്രേറ്റ്, അമോണിയം സള്ഫേറ്റ്, അമോണിയം കാര്ബണേറ്റ്, അമോണിയം തയോസയനേറ്റ് എന്നിവ അമോണിയം ലവണങ്ങള്ക്കുള്ള ചില ഉദാഹരണങ്ങളാണ്.
ലവണങ്ങളുടെ സ്ഥിരത അമ്ലങ്ങളുടെ സ്വഭാവമനുസരിച്ചാണ്. ദുര്ബലാമ്ലങ്ങളുടെ ലവണങ്ങള് താരതമ്യേന പ്രബലാമ്ലങ്ങളുടെ ലവണങ്ങളെക്കാള് താഴ്ന്ന താപനിലകളില് അമോണിയയും അമ്ളവുമായി വിയോജിക്കുന്നു. ഉദാഹരണമായി അമോണിയം ക്ലോറൈഡിന് 320°C-ല് വിഘടനം സംഭവിക്കുമ്പോള് അമോണിയം സല്ഫൈഡിന് 320°C-ല് വിഘടനം സംഭവിക്കുന്നു.
അമോണിയം ലവണങ്ങളെ അമോണിയയും അമ്ലവും യോഗാത്മകമായി ചേര്ന്നുണ്ടാകുന്ന യൗഗികങ്ങളായി പരിഗണിക്കാം. ഇക്കാരണത്താല് അവയുടെ ഫോര്മുല ചിലപ്പോള് അല്പം വ്യത്യസ്തമായ രീതിയില് [H(NH3)]X എന്നിങ്ങനെ എഴുതാറുണ്ട്. വളരെ താഴ്ന്ന താപനിലകളില് അമോണിയം ലവണങ്ങളിലേക്കു നിര്ജല-അമോണിയ (anhydrous ammonia) ചേര്ത്താല് അനേകം അമോണിയാതന്മാത്രകളടങ്ങുന്ന കോംപ്ലെക്സ് ലവണങ്ങള് ഉണ്ടാവുന്നു. ഉദാഹരണമായി അമോണിയം ക്ലോറൈഡ്, 3 അമോണിയാതന്മാത്രകളുമായിച്ചേര്ന്ന് ഒരു ടെട്രാ യൗഗികം ലഭ്യമാക്കുന്നു.
[H(NH3)]Cl + 3NH3 →[H(NH3)4]Cl
ഇത്തരം സങ്കീര്ണ ലവണങ്ങള് ചൂടാക്കുമ്പോള് അവ അമോണിയ ഉപേക്ഷിക്കുന്നു. പ്രായേണ അവയെല്ലാംതന്നെ 0°C-നു മേല് അസ്ഥിരങ്ങളാണ്.
അതാത് അമ്ലങ്ങളുടെ ജലലായനികളില് അമോണിയാവാതകം കടത്തിവിട്ടും അമ്ളങ്ങളെ അമോണിയാലായനികളുമായി മിശ്രണം ചെയ്തും അമ്ലങ്ങളെ അമോണിയം കാര്ബണേറ്റ് ലായനിയുമായി പ്രവര്ത്തിപ്പിച്ചും അമോണിയം ലവണങ്ങള് ഉണ്ടാക്കാം. ജലലേയത തുടങ്ങിയ അനേകം ഗുണധര്മങ്ങളില് അമോണിയം ലവണങ്ങള്ക്ക് ആല്ക്കലി-ലോഹ ലവണങ്ങളോടു സാദൃശ്യമുണ്ട്. പക്ഷേ, ചൂടാക്കുമ്പോള് ബാഷ്പമാവുക എന്നതും പ്രബല-ബേസുകളുമായി പ്രതിപ്രവര്ത്തിക്കുമ്പോള് അമോണിയയെ മോചിപ്പിക്കുക എന്നതും അമോണിയം ലവണങ്ങളുടെ രണ്ടു പ്രത്യേകതകളാണ്.
അമോണിയം ക്ലോറൈഡിന് സാല് അമോണിയാക് (sal ammoniac) എന്ന് ഒരു പേരുകൂടിയുണ്ട്. ഇരുമ്പു ഗാല്വനൈസ് (galvanize) ചെയ്യുവാനും വസ്ത്രങ്ങളില് ചായമിടുവാനും, ശുഷ്ക-സെല് ബാറ്ററികള് ഉണ്ടാക്കുവാനും ഈ ലവണം ഉപയോഗിക്കുന്നു. ലോഹപ്പാത്രങ്ങള് ഈയം പൂശുന്നതിനു മുന്പ് ലോഹപ്രതലം വൃത്തിയാക്കുവാന് ഇതു (നവസാരം എന്ന പേരില്) ഉപയോഗിക്കാറുണ്ട്. അമോണിയം സള്ഫേറ്റ് മുഖ്യമായും വളമായി പ്രയോജനപ്പെടുന്നു. ചായം ഇടുന്ന പ്രക്രിയയില് സംരക്ഷണകാരിയായി അമോണിയം തയോസയനേറ്റ് ഉപയുക്തമാകുന്നു. ഇമള്സീകാരകമായും അപമാര്ജകമായും മറ്റും അമോണിയം സ്റ്റിയറേറ്റ് ഉപയോഗിക്കപ്പെടുന്നു. അമോണിയാവാതകത്തിനും അമോണിയം ലവണങ്ങള്ക്കും ശരീരക്രിയാത്മകമായ ശേഷിയുണ്ട്. ആകയാല് അമോണിയയുടെ ഗാഢവും നേര്ത്തതുമായ ലായനികള്, അമോണിയം ബൈ കാര്ബണേറ്റ്-കാര്ബണേറ്റ് മിശ്രിതം, അമോണിയയും അമോണിയം കാര്ബണേറ്റും കലര്ത്തിയ ബാഷ്പശീലതൈലമിശ്രിതം, അമോണിയം ക്ലോറൈഡ്, അമോണിയം അസറ്റേറ്റ് എന്നിവ ഔഷധങ്ങളായി പ്രയോജനപ്പെടുത്താറുണ്ട്. അമോണിയാവാതകം ശ്വസിച്ചാല് ശ്വസനവ്യൂഹവും ഹൃദയരക്തധമനിവ്യൂഹവും ഉത്തേജിതങ്ങളാകുന്നു. അതുകൊണ്ടാണ് അമോണിയ അടങ്ങുന്ന മരുന്നുകള് (smelling salts) മോഹാലസ്യത്തിലാണ്ടവരെക്കൊണ്ടു മണപ്പിക്കുന്നത്. അമോണിയം ക്ലോറൈഡ് ഒരു മൂത്രവര്ധകം (diuretic) ആണ്. കീടങ്ങളുടെ കടിയേറ്റ ശരീരഭാഗങ്ങളില് അമോണിയ അടങ്ങുന്ന തൈലങ്ങളോ കുഴമ്പുകളോ പുരട്ടുന്നത് തൊലിപ്പുറത്തുള്ള ചൊറിച്ചിലകറ്റുവാനും വിഷം നിര്വീര്യമാക്കുവാനും സഹായകമാണ്.
അമോണിയ വ്യുത്പന്നങ്ങള്. അമോണിയയിലെ ഒരു ഹൈഡ്രജന് അണു നീക്കം ചെയ്തു കിട്ടുന്ന -NH2 എന്ന അംശത്തെ സന്ദര്ഭാനുസരണം അമിഡൊ ഗ്രൂപ് എന്നോ അമിനൊ ഗ്രൂപ് എന്നോ പറയുന്നു. ഈ ഏകസംയോജക ഗ്രൂപ്പിന് മറ്റു ഗ്രൂപ്പുകളോടു ചേര്ന്നു പുതിയ യൗഗികങ്ങള് ഉണ്ടാക്കുവാന് സാധിക്കും. രണ്ട് അമിഡൊ ഗ്രൂപ്പുകള് ചേര്ന്ന് ഒരു ഡൈ അമൈഡ്, H2N-NH2 (ഹൈഡ്രസീന്) ലഭ്യമാക്കുന്നു. ഹൈഡ്രോക്സില് ഗ്രൂപ്പും NH2 ഗ്രൂപ്പും ചേര്ന്ന് ഹൈഡ്രോക്സില് അമീന്, NH2-OH ലഭ്യമാക്കുന്നു. ആല്ക്കൈല് അല്ലെങ്കില് അരൈല് റാഡിക്കലുമായി അമിനൊ ഗ്രൂപ് ചേരുമ്പോള് സംഗതങ്ങളായ അമീനുകള് ഉണ്ടാകുന്നു. അമോണിയയിലെ ഒരു ഹൈഡ്രജന് അണു ലോഹാണുക്കള് കൊണ്ടു പ്രതിസ്ഥാപിതമാകുമ്പോള് ലോഹ-അമൈഡുകള് ഉത്പന്നമാകുന്നു. സോഡമൈഡ്, NaNH2 ഒരു ദൃഷ്ടാന്തമാണ്. അമോണിയയിലെ ഒരു ഹൈഡ്രജന് അണുവിന്റെ സ്ഥാനത്ത് ഒരു ക്ലോറിന് ചേര്ന്നാല് വളരെ അസ്ഥിരമായ ക്ലോറമീന്,NH2Cl എന്ന യൗഗികം ഉണ്ടാകുന്നു. അമ്ലങ്ങളിലെ -OH ഗ്രൂപ് അമിഡൊ ഗ്രൂപ്പുകൊണ്ട് ആദേശിച്ചാല് ആസിഡ് അമൈഡുകള് (ഉദാ. അസറ്റമൈഡ്, സള്ഫമൈഡ്), അമിഡൊ അമ്ലങ്ങള് (ഉദാ. അമിഡൊ സള്ഫോണിക് അമ്ലം) എന്നിവ, ഹൈഡ്രോക്സില് ഗ്രൂപ്പുകളെ പൂര്ണമായോ ഭാഗികമായോ ആദേശിക്കുന്നതനുസരിച്ച് ലഭിക്കുന്നു:
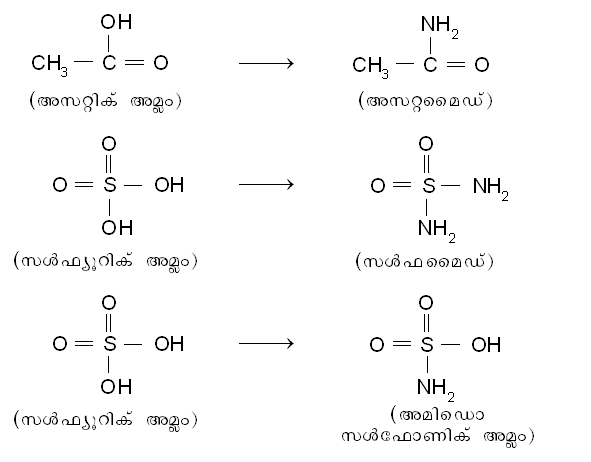
അമോണിയയിലെ 2 ഹൈഡ്രജനണുക്കള് നീക്കം ചെയ്താല് അവശേഷിക്കുന്ന അംശത്തിന് ഇമിഡോ അഥവാ ഇമിനൊ ഗ്രൂപ് (> NH) എന്നാണു പേര്. ഇതിന്റെ സംയോജകത 2 ആണ്. ഈ ഗ്രൂപ്പോടുകൂടിയ വ്യുത്പന്നങ്ങളെ ഇമൈഡുകള് എന്നോ ഇമീനുകള് (emides or emines) എന്നോ വിളിക്കുന്നു. അമോണിയയിലെ 3 ഹൈഡ്രജന് അണുക്കളെയും ആദേശിച്ചുണ്ടാകുന്ന വ്യുത്പന്നങ്ങളും ഉണ്ട്. ഉദാ. നൈട്രിലൊ സള്ഫോണിക് അമ്ലം, N (SO3H)3.
അഭിനിര്ധാരണം. അമോണിയാവാതകത്തിന് അതിന്റേതായ സവിശേഷഗന്ധമുള്ളതുകൊണ്ട് വാതകരൂപത്തില് അതു കണ്ടുപിടിക്കുവാന് പ്രയാസമില്ല. ചുവന്ന ലിറ്റ്മസിനെ അതു നീലയാക്കുന്നു. ഗാഢഹൈഡ്രോക്ലോറിക് അമ്ലത്തിന്റെ ഒരു തുള്ളി അമോണിയാവാതകത്തില് കാണിച്ചാല് വെളുത്ത ധൂമം ധാരാളമായി ഉണ്ടാകുന്നതു കാണാം. ഒരു പദാര്ഥത്തില് അമോണിയ അടങ്ങിയിട്ടുണ്ടോ എന്ന് അറിയുന്നതിന് താഴെ പറയുന്ന മൂന്നു പരീക്ഷണങ്ങള് നിര്വഹിക്കാവുന്നതാണ്. (1) സോഡിയം ഹൈഡ്രോക്സൈഡ് ചേര്ത്തു തപിപ്പിച്ചാല് അമോണിയം ലവണങ്ങളില്നിന്നു അമോണിയാവാതകം ലഭിക്കുന്നു. (2) നെസ്ലേര്സ് അഭികാരക (Nessler's Reagent) ത്തിലേക്കു പരീക്ഷണ വിധേയമായ പദാര്ഥത്തിന്റെ ഒരു ചെറിയ തരിയോ അഥവാ അതിന്റെ ലായനിയുണ്ടാക്കി അതില്നിന്നു രണ്ടോ മൂന്നോ തുള്ളിയോ ചേര്ത്താല് തവിട്ടുനിറം അഥവാ തവിട്ടുനിറത്തിലുള്ള അവക്ഷിപ്തം ലഭിക്കുന്നു. (3) സോഡിയം കോബാള്ടി നൈട്രൈറ്റ് ലായനിലേക്കു പദാര്ഥലായനി ചേര്ത്താല് അമോണിയം കോബാള്ടി നൈട്രൈറ്റ് എന്ന ഒരു മഞ്ഞ അവക്ഷിപ്തം (precippitate) ലഭിക്കുന്നു.
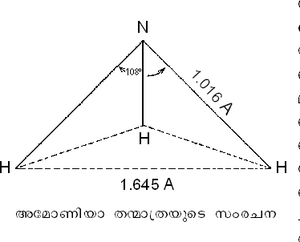
സംരചന. സ്പെക്ട്രോസ്കോപ് ഉപയോഗിച്ച് പരീക്ഷണങ്ങള് നടത്തിയതില്നിന്ന് അമോണിയയുടെ തന്മാത്ര ഒരു പിരമിഡിന്റെ (pyramid) ആകൃതിയോടുകൂടിയതാണ് എന്നറിയാന് കഴിഞ്ഞിട്ടുണ്ട്. മൂന്നു ഹൈഡ്രജനണുക്കളുമായി മൂന്നു സഹസംയോജക ബന്ധങ്ങള് സ്ഥാപിച്ചുകൊണ്ടാണ് നൈട്രജന് ഈ സ്ഥിരതയുള്ള ഇലക്ട്രോണിക-സംരചന കൈവരിച്ചിട്ടുള്ളത്. അമോണിയാ തന്മാത്രയ്ക്കു പിരമിഡ്- ആകൃതിയുടെ അകം പുറമായും പുറം അകമായും അനായാസേന മാറിക്കൊണ്ടിരിക്കുന്ന ഒരു സ്വഭാവവിശേഷം ഉണ്ട്. ഈ മാറ്റത്തിനു വേണ്ട കാലയളവ് സുനിശ്ചിതമാണ്. (ആവൃത്തി 23870 മെഗാസൈക്കിള്). സമയം സൂക്ഷ്മമായി അളക്കുന്നതിന് അമോണിയയുടെ ഈ സ്വഭാവത്തെ ഒരു ഉപായമായി 'അമോണിയാ-ഘടികാരം' എന്ന പേരില് ഉപയോഗിച്ചുകൊണ്ടിരുന്നു. സീസിയം-ഘടികാരം കണ്ടുപിടിക്കപ്പെടുന്നതുവരെ സൂക്ഷ്മതമമായ ഒരു കാലമാപനോപായം ഇതുതന്നെയായിരുന്നു.
അമോണിയാതന്മാത്രയില് നൈട്രജനില് സഹഭുജിക്കപ്പെടാ ത്തതായ ഒരു ഇലക്ട്രോണ്-ജോഡി അവശേഷിക്കുന്നുണ്ട്. പ്രോട്ടോണ് സ്വീകരിച്ച് എളുപ്പത്തില് അമോണിയം അയോണ് ഉണ്ടാകുന്നതിനു കാരണം ഇതാണ്. കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള് (coordination compounds) ലഭ്യമാക്കുന്നതില് അമോണിയയെ സഹായിക്കുന്ന ഘടകവും ഇതുതന്നെ. Co (NH3)6Cl3 ; [Cr(NH8)6](NO3)3 എന്നിവ കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള്ക്ക് ദൃഷ്ടാന്തങ്ങളാണ്.