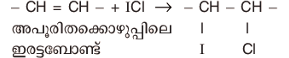This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ക്ലോറിന്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
ക്ലോറിന്
ഒരു രാസമൂലകം. ആവര്ത്തനപ്പട്ടികയിലെ VII A അ ഗ്രൂപ്പില്(ഹാലജന് കുടുംബം)പ്പെട്ട ഇതിനു ഹരിതപീതവര്ണവും രൂക്ഷഗന്ധവുമുണ്ട്. അറ്റോമിക സംഖ്യ 17, അറ്റോമിക ഭാരം 35.45, സിംബല് Cl. സാധാരണ താപനിലയിലും മര്ദത്തിലും വാതകാവസ്ഥയില് സ്ഥിതിചെയ്യുന്നു. 1774-ല് സി.ഡബ്ള്യു. ഷീലെ എന്ന ശാസ്ത്രജ്ഞനാണ് ക്ലോറിന് ആദ്യമായി കണ്ടെത്തിയത്. ക്ലോറിന് ഒരു സംയുക്തമാണെന്നാണ് ആദ്യകാലങ്ങളില് കരുതപ്പെട്ടിരുന്നത്. 1810-ല് സര് ഹംഫ്രി ഡേവി ഇതൊരു മൂലകമാണെന്നു സ്ഥാപിച്ചു. പ്രകൃതിയില് ക്ലോറൈഡ് ലവണങ്ങളുടെ രൂപത്തില് (ഉദാ. കറിയുപ്പ്) ക്ലോറിന് കാണപ്പെടുന്നു. സമുദ്രജലത്തില് 3 ശതമാനത്തോളം സോഡിയം ക്ലോറൈഡ് ഉണ്ട്.
നിര്മാണം
ഹൈഡ്രോക്ലോറിക് അംമ്ലത്തിന്റെ (HCl) ഓക്സീകരണത്തിലൂടെയാണ് സാധാരണയായി പരീക്ഷണശാലകളില് ക്ലോറിന് നിര്മിക്കുന്നത്. മാങ്ഗനീസ് ഡൈഓക്സൈഡ് (MnO2), പൊട്ടാസ്യം പെര്മാങ്ഗനേറ്റ് (KMnO4), പൊട്ടാസ്യം ഡൈക്രോമേറ്റ് (K2 Cr2 O7) തുടങ്ങിയവ ഇതിനായി ഉപയോഗിക്കുന്നു.
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
ഹൈഡ്രോക്ലോറിക് അംമ്ലത്തിനു പകരമായി ഗാഢസള്ഫ്യൂറിക് അംമ്ലത്തിന്റെയും കറിയുപ്പിന്റെയും മിശ്രിതവും ഉപയോഗിക്കാവുന്നതാണ്.
2NaCl + MnO2 + 3H2 SO4 → 2Na HSO4 + MnSO4 + 2H2O + Cl2
ബ്ലിച്ചിങ് പൗഡര് (CaOCl2), ഹൈപ്പോക്ലോറൈറ്റുകള് (ഉദാ. സോഡിയം ഹൈപ്പോക്ലോറൈറ്റ്)-ഇവയിലേതെങ്കിലുമായി ഹൈഡ്രോക്ലോറിക് അംമ്ലംപ്രവര്ത്തിക്കുമ്പോഴും ക്ലോറിന് ലഭിക്കും.
CaO Cl2 + 2HCl → CaCl2 + Cl2 + H2O
കറിയുപ്പ് ലായനി വൈദ്യുതവിസ്ലേഷണം ചെയ്താണ് വ്യാവസായികാടിസ്ഥാനത്തില് ക്ലോറിന് നിര്മിക്കുന്നത്.
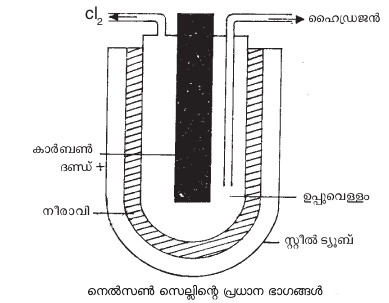
നെല്സണ് സെല് (Nelson cell) പോലുള്ള വിവിധതരം ഡയഫ്രം സെല്ലുകള് ഇതിനായി ഉപയോഗിച്ചുവരുന്നു. കാര്ബണ്കൊണ്ടുള്ള ഒരു ദണ്ഡും 'U' ആകൃതിയിലുള്ള ഒരു സ്റ്റീല് ട്യൂബുമാണ് നെല്സണ് സെല്ലിന്റെ പ്രധാന ഭാഗങ്ങള്.
ഇതിലെ കാര്ബണ്ദണ്ഡ് ആനോഡായും സ്റ്റീല് ട്യൂബ് കാഥോഡായും പ്രവര്ത്തിക്കുന്നു. കാര്ബണ്ദണ്ഡിനടുത്തായി ശേഖരിക്കപ്പെടുന്ന ക്ലോറിന് ചിത്രത്തില് കാണിച്ചിട്ടുള്ളതുപോലെ പുറത്തേക്കു പ്രവഹിക്കുന്നു. ഏറ്റവും പ്രചാരമുള്ള ഡയഫ്രം സെല്ലുകള് ഡൗ ടൈപ്പും ഹൂക്കര് ടൈപ്പും ഡയമണ്ട് ആല്ക്കലി ടൈപ്പുമാണ്. 1970-ന്റെ ആരംഭത്തില് വികസിപ്പിച്ചെടുത്തതും റുഥീനിയം ഓക്സൈഡ്-ടൈറ്റാനിയം ഓക്സൈഡ് മിശ്രിതം കൊണ്ടുണ്ടാക്കിയതുമായ ആനോഡുകളാണ് ഇപ്പോള് ഗ്രാഫൈറ്റ് ആനോഡുകള്ക്കുപകരം വ്യാപകമായി ഉപയോഗിച്ചുവരുന്നത്. ക്ലോറിന് ഉത്പാദിപ്പിക്കുന്നതിനുവേണ്ടി ഉപയോഗിക്കുന്ന മറ്റൊരു വിഭാഗം സെല്ലുകളാണ് മെര്ക്കുറിസെല്ലുകള് (ഉദാ. കാസ്റ്റ്നര്-കെല്നര്സെല്). ഇവയില് മെര്ക്കുറിയാണ് കാഥോഡായി പ്രവര്ത്തിക്കുന്നത്. ഡയഫ്രം സെല്ലുകളുമായി താരതമ്യപ്പെടുത്തുമ്പോള് ഇത്തരം സെല്ലുകള്ക്കുള്ള ചില ന്യൂനതകള് താഴെ ചേര്ക്കുന്നു: (1) ക്ലോറിനോടൊപ്പം ലഭിക്കുന്ന മറ്റൊരുത്പന്നമായ കാസ്റ്റിക് സോഡ (NaOH) ക്ലോറിനുമായി പ്രവര്ത്തിക്കാതിരിക്കാന് പ്രത്യേകം ശ്രദ്ധിച്ചില്ലെങ്കില് ഉത്പാദിപ്പിക്കപ്പെട്ട ക്ലോറിന് മുഴുവന് പാഴായിപ്പോകാനിടയുണ്ട്.
2NaOH + Cl2 → NaCl + H2O + NaClO;
(2) മെര്ക്കുറിയുടെ വിലക്കൂടുതലും അതില്നിന്നുണ്ടാകാനിടയുള്ള മലിനീകരണവും; (3) ഡയഫ്രം സെല്ലുകളില് ഉപയോഗിക്കുന്നതിനെക്കാള് ഉയര്ന്ന വോള്ട്ടത മെര്ക്കുറി സെല്ലുകളില് ആവശ്യമുണ്ട്. മേല്പറഞ്ഞ ന്യൂനതകളെല്ലാം പൂര്ണമായും പരിഹരിക്കാന് പുതിയതരം മെര്ക്കുറിസെല്ലുകള്ക്കു കഴിഞ്ഞിട്ടുണ്ട്.
1868 മുതല് ക്ലോറിന് നിര്മാണത്തിനുപയോഗിച്ചുവന്നിരുന്ന ഡീക്കന് പ്രക്രിയ (Deacon process) ഇടക്കാലത്ത് ഉപേക്ഷിക്കപ്പെട്ടിരുന്നതാണ്. എന്നാല് അല്പം ചില പരിഷ്കാരങ്ങള് വരുത്തിയാല് ഈ പ്രക്രിയ ഉപയോഗിച്ചു ക്ലോറിന് നിര്മാണം ലാഭകരമാക്കാമെന്നു തെളിഞ്ഞതോടെ ഇതിന്റെ പ്രചാരം വര്ധിച്ചിട്ടുണ്ട്. ഹൈഡ്രജന് ക്ലോറൈഡിന്റെ ഓക്സീകരണമാണ് ഈ രീതിയുടെ അടിസ്ഥാനതത്ത്വം.
കുപ്രിക് ക്ലോറൈഡ് (CuCl2) ഇവിടെ രാസത്വരകമായി ഉപയോഗിക്കുന്നു. ഉത്പാദിപ്പിക്കപ്പെടുന്ന ക്ലോറിന്, മീഥേന് വാതകം ഉപയോഗിച്ച് ഡൈ ക്ലോറോ എഥിലീന് ആയി രൂപാന്തരപ്പെടുത്തിയോ അല്ലെങ്കില് ഉത്പാദിപ്പിക്കപ്പെടുന്ന ജലം സള്ഫ്യൂറിക് അംമ്ലംഉപയോഗിച്ചു നീക്കിയോ ഈ രാസപ്രവര്ത്തനത്തിന്റെ സന്തുലിതാവസ്ഥ ക്ലോറിന് ഉത്പാദനത്തിന് അനുകൂലമാക്കാം.
ഭൗതികഗുണങ്ങള്
ഹരിതപീതവര്ണവും രൂക്ഷഗന്ധവുമുള്ള വാതകമാണ് ക്ലോറിന്. ഇതിനു വിഷസ്വഭാവമുണ്ട്. വായുവിനെക്കാള് 2½ ഇരട്ടിയോളം ഭാരമുണ്ട്. ജലത്തില് സാമാന്യമായി ലയിക്കുന്നു. -34.6°C-ല് ദ്രാവകാവസ്ഥയിലും -101.6°C-ല് ഖരാവസ്ഥയിലും എത്തുന്നു. ഖരാവസ്ഥയിലുള്ള ക്ലോറിന് മഞ്ഞനിറമുള്ള ഒരു പദാര്ഥമാണ്.
രാസഗുണങ്ങള്
ഉയര്ന്ന രാസപ്രവര്ത്തനക്ഷമതയുള്ള മൂലകമാണ് ക്ലോറിന്. ഫ്ളൂറിന് കഴിഞ്ഞാല് ഏറ്റവുമധികം പ്രവര്ത്തനക്ഷമതയുള്ള ഹാലജനും ഇതുതന്നെ. ആവര്ത്തനപ്പട്ടികയിലെ VII A ഗ്രൂപ്പില് മുകളില്നിന്നു താഴേക്കു വരുമ്പോള് പ്രവര്ത്തനക്ഷമത ക്രമമായി കുറഞ്ഞുവരുന്നു. എന്നാല് ഹാലജനുകളില് ഏറ്റവുമധികം ഇലക്ട്രോണ് ആഭിമുഖ്യം ഉള്ളത് ക്ലോറിനാണ്. മൂലകങ്ങളില് ഏറ്റവും കൂടുതല് ഇലക്ട്രോണ് ഋണത (ഒരു സംയുക്തത്തിലെ ഒരു പ്രത്യേക അണുവിന് ഇലക്ട്രോണുകളെ തന്നിലേക്ക് ആകര്ഷിക്കാനുള്ള കഴിവ്) ഉള്ളത് ഫ്ളൂറിനാണ്. ഹാലജനുകള് പൊതുവേ ശക്തികൂടിയ ഓക്സീകാരകങ്ങളാണ്. ഫ്ളൂറിനില്നിന്ന് അയഡിന്വരെ എത്തുമ്പോള് മൂലകങ്ങളുടെ ഓക്സീകാരകഗുണം ക്രമമായി കുറഞ്ഞുവരുന്നതുകാണാം. ക്ലോറിന്റെ ഉയര്ന്ന പ്രവര്ത്തനക്ഷമതയ്ക്കുള്ള കാരണങ്ങള് ഇവയാണ്: (i) കൂടിയ ഇലക്ട്രോണ് ഋണത; (ii) അണുവിന്റെ വലുപ്പക്കുറവ്; (iii) ക്ലോറിന് അണുക്കളെ തമ്മില് ഘടിപ്പിക്കുന്ന ബോണ്ടിന്റെ (Cl-Cl)) താരതമ്യേനയുള്ള ദുര്ബലത; (iv) ഉയര്ന്ന ഓക്സീകരണശക്തി.
0oC-ലുള്ള നേര്ത്ത കാത്സ്യം ക്ലോറൈഡ് (Ca Cl2) ലായനിയില്ക്കൂടി ക്ലോറിന് പ്രവഹിക്കുമ്പോള് തൂവലിനു സമാനമായ 'ക്ലോറിന് ഹൈഡ്രേറ്റ്' പരലുകള് ലഭിക്കുന്നു. Cl2. 7.3 H2O എന്ന ഘടനയിലുള്ള ഈ പരലുകളിലെ ചെറിയ പഴുതുകളില് ക്ലോറിന് ഉള്ക്കൊണ്ടിരിക്കുന്നു. പരലുകള് ചൂടാക്കിയാല് ക്ലോറിന് വാതകം ലഭിക്കും. Cl2. 6H2O, Cl2. 8H2O എന്നീ ഖരഹൈഡ്രേറ്റുകളും ഉണ്ട്.
രാസസംയുക്തങ്ങള്, അകാര്ബണിക സംയുക്തങ്ങള്
കാര്ബണ്, നൈട്രജന്, ഓക്സിജന്, അലസവാതകങ്ങള് ((inert gases) എന്നിവയൊഴികെ പലതരം ലോഹങ്ങളുമായും അലോഹങ്ങളുമായും ക്ലോറിന് നേരിട്ട് സംയോജിച്ച് നിരവധി സംയുക്തങ്ങള് ഉണ്ടാകുന്നുണ്ട്.
ഹൈഡ്രജന് ക്ലോറൈഡ്
ഹൈഡ്രജന് ക്ലോറൈഡ് (ഹൈഡ്രോക്ലോറിക് അംമ്ലം) HCl. ക്ലോറിന്റെ ഏറ്റവും പ്രധാനപ്പെട്ട സംയുക്തങ്ങളില് ഒന്നാണിത്. സൂര്യപ്രകാശത്തില് ക്ലോറിനും ഹൈഡ്രജനും നേരിട്ടു സംയോജിച്ച് ഹൈഡ്രജന് ക്ലോറൈഡ് ഉണ്ടാകുന്നു.
H2 + Cl2 → 2HCl
ഗാഢ സള്ഫ്യൂറിക് അമ്ലവുമായി ക്ലോറൈഡ് ലവണങ്ങള് പ്രവര്ത്തിപ്പിച്ചാണ് പരീക്ഷണശാലകളില് ഹൈഡ്രജന് ക്ലോറൈഡ് നിര്മിക്കുന്നത്.
NaCl + H2SO4 → Na HSO4 + HCl
കാസ്റ്റിക്സോഡ നിര്മിക്കുമ്പോള് ലഭിക്കുന്ന ഉപോത്പന്നങ്ങളായ ക്ലോറിനും ഹൈഡ്രജനും തമ്മില് പ്രവര്ത്തിപ്പിച്ചാണ് ഹൈഡ്രോക്ലോറിക് അംമ്ലംവന്തോതില് നിര്മിക്കുന്നത്.
ഭൗതികഗുണങ്ങള്
വാതകരൂപത്തിലുള്ള ഹൈഡ്രജന്ക്ലോറൈഡ് നിറമില്ലാത്തതും രൂക്ഷഗന്ധമുള്ളതുമാണ്. ഇത് ഈര്പ്പമുള്ള വായുവില് പുകയുന്നു. ജലത്തില് വളരെയധികം ഈ വാതകം വായുവിനെക്കാള് ഭാരം കൂടിയതാണ്. -83°C-ല് ദ്രാവകമാവുകയും -113°C-ല് ഖരമാവുകയും ചെയ്യുന്നു.
രാസഗുണങ്ങള്
തികച്ചും ഈര്പ്പരഹിതമായ ഹൈഡ്രജന്ക്ലോറൈഡ് വാതകം നീല ലിറ്റ്മസിനെ ചുവപ്പാക്കുന്നില്ല. എന്നാല് ജലത്തില് ലയിച്ചുകിട്ടുന്ന ഹൈഡ്രോക്ലോറിക് അംമ്ലംതികച്ചും അംമ്ലസ്വഭാവമുള്ളതുമാണ്. ജലത്തില് ലയിക്കുമ്പോള് സംഭവിക്കുന്ന അയോണീകരണം കാരണമാണ് ഇങ്ങനെ സംഭവിക്കുന്നത്:
നേര്ത്ത ജലലായനിയില് ഹൈഡ്രജന്ക്ലോറൈഡ് പൂര്ണമായും അയോണീകരിക്കപ്പെടുന്നു. പല ലോഹങ്ങളുമായി ഹൈഡ്രോക്ലോറിക് അംമ്ലംപ്രവര്ത്തിച്ച് ഹൈഡ്രജന് ഉത്പാദിപ്പിക്കുന്നു:
ക്ഷാരങ്ങളുമായി പ്രവര്ത്തിച്ച് ജലവും ക്ലോറൈഡ് ലവണവും, മറ്റു പല ലവണങ്ങളുമായി പ്രവര്ത്തിച്ച് ക്ലോറൈഡ് ലവണവും ഉണ്ടാകുന്നു. മൂന്നുഭാഗം ഗാഢഹൈഡ്രോക്ലോറിക് അംമ്ലവും ഒരു ഭാഗം ഗാഢനൈട്രിക് അംമ്ലവും ചേര്ന്ന മിശ്രിതമാണ് അക്വാറീജിയ (രാജദ്രാവകം). സ്വര്ണം, പ്ലാറ്റിനം തുടങ്ങിയ ലോഹങ്ങള് ഈ ദ്രാവകത്തില് മാത്രമേ ലയിക്കുകയുള്ളൂ.
ക്ലോറിന്, പലതരം ക്ലോറൈഡ് ലവണങ്ങള്, ഗ്ളൂക്കോസ്, ജലാറ്റിന്, ഔഷധങ്ങള്, അക്വാറീജിയ തുടങ്ങിയവയുടെ നിര്മാണം-ഇങ്ങനെ ഹൈഡ്രജന് ക്ലോറൈഡ് അഥവാ ഹൈഡ്രോക്ലോറിക് അംമ്ലത്തിന്റെ ഉപയോഗങ്ങള് നിരവധിയാണ്.
ഓക്സൈഡുകളും ഓക്സിഅമ്ലങ്ങളും
ക്ലോറിനും ഓക്സിജനുമായി ചേര്ന്ന് പലതരം ക്ലോറിന് ഓക്സൈഡുകളും അവയില്നിന്ന് ജലസംസ്ലേഷണംവഴി ക്ലോറിന്-ഓക്സിഅമ്ലങ്ങളും ലഭിക്കുന്നു. ക്ലോറിന് ഓക്സൈഡുകള് വളരെയധികം പ്രവര്ത്തനക്ഷമതയുള്ളവയും അസ്ഥിരങ്ങളുമാണ്.
ക്ലോറിന് മോണോക്സൈഡ്
ക്ലോറിന് മോണോക്സൈഡ് (Cl2O): നിറമുള്ള ഒരു വാതകമാണ് ഇത്. മെര്ക്കുറിക് ഓക്സൈഡും ക്ലോറിനും തമ്മില് താഴ്ന്ന താപനിലയില് പ്രതിപ്രവര്ത്തിച്ചാണ് Cl2O നിര്മിക്കുന്നത്;
2Cl2 + 2 HgO → HgCl2 HgO + Cl2O
ഈ വാതകം ജലത്തില് ലയിച്ച് ഹൈപ്പോക്ലോറസ് അമ്ലം(HOCl) ഉണ്ടാകുന്നു. ഹൈപ്പോക്ലോറസ് അമ്ലംതാരതമ്യേന ദുര്ബലവും സ്ഥിരവുമാണ്. ഇത് ഹൈപ്പോക്ലോറൈറ്റ് ലവണങ്ങള് നല്കുന്നു. ഉദാ. സോഡിയം ഹൈപ്പോക്ലോറൈറ്റ് (NaOCl). സോഡിയം ഹൈപ്പോക്ലോറൈറ്റും 'പെര്ക്ലോറോണ്' എന്ന പേരില് കാത്സ്യം ഹൈപ്പോക്ലോറൈറ്റും ശ്വേതീകരിണി ആയി ഉപയോഗിക്കപ്പെടുന്നു.
ക്ലോറിന് ഡൈ ഓക്സൈഡ്
ക്ലോറിന് ഡൈ ഓക്സൈഡ് (Cl O2): പൊട്ടാസ്യം ക്ലോറേറ്റ് ((KClO3) ഗാഢസള്ഫ്യൂറിക് അംമ്ലത്തില് ചേര്ത്ത് അല്പം ചൂടാക്കിയോ, അല്ലെങ്കില് ഈര്പ്പരഹിതമായ ക്ലോറിന് വാതകം 90°C-ലുള്ള സില്വര് ക്ലോറേറ്റിലൂടെ പ്രവഹിപ്പിച്ചോ ഇത് നിര്മിക്കാം. കട്ടികൂടിയ, കടുംമഞ്ഞനിറമുള്ള ദ്രാവകമാണ് ഇത്. 11°C-ല് വാതകമാകുന്നു. ഇത് ശക്തിയേറിയ ഒരു ഓക്സീകാരിയും ക്ലോറിനീകാരിയും ആണ്. ജലം ശുദ്ധിചെയ്യാനും സെല്ലുലോസ് ശ്വേതീകരിക്കാനും ഉപയോഗിക്കുന്നു. ക്ലോറിന് ഡൈഓക്സൈഡ് ജലവും ക്ഷാരവുമായി പ്രവര്ത്തിച്ച് ക്ലോറൈറ്റും ക്ലോറേറ്റും ഉത്പാദിപ്പിക്കുന്നതിനാല് ഇത് ഒരു സമ്മിശ്ര അന്ഹൈഡ്രൈഡ് ആണ്. ജലത്തില് ലയിക്കുമ്പോള് ലഭിക്കുന്ന ക്ലോറസ് അംമ്ലംലായനിരൂപത്തില് മാത്രം കാണപ്പെടുന്നു.
ഡൈക്ലോറിന് ഹെക്സോക്സൈഡ്
ഡൈക്ലോറിന് ഹെക്സോക്സൈഡ് (Cl2O6): ക്ലോറിന് ഡൈഓക്സൈഡും (Cl O2) ഓസോണുമായി പ്രവര്ത്തിപ്പിച്ച് Cl2O6 നിര്മിക്കുന്നു. ഇത് ശക്തിയേറിയ ഒരു ഓക്സീകാരകമാണ്. ഗ്രീസ്പോലുള്ള കാര്ബണിക വസ്തുക്കളുടെ സമ്പര്ക്കത്തില് ഇത് പൊട്ടിത്തെറിക്കും. ചുവന്ന നിറമുള്ള ഈ ദ്രാവകം, 3.5°-ല് ഖരീഭവിക്കുന്നു. ക്ഷാരവുമായി പ്രവര്ത്തിച്ച്, ക്ലോറേറ്റും പെര്ക്ലോറേറ്റും ഉണ്ടാകുന്നു. ക്ലോറിക് അംമ്ലം(HCl O3) ലായനിരൂപത്തില്മാത്രം കാണപ്പെടുന്നു. ബേരിയം ക്ലോറേറ്റില് [Ba (ClO3)2] ആവശ്യമായത്ര സള്ഫ്യൂറിക് അംമ്ലംചേര്ത്താണ് ക്ലോറിക് അംമ്ലംനിര്മിക്കുന്നത്. ഇത് ശക്തിയേറിയ ഒരു ഓക്സീകാരകവും അംമ്ലവുമാണ്. സൂര്യപ്രകാശത്തില് ഇത് പെര്ക്ലോറിക് അംമ്ലമായി (H Cl O4) മാറുന്നു.
3H ClO3 → H ClO4 + Cl2 + 2O2 + H2O
ഹൈഡ്രോക്സൈഡു(ഉദാ. സോഡിയം ഹൈഡ്രോക്സൈഡ് NaOH)കളില് ക്ലോറിന് പ്രവര്ത്തിപ്പിച്ചോ ചൂടുള്ള ക്ലോറൈഡ് ലായനികളെ വൈദ്യുതവിസ്ലേഷണം ചെയ്തോ ആണ് ക്ലോറേറ്റ് ലവണങ്ങള് സാധാരണ നിര്മിക്കുന്നത്. കരിമരുന്ന്, തീപ്പെട്ടി എന്നിവയുടെ നിര്മിതിക്ക് ക്ലോറേറ്റ് ലവണങ്ങള് ആവശ്യമാണ്. സോഡിയം ക്ലോറേറ്റ്, ശക്തിയേറിയ ഒരു പായല്നാശിനിയാണ്. ചൂടാക്കുമ്പോള് ക്ലോറേറ്റ് ലവണങ്ങള് സാധാരണ പൊട്ടിത്തെറിക്കും. താപനിലയ്ക്കനുസൃതമായി ക്ലോറേറ്റുകള് മറ്റു വ്യത്യസ്ത ലവണങ്ങളായി രൂപാന്തരപ്പെടും:
2K ClO3 → 2K Cl + 3O2
താഴ്ന്ന താപനിലയിലും, മാങ്ഗനീസ് ഡൈഓക്സൈഡ് പോലെയുള്ള രാസത്വരകങ്ങളുടെ സാന്നിധ്യത്തിലും പൊട്ടാസ്യം ക്ലോറേറ്റ്, പെര്ക്ലോറേറ്റ് ലവണവും ക്ലോറൈഡ് ലവണവുമായി മാറുന്നു.
4K ClO3 → 3K ClO4 + KCl
ഡൈക്ലോറിന് ഹെപ്റ്റോക്സൈഡ്
ഡൈക്ലോറിന് ഹെപ്റ്റോക്സൈഡ് (Cl 2 O 7): സാമാന്യം സ്ഥിരമായ ഒരു ദ്രാവകമാണ്. ഫോസ്ഫറസ് പെന്റോക്സൈഡ് (P2O5) കൊണ്ട് പെര്ക്ലോറിക് അംമ്ലത്തിലെ ജലാംശം മാറ്റിയാണ് Cl 2 O 7 നിര്മിക്കുന്നത്. ഇത് ബാഷ്പശീലമുള്ള, നിറമില്ലാത്ത ഒരു ദ്രാവകമാണ്. മര്ദമോ ചൂടോ ഏറ്റാല് പൊട്ടിത്തെറിക്കും. പെര്ക്ലോറിക് അമ്ലം(H ClO4) ഏറ്റവും ശക്തിയേറിയ അംമ്ലങ്ങളില് ഒന്നാണ്.
ബ്ലിച്ചിങ്പൗഡറും (CaO Cl2) ശ്വേതീകരണ സ്വഭാവവും
ചുണ്ണാമ്പുപൊടി(slaked lime)യില്ക്കൂടി ക്ലോറിന് കടത്തിവിട്ടാണ് ബ്ലിച്ചിങ് പൗഡര് വ്യാവസായികമായി ഉത്പാദിപ്പിക്കുന്നത്. ഇതിന് ഹേസന് ക്ലെവര് രീതി(Hesan clever method)യും ബാക്മാന് രീതി(Bachman method)യും പ്രയോജനപ്പെടുത്തിവരുന്നു. രണ്ടു രീതികളുടെയും അടിസ്ഥാനതത്ത്വം ഒന്നുതന്നെ; അതായത്,
Ca (OH) 2 + Cl 2 → CaO Cl 2 + H 2O
അല്പം മഞ്ഞകലര്ന്ന വെള്ളനിറമുള്ള ബ്ലിച്ചിങ് പൗഡറിന് ക്ലോറിന്റെ പ്രത്യേക ഗന്ധമുണ്ട്. നേര്പ്പിച്ച അംമ്ലങ്ങളുമായോ കാര്ബണ് ഡൈ ഓക്സൈഡുമായോ പ്രവര്ത്തിക്കുമ്പോള് ബ്ലിച്ചിങ് പൗഡറില്നിന്ന് ക്ലോറിന് ഉത്പാദിപ്പിക്കപ്പെടുന്നു:
CaO Cl 2 + H 2 SO 4 → Ca SO 4 + H 2O + Cl 2
ഇങ്ങനെ ലഭിക്കുന്ന ക്ലോറിന്റെ അളവിനെ ലഭ്യമായ ക്ലോറിന് (available chlorine) എന്നാണു പറയുക. താത്ത്വികമായി ബ്ലിച്ചിങ് പൗഡറില്നിന്ന് 49 ശതമാനം 'ലഭ്യമായ ക്ലോറിന്' ഉത്പാദിപ്പിക്കാന് കഴിയേണ്ടതാണ്. എന്നാല് കടകളില്നിന്നു കിട്ടുന്ന ബ്ലിച്ചിങ് പൗഡറില് ഉദ്ദേശം 'ലഭ്യമായ ക്ലോറിന്' 35-40 ശതമാനം മാത്രമേ കാണുകയുള്ളൂ. കുറേ ബ്ലിച്ചിങ് പൗഡര് കാത്സ്യം ക്ലോറേറ്റും കാത്സ്യം ക്ലോറൈഡുമായി വിഘടിച്ചുപോകുന്നതിനാലായിരിക്കാം ഇങ്ങനെ സംഭവിക്കുന്നത്:
CaO Cl2 → Ca Cl2 + Ca (Cl O3)2
യഥാര്ഥത്തില് ശ്വേതീകരണം നടത്തുന്നത് ക്ലോറിന് വാതകമല്ല, പ്രത്യുത, അത് സ്വതന്ത്രമാക്കുന്ന നവജാത ഓക്സിജന് ആണ്. അല്പമാത്രവും നേര്ത്തതുമായ അംമ്ലവുമായി പ്രവര്ത്തിച്ച് ബ്ലിച്ചിങ് പൗഡറില്നിന്ന് ഹൈപ്പോ ക്ലോറസ് അംമ്ലം(ഒ ഇഹഛ) ഉണ്ടാവുകയും, ആ അംമ്ലത്തില്നിന്ന് ഓക്സിജന് സ്വതന്ത്രമാക്കപ്പെടുകയും ചെയ്യുന്നു.
2CaO Cl2 + H2 SO4 → Ca Cl2 + Ca SO4 + 2HClO HClO → HCl + [O]
നവജാത ഓക്സിജന് ശക്തിയേറിയ ഒരു ശ്വേതീകാരിയാണ്. കാര്ബണ്, അതിന്റെ സംയുക്തങ്ങള് എന്നിവയൊഴികെ മിക്കവാറും എല്ലാ വസ്തുക്കളെയും ബ്ലിച്ചുചെയ്യുവാന് ഇതിനു കഴിയും. വസ്ത്രങ്ങളും മറ്റു സാധനങ്ങളും ശ്വേതീകരിക്കുക, ജലം ശുദ്ധീകരിക്കുക, അണുക്കളെയും കീടങ്ങളെയും നശിപ്പിക്കുക, കമ്പിളി ചുരുങ്ങുന്നതു തടയുക തുടങ്ങിയ ഉപയോഗങ്ങള് കൂടാതെ ക്ലോറോഫോം നിര്മിക്കുന്നതിനും ബ്ലിച്ചിങ് പൗഡര് ഉപയോഗിച്ചുവരുന്നു.
അന്തര്ഹാലജന് സംയുക്തങ്ങള്
അന്തര്ഹാലജന് സംയുക്തങ്ങള് (Inter halogen compounds) ഹാലജന് കുടുംബത്തിലെ അംഗങ്ങള് തമ്മില് സംയോജിച്ച് അന്തര്ഹാലജന് സംയുക്തങ്ങള് ഉണ്ടാകുന്നു. ഇത്തരത്തിലുള്ള ക്ലോറിന് സംയുക്തങ്ങള് ഇനി പറയുന്നവയാണ്:
ക്ലോറിന്മോണോ ഫ്ളൂറൈഡ് (Cl F); നിറമില്ലാത്ത വാതകമാണ് 103°C-ല് ദ്രാവകമാകുന്നു.
അയഡിന് മോണോക്ലോറൈഡ് (I Cl); കടുംചുവപ്പുനിറമുള്ള ദ്രാവകം; 101°C-ല് വാതകമാകുന്നു.
അയഡിന് ട്രൈ ക്ലോറൈഡ് (I Cl3); ഖരം 67°C-ല് വിഘടിക്കുന്നു.
ക്ലോറിന് ട്രൈ ഫ്ളൂറൈഡ് (Cl F3); ബ്രോമിന് മോണോക്ലോറൈഡ് (Br Cl).
മേല്പറഞ്ഞ എല്ലാ സംയുക്തങ്ങളും ബന്ധപ്പെട്ട ഹാലജനുകള് തമ്മില് നേരിട്ടു പ്രവര്ത്തിപ്പിച്ചോ അല്ലെങ്കില് ഒരു ഹാലജനും മറ്റൊരു താഴ്ന്ന അന്തര്ഹാലജനും (inter halogen) തമ്മില് പ്രവര്ത്തിപ്പിച്ചോ നിര്മിക്കാവുന്നതാണ്. ഇങ്ങനെ ഉണ്ടാകുന്ന ഉത്പന്നം പ്രവര്ത്തനം നടക്കുന്ന പരിതഃസ്ഥിതിയെ ആശ്രയിച്ചിരിക്കും.
ഉദാ. I2 + Cl2 liquid (തുല്യ തന്മാത്രയില്) → 2I Cl.
I2 + 3Cl2 liquid (അധിക ക്ലോറിന്)→ 2I Cl3.
ഇത്തരം സംയുക്തങ്ങളുടെ ഒരു പ്രത്യേകത, ഒരു തന്മാത്രയില് രണ്ടു വ്യത്യസ്ത ഹാലജനുകള് മാത്രമേ ഉണ്ടായിരിക്കുകയുള്ളൂ എന്നതാണ്. അയഡിന് മോണോക്ലോറൈഡ് (I Cl) ആണ് ഏറ്റവും അധികമായി അറിയപ്പെടുന്ന അന്തര്ഹാലജന് സംയുക്തം. അപൂരിത കൊഴുപ്പുകളുടെയും എണ്ണകളുടെയും അപൂരിതാവസ്ഥയെ സൂചിപ്പിക്കുന്ന അയഡിന് സംഖ്യ നിര്ണയിക്കുന്നതിന് വിജ്സ് റിയേജന്റ് (Wigs reagent) എന്ന പേരില് ഇത് പരീക്ഷണശാലകളില് ഉപയോഗിച്ചുവരുന്നു.
അയഡിന് മോണോക്ലോറൈഡ് ക്ഷാരഹാലൈഡുകളുമായിച്ചേര്ന്ന് ബഹു ഹാലൈഡുകള് ((Poly halides) ലഭ്യമാക്കുന്നു:
Na Br + I Cl → Na Br I Cl.
കാര്ബണിക സംയുക്തങ്ങളുമായി ഇത് പ്രവര്ത്തിപ്പിക്കുമ്പോള് പരിതഃസ്ഥിതികളനുസരിച്ച് ക്ലോറിനീകരണമോ അല്ലെങ്കില് അയഡിനീകരണമോ സംഭവിക്കാം.
ലായനിരൂപത്തില് I Cl ഏകദേശം ഒരു ശതമാനം മാത്രമേ അയണീകരിക്കപ്പെടുന്നുള്ളൂ.
ക്ലോറൈഡുകള്
ഹൈഡ്രജന് ക്ലോറൈഡിന്റെ ഹൈഡ്രോക്ലോറിക്കമ്ളത്തിന്റെ ലവണങ്ങളാണ് ക്ലോറൈഡുകള്. മിക്കവാറും ക്ലോറൈഡ് ലവണങ്ങള് പരലാകൃതിയുള്ളവയും ജലത്തില് അലിഞ്ഞുചേരുന്നവയുമാണ്. ഉദാ. സോഡിയം ക്ലോറൈഡ് (NaCl). എന്നാല് ലെഡ് ക്ലോറൈഡ് (Pb Cl2) ജലത്തില് സാമാന്യമായി ലയിക്കുമ്പോള്, മെര്ക്കുറസ് ക്ലോറൈഡ് (Hg2 Cl2) സില്വര് ക്ലോറൈഡ് (Ag C), കുപ്രസ് ക്ലോറൈഡ് (CuCl2) എന്നിവ ജലത്തില് അലേയങ്ങളാണ്. മിക്കവാറും ക്ലോറൈഡുകള് തപിപ്പിച്ചാല്, രാസമാറ്റം സംഭവിക്കുന്നില്ല. എന്നാല് ചില ജലയോജിത ക്ലോറൈഡുകള് (ഉദാ. ഫെറിക് ക്ലോറൈഡ്. Fe Cl3 6H2O), അലുമിനിയം ക്ലോറൈഡ് (Al Cl3 6H2O) ചൂടാക്കുമ്പോള് വിഘടിച്ച് ഹൈഡ്രജന് ക്ലോറൈഡ് ഉത്പാദിപ്പിക്കുന്നു. കുപ്രിക് ക്ലോറൈഡ് (Cu Cl2) ചൂടാക്കിയാല് ക്ലോറിന് വാതകമാണ് ലഭിക്കുക. ചില ക്ലോറൈഡ് ലവണങ്ങള് ഭാഗികമായി ജലവിസ്ലേഷണത്തിനു വിധേയമാവുകയും ബന്ധപ്പെട്ട ഓക്സിക്ലോറൈഡുകള് ഉത്പാദിപ്പിക്കുകയും ചെയ്യുന്നു. ഉദാ. ബിസ്മത്ത് ട്രൈ ക്ലോറൈഡ്.
ക്ലോറൈഡിന്റെ നിദര്ശനം: 1. ക്ലോറൈഡ്ലവണം, മാങ്ഗനീസ് ഡൈ ഓക്സൈഡ്, സള്ഫ്യൂറിക്കമ്ളം എന്നിവ ചേര്ത്ത് ചൂടാക്കുമ്പോള് ക്ലോറിന്വാതകം ഉദ്ഗമിക്കുന്നു.
2. ജലത്തില് ലയിക്കുന്ന ക്ലോറൈഡുകള്, സില്വര് നൈട്രേറ്റുലായനി(Ag NO3)യുമായിച്ചേര്ന്ന് സില്വര് ക്ലോറൈഡിന്റെ വെളുത്ത അവക്ഷിപ്തം ഉണ്ടാക്കുന്നു. ഇത് ജലത്തില് അലേയമാണ്; എന്നാല് അമോണിയം ഹൈഡ്രോക്സൈഡില് (NH4OH) ലയിക്കുന്നു.
മേല്പറഞ്ഞ പരീക്ഷണങ്ങള്വഴി ക്ലോറൈഡ് റാഡിക്കലിന്റെ സാന്നിധ്യം സ്ഥിരീകരിക്കാവുന്നതാണ്.
കാര്ബണികയൗഗികങ്ങള്.
ക്ലോറിന്റെ കാര്ബണിക സംയുക്തങ്ങളില് മുഖ്യമായവ ക്ലോറിനീകരിച്ച ആല്ക്കേനുകളും അല്ക്കീനുകളും ആണ്. കാര്ബണ് ടെട്രാക്ലോറൈഡ് (CCl4), ക്ലോറോഫോം (CHCl3). മെഥിലീന് ക്ലോറൈഡ് (CH2Cl2), ട്രൈക്ലോറോ എഥിലീന് (CHCl = CCl2), ടെട്രാക്ലോറോ എഥിലീന് (CCl2 = CCl2) എന്നിവ ഇതില്പ്പെടുന്നു. ലായകങ്ങള്, പെയ്ന്റ് ദൂരികാരി, ലോഹം വൃത്തിയാക്കുന്ന ലായനി തുടങ്ങിയവ നിര്മിക്കാന് ഇവ ഉപയോഗിക്കുന്നു. ശീതീകാരികളില് ഉപയോഗിക്കുന്ന ഫ്രിയോണ്വാതകം നിര്മിക്കുന്നതിന് കാര്ബണ് ടെട്രാക്ലോറൈഡും ക്ലോറോഫോമും ഉപയോഗപ്പെടുത്തുന്നു. പെട്രോളിന്റെ 'ആന്റിനോക്ക്' (antiknock) ഗുണം വര്ധിപ്പിക്കുന്നതിനുള്ള ടെട്രാ ഈഥൈന് ലെഡിനോടൊപ്പം എഥിലീന് ഡൈ ക്ലോറൈഡും (CH2ClCH2Cl) ചേര്ക്കുന്നുണ്ട്. കീടനാശിനികളായ ഡി.ഡി.റ്റി, ബി.എച്ച്.സി. (ബെന്സീന് ഹെക്സാക്ലോറൈഡ്), ലിന്ഡേന്, ക്ലോര്ഡേന് തുടങ്ങിയവയും ക്ലോറിന്റെ കാര്ബണിക സംയുക്തങ്ങളാണ്. 2-4 ഡി (2-4 ഡൈക്ലോറോ ഫീനോക്സി അസറ്റി അംമ്ലം) ഒരു സസ്യഹോര്മോണ് ആയി പ്രയോജനപ്പെടുന്നു. ഒരു 'ഹെര്ബിസൈഡ്' ആയ മോണോക്ലോറോ അസറ്റിക് അംമ്ല(ClCH2COOH)വും ഒരു കാര്ബണിക ക്ലോറിന് സംയുക്തമാണ്. പ്ലാസ്റ്റിക് (PVC) നിര്മാണത്തിനുള്ള മോണോമര് ആയ വിനൈല് ക്ലോറൈഡ് (CH2 = CHCl) മറ്റൊരു പ്രധാന സംയുക്തമാണ്.
പരിമാണപരമായ നിര്ണയം
ക്ലോറിന്വാതകം പൊട്ടാസ്യം അയഡൈഡ് (K I) ലായനിയില്നിന്ന് അയഡിനെ വിസ്ഥാപനം ചെയ്യുന്നു:
2KI + Cl2 → 2KCl + I2
ഈ തത്ത്വത്തെ അടിസ്ഥാനമാക്കിയാണ് ക്ലോറിന്റെ പരിമാണാത്മകനിര്ണയം നടത്തുന്നത്. അയഡിന്റെ പ്രത്യേക നിറമുള്ള ഈ ലായനി മാനനീകരിച്ച സോഡിയം തയോസള്ഫേറ്റി(Na2S2O3)നെതിരായി ടൈട്രേറ്റുചെയ്ത് ക്ലോറിന്റെ പരിമാണം കണക്കാക്കാം.
2Na2S2O3 + I2 → 2Nal + Na2S4O6
ഉപയോഗങ്ങള്
ക്ലോറിനും അതിന്റെ സംയുക്തങ്ങള്ക്കും രസതന്ത്രത്തിലും വ്യവസായത്തിലും വളരെ പ്രാധാന്യമുണ്ട്. അവയുടെ പ്രധാന ഉപയോഗങ്ങള് ഇനി പറയുന്നവയാണ്.
1. വസ്ത്രങ്ങള്, കടലാസുണ്ടാക്കാനുപയോഗിക്കുന്ന പള്പ്പ്, റയോണ് തുടങ്ങിയവയെല്ലാം ശ്വേതീകരിക്കാന് ക്ലോറിന് പ്രയോജനപ്പെടുത്തിവരുന്നു.
2. കുടിവെള്ളം ശുദ്ധീകരിക്കാന് ക്ലോറിന്, ബ്ലിച്ചിങ് പൗഡര്, ക്ലോറിന് ഹൈപ്പോക്ലോറൈറ്റ് ലവണങ്ങള് ഇവ പ്രയോജനപ്പെടുത്തിവരുന്നു. വലിയതോതില് ശുദ്ധീകരിക്കാന് ക്ലോറിനും ചെറിയ ജലാശയങ്ങള്, കിണറുകള്, കുളങ്ങള് ഇവ ശുദ്ധീകരിക്കാന് ബ്ലിച്ചിങ് പൗഡറും ക്ലോറിന് ജലവും ആണ് ഉപയോഗിക്കുന്നത്. ജലം ശുദ്ധീകരിക്കാന് ഓസോണ് (ozone), അള്ട്രാവയലറ്റ് രശ്മികള് തുടങ്ങിയവയും ഉപയോഗിക്കാറുണ്ട്.
3. ക്ലോറോഫോം, കാര്ബണ് ടെട്രാക്ലോറൈഡ് ലായകങ്ങള്, കൃത്രിമ പ്ലാസ്റ്റിക്, കൃത്രിമ റബ്ബര്, പി.വി.സി. തുടങ്ങിയ വസ്തുക്കളും രാസവസ്തുക്കളും നിര്മിക്കാന് ക്ലോറിന് പ്രയോജനപ്പെടുത്തിവരുന്നു. കമ്പിളി ചുരുങ്ങിപ്പോകാതിരിക്കാന് ക്ലോറിന്റെ ഒരു സംയുക്തം (ബ്ലിച്ചിങ് പൗഡര്) ഉപയോഗിക്കുന്നു.
4. ബ്ലിച്ചിങ് പൗഡര്, ഡി.ഡി.റ്റി., ഗമാക്സിന് ഇവ നിര്മിക്കാനും ചിലതരം വായുശുദ്ധീകരണികള്, കീടങ്ങളെ തടുക്കുവാനുള്ള വസ്തുക്കള് തുടങ്ങിയവയുടെ നിര്മാണത്തിനും ക്ലോറിന് ഉപയോഗിക്കുന്നു.
5. അകാര്ബണിക രസതന്ത്രത്തിലെ പല വസ്തുക്കളും-ക്ലോറേറ്റുകള്, പെര്ക്ലോറേറ്റുകള്, ബ്രോമിന്, ഹൈഡ്രോക്ലോറിക് അംമ്ലംതുടങ്ങിയവയുടെ നിര്മാണത്തില് ക്ലോറിന് അത്യന്താപേക്ഷിതമാണ്.
6. സ്വര്ണം, പ്ലാറ്റിനം തുടങ്ങിയ കുലീനലോഹങ്ങള് അവയുടെ അയിരില്നിന്നും വേര്തിരിച്ചെടുക്കാന് ക്ലോറിന് 'സംയുക്തം' (അക്വാറീജിയ) ആവശ്യമാണ്.
7. ഫോസ്ജീന്, ടിയര്ഗ്യാസ്, മസ്റ്റേര്ഡ്ഗ്യാസ് തുടങ്ങിയ വിഷവാതകങ്ങള് ഉത്പാദിപ്പിക്കാന് ക്ലോറിനോ തത്സംയുക്തങ്ങളോ ഉപയോഗിക്കുന്നു. ക്ലോറിന്വാതകത്തെ തിരിച്ചറിയുന്നത് താഴെപ്പറയുന്ന ഉപാധികളാണ്:
(i) വാതകത്തിനു ഹരിത-പീതവര്ണവും പ്രത്യേകതരത്തിലുള്ള അസുഖകരമായ ഗന്ധവുമുണ്ട്.
(ii) 'സ്റ്റാര്ച്ച് അയഡൈഡി'ല് മുക്കിയ കടലാസിനെ ക്ലോറിന് കടുംനീലയാക്കി മാറ്റുന്നു. സ്റ്റാര്ച്ച് അയഡൈഡില്നിന്ന് അയഡിന്മൂലകത്തെ വിമുക്തമാക്കുന്നതുകൊണ്ടാണ് ഇങ്ങനെ സംഭവിക്കുന്നത്.
(iii) ലിറ്റ്മസ് പേപ്പറിനെയും ഇന്ഡിഗോ ലായനിയെയും വര്ണരഹിതമാക്കുന്നു (ക്ലോറിന്റെ ശ്വേതീകരണസ്വഭാവം).
ഐസോടോപ്പുകള്.
ക്ലോറിന്റെ അറ്റോമിക ഭാരം 35.45 ആണെങ്കിലും ഇതില് 75 ശതമാനവും '35' അറ്റോമിക ഭാരമുള്ള ക്ലോറിനും 25 ശതമാനത്തോളം '37' അറ്റോമിക ഭാരമുള്ള ക്ലോറിനുമാണ്. 33, 34, 36, 38 എന്നിങ്ങനെ അറ്റോമിക ഭാരമുള്ള റേഡിയോ ആക്റ്റീവ് ക്ലോറിനും കൃത്രിമമായി നിര്മിച്ചെടുക്കാന് കഴിഞ്ഞിട്ടുണ്ട്. Cl36 ക്ലോറിന് രാസപ്രവര്ത്തന മെക്കാനിസം പഠിക്കാന് ട്രേസര് ആയി ഉപയോഗിക്കുന്നു.
ജീവജാലങ്ങളില്.
ക്ലോറിന് സ്വതന്ത്രാവസ്ഥയില് ജീവജാലങ്ങളില് നിലനില്ക്കുകയില്ല. എന്നാല് ക്ലോറൈഡ് രൂപത്തില് (ഉദാ. സോഡിയം ക്ലോറൈഡ്, പൊട്ടാസ്യം ക്ലോറൈഡ്) ജന്തുജാലങ്ങളിലും സസ്യജാലങ്ങളിലും അടങ്ങിയിരിക്കുന്നു. മാത്രമല്ല, ജന്തുക്കള്ക്കും സസ്യങ്ങള്ക്കുംവേണ്ട ഒരവശ്യ പോഷകഘടകമാണ് ക്ലോറൈഡ്. സസ്യങ്ങള് പല പോഷകങ്ങളും മണ്ണില്നിന്നു വലിച്ചെടുക്കുന്നത് അവയുടെ ക്ലോറൈഡു ലവണങ്ങളായാണ്. സസ്യകോശങ്ങളിലെ ഓസ്മോസികമര്ദം നിലനിര്ത്താനും ക്ലോറൈഡ് ഉള്പ്പെടെയുള്ള അയോണുകള് സഹായിക്കുന്നു.
ഒരു പോഷകഘടകമെന്ന നിലയില് ക്ലോറൈഡ് മനുഷ്യനും അത്യാവശ്യമാണ്. മനുഷ്യകോശങ്ങളിലെയും രക്തത്തിലെയും അയോണുകളുടെ സാന്ദ്രത സന്തുലിതമാക്കി നിര്ത്താന് ക്ലോറൈഡ് ആവശ്യമാണ്. ക്ലോറിന്റെ തൊട്ടടുത്ത 'ബന്ധു'വായ ഫ്ളൂറിന്റെ ആവശ്യകത ഇപ്പോഴും സംശയാതീതമായി തെളിയിക്കപ്പെട്ടിട്ടില്ല. ദന്തക്ഷയം ചെറുക്കുന്നതിലും മറ്റും ഫ്ളൂറിനുള്ള പങ്ക് ചില ശാസ്ത്രജ്ഞന്മാര് വാഴ്ത്തുന്നുണ്ടെങ്കിലും പോഷണപരമായി അത് പ്രാധാന്യമര്ഹിക്കുന്നില്ല. നമ്മുടെ മിക്കവാറും എല്ലാ ആഹാരസാധനങ്ങളിലും ക്ലോറൈഡ് കലര്ന്നിരിക്കും. ഉദാ. കറിയുപ്പ്. അതുകൊണ്ട് ക്ലോറൈഡിന്റെ അഭാവം മനുഷ്യനില് കാണാറില്ല. ശക്തിയായ വയറിളക്കം, ഛര്ദി തുടങ്ങിയവ ഉണ്ടാകുന്ന ഘട്ടങ്ങളില് ശരീരത്തില്നിന്ന് ക്ലോറൈഡ് ലവണങ്ങള് നഷ്ടപ്പെട്ടേക്കാം. പ്രസ്തുത സന്ദര്ഭങ്ങളില് സോഡിയം ക്ലോറൈഡ് അടങ്ങിയ പാനീയങ്ങള് കഴിക്കേണ്ടതുണ്ട്. മനുഷ്യശരീരത്തിലെ ഒരു ദഹനരസമായ ആമാശയരസത്തിലെ ഒരു പ്രധാന ഘടകമാണ് ഹൈഡ്രോ ക്ലോറിക് അംമ്ലം. ക്ലോറൈഡ്, ബ്രോമൈഡ് തുടങ്ങിയ അയോണുകള് കോശസ്തരംവഴി ബൈകാര്ബണേറ്റ് തുടങ്ങിയ അയോണുകളെക്കാള് വേഗത്തില് കോശങ്ങള്ക്കുള്ളില് പ്രവേശിക്കും. മനുഷ്യരക്തത്തിലെ പ്ലാസ്മയിലെ ക്ലോറൈഡ് അയോണിന്റെ (Cl-) സാന്ദ്രത 100-110 meq/l (മില്ലി ഇക്വവലന്റ്/ലിറ്റര്) ആണ്. ശരാശരി നിലവാരത്തിലുള്ള ആഹാരത്തില്നിന്ന് ഒരു മനുഷ്യനു പ്രതിദിനം ഉദ്ദേശം (200 meq/l) സോഡിയത്തിന്റെയും ക്ലോറൈഡിന്റെയും അയോണുകള് ലഭിക്കും. ഇതില് ഭൂരിഭാഗവും മൂത്രത്തില്ക്കൂടി വിസര്ജിക്കപ്പെടുന്നു. ക്ലോറൈഡ് ആണ് മൂത്രത്തില് കണ്ടുവരുന്ന ഏറ്റവും പ്രധാനപ്പെട്ട ആനയോണ് (anion). വിസര്ജിക്കപ്പെടുന്ന ക്ലോറൈഡിന്റെയും ഉള്ളില്ച്ചെന്ന ക്ലോറൈഡിന്റെയും അളവുകള് ഏകദേശം തുല്യമായിരിക്കും. സെറിബ്രോ-സ്പൈനല് ദ്രാവകത്തില് ക്ലോറൈഡിന്റെ സാന്ദ്രത പ്ലാസ്മയിലെക്കാള് കൂടുതലാണ്. (125meq/l). ചുവന്ന രക്താണുവില് ഇതിന്റെ സാന്ദ്രത 90-95 meq/l ആണ്. സെല്ലിനു പുറത്തുള്ള ദ്രാവകങ്ങളിലെ ക്ലോറൈഡിന്റെയും (Cl-) ബൈകാര്ബണേറ്റിന്റെയും (HCO3)അനുപാതം-അതായത് [Cl-] / [H CO-3], ആയിരിക്കും. ഇതില്വരുന്ന പ്രകടമായ വ്യത്യാസങ്ങള്, അസിഡോസിസ് തുടങ്ങിയ രോഗാവസ്ഥകളുടെ ലക്ഷണങ്ങളായിരിക്കാം. പാന്ക്രിയാസിലെയും ഉമിനീരിലെയും 'അമിലേസ്' എന്ന ആഗ്നേയരസം പ്രവര്ത്തിക്കുന്നതിന് ക്ലോറൈഡ് അയോണുകളുടെ സാന്നിധ്യം അത്യാവശ്യമാണ്. അഡ്രിനല് കോര്ട്ടക്സില് ഉത്പാദിപ്പിക്കപ്പെടുന്ന അല്ഡോസ്റ്റിറോണ്, ഡി ഓക്സി കോര്ട്ടിക്കോസ്റ്റിറോണ് തുടങ്ങിയ ഹോര്മോണുകള്, കോശദ്രാവകങ്ങളിലും മൂത്രത്തിലുമുള്ള ക്ലോറൈഡ് അയോണുകളുടെ സാന്ദ്രതയിലും മറ്റും സ്വാധീനം ചെലുത്താന് കഴിവുള്ളവയാണ്. നോ. കാര്ബണ് ടെട്രാക്ലോറൈഡ്; ക്ലോറോഫോം
(വി.എസ്. ഗോവിന്ദന് നമ്പൂതിരി)