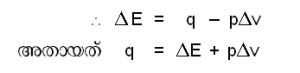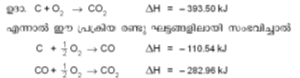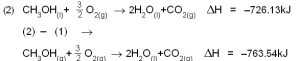This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
തെര്മോകെമിസ്ട്രി
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
തെര്മോകെമിസ്ട്രി
Thermochemistry
രാസപ്രക്രിയകള്, പദാര്ഥങ്ങളുടെ ഭൗതികാവസ്ഥയിലുണ്ടാകുന്ന മാറ്റങ്ങള് തുടങ്ങിയവയുമായി ബന്ധപ്പെട്ടുണ്ടാകുന്ന താപ വ്യതിയാനങ്ങളെക്കുറിച്ചു പഠിക്കുന്ന രസതന്ത്രശാഖ. താപം ഉത്പാദിപ്പിക്കുന്ന പ്രവര്ത്തനങ്ങളെ താപമോചക (exothermic) പ്രവര്ത്തനങ്ങളെന്നും താപം ആഗിരണം ചെയ്യുന്ന പ്രവര്ത്തനങ്ങളെ താപശോഷക (endothermic) പ്രവര്ത്തനങ്ങളെന്നുമാണ് വിളിക്കുന്നത്. പ്രതിപ്രവര്ത്തനങ്ങളിലെ രാസാകര്ഷണം (chemical affinity), സ്വതന്ത്ര ഊര്ജം (free energy) എന്നിവ കണക്കാക്കുന്നതിന് താപവ്യതിയാനങ്ങളെക്കുറിച്ചുള്ള ഈ അറിവ് ഉപകരിക്കുന്നു. താപവ്യതിയാനങ്ങള് കിലോ ജൂള്സിലാണ് അളക്കുന്നത്.
ഊര്ജ സംരക്ഷണ നിയമ (law of conservation of energy)മാണ് തെര്മോ കെമിസ്ട്രിയുടെ അടിസ്ഥാനം. ഒരു രാസ വ്യവസ്ഥ രാസ പരിവര്ത്തനത്തിനു വിധേയമാകുമ്പോള് ആന്തരിക ഊര്ജത്തിനുണ്ടാകുന്ന വ്യത്യാസം ΔH, ആഗിരണം ചെയ്യപ്പെടുന്ന താപം q, രാസവ്യവസ്ഥയില് നടക്കുന്ന പ്രവര്ത്തനം (work) w, എന്നിവയെ ബന്ധിപ്പിക്കുന്നത് ΔE=q-w എന്ന സമവാക്യമാണ്. ΔE ഋണ സംഖ്യയാണെങ്കില് ആന്തരിക ഊര്ജത്തില് കുറവ് സംഭവിക്കുന്നു എന്നര്ഥം. അതായത് ഈ പ്രക്രിയ ഊര്ജം ഉത്പാദിപ്പിക്കുന്ന ഒരു താപമോചക പ്രക്രിയയായിരിക്കും. സ്ഥിരമായ താപത്തിലും വ്യാപ്തത്തിലും നടക്കുന്ന പ്രക്രിയകള്ക്ക് ΔE=q ആയിരിക്കും. സ്ഥിരമര്ദത്തില് w=pΔv(Δv- വ്യാപ്തത്തിലുണ്ടാകുന്ന വ്യത്യാസം).
ഊര്ജ ആഗിരണ വിമോചനങ്ങളെ (q), ആ വ്യവസ്ഥയുടെ എന്ഥാല്പി മാറ്റം (ΔH) ആയാണ് കണക്കാക്കുന്നത്.
q=ΔH; ΔE+pΔv=ΔH
അപ്പോള് H = E + PV ( സ്ഥിരമര്ദ്ദത്തില്)
ഗിബ്സ് - ഹെല്മ്ഹോള്ട്സ് സമവാക്യം, വാന്ഹോഫ് സമവാക്യം, ക്ലൗസീയസ്-ക്ലാപിറോണ് സമവാക്യം എന്നിവയുപയോഗിച്ച് പരോക്ഷമായി ΔH നിര്ണയിക്കാം.
ആദ്യത്തെ തെര്മോ കെമിക്കല് നിയമം നിര്ദേശിച്ചത് എ.എല്. ലാവോസിയര്, പി.എസ്. ലാപ്ലേസ് എന്നിവരാണ് (1780). ഈ നിയമമനുസരിച്ച് ഒരു സംയുക്തം മൂലകങ്ങളായി വിഘടിക്കാന് ആവശ്യമായ താപം, മൂലകങ്ങളില്നിന്ന് ആ സംയുക്തം ഉണ്ടാകുമ്പോള് ഉത്പാദിപ്പിക്കപ്പെടുന്ന താപത്തിന് തുല്യമായിരിക്കും. അതായത് ഒരു സംയുക്തത്തിന്റെ വിഘടന താപ(heat of decomposition)വും രൂപീകരണ താപ(heat of formation)വും എതിര് ചിഹ്നത്തോടു കൂടിയതെങ്കിലും സാംഖ്യികമായി തുല്യമായിരിക്കും എന്നാണ് ഈ നിയമം പറയുന്നത്.
തെര്മോ കെമിസ്ട്രിയിലെ രണ്ടാമത്തെ നിയമം നിര്ദേശിച്ചത് ജി.എച്ച്. ഹെസ്സ് ആണ് (1840). ഹെസ്സ് നിയമം അഥവാ പ്രിന്സിപ്പിള് ഒഫ് കോണ്സ്റ്റന്റ് ഹീറ്റ് സമ്മേഷന് (Principle of constant heat summation) എന്ന നിയമം തെര്മോ കെമിക്കല് നിയമങ്ങളില് ഏറ്റവും പ്രാധാന്യമര്ഹിക്കുന്നു. ഒരു രാസപ്രക്രിയയില് ഉത്പാദിപ്പിക്കപ്പെടുന്നതോ ആഗിരണം ചെയ്യപ്പെടുന്നതോ ആയ താപം, പ്രാരംഭ പദാര്ഥങ്ങളെയും അന്തിമ ഉത്പന്നങ്ങളെയും മാത്രമേ ആശ്രയിക്കുന്നുള്ളൂ എന്നും മറിച്ച് ഇടയ്ക്കു നടക്കുന്ന രാസപ്രവര്ത്തനങ്ങളുമായി യാതൊരു ബന്ധവുമില്ല എന്നും ഈ നിയമം നിര്ദേശിക്കുന്നു. ഉദാ: C+O2→CO2 എന്നാല് ഈ പ്രക്രിയ രണ്ടു ഘട്ടങ്ങളിലായി സംഭവിച്ചിച്ചാല്
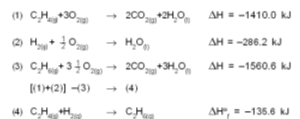
ഈ രണ്ട് ഘടക പ്രക്രിയകളുടേയും മൊത്തം താപം, കാര്ബണില്നിന്നു നേരിട്ട് co2 ഉണ്ടാക്കുന്നതിനു തുല്യമാണ്. -393.50 kJ എന്ന സംഖ്യ കാര്ബണിന്റെ ദഹനതാപം (heat of combustion) ആണ്. ഇത് ഒരു സ്ഥിരസംഖ്യയായിരിക്കും. സംഭവിക്കാന് ബുദ്ധിമുട്ടുള്ളതോ അസാധ്യമായതോ ആയ പല പ്രതിപ്രവര്ത്തനങ്ങളുടെയും എന്ഥാല്പി കണക്കാക്കുന്നതിന് 'ഹെസ്സ് നിയമം' ഉപയോഗപ്രദമാണ്. ഉദാ. ഗ്രാഫൈറ്റ് വജ്രമാകുമ്പോഴുണ്ടാകുന്ന താപ വ്യതിയാനം. ഈ പ്രക്രിയ സാധാരണ സാഹചര്യങ്ങളില് തികച്ചും അസംഭവ്യമാണ്. എന്നാല് രണ്ടു ജ്വലന പ്രക്രിയകളില്നിന്ന് ഈ പ്രക്രിയയുടെ എന്ഥാല്പി കണക്കാക്കാനാകും.
Cgr+O2→CO2 ΔH=-393.50kJ
Cdia+O2→CO2 ΔH=-395.4kJ
ഈ രണ്ട് പ്രക്രിയകള് തമ്മിലുള്ള എന്ഥാല്പി വ്യത്യാസമായ -1.88 kJ ആണ് ഗ്രാഫൈറ്റ് വജ്രമാകുന്നതിനുവേണ്ട പ്രതിക്രിയാ താപം (haet of reaction). അഭികാരകങ്ങളും ഉത്പന്നങ്ങളും 250C-ല് ആയിരിക്കുമ്പോള് ഉത്പാദിപ്പിക്കുന്നതോ ആഗിരണം ചെയ്യപ്പെടുന്നതോ ആയ താപമാണ് പ്രതിക്രിയാതാപമായി കണക്കാക്കുന്നത്. അഭികാരകങ്ങളുടെയും ഉത്പന്നങ്ങളുടെയും താപധാരിത (haet of capacity) അറിയാമെങ്കില് മറ്റു താപനിലകളിലെ പ്രതിക്രിയാതാപം പ്രവചിക്കാനാവും. എല്ലാ അഭികാരകങ്ങളുടെയും ഉത്പന്നങ്ങളുടെയും ദഹന താപം അറിയാമെങ്കില് പ്രതിക്രിയാതാപം കണ്ടുപിടിക്കാനാവും എന്നതാണ് ഹെസ്സ് നിയമത്തിന്റെ മറ്റൊരു ഉപയോഗം.
പ്രാമാണികാവസ്ഥ(standard state)യില് എല്ലാ മൂലകങ്ങളുടെയും എന്ഥാല്പി പൂജ്യമായാണ് കണക്കാക്കിയിട്ടുള്ളത്. അതിനാല് ഒരു സംയുക്തത്തിന്റെ എന്ഥാല്പി, അതിന്റെ സംഭവന ഊഷ്മാവ് (heat of formation)ΔH0f -ന് തുല്യമായിരിക്കും.
ഭൗതിക മാറ്റങ്ങളുടെ താപവ്യതിയാനങ്ങളും പ്രാധാന്യമര്ഹിക്കുന്നവയാണ്. ഉദാ. ഒരു ഗ്രാംമോള് മെതനോള് ബാഷ്പീകരിക്കുന്ന പ്രക്രിയ ഇപ്രകാരമാണ്.
ഹെസ്സ് നിയമം അനുസരിച്ച് ഈ പ്രക്രിയയും ദ്രവ മെതനോളിന്റെ ദഹന പ്രക്രിയയും ചേര്ത്ത് മെതനോളിന്റെ ദഹന താപം കണ്ടുപിടിക്കാനാവും.
മെതനോള് സംശ്ലേഷണത്തിനുവേണ്ട താപ ക്രമീകരണങ്ങള്ക്ക് ഈ അറിവ് പ്രയോജനപ്രദമാണ്.
ലായനീകരണ താപം (heat of solution), ലായനികളെ നേര്പ്പിക്കുമ്പോഴുണ്ടാകുന്ന താപം (heat of dilutioon) തുടങ്ങിയവയും തെര്മോ കെമിസ്ട്രിയില് പഠനവിധേയമാണ്.