This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ഡൈബോറേന്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
(→ഡൈബോറേന്) |
|||
| (ഇടക്കുള്ള 9 പതിപ്പുകളിലെ മാറ്റങ്ങള് ഇവിടെ കാണിക്കുന്നില്ല.) | |||
| വരി 7: | വരി 7: | ||
[[Image:p59.png|300px|center]] | [[Image:p59.png|300px|center]] | ||
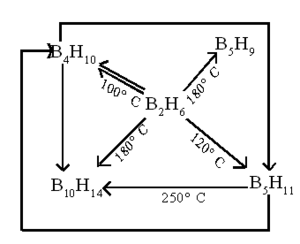
| - | '''ഗുണധര്മങ്ങള്.''' താഴ് ന്ന ഊഷ്മാവില് സ്ഥിരതയുള്ള ഒരു വാതകമാണ് ഡൈബോറേന്. 100-250°C വരെയുള്ള താപനില കളില് സങ്കീര്ണമായ പലപ്രതിപ്രവര്ത്തനങ്ങളില് ഏര്പ്പെടുകയും മറ്റ് ബോറേനുകള് രൂപീകരിക്കുകയും ചെയ്യുന്നു. | + | |
| - | [[Image:p60a.png|300px|center]] | + | '''ഗുണധര്മങ്ങള്.''' താഴ് ന്ന ഊഷ്മാവില് സ്ഥിരതയുള്ള ഒരു വാതകമാണ് ഡൈബോറേന്. 100-250°C വരെയുള്ള താപനില കളില് സങ്കീര്ണമായ പലപ്രതിപ്രവര്ത്തനങ്ങളില് ഏര്പ്പെടുകയും മറ്റ് ബോറേനുകള് രൂപീകരിക്കുകയും ചെയ്യുന്നു.[[Image:p60a.png|300px|center]] |
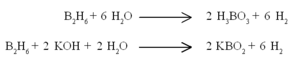
ഡൈബോറേനും മറ്റ് ബോറേനുകളും ഓക്സിജനും തമ്മിലുള്ള പ്രതിപ്രവര്ത്തനം താപമോചക പ്രക്രിയകളാണ്. | ഡൈബോറേനും മറ്റ് ബോറേനുകളും ഓക്സിജനും തമ്മിലുള്ള പ്രതിപ്രവര്ത്തനം താപമോചക പ്രക്രിയകളാണ്. | ||
| + | [[Image:p60b.png|300px|center]] | ||
| - | + | ജലവുമായി ബോറിക് അമ്ളവും ഗാഢ ആല്ക്കലിയുമായി മെറ്റാബോറേറ്റുമുണ്ടാവുന്നു. | |
| - | + | [[Image:p60c.png|300px|center]] | |
| - | + | ||
| - | + | ||
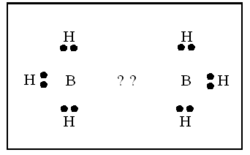
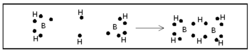
| - | + | ബോറേനുകള് ന്യൂന ഇലക്ട്രോണ് യൌഗികങ്ങളാണ്. പങ്കു വയ്ക്കാന് പ്രാപ്തമായ മൂന്ന് ഇലക്ട്രോണുകളാണ് ബോറോണിനുള്ളത്. അതിനാല് ഓരോ ബോറോണിനും മൂന്ന് ഹൈഡ്രജനുമായി ബന്ധപ്പെടുവാന് സാധിക്കും. അങ്ങനെ വരുമ്പോള് രണ്ട് ബോറോണുകള് തമ്മില് ബന്ധം രൂപീകരിക്കുന്നതിന് ഇലക്ട്രോണുകള് ശേഷിക്കുന്നില്ല.[[Image:p60d.png|250x250px|right]] | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | |||
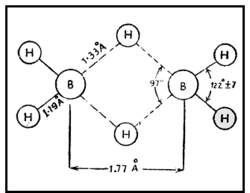
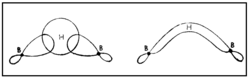
| - | + | ഇലക്ട്രോണ് വിഭംഗനം വഴിയും ഇന്ഫ്രാറെഡ് സ്പെക് ട്രോസ്കോപികപരീക്ഷണങ്ങളിലൂടെയും ഡൈബോറേനിന്റെ ഘടന നിര്ണയിച്ചിട്ടുണ്ട്. ഇരുവശങ്ങളിലുമുള്ള ടെര്മിനല് ഹൈഡ്രജനുകള് നടുവിലുള്ള ബ്രിഡ്ജിങ് ഹൈഡ്രജനുകളില് നിന്നു വ്യത്യസ്തമായ ഒരു പരിസ്ഥിതിയിലാണ് സ്ഥിതി ചെയ്യുന്നത്. [[Image:p60e.png|250x250px|left]]രണ്ട് ബോറോണ് അണുകങ്ങളും നാല് ടെര്മിനല് ഹൈഡ്രജനുകളും ഒരേ തലത്തിലാണ്. എന്നാല് രണ്ട് ബ്രിഡ്ജിങ് ഹൈഡ്രജനുകള് ഈ തലത്തിനു ലംബമായി മുകളിലും താഴെയുമായി സ്ഥിതി ചെയ്യുന്നു. അപേക്ഷിക താപം, ന്യൂക്ളിയര് മാഗ്നറ്റിക് റെസൊണെന്സ് സ്പെക്ട്രാ, രാമന് സ്പെക്ട്രാ എന്നിവ ഈ ഘടനയെ സാധൂകരിക്കുന്നു. B-H-B ബന്ധം ഒരു ത്രികേന്ദ്ര ദ്വിഇലക്ട്രോണ് ബന്ധം (three centre electron pair bond) എന്നാണറിയപ്പെടുന്നത്. മൂന്ന് അണുകേന്ദ്രങ്ങളും രണ്ട് ഇലക്ട്രോണുകളും മാത്രമുള്ള സന്ദര്ഭത്തില് മൂന്ന് അണുകഓര്ബിറ്റലുകളുടെ അതിവ്യാപനത്താല് ഒരു തന്മാത്രീയ ഓര്ബിറ്റല് ഉണ്ടാകുന്നു. ഇതില് ഒരു ഇലക്ട്രോണ് യുഗ്മത്താല് മൂന്ന് അണുകങ്ങള് പരസ്പരം ബന്ധിച്ചിരിക്കും. [[Image:p60f.png|250px|center]]രണ്ട് BH<sub>2</sub> ഘടകങ്ങളേയും ബ്രിഡ്ജിങ്ങ് ഹൈഡ്രജനേയും പ്രത്യേകമായി പഠിക്കുക വഴി B-H-B ബന്ധം വിശദീകരിക്കാനാവും. ഓരോ ബോറോണിലും ഒരു ഒറ്റ ഇലക്ട്രോണ് ഉള്ളതായി കാണാം. ബ്രിഡ്ജിങ് ഹൈഡ്രജനിലുള്ള ഇലക്ട്രോണിനെ ഈ ഇലക്ട്രോണ് വലിക്കുന്നതിനാല് ഈ രണ്ട് ഇലക്ട്രോണുകള് രണ്ട് ബോറോണുകളിലേക്കും ഹൈഡ്രജനിലേക്കും മാറി മാറി സഞ്ചരിക്കുന്നു.[[Image:p60g.png|250x250px|right]] ഇപ്രകാരം B-H-B ബന്ധം സ്ഥാപിക്കപ്പെടുന്നു. ഓരോ ബോറോണ് അണുവിന്റെയും സങ്കര ഓര്ബിറ്റല് (hybrid orbital) ഹൈഡ്രജന്റെ 1 S ഓര്ബിറ്റലുമായി അതിവ്യാപനം ചെയ്ത് ഒരു തന്മാത്രീയ ഓര്ബിറ്റല് ഉണ്ടാകുന്നു. ഹൈഡ്രജന് അണുകേന്ദ്രങ്ങള് തമ്മിലുള്ള വികര്ഷണം മൂലം ബ്രിഡ്ജിങ് ബന്ധം മുകളിലേക്ക് വളഞ്ഞിരിക്കുന്നതായി കാണാം. അതേ തന്മാത്രയിലെ രണ്ടാമത്തെ B-H-B ബന്ധം താഴേക്കും വളഞ്ഞിരിക്കും. | |
| - | ഇലക്ട്രോണ് വിഭംഗനം വഴിയും ഇന്ഫ്രാറെഡ് സ്പെക് ട്രോസ്കോപികപരീക്ഷണങ്ങളിലൂടെയും ഡൈബോറേനിന്റെ ഘടന നിര്ണയിച്ചിട്ടുണ്ട്. ഇരുവശങ്ങളിലുമുള്ള ടെര്മിനല് | + | |
Current revision as of 08:43, 12 ജൂണ് 2008
ഡൈബോറേന്
Diborane
ഒരു ബോറോണ്-ഹൈഡ്രജന് സംയുക്തം. ബോറോണ് ഹൈ ഡ്രൈഡുകളെ പൊതുവേ ബോറേനുകളെന്നാണ് പറയുന്നത്. പേരു സൂചിപ്പിക്കുന്നതുപോലെ ഡൈബോറേന് രണ്ട് ബോറോണ് അണുക്കളടങ്ങുന്ന ഹൈഡ്രൈഡാണ്. ഫോര്മുല B2H6. ബോറോണ് മൂന്നാമത്തെ ഗ്രൂപ്പില്പ്പെടുന്ന മൂലകമായതിനാല് ബോറോണ്ട്രൈഹൈഡ്രൈഡ് (BH3) എന്ന സംയുക്തം രൂപീകരിക്കുമെന്നാണ് പ്രതീക്ഷിക്കുക. എന്നാല് BH3 വളരെ അസ്ഥിരമായ ഒരു സംയുക്തമാണ്. B2H6,B4H10 തുടങ്ങിയ ഉയര്ന്ന ഹൈഡ്രൈഡുകളാണ് സ്ഥിരതയുള്ളവ. ഇവയിലേറ്റവും ലഘുവും പ്രാധാന്യമര്ഹിക്കുന്നതുമായ ഹൈഡ്രൈഡാണ് B2H6.
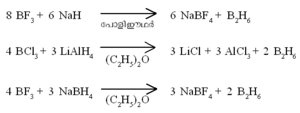
ഹൈഡ്രജനുമായി ബോറോണ് നേരിട്ട് പ്രതിപ്രവര്ത്തിക്കു ന്നില്ല. ബോറോണ് ഹാലൈഡുകളുടെ അപചയം വഴി ഡൈബോ റേന് ഉണ്ടാവുന്നു.
ഡൈബോറേനും മറ്റ് ബോറേനുകളും ഓക്സിജനും തമ്മിലുള്ള പ്രതിപ്രവര്ത്തനം താപമോചക പ്രക്രിയകളാണ്.
ജലവുമായി ബോറിക് അമ്ളവും ഗാഢ ആല്ക്കലിയുമായി മെറ്റാബോറേറ്റുമുണ്ടാവുന്നു.