This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ഡൈബോറേന്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
(→ഡൈബോറേന്) |
|||
| വരി 8: | വരി 8: | ||
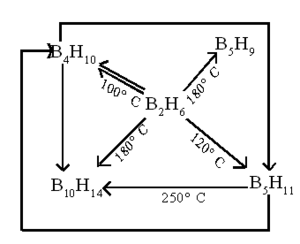
'''ഗുണധര്മങ്ങള്.''' താഴ് ന്ന ഊഷ്മാവില് സ്ഥിരതയുള്ള ഒരു വാതകമാണ് ഡൈബോറേന്. 100-250°C വരെയുള്ള താപനില കളില് സങ്കീര്ണമായ പലപ്രതിപ്രവര്ത്തനങ്ങളില് ഏര്പ്പെടുകയും മറ്റ് ബോറേനുകള് രൂപീകരിക്കുകയും ചെയ്യുന്നു. | '''ഗുണധര്മങ്ങള്.''' താഴ് ന്ന ഊഷ്മാവില് സ്ഥിരതയുള്ള ഒരു വാതകമാണ് ഡൈബോറേന്. 100-250°C വരെയുള്ള താപനില കളില് സങ്കീര്ണമായ പലപ്രതിപ്രവര്ത്തനങ്ങളില് ഏര്പ്പെടുകയും മറ്റ് ബോറേനുകള് രൂപീകരിക്കുകയും ചെയ്യുന്നു. | ||
| - | [[Image:p60a.png|300px| | + | [[Image:p60a.png|300px|left]] |
ഡൈബോറേനും മറ്റ് ബോറേനുകളും ഓക്സിജനും തമ്മിലുള്ള പ്രതിപ്രവര്ത്തനം താപമോചക പ്രക്രിയകളാണ്. | ഡൈബോറേനും മറ്റ് ബോറേനുകളും ഓക്സിജനും തമ്മിലുള്ള പ്രതിപ്രവര്ത്തനം താപമോചക പ്രക്രിയകളാണ്. | ||
08:32, 12 ജൂണ് 2008-നു നിലവിലുണ്ടായിരുന്ന രൂപം
ഡൈബോറേന്
Diborane
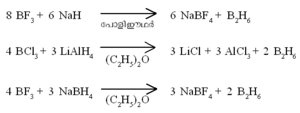
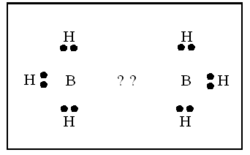
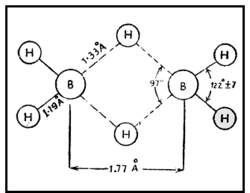
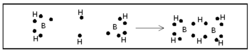
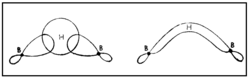
ഒരു ബോറോണ്-ഹൈഡ്രജന് സംയുക്തം. ബോറോണ് ഹൈ ഡ്രൈഡുകളെ പൊതുവേ ബോറേനുകളെന്നാണ് പറയുന്നത്. പേരു സൂചിപ്പിക്കുന്നതുപോലെ ഡൈബോറേന് രണ്ട് ബോറോണ് അണുക്കളടങ്ങുന്ന ഹൈഡ്രൈഡാണ്. ഫോര്മുല B2H6. ബോറോണ് മൂന്നാമത്തെ ഗ്രൂപ്പില്പ്പെടുന്ന മൂലകമായതിനാല് ബോറോണ്ട്രൈഹൈഡ്രൈഡ് (BH3) എന്ന സംയുക്തം രൂപീകരിക്കുമെന്നാണ് പ്രതീക്ഷിക്കുക. എന്നാല് BH3 വളരെ അസ്ഥിരമായ ഒരു സംയുക്തമാണ്. B2H6,B4H10 തുടങ്ങിയ ഉയര്ന്ന ഹൈഡ്രൈഡുകളാണ് സ്ഥിരതയുള്ളവ. ഇവയിലേറ്റവും ലഘുവും പ്രാധാന്യമര്ഹിക്കുന്നതുമായ ഹൈഡ്രൈഡാണ് B2H6.
ഹൈഡ്രജനുമായി ബോറോണ് നേരിട്ട് പ്രതിപ്രവര്ത്തിക്കു ന്നില്ല. ബോറോണ് ഹാലൈഡുകളുടെ അപചയം വഴി ഡൈബോ റേന് ഉണ്ടാവുന്നു.
ഗുണധര്മങ്ങള്. താഴ് ന്ന ഊഷ്മാവില് സ്ഥിരതയുള്ള ഒരു വാതകമാണ് ഡൈബോറേന്. 100-250°C വരെയുള്ള താപനില കളില് സങ്കീര്ണമായ പലപ്രതിപ്രവര്ത്തനങ്ങളില് ഏര്പ്പെടുകയും മറ്റ് ബോറേനുകള് രൂപീകരിക്കുകയും ചെയ്യുന്നു.
ഡൈബോറേനും മറ്റ് ബോറേനുകളും ഓക്സിജനും തമ്മിലുള്ള പ്രതിപ്രവര്ത്തനം താപമോചക പ്രക്രിയകളാണ്.
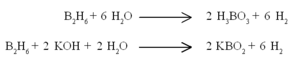
ജലവുമായി ബോറിക് അമ്ളവും ഗാഢ ആല്ക്കലിയുമായി മെറ്റാബോറേറ്റുമുണ്ടാവുന്നു.