This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ഡൈപോള് മൊമന്റ് (തന്മാത്രീ
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
| (ഇടക്കുള്ള 2 പതിപ്പുകളിലെ മാറ്റങ്ങള് ഇവിടെ കാണിക്കുന്നില്ല.) | |||
| വരി 10: | വരി 10: | ||
ചാര്ജുകളുടെ ഈ വിസ്ഥാപനം വിദ്യുത്കാന്തിക ആഘൂര്ണങ്ങള്ക്ക് സമാനവും വിസ്ഥാപിത ചാര്ജി(Z)ന്റേയും അണുകങ്ങള്ക്കിടയിലെ അകലത്തി(l)ന്റേയും ഗുണനത്തിനു തുല്യവും ആയ ഒരു ഡൈപോള് മൊമന്റ് (ദ്വിധ്രുവ ആഘൂര്ണം) (μ) ഉളവാക്കുന്നു. | ചാര്ജുകളുടെ ഈ വിസ്ഥാപനം വിദ്യുത്കാന്തിക ആഘൂര്ണങ്ങള്ക്ക് സമാനവും വിസ്ഥാപിത ചാര്ജി(Z)ന്റേയും അണുകങ്ങള്ക്കിടയിലെ അകലത്തി(l)ന്റേയും ഗുണനത്തിനു തുല്യവും ആയ ഒരു ഡൈപോള് മൊമന്റ് (ദ്വിധ്രുവ ആഘൂര്ണം) (μ) ഉളവാക്കുന്നു. | ||
| - | &mu = Zl | + | μ = Zl |
ഇലക്ട്രോണ് ചാര്ജ് സു. 10<sup>-10</sup> സ്ഥിര വൈദ്യുത ഏകകവും (e.s.u) തന്മാത്രയുടെ വ്യാസം സു. 10<sup>-8</sup> സെ.മീ. ഉം ആയതിനാല് ഡൈപോള് മൊമന്റുകളുടെ പരിധി 10<sup>-18</sup> ആയിരിക്കും. | ഇലക്ട്രോണ് ചാര്ജ് സു. 10<sup>-10</sup> സ്ഥിര വൈദ്യുത ഏകകവും (e.s.u) തന്മാത്രയുടെ വ്യാസം സു. 10<sup>-8</sup> സെ.മീ. ഉം ആയതിനാല് ഡൈപോള് മൊമന്റുകളുടെ പരിധി 10<sup>-18</sup> ആയിരിക്കും. | ||
| വരി 18: | വരി 18: | ||
ഡൈപോള് മൊമന്റ് ഡീബൈ യൂണിറ്റിലാണ് കണക്കാക്കുന്നത്. ഒരു ഡീബൈ യൂണിറ്റ് (D) = 10<sup>-18</sup>esu.cm ഉദാ. HClന്റെ ഡൈപോള് മൊമന്റ് 1.03 x 10<sup>-18</sup> esu.cm = 1.03 D ആണ്. വിവിധ തന്മാത്രകളുടെ ഡൈപോള് മൊമന്റുകള് പട്ടികയില് കാണിച്ചിരിക്കുന്നു. | ഡൈപോള് മൊമന്റ് ഡീബൈ യൂണിറ്റിലാണ് കണക്കാക്കുന്നത്. ഒരു ഡീബൈ യൂണിറ്റ് (D) = 10<sup>-18</sup>esu.cm ഉദാ. HClന്റെ ഡൈപോള് മൊമന്റ് 1.03 x 10<sup>-18</sup> esu.cm = 1.03 D ആണ്. വിവിധ തന്മാത്രകളുടെ ഡൈപോള് മൊമന്റുകള് പട്ടികയില് കാണിച്ചിരിക്കുന്നു. | ||
[[Image:p58a1a.png]] | [[Image:p58a1a.png]] | ||
| + | |||
[[Image:p58a2.png]] | [[Image:p58a2.png]] | ||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
ഇലക്ട്രോണുകളുടെ അസമവിതരണം മൂലം തന്മാത്രകള്ക്ക് സ്ഥിരമായ ഡൈപോള് മൊമന്റുണ്ടായിരിക്കും. ഒരു വിദ്യുത്- കാന്തിക മേഖലയുടെ അഭാവത്തില്പ്പോലും നിലനില്ക്കുന്നതാണ് സ്ഥിര ഡൈപോള് മൊമന്റ്. ഒരു ജല തന്മാത്രയില് രണ്ട് ഹൈഡ്രജന് അണുകങ്ങളും ഓക്സിജന് അണുകവും ഒരു സമപാര്ശ്വ ത്രികോണത്തിന്റെ രൂപത്തിലാണ് വിന്യസിച്ചിരിക്കുന്നത്. ജലതന്മാത്രയില് ഭൂരിഭാഗം ഋണചാര്ജും ഓക്സിജന് അണുകേന്ദ്രത്തിനു ചുറ്റുമായി വ്യാപിക്കുന്നതിനാല് പ്രോട്ടോണുകള് ഏതാണ്ട് സ്വതന്ത്രമായി നിലകൊള്ളുന്നു. | ഇലക്ട്രോണുകളുടെ അസമവിതരണം മൂലം തന്മാത്രകള്ക്ക് സ്ഥിരമായ ഡൈപോള് മൊമന്റുണ്ടായിരിക്കും. ഒരു വിദ്യുത്- കാന്തിക മേഖലയുടെ അഭാവത്തില്പ്പോലും നിലനില്ക്കുന്നതാണ് സ്ഥിര ഡൈപോള് മൊമന്റ്. ഒരു ജല തന്മാത്രയില് രണ്ട് ഹൈഡ്രജന് അണുകങ്ങളും ഓക്സിജന് അണുകവും ഒരു സമപാര്ശ്വ ത്രികോണത്തിന്റെ രൂപത്തിലാണ് വിന്യസിച്ചിരിക്കുന്നത്. ജലതന്മാത്രയില് ഭൂരിഭാഗം ഋണചാര്ജും ഓക്സിജന് അണുകേന്ദ്രത്തിനു ചുറ്റുമായി വ്യാപിക്കുന്നതിനാല് പ്രോട്ടോണുകള് ഏതാണ്ട് സ്വതന്ത്രമായി നിലകൊള്ളുന്നു. | ||
| - | + | ചാര്ജുകളുടെ ഈ വിഭജനം തന്മാത്രയ്ക്ക് സ്ഥിര ഡൈപോള് പ്രദാനം ചെയ്യുന്നു. എന്നാല് H<sub>2</sub>, CO<sub>2</sub>, CH<sub>4</sub>, CCl<sub>4</sub> തുടങ്ങിയ തന്മാത്രകളില് പ്രതിസമമായാണ് ചാര്ജുകളുടെ വിതരണം. അതായത് ഋണചാര്ജുകളുടെ സാന്ദ്രതാകേന്ദ്രം ധനചാര്ജുകളുടെ സാന്ദ്രതാകേന്ദ്രവുമായി സംഗമിക്കുന്നു. ഈ തന്മാത്രകള്ക്ക് ബാഹ്യമായി പ്രയോഗിക്കുന്ന വൈദ്യുത മേഖലയുടെ പ്രഭാവത്താല് ഒരു വേശിത ഡൈപോള് (induced dipole) ഉണ്ടാവാറുണ്ട്. പ്രയുക്ത മേഖലയുടെ പ്രഭാവം തന്മാത്രയുടെ ധ്രുവീകരണക്ഷമത(polarisability)യെ ആശ്രയിച്ചാണിരിക്കുന്നത്. ഏകബലകമായ ഒരു പ്രയുക്ത മേഖലയുടെ പ്രഭാവത്തില് ഉണ്ടാകുന്ന ഡൈപോള് മൊമന്റാണ് ഒരു തന്മാത്രയുടെ ധ്രുവീകരണക്ഷമത. | |
| - | ചാര്ജുകളുടെ ഈ വിഭജനം തന്മാത്രയ്ക്ക് സ്ഥിര ഡൈപോള് പ്രദാനം ചെയ്യുന്നു. എന്നാല് | + | |
| - | |||
ഒരു തന്മാത്രയുടെ ഡൈപോള് മൊമന്റ് വ്യക്തിഗത രാസബന്ധങ്ങളുടെ ഡൈപോള്മൊമന്റുകളുടെ സദിശതുക ആയിരിക്കും. ദ്വിഅണുക തന്മാത്രകളിലും മറ്റ് ലഘുതന്മാത്രകളിലും ഡൈപോള് മൊമന്റും അണുകങ്ങളുടെ ഇലക്ട്രോനെഗറ്റിവതയുടെ വ്യത്യാസവും ആനുപാതികമായിരിക്കും. എന്നാല് സങ്കീര്ണ തന്മാത്രകളില് സ്ഥിതി വ്യത്യസ്തമാണ്. വിവിധ ബോണ്ടുകളുടെ ഡൈപോള് മൊമന്റുകള് പരസ്പരം ശക്തിപ്പെടുത്തുകയോ റദ്ദു ചെയ്യുകയോ ചെയ്യുന്നതാണിതിനു കാരണം. | ഒരു തന്മാത്രയുടെ ഡൈപോള് മൊമന്റ് വ്യക്തിഗത രാസബന്ധങ്ങളുടെ ഡൈപോള്മൊമന്റുകളുടെ സദിശതുക ആയിരിക്കും. ദ്വിഅണുക തന്മാത്രകളിലും മറ്റ് ലഘുതന്മാത്രകളിലും ഡൈപോള് മൊമന്റും അണുകങ്ങളുടെ ഇലക്ട്രോനെഗറ്റിവതയുടെ വ്യത്യാസവും ആനുപാതികമായിരിക്കും. എന്നാല് സങ്കീര്ണ തന്മാത്രകളില് സ്ഥിതി വ്യത്യസ്തമാണ്. വിവിധ ബോണ്ടുകളുടെ ഡൈപോള് മൊമന്റുകള് പരസ്പരം ശക്തിപ്പെടുത്തുകയോ റദ്ദു ചെയ്യുകയോ ചെയ്യുന്നതാണിതിനു കാരണം. | ||
| - | ഉദാ | + | '''''ഉദാ''':''CF<sub>4</sub>, കാര്ബണിന്റെ ഇലക്ട്രോനെഗറ്റിവത 2.5-ഉം ഫ്ളൂറിന്റേത് 4.0-ഉം ആണ്. അതായത് C-F ബന്ധങ്ങള് ധ്രുവതയുള്ളതായിരിക്കും. എന്നാല് ധ്രുവതയുള്ള നാല് C-F ബന്ധങ്ങള് ഉണ്ടായിട്ടും CF<sub>4</sub> തന്മാത്ര ധ്രുവരഹിതമാണ്. ബോണ്ടുകളുടെ പ്രതിസമമായ വിന്യാസം മൂലം നാല് ഡൈപോള് മൊമന്റുകള് പരസ്പരം റദ്ദാകുന്നു. |
| - | + | [[Image:p58bb.png|right]] | |
| - | + | ഒരു തന്മാത്രയുടെ ഡൈപോള് മൊമന്റ് കണക്കാക്കുന്നതിന് വിവിധ മാര്ഗങ്ങളുണ്ട്. ഡൈഇലക്ട്രിക് സ്ഥിരാങ്ക (dielectric constant)ത്തിന്റെ നിര്ണയനമാണ് ഏറ്റവും സ്വീകാര്യമായ മാര്ഗം. ധ്രുവതന്മാത്രകളുടെ നേര്ത്ത ലായനികളിലാണ് ഡൈഇലക്ട്രിക് സ്ഥിരാങ്കം അളക്കുന്നത് (ലായകങ്ങള് ധ്രുവരഹിതമായിരിക്കണം). ക്ലാഷിയ്സ്, മൊസോട്ടി, ഡീബൈ എന്നീ ശാസ്ത്രജ്ഞര് ഡൈപോള് മൊമന്റ്, ഡൈഇലക്ട്രിക് സ്ഥിരാങ്കം, മോളാര് ധ്രുവീകരണം (total molar polarisability) എന്നിവ തമ്മിലുള്ള ബന്ധം നിര്ണയിച്ചിട്ടുണ്ട്. ഇതുപയോഗിച്ച് വിവിധ താപനിലകളിലെ ഡൈഇലക്ട്രിക് സ്ഥിരാങ്കങ്ങളില് നിന്ന് ഡൈപോള് മൊമന്റു കണ്ടെത്താനാവും. | |
| - | ഒരു തന്മാത്രയുടെ ഡൈപോള് മൊമന്റ് കണക്കാക്കുന്നതിന് വിവിധ മാര്ഗങ്ങളുണ്ട്. ഡൈഇലക്ട്രിക് സ്ഥിരാങ്ക ( | + | |
| - | + | തന്മാത്രകളുടെ അയോണികസ്വഭാവം (ionic character), ബഹു അണുക തന്മാത്രകളിലെ ഓരോ രാസബന്ധത്തിന്റേയും ആഘൂര്ണം അഥവാ ബോണ്ട്മൊമന്റ് എന്നിവ കണക്കാക്കുന്നതിന് തന്മാത്രയുടെ ഡൈപോള് മൊമന്റിനെ കുറിച്ചുള്ള അറിവ് ആവശ്യമാണ്. തന്മാത്രാഘടന നിര്ണയിക്കുന്നതിനും ഹൈഡ്രജന് ബന്ധങ്ങളെ കുറിച്ചു വിവരങ്ങള് ലഭ്യമാക്കുന്നതിനും ഡൈപോള്മൊമന്റ് സഹായകമാണ്. സിസ്-ട്രാന്സ് ഐസോമറുകള് തമ്മിലും ഓര്ത്തോ, മെറ്റാ, പാരാ വ്യുത്പന്നങ്ങള് തമ്മിലും വേര്തിരിച്ചറിയുന്നതിന് ഡൈപോള് മൊമന്റുകളുടെ നിര്ണയനം പ്രയോജനപ്രദമാണ്. | |
| - | തന്മാത്രകളുടെ അയോണികസ്വഭാവം ( | + | |
Current revision as of 08:30, 12 ജൂണ് 2008
ഡൈപോള് മൊമന്റ് (തന്മാത്രീയ)
Molecular dipole moment
ഒരു തന്മാത്രയുടെ ധ്രുവതയുടെ അളവ്. ഒരു തന്മാത്രയിലെ ഇലക്ട്രോണുകളുടേയും പ്രോട്ടോണുകളുടേയും എണ്ണം തുല്യമാണെങ്കിലും ധന, ഋണ ചാര്ജുകള് അസമമായി വിതരണം ചെയ്തിരിക്കുന്നതുമൂലം തന്മാത്രയില് രണ്ടു ധ്രുവങ്ങള് അഥവാ ഡൈപോള് സൃഷ്ടിക്കപ്പെടുന്നു. ഇലക്ട്രോനെഗറ്റിവതയിലോ വലുപ്പത്തിലോ ഗണ്യമായ വ്യത്യാസമുള്ള അണുകങ്ങള് തമ്മില് ഇലക്ട്രോണുകള് പങ്കുവച്ച് കോവാലന്റ് ബന്ധം രൂപീകൃതമാവു മ്പോഴാണ് ധന, ഋണ ചാര്ജുകളുടെ അസമവിതരണം ഉണ്ടാകുന്നത്. പങ്കുവയ്ക്കപ്പെടുന്ന ഇലക്ട്രോണുകളെ ആകര്ഷിക്കുന്നതിനുള്ള പ്രവണതയാണ് ഇലക്ട്രോനെഗറ്റിവത എന്നതു കൊണ്ട് വിവക്ഷിക്കുന്നത്.
ഒരേ മൂലകത്തിന്റെ അണുകങ്ങള് തമ്മില് കോവാലന്റ് ബന്ധങ്ങള് വഴി തന്മാത്രകളുണ്ടാവുമ്പോള് ഇലക്ട്രോണുകളുടെ ഋണ ചാര്ജ് അണുകങ്ങള്ക്കിടയില് തുല്യമായ അകലത്തിലായിരിക്കും വിന്യസിച്ചിരിക്കുന്നത്. ഇപ്രകാരം ഇലക്ട്രോണുകളെ സമമായി പങ്കുവച്ചുണ്ടാവുന്ന തന്മാത്രകളെ ധ്രുവരഹിത അഥവാ 'നോണ് പോളാര്' തന്മാത്രകളെന്നു പറയുന്നു. എന്നാല് വ്യത്യസ്ത മൂലകങ്ങളുടെ അണുകങ്ങള് തമ്മില് ഇലക്ട്രോനെഗറ്റിവതയിലും വലുപ്പത്തിലും വ്യത്യാസം ഉള്ളതിനാല് അവ ചേര്ന്നു രൂപീകരിക്കുന്ന തന്മാത്രയില് അധിന്യൂനാധാനങ്ങളുള്ള രണ്ട് ധ്രുവങ്ങള് ഉണ്ടാവുന്നു. ഇലക്ട്രോനെഗറ്റിവത കൂടുതലുള്ള അണുവിനു ഭാഗികമായി ഋണചാര്ജും ഇലക്ട്രോനെഗറ്റിവത കുറഞ്ഞ അണുവിനു ഭാഗിക ധനചാര്ജും ലഭിക്കുന്നു.
ചാര്ജുകളുടെ ഈ വിസ്ഥാപനം വിദ്യുത്കാന്തിക ആഘൂര്ണങ്ങള്ക്ക് സമാനവും വിസ്ഥാപിത ചാര്ജി(Z)ന്റേയും അണുകങ്ങള്ക്കിടയിലെ അകലത്തി(l)ന്റേയും ഗുണനത്തിനു തുല്യവും ആയ ഒരു ഡൈപോള് മൊമന്റ് (ദ്വിധ്രുവ ആഘൂര്ണം) (μ) ഉളവാക്കുന്നു.
μ = Zl
ഇലക്ട്രോണ് ചാര്ജ് സു. 10-10 സ്ഥിര വൈദ്യുത ഏകകവും (e.s.u) തന്മാത്രയുടെ വ്യാസം സു. 10-8 സെ.മീ. ഉം ആയതിനാല് ഡൈപോള് മൊമന്റുകളുടെ പരിധി 10-18 ആയിരിക്കും.
(μ=10-10 e.s.u x 10-8 cm = 1018 esu.cm)
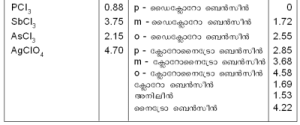
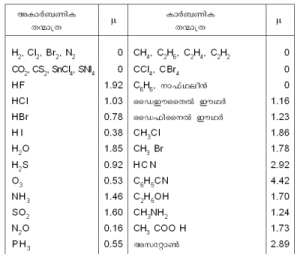
ഡൈപോള് മൊമന്റ് ഡീബൈ യൂണിറ്റിലാണ് കണക്കാക്കുന്നത്. ഒരു ഡീബൈ യൂണിറ്റ് (D) = 10-18esu.cm ഉദാ. HClന്റെ ഡൈപോള് മൊമന്റ് 1.03 x 10-18 esu.cm = 1.03 D ആണ്. വിവിധ തന്മാത്രകളുടെ ഡൈപോള് മൊമന്റുകള് പട്ടികയില് കാണിച്ചിരിക്കുന്നു.
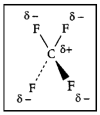
ഇലക്ട്രോണുകളുടെ അസമവിതരണം മൂലം തന്മാത്രകള്ക്ക് സ്ഥിരമായ ഡൈപോള് മൊമന്റുണ്ടായിരിക്കും. ഒരു വിദ്യുത്- കാന്തിക മേഖലയുടെ അഭാവത്തില്പ്പോലും നിലനില്ക്കുന്നതാണ് സ്ഥിര ഡൈപോള് മൊമന്റ്. ഒരു ജല തന്മാത്രയില് രണ്ട് ഹൈഡ്രജന് അണുകങ്ങളും ഓക്സിജന് അണുകവും ഒരു സമപാര്ശ്വ ത്രികോണത്തിന്റെ രൂപത്തിലാണ് വിന്യസിച്ചിരിക്കുന്നത്. ജലതന്മാത്രയില് ഭൂരിഭാഗം ഋണചാര്ജും ഓക്സിജന് അണുകേന്ദ്രത്തിനു ചുറ്റുമായി വ്യാപിക്കുന്നതിനാല് പ്രോട്ടോണുകള് ഏതാണ്ട് സ്വതന്ത്രമായി നിലകൊള്ളുന്നു.
ചാര്ജുകളുടെ ഈ വിഭജനം തന്മാത്രയ്ക്ക് സ്ഥിര ഡൈപോള് പ്രദാനം ചെയ്യുന്നു. എന്നാല് H2, CO2, CH4, CCl4 തുടങ്ങിയ തന്മാത്രകളില് പ്രതിസമമായാണ് ചാര്ജുകളുടെ വിതരണം. അതായത് ഋണചാര്ജുകളുടെ സാന്ദ്രതാകേന്ദ്രം ധനചാര്ജുകളുടെ സാന്ദ്രതാകേന്ദ്രവുമായി സംഗമിക്കുന്നു. ഈ തന്മാത്രകള്ക്ക് ബാഹ്യമായി പ്രയോഗിക്കുന്ന വൈദ്യുത മേഖലയുടെ പ്രഭാവത്താല് ഒരു വേശിത ഡൈപോള് (induced dipole) ഉണ്ടാവാറുണ്ട്. പ്രയുക്ത മേഖലയുടെ പ്രഭാവം തന്മാത്രയുടെ ധ്രുവീകരണക്ഷമത(polarisability)യെ ആശ്രയിച്ചാണിരിക്കുന്നത്. ഏകബലകമായ ഒരു പ്രയുക്ത മേഖലയുടെ പ്രഭാവത്തില് ഉണ്ടാകുന്ന ഡൈപോള് മൊമന്റാണ് ഒരു തന്മാത്രയുടെ ധ്രുവീകരണക്ഷമത.
ഒരു തന്മാത്രയുടെ ഡൈപോള് മൊമന്റ് വ്യക്തിഗത രാസബന്ധങ്ങളുടെ ഡൈപോള്മൊമന്റുകളുടെ സദിശതുക ആയിരിക്കും. ദ്വിഅണുക തന്മാത്രകളിലും മറ്റ് ലഘുതന്മാത്രകളിലും ഡൈപോള് മൊമന്റും അണുകങ്ങളുടെ ഇലക്ട്രോനെഗറ്റിവതയുടെ വ്യത്യാസവും ആനുപാതികമായിരിക്കും. എന്നാല് സങ്കീര്ണ തന്മാത്രകളില് സ്ഥിതി വ്യത്യസ്തമാണ്. വിവിധ ബോണ്ടുകളുടെ ഡൈപോള് മൊമന്റുകള് പരസ്പരം ശക്തിപ്പെടുത്തുകയോ റദ്ദു ചെയ്യുകയോ ചെയ്യുന്നതാണിതിനു കാരണം.
ഉദാ:CF4, കാര്ബണിന്റെ ഇലക്ട്രോനെഗറ്റിവത 2.5-ഉം ഫ്ളൂറിന്റേത് 4.0-ഉം ആണ്. അതായത് C-F ബന്ധങ്ങള് ധ്രുവതയുള്ളതായിരിക്കും. എന്നാല് ധ്രുവതയുള്ള നാല് C-F ബന്ധങ്ങള് ഉണ്ടായിട്ടും CF4 തന്മാത്ര ധ്രുവരഹിതമാണ്. ബോണ്ടുകളുടെ പ്രതിസമമായ വിന്യാസം മൂലം നാല് ഡൈപോള് മൊമന്റുകള് പരസ്പരം റദ്ദാകുന്നു.
ഒരു തന്മാത്രയുടെ ഡൈപോള് മൊമന്റ് കണക്കാക്കുന്നതിന് വിവിധ മാര്ഗങ്ങളുണ്ട്. ഡൈഇലക്ട്രിക് സ്ഥിരാങ്ക (dielectric constant)ത്തിന്റെ നിര്ണയനമാണ് ഏറ്റവും സ്വീകാര്യമായ മാര്ഗം. ധ്രുവതന്മാത്രകളുടെ നേര്ത്ത ലായനികളിലാണ് ഡൈഇലക്ട്രിക് സ്ഥിരാങ്കം അളക്കുന്നത് (ലായകങ്ങള് ധ്രുവരഹിതമായിരിക്കണം). ക്ലാഷിയ്സ്, മൊസോട്ടി, ഡീബൈ എന്നീ ശാസ്ത്രജ്ഞര് ഡൈപോള് മൊമന്റ്, ഡൈഇലക്ട്രിക് സ്ഥിരാങ്കം, മോളാര് ധ്രുവീകരണം (total molar polarisability) എന്നിവ തമ്മിലുള്ള ബന്ധം നിര്ണയിച്ചിട്ടുണ്ട്. ഇതുപയോഗിച്ച് വിവിധ താപനിലകളിലെ ഡൈഇലക്ട്രിക് സ്ഥിരാങ്കങ്ങളില് നിന്ന് ഡൈപോള് മൊമന്റു കണ്ടെത്താനാവും.
തന്മാത്രകളുടെ അയോണികസ്വഭാവം (ionic character), ബഹു അണുക തന്മാത്രകളിലെ ഓരോ രാസബന്ധത്തിന്റേയും ആഘൂര്ണം അഥവാ ബോണ്ട്മൊമന്റ് എന്നിവ കണക്കാക്കുന്നതിന് തന്മാത്രയുടെ ഡൈപോള് മൊമന്റിനെ കുറിച്ചുള്ള അറിവ് ആവശ്യമാണ്. തന്മാത്രാഘടന നിര്ണയിക്കുന്നതിനും ഹൈഡ്രജന് ബന്ധങ്ങളെ കുറിച്ചു വിവരങ്ങള് ലഭ്യമാക്കുന്നതിനും ഡൈപോള്മൊമന്റ് സഹായകമാണ്. സിസ്-ട്രാന്സ് ഐസോമറുകള് തമ്മിലും ഓര്ത്തോ, മെറ്റാ, പാരാ വ്യുത്പന്നങ്ങള് തമ്മിലും വേര്തിരിച്ചറിയുന്നതിന് ഡൈപോള് മൊമന്റുകളുടെ നിര്ണയനം പ്രയോജനപ്രദമാണ്.