This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
കോംപ്ലക്സ് അയോണുകള്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
Mksol (സംവാദം | സംഭാവനകള്) (പുതിയ താള്: == കോംപ്ലക്സ് അയോണുകള് == ഒരു ലോഹ ആറ്റമോ അയോണോ നേരിട്ട്, ഒര...) |
(→കോംപ്ലക്സ് അയോണുകള്) |
||
| വരി 2: | വരി 2: | ||
== കോംപ്ലക്സ് അയോണുകള് == | == കോംപ്ലക്സ് അയോണുകള് == | ||
| - | ഒരു ലോഹ ആറ്റമോ അയോണോ നേരിട്ട്, ഒരുകൂട്ടം ഉദാസീന തന്മാത്രകളുമായോ അയോണുകളുമായോ ചേര്ന്നുണ്ടാകുന്ന, താരതമ്യേന സ്ഥിരതയുള്ള ഒരു സംയുക്തം. ഉദാസീന തന്മാത്രകളെയോ അയോണുകളെയോ ലിഗാന്ഡുകള് (ligands)എന്നു വിളിക്കുന്നു. കേന്ദ്രസ്ഥിതമായ ലോഹ അയോണിനോട് ഇവ സങ്കരീകരിക്കുകയോ ഉപസഹ സംയോജിതം ആകയോ ചെയ്യുന്നു. സങ്കീര്ണ അയോണിന്റെ കോ-ഓര്ഡിനേഷന് മണ്ഡലം ഒരു ചതുരബ്രായ്ക്കറ്റിനകത്താണ് എഴുതുക. ഉദാ. [Mg( | + | ഒരു ലോഹ ആറ്റമോ അയോണോ നേരിട്ട്, ഒരുകൂട്ടം ഉദാസീന തന്മാത്രകളുമായോ അയോണുകളുമായോ ചേര്ന്നുണ്ടാകുന്ന, താരതമ്യേന സ്ഥിരതയുള്ള ഒരു സംയുക്തം. ഉദാസീന തന്മാത്രകളെയോ അയോണുകളെയോ ലിഗാന്ഡുകള് (ligands)എന്നു വിളിക്കുന്നു. കേന്ദ്രസ്ഥിതമായ ലോഹ അയോണിനോട് ഇവ സങ്കരീകരിക്കുകയോ ഉപസഹ സംയോജിതം ആകയോ ചെയ്യുന്നു. സങ്കീര്ണ അയോണിന്റെ കോ-ഓര്ഡിനേഷന് മണ്ഡലം ഒരു ചതുരബ്രായ്ക്കറ്റിനകത്താണ് എഴുതുക. ഉദാ. [[Mg(H<sub>2</sub>O)<sub>6</sub>]<sup>2+</sup>, [Cu (H<sub>2</sub>O)<sub>4</sub>]<sup>2+</sup>, ഇവയുടെ ചാര്ജ് മറ്റ് അയോണുകള്മൂലം ഉദാസീനമാകുമ്പോള് കോംപ്ലക്സ് യൗഗികങ്ങള് ഉണ്ടാകുന്നു. ഉദാ. [Mg(H<sub>2</sub>O)<sub>6</sub>]Cl<sub>2</sub>. കോ-ഓര്ഡിനേറ്റിത ഗ്രൂപ്പുകള് ചാര്ജിതങ്ങള് ആണെങ്കില് കോംപ്ലക്സിന്റെ ചാര്ജ് ലോഹത്തിലെയും കോ-ഓര്ഡിനേറ്റു ചെയ്തിട്ടുള്ള അയോണുകളുടെയും ആകെ ചാര്ജുകള്ക്കു തുല്യമായിരിക്കും. അതായത് [Pt(NH<sub>2</sub>)<sub>6</sub>]<sup>4+</sup>ന്റെ ചാര്ജ് +4 ആയിരിക്കും (പ്ലാറ്റിനത്തിന്റെ +4 -ഉം അമോണിയയുടെ പൂജ്യവും ചേര്ന്നത്). [PtCl<sub>6</sub>]<sup>2–</sup> എന്ന കോംപ്ലക്സ് അയോണിന്റെ ചാര്ജ് –2 ആണ് (അതായത് പ്ലാറ്റിനത്തിന്റെ +4 -ഉം ക്ളോറിന്റെ –6 -ഉം ചേര്ന്നത്). |
കേന്ദ്രത്തിലെ ലോഹ അയോണുമായി ഉപസഹസംയോജിതമായി ബന്ധിച്ചിട്ടുള്ള അയോണുകളോ ഗ്രൂപ്പുകളോ ലിഗാന്ഡുകള് എന്നറിയപ്പെടുന്നു. 2 മുതല് 10 വരെ കോ-ഓര്ഡിനേഷന് സംഖ്യകളുള്ള കോംപ്ലക്സുകള് വേര്തിരിച്ചിട്ടുണ്ട്. എങ്കിലും 4, 6 എന്നിവയാണ് സര്വ സാധാരണമായവ. കോ-ഓര്ഡിനേഷന് സംഖ്യ 6 ആയിട്ടുള്ള കോംപ്ലക്സുകള്ക്ക് ഷഡ്ഫലകീയ ഘടനയും 4 ആയിട്ടുള്ളവയ്ക്ക് ചതുഷ്ഫലകീയ ഘടനയോ സമതലീയ ചതുരഘടനയോ ആണ് പൊതുവേ കാണുന്നത്. | കേന്ദ്രത്തിലെ ലോഹ അയോണുമായി ഉപസഹസംയോജിതമായി ബന്ധിച്ചിട്ടുള്ള അയോണുകളോ ഗ്രൂപ്പുകളോ ലിഗാന്ഡുകള് എന്നറിയപ്പെടുന്നു. 2 മുതല് 10 വരെ കോ-ഓര്ഡിനേഷന് സംഖ്യകളുള്ള കോംപ്ലക്സുകള് വേര്തിരിച്ചിട്ടുണ്ട്. എങ്കിലും 4, 6 എന്നിവയാണ് സര്വ സാധാരണമായവ. കോ-ഓര്ഡിനേഷന് സംഖ്യ 6 ആയിട്ടുള്ള കോംപ്ലക്സുകള്ക്ക് ഷഡ്ഫലകീയ ഘടനയും 4 ആയിട്ടുള്ളവയ്ക്ക് ചതുഷ്ഫലകീയ ഘടനയോ സമതലീയ ചതുരഘടനയോ ആണ് പൊതുവേ കാണുന്നത്. | ||
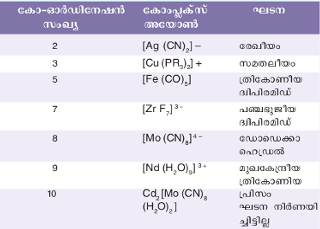
കോ-ഓര്ഡിനേഷന് സംഖ്യ 4, 6 എന്നിവ ഒഴികെയുള്ള ഏതാനും കോംപ്ലക്സ് അയോണുകളുടെ ഘടന കൊടുക്കുന്നു. | കോ-ഓര്ഡിനേഷന് സംഖ്യ 4, 6 എന്നിവ ഒഴികെയുള്ള ഏതാനും കോംപ്ലക്സ് അയോണുകളുടെ ഘടന കൊടുക്കുന്നു. | ||
| - | + | ||
| - | + | [[ചിത്രം:Page161screen.png ]] | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
കൂടാതെ ഏതാനും ഘടനകളും വിവിധ കോ-ഓര്ഡിനേഷന് സംഖ്യകളിലുള്ള സംയുക്തങ്ങള്ക്ക് ഉള്ളതായി തെളിഞ്ഞിട്ടുണ്ട്. കോംപ്ലക്സ് അയോണുകള്ക്ക് ഐസോമെറിസം തുടങ്ങിയ ഗുണധര്മങ്ങളുണ്ട്. | കൂടാതെ ഏതാനും ഘടനകളും വിവിധ കോ-ഓര്ഡിനേഷന് സംഖ്യകളിലുള്ള സംയുക്തങ്ങള്ക്ക് ഉള്ളതായി തെളിഞ്ഞിട്ടുണ്ട്. കോംപ്ലക്സ് അയോണുകള്ക്ക് ഐസോമെറിസം തുടങ്ങിയ ഗുണധര്മങ്ങളുണ്ട്. | ||
(ചുനക്കര ഗോപാലകൃഷ്ണന്) | (ചുനക്കര ഗോപാലകൃഷ്ണന്) | ||
16:22, 6 ഓഗസ്റ്റ് 2015-നു നിലവിലുണ്ടായിരുന്ന രൂപം
കോംപ്ലക്സ് അയോണുകള്
ഒരു ലോഹ ആറ്റമോ അയോണോ നേരിട്ട്, ഒരുകൂട്ടം ഉദാസീന തന്മാത്രകളുമായോ അയോണുകളുമായോ ചേര്ന്നുണ്ടാകുന്ന, താരതമ്യേന സ്ഥിരതയുള്ള ഒരു സംയുക്തം. ഉദാസീന തന്മാത്രകളെയോ അയോണുകളെയോ ലിഗാന്ഡുകള് (ligands)എന്നു വിളിക്കുന്നു. കേന്ദ്രസ്ഥിതമായ ലോഹ അയോണിനോട് ഇവ സങ്കരീകരിക്കുകയോ ഉപസഹ സംയോജിതം ആകയോ ചെയ്യുന്നു. സങ്കീര്ണ അയോണിന്റെ കോ-ഓര്ഡിനേഷന് മണ്ഡലം ഒരു ചതുരബ്രായ്ക്കറ്റിനകത്താണ് എഴുതുക. ഉദാ. [[Mg(H2O)6]2+, [Cu (H2O)4]2+, ഇവയുടെ ചാര്ജ് മറ്റ് അയോണുകള്മൂലം ഉദാസീനമാകുമ്പോള് കോംപ്ലക്സ് യൗഗികങ്ങള് ഉണ്ടാകുന്നു. ഉദാ. [Mg(H2O)6]Cl2. കോ-ഓര്ഡിനേറ്റിത ഗ്രൂപ്പുകള് ചാര്ജിതങ്ങള് ആണെങ്കില് കോംപ്ലക്സിന്റെ ചാര്ജ് ലോഹത്തിലെയും കോ-ഓര്ഡിനേറ്റു ചെയ്തിട്ടുള്ള അയോണുകളുടെയും ആകെ ചാര്ജുകള്ക്കു തുല്യമായിരിക്കും. അതായത് [Pt(NH2)6]4+ന്റെ ചാര്ജ് +4 ആയിരിക്കും (പ്ലാറ്റിനത്തിന്റെ +4 -ഉം അമോണിയയുടെ പൂജ്യവും ചേര്ന്നത്). [PtCl6]2– എന്ന കോംപ്ലക്സ് അയോണിന്റെ ചാര്ജ് –2 ആണ് (അതായത് പ്ലാറ്റിനത്തിന്റെ +4 -ഉം ക്ളോറിന്റെ –6 -ഉം ചേര്ന്നത്).
കേന്ദ്രത്തിലെ ലോഹ അയോണുമായി ഉപസഹസംയോജിതമായി ബന്ധിച്ചിട്ടുള്ള അയോണുകളോ ഗ്രൂപ്പുകളോ ലിഗാന്ഡുകള് എന്നറിയപ്പെടുന്നു. 2 മുതല് 10 വരെ കോ-ഓര്ഡിനേഷന് സംഖ്യകളുള്ള കോംപ്ലക്സുകള് വേര്തിരിച്ചിട്ടുണ്ട്. എങ്കിലും 4, 6 എന്നിവയാണ് സര്വ സാധാരണമായവ. കോ-ഓര്ഡിനേഷന് സംഖ്യ 6 ആയിട്ടുള്ള കോംപ്ലക്സുകള്ക്ക് ഷഡ്ഫലകീയ ഘടനയും 4 ആയിട്ടുള്ളവയ്ക്ക് ചതുഷ്ഫലകീയ ഘടനയോ സമതലീയ ചതുരഘടനയോ ആണ് പൊതുവേ കാണുന്നത്.
കോ-ഓര്ഡിനേഷന് സംഖ്യ 4, 6 എന്നിവ ഒഴികെയുള്ള ഏതാനും കോംപ്ലക്സ് അയോണുകളുടെ ഘടന കൊടുക്കുന്നു.
കൂടാതെ ഏതാനും ഘടനകളും വിവിധ കോ-ഓര്ഡിനേഷന് സംഖ്യകളിലുള്ള സംയുക്തങ്ങള്ക്ക് ഉള്ളതായി തെളിഞ്ഞിട്ടുണ്ട്. കോംപ്ലക്സ് അയോണുകള്ക്ക് ഐസോമെറിസം തുടങ്ങിയ ഗുണധര്മങ്ങളുണ്ട്.
(ചുനക്കര ഗോപാലകൃഷ്ണന്)