This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
കാര്ബണ്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
കാര്ബണ്
Carbon
ഖരരൂപത്തിലുള്ള ഒരു അലോഹമൂലകം. ആവര്ത്തനപ്പട്ടികയിലെ പതിനാലാം ഗ്രൂപ്പില് ഉള്പ്പെടുന്ന മൂലകമാണ് കാര്ബണ്. സിംബല്: C; അണുസംഖ്യ: 6; അണുഭാരം: 12.01115.
IS2, 2S2, 2P2 എന്ന ഇലക്ട്രാണിക വിന്യാസമുള്ള കാര്ബണ് സ്വതന്ത്രാവസ്ഥയിലും സംയുക്താവസ്ഥയിലും പ്രകൃതിയില് കാണപ്പെടുന്നു. വജ്രവും ഗ്രാഫൈറ്റും കല്ക്കരിയും ഇതിന്റെ സ്വതന്ത്രാവസ്ഥകളാണ്. അന്തരീക്ഷവായുവില് (0.03 ശ.മാ. വ്യാപ്ത അളവില്) കാര്ബണ്ഡൈഓക്സൈഡ് രൂപത്തില് കാര്ബണ് നിലനില്ക്കുന്നു. കുറഞ്ഞൊരളവില് കാര്ബണ് സംയുക്തങ്ങള് പ്രകൃതിജലത്തിലും കാണാന് കഴിയും. പെട്രാളിയം, പ്രകൃതിവാതകങ്ങള് എന്നിവയിലെ പ്രധാനഘടകം കാര്ബണ് ആണ്. ചുണ്ണാമ്പുകല്ല്, ഡോളോമൈറ്റ്, മാര്ബിള്, ചോക്ക് എന്നിവയില് കാര്ബണേറ്റ് രൂപത്തില് കാര്ബണ് കാണപ്പെടുന്നു.
ജൈവമണ്ഡലത്തിലെ എല്ലാ സുപ്രധാന സംയുക്തങ്ങളിലെയും മുഖ്യഘടകം കാര്ബണ് ആണ്. ഹീലിയത്തിന്റെ ജ്വലനത്തിലൂടെ ഒരു കോസ്മിക് ഉത്പന്നമായി കാര്ബണ് നിര്മിക്കപ്പെടുന്നുണ്ട്. പ്രകൃതിയുടെ എല്ലാ തലങ്ങളിലും കാര്ബണും കാര്ബണ് സംയുക്തങ്ങളും വിതരണം ചെയ്യപ്പെട്ടിട്ടുണ്ടെങ്കിലും അവയുടെ അളവ് താരതമ്യേനകുറവാണ്. ഭൂവല്കത്തില് കഷ്ടിച്ച് 0.032 ശ. മാ. മാത്രമേ കാര്ബണ് ഉള്ളൂ. എന്നാല്, കാര്ബണ് സംയുക്തങ്ങളുടെ എണ്ണം മറ്റു മൂലകങ്ങളുടെയെല്ലാം സംയുക്തങ്ങളുടെയും എണ്ണത്തെക്കാള് വളരെ കൂടുതലാണ്. പത്തുലക്ഷത്തില്പ്പരം കാര്ബണ് സംയുക്തങ്ങള് ഇതിനകം കണ്ടെത്തിയിട്ടുണ്ട്. കാര്ബണ്സംയുക്തങ്ങളുടെ എണ്ണം ദിനംപ്രതി വര്ധിച്ചുകൊണ്ടുമിരിക്കുന്നു. കാര്ബണിനുള്ളതുപോലെ വിവിധങ്ങളും സങ്കീര്ണങ്ങളുമായ സംയുക്തങ്ങള് മറ്റ് ഏറെ മൂലകങ്ങള്ക്കില്ല. ഇവയില് കാര്ബണ്, ഹൈഡ്രജന് സംയുക്തങ്ങളാണ് ഏറിയ പങ്കും. കാര്ബണ്സംയുക്തങ്ങളുടെ വൈപുല്യവും പ്രത്യേകതകളും സാധ്യതകളുംമൂലം "കാര്ബണികരസതന്ത്രം' (Organic chemistry) എന്നൊരു ശാഖതന്നെ രൂപംകൊണ്ടിട്ടുണ്ട്.
കാര്ബണിന്റെ സംയോജകത നാല് ആണ്. ഒന്നിനോടൊന്നു ഘടിപ്പിച്ചുകൊണ്ട് ദൈര്ഘ്യമേറിയ ശൃംഖലകള് ഉണ്ടാക്കാന് കാര്ബണ് അണുകങ്ങള്ക്കു കഴിയും. ഏറ്റവും ചെറിയ ശൃംഖലയില് രണ്ട് കാര്ബണ് അണുകങ്ങള് ഉണ്ടായിരിക്കും. ഉദാ. ഈഥേന് (H3C-CH3). എഴുപതില്പരം കാര്ബണ് അണുകങ്ങള് ബന്ധിച്ചുള്ള സംയുക്തങ്ങള് ലഭ്യമായിട്ടുണ്ട്. ബഹുലകങ്ങളിലെ (പോളിമര്) കാര്ബണ് ശൃംഖല ഇതിലും വളരെ വലുതാണ്. ശൃംഖലാരൂപീകരണത്തില് കാര്ബണിനെ അതിശയിക്കുന്ന മറ്റു മൂലകങ്ങളില്ല. രേഖീയമായി മാത്രമല്ല, ശാഖകളായി പിരിയുവാഌം സംവൃതവലയങ്ങളായി രൂപപ്പെടുവാഌം കാര്ബണ് ശൃംഖലകള്ക്കു കഴിയും.
അല്ലോട്രാപ്പുകള്
അണുകങ്ങള് വ്യത്യസ്തമായ രീതികളില് വിന്യസിച്ച് രൂപംകൊള്ളുന്ന വിവിധ തന്മാത്രീയ രൂപങ്ങള് ആണ് അല്ലോട്രാപ്പുകള്. കാര്ബണ് അല്ലോട്രാപ്പുകള് എന്നപേരില് അറിയപ്പെട്ടിരുന്നത് വജ്രം, ഗ്രാഫൈറ്റ്, അമോര്ഫസ് കാര്ബണ് എന്നിവയായിരുന്നു. കരി, കല്ക്കരി തുടങ്ങിയവയെയാണ് അമോര്ഫസ് അഥവാ അക്രിസ്റ്റലീയ കാര്ബണായി കണക്കാക്കിയിരുന്നത്. ഇവയ്ക്ക് നിയതമായ ക്രിസ്റ്റല് ഘടനയില്ലെങ്കിലും ചെറുപരിധിക്കുള്ളില് കൃത്യമായ അണുവിന്യാസം ഉണ്ട്. ഇവ യഥാര്ഥത്തില് ഗ്രാഫൈറ്റിന്റെയോ വജ്രത്തിന്റെയോ ക്രിസ്റ്റല്ഖണ്ഡങ്ങളെ തമ്മില് പിടിച്ചുനിര്ത്തുന്ന അമോര്ഫസ് കാര്ബണുകള് അടങ്ങുന്ന പോളിക്രിസ്റ്റലീയ/നാനോക്രിസ്റ്റലീയ രൂപങ്ങളാണെന്നും തെളിഞ്ഞിട്ടുണ്ട്. സമീപകാലത്തായി കണ്ടെത്തിയ കാര്ബണിന്റെ നാനോക്രിസ്റ്റലീയ അല്ലോട്രാപ്പുകളാണ് ഗ്രാഫീന്, ഫുള്ളറീന്, കാര്ബണ് നാനോട്യൂബ്, കാര്ബണ് നാനോബഡ്, കാര്ബണ് നാനോഫോം തുടങ്ങിയവ. കൂടാതെ ഗ്രാഫീന് അധിഷ്ഠിതമല്ലാത്ത അമോര്ഫസ് അല്ലോട്രാപ്പാണ് ഗ്ലാസ്സികാര്ബണ്.
വജ്രം
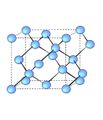
കാര്ബണിന്റെ ഏറ്റവും ശുദ്ധമായ രൂപം വജ്രമാണ്. അറിയപ്പെടുന്നതില് വച്ച് ഏറ്റവും കാഠിന്യമുള്ള പദാര്ഥമാണിത്. പ്രകൃതിയില് വളരെ അപൂര്വമായി മാത്രം കാണപ്പെടുന്നു. തെക്കേ ആഫ്രിക്കയിലും സൈബീരിയയിലും കോംഗോയിലും ബ്രസീലിലും ഇന്ത്യയിലും വജ്രത്തിന്റെ നിക്ഷേപങ്ങള് ഉണ്ട്. ശുദ്ധമായ വജ്രത്തിന് നിറമില്ല. എന്നാല് മാലിന്യങ്ങളുടെ സാന്നിധ്യംമൂലം ചുവപ്പ്, പച്ച, നീല, മഞ്ഞ എന്നീ നിറങ്ങളിലാണ് അത് കണ്ടുവരുന്നത്. മഞ്ഞ ഒഴികെയുള്ള വജ്രങ്ങള് വിലകൂടിയവയാണ്. "കറുത്ത വജ്രം' എന്നറിയപ്പെടുന്ന കാര്ബോനാഡോ ഉള്പ്പെടുന്ന വ്യാവസായിക വജ്രങ്ങള്ക്ക് രത്നം എന്ന നിലയില് മൂല്യമില്ല; എങ്കിലും ഡ്രില്ലിങ്, കട്ടിങ് ഉപകരണങ്ങളുടെ നിര്മാണത്തില് ഇവയ്ക്ക് അദ്വിതീയമായ പങ്കുണ്ട്.
വജ്രത്തിന്റെ ആപേക്ഷിക ഘനത്വം 3.51 ആണ്. പ്രകാശരശ്മികളെ വളരെ ശക്തിയായി അപവര്ത്തനവിധേയമാക്കുന്ന വജ്രത്തിന്റെ അപവര്ത്തനാങ്കം 2.4173 ആണ്. വജ്രം താപത്തിന്റെയോ വൈദ്യുതിയുടെയോ ചാലകമല്ല. എക്സ്കിരണങ്ങളെ കടത്തിവിടുന്നു. എല്ലാത്തരം വജ്രങ്ങള്ക്കും ഒരേ രൂപമല്ല. ബ്രസീലിയന് വജ്രത്തിന് ക്യൂബിക് രൂപമാണ്. തെക്കേ ആഫ്രിക്കയില് നിന്നുള്ളതിന് മുഖ്യമായും ഒക്ടാഹെഡ്രല് രൂപമാണുള്ളത്. "മോ' സ്കെയിലില് വജ്രത്തിന്റെ കാഠിന്യം 10 ആണ്. വജ്രത്തിന്റെ അനിതരസാധാരണമായ ഈ കാഠിന്യത്തിനുകാരണം അതിന്റെ സവിശേഷമായ ഘടനയാണ്. ഓരോ കാര്ബണ് അണുവും വേറെ നാലു കാര്ബണ് അണുകങ്ങളോട് ഒരു ക്രമ ചതുഷ്കോണത്തിന്റെ രൂപത്തില് സഹസംയോജകമായി ബന്ധിച്ചിട്ടുള്ള ഘടനയാണ് വജ്രത്തിന്റേത്. ഇഇ ബന്ധഅകലം 1.54ആണ്. ഇത്തരമൊരു ഘടനയെ തകര്ക്കണമെങ്കില് ധാരാളം ബന്ധങ്ങള് വിച്ഛേദിക്കേണ്ടതുണ്ട്. വജ്രത്തില് ഇലക്ട്രാണുകള് മുഴുവന് യുഗ്മങ്ങളായി (pairs) സ്ഥിതിചെയ്യുന്നതിനാലാണ് വിദ്യുത്ചാലകത ഇല്ലാത്തത്. വായുവില് 600800oC വരെ താപനിലയില് ചൂടാക്കിയാല് വജ്രം കത്തുന്നു. വജ്രം കൃത്രിമമായും നിര്മിക്കുന്നുണ്ട്. ഒരു ലക്ഷം അന്തരീക്ഷമര്ദത്തിലും ഏകദേശം 3,000oC താപനിലയിലും ഗ്രാഫൈറ്റ് സംസ്കരിച്ചാണ് കൃത്രിമ വജ്രം നിര്മിച്ചുവരുന്നത്. ഇപ്രകാരം ലഭിക്കുന്ന വജ്രം മഞ്ഞനിറത്തിലുള്ള ചെറിയ ക്രിസ്റ്റലുകളാണ്. ആഭരണനിര്മാണം, ഡ്രില്ലിങ്, കട്ടിങ് ഉപകരണങ്ങളുടെ നിര്മാണം എന്നിവയ്ക്കായി വജ്രം ഉപയോഗിച്ചുവരുന്നു.
ഗ്രാഫൈറ്റ്
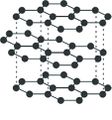
മൃദുത്വവും, ചാരനിറം കലര്ന്ന കറുപ്പുനിറവും തിളക്കവുമുള്ള ഒരു പദാര്ഥമാണ് ഗ്രാഫൈറ്റ്. തൊട്ടാല് തണുപ്പും പശിമയും തോന്നിക്കും. ശ്രീലങ്ക, സൈബീരിയ, യു.എസ്., ബൊഹീമിയ, ഇറ്റലി എന്നീ പ്രദേശങ്ങളില് ഗ്രാഫൈറ്റ് സ്വതന്ത്രാവസ്ഥയില് കാണപ്പെടുന്നു. 1779ല് ആണ് ഗ്രാഫൈറ്റ് ആദ്യം കണ്ടെത്തിയത്. "ഉരസുമ്പോള് കറുത്ത വര വീഴുന്ന' എന്ന് അര്ഥമുള്ള ഗ്രാഫീന് എന്ന ഗ്രീക് പദത്തില്നിന്നാണ് ഗ്രാഫൈറ്റ് എന്ന ഇംഗ്ലീഷ് പദം നിഷ്പന്നമായത്. ആദ്യകാലത്ത് ഈ പദാര്ഥത്തെ ലെഡ്, മോളിബ്ഡേറ്റ് ഖനിജം എന്നൊക്കെയാണ് കരുതിയിരുന്നത്.
വൈദ്യുതി, താപം എന്നിവയുടെ നല്ലൊരു ചാലകമാണ് ഗ്രാഫൈറ്റ്. ആപേക്ഷിക ഘനത്വം 2.25. ഗ്രാഫൈറ്റിന്റെ വ്യാവസായികോത്പാദനം അക്കീസണ് പ്രക്രിയവഴി നടത്തുന്നു. ഇഷ്ടികകള്കൊണ്ടു നിര്മിച്ച വൈദ്യുതചൂളകളില് നിറച്ച മണലിന്റെയും ആന്ഥ്രസൈറ്റിന്റെയും മിശ്രിതത്തില് കാര്ബണ് ഇലക്ട്രാഡുകള്വച്ച് ഉന്നതതാപനിലയില് 30 മണിക്കൂറോളം വൈദ്യുതി പ്രവഹിപ്പിക്കുമ്പോള് ഉണ്ടാകുന്ന സിലിക്കണ് കാര്ബൈഡ് ഉയര്ന്ന താപനിലയില് വിഘടിച്ച് ഗ്രാഫൈറ്റ് ഉണ്ടാവുന്നു.
SiO2 + 3C SiC + 2CO SiC Si + C
വജ്രത്തിന്റേതില്നിന്നു വ്യത്യസ്തമാണ് ഗ്രാഫൈറ്റിന്റെ ഘടന. കാര്ബണ് അണുക്കള് ക്രമഷഡ്ഭുജങ്ങളുടെ പാളികളായി ഇതില് ക്രമീകരിച്ചിരിക്കുന്നു. C-C ബന്ധഅകലം 1.415. ഗ്രാഫൈറ്റിനു വജ്രത്തേക്കാള് ഘനത്വം കുറയാനുള്ള കാരണം സമീപസ്ഥങ്ങളായ പാളികള് തമ്മിലുള്ള പ്രകടമായ അകലമാണ് (3.35 ). വിവിധ പാളികള് തമ്മില് ശക്തമായ ബന്ധം ഇല്ലാത്തതിനാല് പാളികള് തെന്നിമാറുന്നു. ഗ്രാഫൈറ്റിന്റെ സ്നേഹനസ്വഭാവത്തിനുള്ള കാരണം ഇതാണ്. ഗ്രാഫൈറ്റിന്റെ വിവിധ പാളികള്ക്കിടയില് ഫ്ളൂറിന്, നൈട്രജന്, ഓക്സിജന് എന്നിവയുടെ തന്മാത്രകള് കടന്നുകൂടാറുണ്ട്. (CF)n, C16K, C8K, C8Br തുടങ്ങിയ സ്തരസംയുക്തങ്ങള് ഇങ്ങനെ ഉണ്ടാകുന്നു. കാര്ബണിന്റെ ഏറ്റവും സ്ഥിരതയുള്ള രൂപം ഗ്രാഫൈറ്റാണ്. ഗ്രാഫൈറ്റിന്റെ ജ്വലനതാപം: 7,832 കലോറി/ഗ്രാം (വജ്രം: 7,873 കലോറി/ഗ്രാം). എല്ലാത്തരം ഗ്രാഫൈറ്റുകളും ശക്തമായ ഓക്സീകാരകങ്ങളാല് ആക്രമിക്കപ്പെടുന്നു. നൈട്രിക് അമ്ലം, പൊട്ടാസിയം ക്ലോറേറ്റ് തുടങ്ങിയവയുമായി പ്രവര്ത്തിച്ച് ഗ്രാഫൈറ്റിക് അമ്ലം, ഗ്രാഫൈറ്റിക് ഓക്സൈഡ് എന്നിവ ഉണ്ടാകുന്നു. ഗ്രാഫൈറ്റിന്റെ പൂര്ണമായ ഓക്സീകരണം നടക്കുമ്പോള് മെലിറ്റിക് അമ്ലം, C6 (COOH)6 ഉത്പാദിപ്പിക്കപ്പെടുന്നു. ഉയര്ന്ന താപനിലയില് ഗ്രാഫൈറ്റ് ഫ്ളൂറിനെ അവശോഷണം ചെയ്യുന്നതിന്റെ ഫലമായി മോണോഫ്ളൂറൈഡ് (CF) ഉണ്ടാകുന്നു. ഇത് ഗ്രാഫൈറ്റിനെപ്പോലെ വിദ്യുത്ചാലകമല്ല. ഹൈഡ്രാകാര്ബണ് വാതകങ്ങള് 650oC നു മുകളില് വിഘടനം നടത്തുമ്പോള് ഉണ്ടാകുന്ന വിട്രിയസ് കാര്ബണ് ഒരുതരം ഗ്രാഫൈറ്റാണ്.
പെന്സില്, ക്രൂസിബിള്, ഇലക്ട്രാഡ്, ഡ്രസെല് എന്നിവയുടെ നിര്മാണത്തിന് ഗ്രാഫൈറ്റ് ഉപയോഗിക്കുന്നു. യന്ത്രങ്ങള്ക്കുള്ള സ്നേഹകമായും (lubricant) ഇരുമ്പ് തുരുമ്പിക്കുന്നതു തടയാനുള്ള ആവരണമായും ഗ്രാഫൈറ്റ് ഉപയോഗിച്ചുവരുന്നു. ന്യുക്ലിയര് റിയാക്ടറുകളില് മോഡറേറ്ററായി ഗ്രാഫൈറ്റ് ദണ്ഡുകള് ഉപയോഗിക്കുന്നുണ്ട്.
ഗ്രാഫീന്.
ഗ്രാഫൈറ്റിന്റെ ഒറ്റപ്പാളിയെയാണ് ഗ്രാഫീന് എന്നു വിളിക്കുന്നത്. ഒരു തേന്കൂട് ക്രിസ്റ്റല് ജാലികയില് നിബിഡമായി അടുക്കിയ, SP2 ബന്ധനത്തിലുള്ള കാര്ബണ് ആറ്റങ്ങളുടെ, ഒരാറ്റം കനമുള്ള സമതലപാളിയാണ് ഗ്രാഫീന്. അതായത്, പല ഗ്രാഫീന് പാളികള് ഒന്നിച്ച് അട്ടിവെച്ചതാണ് ഗ്രാഫൈറ്റ്.
ഗ്രാഫീന് സംബന്ധമായ ഗവേഷണങ്ങള്ക്ക് ആന്ദ്രഗെയിം, കോണ്സ്റ്റാന്റിന് നൊവോസെലേഫ് എന്നീ ശാസ്ത്രജ്ഞര്ക്ക് 2010ലെ ഊര്ജതന്ത്രത്തിനുള്ള നോബല്സമ്മാനം ലഭിക്കുകയുണ്ടായി. കേവലം ഒരാറ്റം കനമുള്ള ഗ്രാഫീന് ലോകത്തിലെ ഏറ്റവും നേര്ത്തതും ഏറ്റവും ബലമുള്ളതുമായ നാനോ വസ്തുവാണ്. ഉരുക്കിനേക്കാള് ഇരുനൂറ് മടങ്ങ് ബലമുള്ളതാണ് ഗ്രാഫീന്. സുതാര്യവും ചൂടിന്റെയും വൈദ്യുതിയുടെയും നല്ല ചാലകവുമായ ഗ്രാഫീന് വീട്ടുപകരണങ്ങളുടെ നിര്മാണത്തിലും ഗതാഗതരംഗത്തും ശ്രദ്ധേയമായ മാറ്റങ്ങള്ക്ക് വഴിതുറക്കുമെന്ന് പ്രതീക്ഷിക്കുന്നു. കംപ്യൂട്ടറുകളിലും മറ്റ് ഇലക്ട്രാണിക് ഉപകരണങ്ങളിലും ഉപയോഗിച്ചുവരുന്ന സിലിക്കണ് ട്രാന്സിസ്റ്ററുകള്ക്ക് പകരം ഗ്രാഫീന് ട്രാന്സിസ്റ്ററുകള് ഉപയോഗപ്പെടുത്താമെന്നാണ് ഈ രംഗത്തെ ഗവേഷകര് പ്രതീക്ഷിക്കുന്നത്. സിലിക്കണ് ട്രാന്സിസ്റ്ററുകളേക്കാള് കാര്യക്ഷമതയിലും വേഗതയിലും മുന്പന്തിയിലാണ് ഗ്രാഫീന് ട്രാന്സിസ്റ്ററുകള്. ടച്ച് സ്ക്രീന്, സോളാര്സെല്, പ്രകാശപാനലുകള് മുതലായവയുടെ നിര്മാണത്തിഌം ഗ്രാഫീന് വ്യാപകമായി ഉപയോഗിക്കാനിടയുണ്ട്. ദ്വിമാന ഘടനയുള്ളതുകൊണ്ട് ഗ്രാഫീന് ഒരൊന്നാന്തരം സെന്സര് ആയും ഉപയോഗിക്കാന് കഴിയും. ഇന്റഗ്രറ്റഡ് സര്ക്യൂട്ടുകളിലെ ഒരു ഘടകമായി വര്ത്തിക്കാന് ആവശ്യമായ ഉത്തമ ഗുണവിശേഷങ്ങള് ഗ്രാഫീന് പ്രകടമാക്കുന്നു. ടച്ച് സ്ക്രീനുകള്, ലിക്വിഡ് ക്രിസ്റ്റല് ഡിസ്പ്ലേകള്, ഓര്ഗാനിക ഫോട്ടോ വോള്ട്ടാ സെല്ലുകള്, ഓര്ഗാനിക ലൈറ്റ് എമിറ്റിങ് ഡയോഡുകള് എന്നിവയ്ക്കാവശ്യമായ സുതാര്യ ചാലക ഇലക്ട്രാഡുകളുടെ നിര്മാണത്തിന് ഗ്രാഫീന് ഒരുത്തമ വസ്തുവാണ്. ഉയര്ന്ന ഊര്ജശേഖരണ സാന്ദ്രതയോടുകൂടിയ അള്ട്രാ കപ്പാസിറ്റേഴ്സിന്റെ നിര്മാണത്തിന് ഗ്രാഫീന് ഉപയോഗിക്കാം. ദ്രുതഗതിയിലുള്ളതും ചെലവുകുറഞ്ഞതുമായ ഇലക്ട്രാണിക് ഡി.എന്.എ. അനുക്രമനിര്ണയമാണ് ഗ്രാഫീന്റെ ഒരു പ്രധാന ജൈവ അനുപ്രയോഗം.
ചില നിശ്ചിത വൈദ്യുത ഗുണവിശേഷങ്ങള് നല്കാനായി ഒരു പ്രത്യേക വിധത്തില് മുറിച്ചെടുത്ത ഗ്രാഫീന്റെ ഒറ്റപ്പാളികളാണ് ഗ്രാഫീന് നാനോ റിബണുകള് എന്നറിയപ്പെടുന്നത്. നൂതന സാങ്കേതിക ഉപകരണങ്ങളില് അര്ധചാലകമെന്ന നിലയില് സിലിക്കണിനുപകരം ഗ്രാഫീന് നാനോ റിബണുകള് ഉപയോഗപ്പെടുത്താന് കഴിയുമെന്ന് പ്രതീക്ഷിക്കുന്നു.
അമോര്ഫസ് കാര്ബണ്
നിയതമായ ക്രിസ്റ്റല് രൂപമില്ലാത്ത ചാര്ക്കോള്, കോക്ക്, കല്ക്കരി തുടങ്ങിയ അല്ലോട്രാപ്പുകളെ അക്രിസ്റ്റലീയ കാര്ബണ് എന്ന് പൊതുവേ പറയുന്നു. തടി, പഞ്ചസാര, എല്ല്, രക്തം തുടങ്ങിയവ വായുവിന്റെ സാന്നിധ്യമില്ലാതെ കത്തിച്ചാല് ചാര്ക്കോള് ലഭിക്കുന്നു. ഗ്രാഫൈറ്റിന്റെ ഘടനയ്ക്കു സമാനമായ ഘടന ഇതിനുണ്ടെന്ന് എക്സ് റേ പഠനങ്ങള് സൂചിപ്പിക്കുന്നു. എന്നാല് ക്രിസ്റ്റലീയത അത്രത്തോളമില്ല. ഉത്തേജിത ചാര്ക്കോള് (നീരാവിയില് ചൂടാക്കി ചാര്ക്കോളിനെ ഉത്തേജിപ്പിക്കാം) വാതകങ്ങളെ അധിശോഷണം ചെയ്യുന്നു. ഉയര്ന്ന പ്രതലവിസ്തീര്ണ്ണം ചാര്ക്കോളിന് ഉണ്ടെന്നതാണ് ഇതിനുകാരണം. ഒരു ഘനസെന്റിമീറ്റര് ചാര്ക്കോളിന് 100 ചതുരശ്രമീറ്റര് പ്രതലവിസ്തീര്ണം ഉണ്ട്. പ്രകൃതിദത്തമായ ഒരു പദാര്ഥമാണ് കല്ക്കരി. ഭൂമിക്കടിയില് ഉന്നതമര്ദത്തിലും വായുവിന്റെ അസാന്നിധ്യത്തിലും കിടന്ന സസ്യഭാഗങ്ങള് ബാക്റ്റീരിയകളുടെ നിരന്തരമായ പ്രവര്ത്തനഫലമായി വിഘടിച്ചുണ്ടാകുന്ന ഉത്പന്നമാണ് കല്ക്കരി. കല്ക്കരി രൂപീകരണത്തിന്റെ വിവിധഘട്ടങ്ങളാണ് പീറ്റ് (60 ശ. മാ. കാര്ബണ്), ലിഗ്നൈറ്റ് (67 ശ.മാ. കാര്ബണ്)., ബിറ്റൂമിനസ് കല്ക്കരി (88.4 ശ.മാ. കാര്ബണ്), ആന്ഥ്രസൈറ്റ് കല്ക്കരി (94 ശ.മാ. കാര്ബണ്) എന്നിവ. കോള്ഗ്യാസ്, കോക്ക്, കോള്ടാര്, അമോണിയാക്കല് ലിക്കര് എന്നിവ കല്ക്കരിയുടെ സ്വേദനത്തില് നിന്ന് ഉത്പാദിപ്പിക്കാം. വായുവിന്റെ സാന്നിധ്യത്തിലല്ലാതെ പഞ്ചസാര (സുക്രാസ്) താപീയവിഘടനം നടത്തി ശുദ്ധമായ കാര്ബണ് നിര്മിക്കാം. ഉന്നതതാപനിലയില് ക്ലോറിന് കടത്തിവിട്ട് ഈ പ്രക്രിയയില് ഉണ്ടാകാവുന്ന അപദ്രവ്യങ്ങളെ നീക്കം ചെയ്തശേഷം വെള്ളത്തില് കഴുകുന്നു. ഹൈഡ്രജന്റെ സാന്നിധ്യത്തില് ചൂടാക്കി അവശിഷ്ടക്ലോറിനെ മാറ്റുന്നു.
ഫുള്ളറീന്
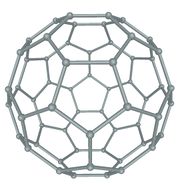
കാര്ബണിന്റെ മൂന്നാമത്തെ ക്രിസ്റ്റലീയ അല്ലോട്രാപ്പിക വിഭാഗം. ഗ്രാഫീന് ഷീറ്റുകള് ഗോളത്തിന്റെയോ ട്യൂബിന്റെയോ രൂപത്തില് ക്രമീകരിച്ചിരിക്കുന്ന വലിയ തന്മാത്രകളാണിവ. ഗോളാകൃതിയിലുളള ഫുള്ളറീനുകള് ബക്കിബാളുകളെന്നും സിലിണ്ടറാകൃതിയിലുള്ളവ ബക്കിട്യൂബുകളെന്നും അറിയപ്പെടുന്നു. 1985ല് റോബര്ട്ട് കേള് (Robert Curl), ഹരോള്ഡ് ക്രാട്ടോ, റിച്ചാര്ഡ് സ്മാളി എന്നീ ശാസ്ത്രജ്ഞര് ചേര്ന്ന് കരിയില് (soot) നിന്നാണ് ഫുള്ളറീന് ആദ്യമായി കണ്ടെത്തിയത്. 1996ല് പ്രസ്തുത കണ്ടുപിടുത്തത്തിന് ഇവര്ക്ക് രസതന്ത്രത്തിനുള്ള നോബല് സമ്മാനം ലഭിച്ചു. 1992ല് ഷണ്ഗൈറ്റ് (Shungite) ധാതുവിലും 2010ല് കോസ്മിക ധൂളിയിലും ഫുള്ളറീനുകള് കണ്ടെത്തി.
ബക്ക് മിനിസ്റ്റര് ഫുള്ളറീന്
C60 അഥവാ ബക്ക്മിന്സ്റ്റര് ഫുള്ളറീന് ആണ് ആദ്യമായി കണ്ടെത്തിയ ഫുള്ളറീന്. റിച്ചാര്ഡ് ബക്ക്മിന്സ്റ്റര് ഫുള്ളര് എന്ന പ്രശസ്ത ആര്ക്കിടെക്റ്റ് രൂപകല്പന ചെയ്ത ജിയോഡെസിക് കുംഭഗോപുരങ്ങളോട് സദൃശമായതിനാലാണ് C60 ഫുള്ളറീന് ഇദ്ദേഹത്തിന്റെ സ്മരണാര്ഥം ബക്ക്മിന്സ്റ്റര് ഫുള്ളറീന് എന്നപേര് ലഭിച്ചത്. ഫുള്ളറീനുകള് C20+m (m പൂര്ണസംഖ്യ) എന്ന ഫോര്മുല അനുസരിക്കുന്ന തന്മാത്രകളാണ്. മുന്നൂറില് കുറവ് എണ്ണം കാര്ബണ് അണുക്കള് ചേര്ന്ന് രൂപംകൊള്ളുന്ന ഫുള്ളറീനുകള് ബക്കിബാളുകള് എന്നറിയപ്പെടുന്നു. C60 ഫുള്ളറീനാണ് ഇവയില് പ്രമുഖം. ഇരുപത് ഷഡ്ഭുജങ്ങളും പന്ത്രണ്ട് പഞ്ചഭുജങ്ങളും ചേര്ന്നുനിര്മിതമായ ഒരു സോസര്ബോളിനു സദൃശമാണ് C60 ഫുള്ളറീന്റെ ഘടന. പ്രകൃതിയില് ഏറ്റവും കൂടുതല് കാണപ്പെടുന്ന ഫുള്ളറീഌം C60 യാണ്. അറുപതില് കുറവ് എണ്ണം കാര്ബണ് അണുക്കളാല് നിര്മിതമായ ഫുള്ളറീനുകള് "ബക്കിബേബീസ്' എന്നറിയപ്പെടുന്നു.
മതിയായ അളവില് ഓക്സിജന് ലഭിക്കാത്ത സാഹചര്യത്തില് കാര്ബണ് പദാര്ഥങ്ങള്ക്ക് ജ്വലനം നടക്കുമ്പോഴാണ് ഫുള്ളറീന് ഉത്പാദിപ്പിക്കപ്പെടുന്നത്. ഒരു നിഷ്ക്രിയ വാതകാന്തരീക്ഷത്തില് (സാധാരണയായി ഹീലിയം) സമീപസ്ഥങ്ങളായ രണ്ട് ഗ്രാഫൈറ്റ് ഇലക്ട്രാഡുകള്ക്കിടയില് വൈദ്യുതി പ്രവഹിച്ചുകൊണ്ട് ഫുള്ളറീന് നിര്മിക്കാം. വൈദ്യുതപ്രവാഹത്തിന്റെ ഫലമായി ഉത്പാദിപ്പിക്കപ്പെടുന്ന കാര്ബണ് പ്ലാസ്മ തണുക്കുമ്പോള് ലഭിക്കുന്ന ഫുള്ളറീന് സൂട്ടില് വിവിധ ഫുള്ളറീനുകള് അടങ്ങിയിരിക്കും. ഇവയെ ടൊളുവീന് പോലുള്ള ഏതെങ്കിലും ലായകമുപയോഗിച്ച് നിഷ്കര്ഷണം ചെയ്തെടുക്കുന്നു. കോളംക്രാമറ്റോഗ്രാഫി വഴി ഇവയെ വേര്തിരിച്ച് ശുദ്ധീകരിച്ചെടുക്കാം.
ഗന്ധമില്ലാത്ത, കറുത്ത ഖരവസ്തുവാണ് C60 ഫുള്ളറീന്. ബെന്സീന്, ടൊളുവീന്, ക്ലോറോഫോം എന്നിവയില് ഫുള്ളറീനുകള് ലേയമാണ്. C60 യുടെ ലേയത്വം ടൊളുവിനില് 2.8 മി.ഗ്രാം/മി.ലി. ആണ്. വലിപ്പം കൂടുന്നതിനനുസരിച്ച്, ഫുള്ളറീനുകളുടെ ലേയത്വം കുറയും. C60 യുടെ സാന്ദ്രത 1.6 ഗ്രാം/സെ.മീ3. ഒരു C60 ഫുള്ളറീനില് ഓരോ കാര്ബണ് അണുവും മൂന്നു കാര്ബണ് അണുക്കളുമായി ബന്ധിച്ചിരിക്കുന്നു. C60 തന്മാത്ര ആല്ക്കീനുകളുടേതുപോലെ പെരുമാറുന്നു. ഇവ, ഇലക്ട്രാണ് സമൃദ്ധ സ്പീഷിസുകളുമായി എളുപ്പത്തില് പ്രവര്ത്തിക്കുന്നു. C60 ഒരു നല്ല ഓക്സീകാരകമാണ്. ഉയര്ന്ന താപനിലകളില് C60 അസ്ഥിരമാണ്. ഫുള്ളറീനുകളുടെ ഭൗതിക, രാസ ഗുണധര്മങ്ങളെക്കുറിച്ചുള്ള വിശദമായ പഠനങ്ങള് നടന്നുവരുന്നു.
നാനോടെക്നോളജി, ഇലക്ട്രാണിക്സ്, അതിചാലകത, പദാര്ഥശാസ്ത്രം തുടങ്ങിയ മേഖലകളില് ഫുള്ളറീനുകളുടെ ഉപയോഗത്തെക്കുറിച്ചുള്ള ഗവേഷണങ്ങള് നടക്കുന്നുണ്ട്. കാര്ബണികഫോട്ടോവോള്ട്ടായിക് സെല്ലുകളില് n ടൈപ്പ് അര്ധചാലകമായും പോളിമര് അഡിറ്റീവ്സ്, ആന്റിഓക്സിഡന്റ് എന്നീ നിലകളിലും ഫുള്ളറീനുകള് ഉപയോഗിക്കാം. ജൈവ, വൈദ്യശാസ്ത്രരംഗങ്ങളില് ഫുള്ളറീനുകള്ക്ക് വളരെയേറെ സാധ്യതകളുണ്ട്. വൈദ്യശാസ്ത്രമേഖലയില് അര്ബുദചികിത്സയിലും മറ്റും ഫുള്ളറീനുകളുടെ ഉപയോഗത്തെക്കുറിച്ച് പഠനങ്ങള് നടക്കുന്നുണ്ട്. ജൈവമേഖലയില് എന്സൈം ഇന്ഹിബിഷന്, ആന്റിവൈറല് ആക്റ്റിവിറ്റി, ഡി.എന്.എ. വിഘടനം, ഫോട്ടോഡൈനമിക് തെറാപ്പി എന്നിവയിലെല്ലാം ഫുള്ളറീനുകള് ഉപയോഗപ്രദമാണെന്ന് പഠനങ്ങള് തെളിയിച്ചിട്ടുണ്ട്. കാര്ബണിക തന്മാത്രകളെ തിരിച്ചറിയുന്ന രാസസംവേദകമായും ഫുള്ളറീനുകള് ഉപയോഗിക്കാം.
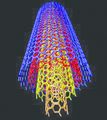
കാര്ബണ് നാനോട്യൂബ്
നാനോ വലുപ്പത്തിലുള്ള സിലിണ്ടറിന്റെ ആകൃതിയിലുള്ള കാര്ബണ് അല്ലോട്രാപ്പാണിത്. ബക്കിട്യൂബുകളെന്നും അറിയപ്പെടുന്ന ഇവയ്ക്ക് ഗ്രാഫൈറ്റിനു സമാനമായ ഘടനയാണുള്ളത്. നാനോമീറ്ററുകള് മാത്രം വീതിയുള്ള ഇത്തരം ട്യൂബുകള്ക്ക് ഏതാഌം മൈക്രാമീറ്ററുകള് മുതല് മില്ലിമീറ്ററുകള് വരെ നീളവും ഒരു നാനോമീറ്റര് വ്യാസവുമുണ്ടായിരിക്കും. ഇവയുടെ അഗ്രങ്ങള് തുറന്നതോ അടഞ്ഞതോ ആയിരിക്കും. കാര്ബണ് നാനോട്യൂബുകള് രണ്ടുവിധത്തിലുണ്ട്ഏകഭിത്തിയുള്ളവയും (single walled nanotube) ബഹുഭിത്തിയുള്ളവയും (Multi walled nanotube). തന്മാത്രാഘടനയിലുള്ള പ്രത്യേകതകള് കാര്ബണ്നാനോട്യൂബുകള്ക്ക് ഉയര്ന്ന താപചാലകത, വിദ്യുത്ചാലകത, വലിവുബലം, വിവിധ യാന്ത്രികഗുണധര്മങ്ങള് എന്നിവ പ്രദാനം ചെയ്യുന്നു. നാനോ സാങ്കേതികവിദ്യ, ഇലക്ട്രാണികം, ഒപ്റ്റിക്സ്, ഊര്ജവിനിയോഗം, വൈദ്യശാസ്ത്രം, വാസ്തുവിദ്യ, പദാര്ഥശാസ്ത്രം എന്നീ മേഖലകളില് കാര്ബണ് നാനോട്യൂബുകള്ക്ക് നിരവധി ഉപയോഗങ്ങളുണ്ട്. ഉയര്ന്ന വൈദ്യുതചാലകതയുള്ളതിനാല് ഇവ ചാലകങ്ങളായും അര്ധചാലകങ്ങളായും ഉപയോഗിക്കാം. കൂടാതെ, സുതാര്യവും വലിച്ചുനീട്ടാവുന്നതും വളയുന്നതുമായതിനാല് ഡിസ്പ്ലേകള്, ടച്ച് സ്ക്രീന്, ഫോട്ടോവോള്ട്ടെയ്ക്കുകള് എന്നിവയിലും ഉപയോഗപ്രദമാണ്. കാര്ബണ് നാനോട്യൂബുകള് ഏറ്റവും നല്ല ഫീല്ഡ്എമിറ്ററുകളാണ്. ഫ്ളാറ്റ്പാനല് ഡിസ്പ്ലേകള്, ഇടിമിന്നല്രോധകങ്ങള്, ഇലക്ട്രാണ് മൈക്രാസ്കോപ്പ് സ്രാതസ്സുകള് എന്നിവയില് ഇവ ഫീല്ഡ് എമിറ്ററുകളായി ഉപയോഗപ്പെടുത്താവുന്നതാണ്. ചാലകപ്ലാസ്റ്റിക്കുകളില് കണ്ടക്റ്റീവ് ഫില്ലറായി (കാര്ബണ് ബ്ലാക്ക്, ഗ്രാഫൈറ്റ് നാരുകള് എന്നിവയാണ് സാധാരണ ഉപയോഗിക്കുന്ന കണ്ടക്റ്റീവ് ഫില്ലറുകള്) കാര്ബണ് നാനോട്യൂബ് ഉപയോഗിക്കാം.
തന്മാത്രീയ ഇലക്ട്രാണികത്തില് നാനോ സ്കെയില് ഇലക്ട്രിക് സ്വിച്ചായി വര്ത്തിക്കുവാഌം സ്വിച്ചുകളെ തമ്മില് ബന്ധിപ്പിക്കുവാഌം കാര്ബണ് നാനോട്യൂബുകള്ക്ക് കഴിവുണ്ട്. ഊര്ജസംഭരണത്തിലും ബക്കിട്യൂബുകള് പ്രയോജനപ്രദമാണ്. ബാറ്ററികള്ക്കും കപ്പാസിറ്ററുകള്ക്കും വേണ്ട ഇലക്ട്രാഡ് നിര്മാണത്തിന് ഇവ ഉപയോഗിക്കാം. സൂപ്പര്കപ്പാസിറ്ററുകളുടെ ഇലക്ട്രാഡ് നിര്മിതിക്ക് ഏറ്റവും മികച്ച പദാര്ഥമാണ് കാര്ബണ് നാനോട്യൂബുകള്. ഫ്യുവല് സെല്ലുകളിലും ഇവ ഉപയോഗപ്രദമാണ്.
ഉയര്ന്ന ദൃഢത, കടുപ്പം, ബലം തുടങ്ങിയ യാന്ത്രിക ഗുണധര്മങ്ങളുള്ള കാര്ബണ് നാനോട്യൂബുകള് ഇത്തരം ഗുണധര്മങ്ങള് ആവശ്യമായ കോംപസിറ്റുകളുടെ നിര്മാണത്തിന് ഉപയോഗിക്കാവുന്നതാണ്. ട്രാന്സ്മിഷന് ലൈന് കേബിളുകള്, വാഹനങ്ങളുടെ യന്ത്രഭാഗങ്ങളും പുറംചട്ടയും നിര്മിക്കല്, തുണിത്തരങ്ങള് എന്നിവയില് ബക്കിട്യൂബ് കോംപസിറ്റ് നാരുകളും ബക്കിട്യൂബ് സ്പണ് നാരുകളും പ്രയോജനകരമാണ്. ഉയര്ന്ന പ്രതലവിസ്തീര്ണമുള്ളതിനാല് കാര്ബണ് നാനോട്യൂബുകള് ഉല്പ്രരകങ്ങള്, ഉല്പ്രരക സപ്പോര്ട്ടുകള് എന്നീ നിലകളില് ഉപയോഗിക്കാം.
ചികിത്സാരംഗത്തും നാനോട്യൂബുകള് വളരെയധികം പ്രയോജനകരമായേക്കാം. തന്മാത്രകളെ തിരിച്ചറിയുന്ന സംവേദകമായും രോഗാതുരമായ ശരീരകലകളില് ഔഷധമെത്തിക്കുന്ന രക്തക്കുഴലുകളായും കാര്ബണ് നാനോട്യൂബുകള് പ്രയോജനപ്പെടുത്താം.
കാര്ബണ് നാനോബഡ്
കാര്ബണ് നാനോട്യൂബും ഫുള്ളറീഌം ചേര്ന്നുകാണപ്പെടുന്ന ഒരു ഹൈബ്രിഡ് അല്ലോട്രാപ്പാണിത്. കാര്ബണ് നാനോട്യൂബിന്റെ ഭിത്തിയുടെ ബഹിര്ഭാഗത്ത് സഹസംയോജകബന്ധനംവഴി ഫുള്ളറീനുകള് ബന്ധിപ്പിക്കപ്പെട്ടിരിക്കുന്നു. 2006ലാണ് ഇവ കണ്ടെത്തിയത്. കാര്ബണ് നാനോട്യൂബിന്റെയും ഫുള്ളറീനുകളുടെയും ഗുണധര്മങ്ങള് ഇവ പ്രദര്ശിപ്പിക്കുന്നു. നാനോട്യൂബുകളുടെ വിദ്യുത്ചാലകതയും ഫുള്ളറീനുകളുടെ ഇലക്ട്രാണ് ബഹിര്ഗമനശേഷിയും നാനോബഡുകളെ മികച്ച ഫീല്ഡ് എമിറ്ററുകളാക്കുന്നു.
കാര്ബണ് നാനോഫോം
കാര്ബണിന്റെ ഈ ക്രിസ്റ്റലീയ അല്ലോട്രാപ്പ് 1997ല് ആസ്ട്രലിയന് നാഷണല് സര്വകലാശാലയിലെ ആന്ഡ്രി. വി. റോഡും സഹപ്രവര്ത്തകരും ചേര്ന്നാണ് കണ്ടെത്തിയത്. ഒരു അയഞ്ഞ ത്രിമാനജാലികയില് നിരവധി കാര്ബണ് കൂട്ടങ്ങള് ക്രമരഹിതമായി കാണപ്പെടുന്ന ഒരു ഘടനയാണ് കാര്ബണ്നാനോഫോമിനുള്ളത്. ഓരോ കാര്ബണ് കൂട്ടവും ആറ് നാനോമീറ്റര് വീതിയില് കാണപ്പെടുന്നു. ഇവയില് നാലായിരത്തോളം കാര്ബണ് ആറ്റങ്ങള് ഗ്രാഫൈറ്റിലേതുപോലെ ഷീറ്റുകളായി കാണപ്പെടുന്നു. ക്രമമായി വിന്യസിച്ചിരിക്കുന്ന ഷഡ്ഭുജങ്ങള്ക്കിടയില് ഉള്ച്ചേര്ന്നിരിക്കുന്ന സപ്തഭുജരൂപങ്ങള് ഈ ഷീറ്റുകള്ക്ക് ഒരു ഋണവക്രത പ്രദാനം ചെയ്യുന്നു. അതായത് ഷീറ്റുകള് ഉള്ളിലേക്ക് വളഞ്ഞ രീതിയിലാണ് കാണപ്പെടുന്നത്. ഷഡ്ഭുജങ്ങള്ക്കിടയില് പഞ്ചഭുജങ്ങള്കൂടി ഉള്ക്കൊണ്ടിട്ടുള്ള ഫുള്ളറീനുകള്ക്ക് ധനവക്രതയാണ്. കാര്ബണ് നാനോഫോളിനെ ഫുള്ളറീനുകളില്നിന്ന് വ്യത്യസ്തമാക്കുന്നത് ഇതാണ്.
വളരെ കുറഞ്ഞ സാന്ദ്രതയുള്ള ഇവ കാര്ബണ്, സിലിക്കണ് എയറോജെല്ലുകളോട് സമാനത പുലര്ത്തുന്നു. ഒരു നിഷ്ക്രിയ വാതകാന്തരീക്ഷത്തില് (സാധാരണയായി ആര്ഗണ്) ഗ്രാഫൈറ്റിലേക്ക് ഉന്നത ഊര്ജമുള്ള ലേസര് രശ്മികള് കടത്തിവിട്ട് കാര്ബണ് നാനോഫോം നിര്മിക്കാം. വളരെ ഉയര്ന്ന പ്രതലവിസ്തീര്ണം പ്രദര്ശിപ്പിക്കുന്ന ഇവ, ഒരു നല്ല താപരോധിയാണ്. പൊതുവേ അതാര്യമാണ്. കാര്ബണ് നാനോഫോമിന്റെ ഏറ്റവും അസാധാരണമായ ഒരു ഗുണധര്മം ഇവ പ്രദര്ശിപ്പിക്കുന്ന ഫെറോകാന്തികതയാണ്. ഇരുമ്പിനെപ്പോലെ, ഇവ കാന്തങ്ങളാല് ശക്തിയായി ആകര്ഷിക്കപ്പെടുന്നു. രൂപീകരണത്തിനുകുറച്ചു മണിക്കൂറുകള്ക്കുശേഷം ഇവയ്ക്ക് ഫെറോകാന്തികത നഷ്ടപ്പെടുമെങ്കിലും വളരെ താഴ്ന്ന താപനിലയില് തണുപ്പിച്ച് ഇത് നിലനിര്ത്താവുന്നതാണ്. കാന്തികസ്വഭാവം അടിസ്ഥാനപ്പെടുത്തി നിര്മിക്കുന്ന ഉപകരണങ്ങളെക്കുറിച്ച് പഠിക്കുന്ന സ്പിന്ട്രാണികത്തില് (spintronics) ഇവ പ്രയോജനപ്രദമായിരിക്കും. ആവരണം, അധിശോഷകം എന്നീ നിലകളിലും വളയുന്ന ഇലക്ട്രാഡുകളായും ഇവ ഉപയോഗിക്കാം എന്ന് പ്രതീക്ഷിക്കുന്നു. ചികിത്സാരംഗത്ത്, രക്തധമനികളിലൂടെ നാനോഫോം കടത്തിവിട്ട് മേന്മയേറിയ എം.ആര്.ഐ. ചിത്രങ്ങള് ലഭ്യമാക്കാം.
ഗ്ലാസ്സികാര്ബണ്
വിട്രിയസ് കാര്ബണ് എന്ന പേരിലും അറിയപ്പെടുന്ന അക്രിസ്റ്റലീയ അല്ലോട്രാപ്പാണിത്. വൈദ്യുതരസതന്ത്രത്തില് ഇലക്ട്രാഡുകള്, ഉന്നതതാപക്ഷമക്രൂസിബിളുകള് എന്നിവയുടെ നിര്മിതിക്കായാണ് ഗ്ലാസ്സികാര്ബണ് കൂടുതലായും ഉപയോഗിക്കുന്നത്. കാര്ബണിക പദാര്ഥങ്ങളെ 3000ºC താപനില വരെയുള്ള ഉന്നത ഊഷ്മാവില് വിവിധ താപീയ പ്രക്രിയകള്ക്ക് വിധേയമാക്കിയാണ് ഗ്ലാസ്സികാര്ബണ് നിര്മിക്കുന്നത്. 1950ല് ഇംഗ്ലണ്ടിലെ കാര്ബൊറണ്ടം കമ്പനിയിലെ ഉദ്യോഗസ്ഥനായ ബര്നാര്ഡ് റെഡ്ഫേണ് ആണ് ഗ്ലാസ്സികാര്ബണെക്കുറിച്ച് ആദ്യമായി നിരീക്ഷണം നടത്തുന്നത്. പിന്നീട് 1960ല്ഇംഗ്ലണ്ടിലെ "ദ് ജനറല് ഇലക്ട്രിക് കമ്പനി'യിലെ ലബോറട്ടറി ജീവനക്കാര് സെല്ലുലോസ് ആരംഭപദാര്ഥമായി ഉപയോഗിച്ച് ഗ്ലാസ്സികാര്ബണ് നിര്മിച്ചു.
ഗ്ലാസ്സികാര്ബണ് രാസപരമായി നിഷ്ക്രിയമാണ്. വാതകങ്ങള്ക്കും ദ്രാവകങ്ങള്ക്കും തികച്ചും അതാര്യമാണ്. ഉയര്ന്ന താപരോധം, ദൃഢത, താഴ്ന്ന സാന്ദ്രത, താഴ്ന്ന വിദ്യുത്രോധം, താഴ്ന്ന ഘര്ഷണം എന്നിവയെല്ലാം ഗ്ലാസ്സികാര്ബണിന്റെ ഗുണധര്മങ്ങളാണ്. അമ്ലങ്ങളുടെ പ്രവര്ത്തനങ്ങളെയും ഇവ ഫലപ്രദമായി ചെറുക്കുന്നു. സാന്ദ്രസള്ഫ്യൂറിക് അമ്ലത്തിന്റെയും നൈട്രിക് അമ്ലത്തിന്റെയും മിശ്രിതത്തിന് ഗ്ലാസ്സികാര്ബണെ നിരോക്സീകരിക്കുവാന് കഴിയില്ല. ഓക്സിജന്, കാര്ബണ്ഡൈഓക്സൈഡ്, ജലഭാഷ്പം എന്നിവയിലെല്ലാം ഗ്ലാസ്സികാര്ബണിന്റെ ഓക്സീകരണനിരക്ക് മറ്റു കാര്ബണുകളുടേതിനെക്കാള് കുറവാണ്.
ഐസോടോപ്പുകള്
കാര്ബണിന് C10, C11, C12, C13, C14, C15 , C16 എന്നിങ്ങനെ ഏഴ് ഐസോടോപ്പുകള് അറിയപ്പെട്ടിട്ടുണ്ട്. C12, C13 എന്നിവയ്ക്കു മാത്രമേ സുസ്ഥിരതയുള്ളൂ. പ്രകൃതിദത്ത കാര്ബണ് 98.89 ശ.മാ. C12 ഉം 1.11 ശ.മാ. C13 ഉം അടങ്ങിയതാണ്. മറ്റുള്ളവ റേഡിയോ ആക്റ്റീവ് ഐസോടോപ്പുകളാണ്. ചിലവയുടെ അര്ധകാലം ഇപ്രകാരമാണ്: C10 20സെക്കന്ഡ്, C11 20.5മിനിട്ട്, C14 5730 40 വര്ഷം, C15 2.4സെക്കന്ഡ്. ഏറ്റവും പ്രധാനമായ കാര്ബണ് ഐസോടോപ്പ് C12 ആണ്.
ഭൗതിക, രാസഗുണധര്മങ്ങള്
രാസപ്രവര്ത്തനങ്ങളില് കാര്ബണിന്റെ സാധാരണ സംയോജകത 4 ആണെങ്കിലും 2, 3 സംയോജകതകളും പ്രദര്ശിപ്പിക്കുന്നുണ്ട്. സാധാരണ താപനിലയില് കാര്ബണ്മൂലകം ക്രിയാശീലത കുറഞ്ഞതാണ്. ജലത്തിലോ അമ്ലങ്ങളിലോ കാര്ബണിക ലായനികളിലോ ലയിക്കുന്നില്ല. ചൂടാക്കുമ്പോള് കാര്ബണിന്റെ ക്രിയാശീലത വര്ധിക്കുന്നു. ഉയര്ന്ന താപനിലകളില് കാര്ബണ് എളുപ്പത്തില് ഓക്സീകരിക്കപ്പെട്ട് കാര്ബണ് ഡൈഓക്സൈഡ് രൂപീകരിക്കുന്നു. ഇത് ഒരു നല്ല നിരോക്സീകാരകമാണ്. ലോഹനിഷ്കര്ഷണത്തില് (Fe, Zn) അയിരുകളില് നിന്നും ലോഹം ഉരുക്കി വേര്തിരിക്കുന്നതിന് കാര്ബണിന്റെ ഈ സ്വഭാവം ഉപയോഗപ്പെടുത്തുന്നു.
കാര്ബണിന്റെ ഭൗതിക, രാസ ഗുണധര്മങ്ങള് ക്രിസ്റ്റല് ഘടനയോടു ബന്ധപ്പെട്ടിരിക്കുന്നു. ഗ്രാഫൈറ്റിന്റെ ഉരുകല്നില 3,500ºC വജ്രത്തിന്റെ ഉരുകല്നില 4,830ºC.
കാര്ബണ് സംയുക്തങ്ങള്
കാര്ബണിന്റെ സംയുക്തങ്ങളെ കാര്ബണികം (organic) എന്നും അകാര്ബണികം (inorganic) എന്നും രണ്ടു വിഭാഗങ്ങളായി തിരിച്ചിരിക്കുന്നു. ഓര്ഗാനിക സംയുക്തങ്ങളെ അവയുടെ ബാഹുല്യം പരിഗണിച്ച് പ്രത്യേകമായി പരാമര്ശിക്കേണ്ടതുണ്ട്. കാര്ബണിന്റെ ഇനോര്ഗാനിക സംയുക്തങ്ങളെക്കുറിച്ചാണ് ഇവിടെ പ്രതിപാദിക്കുന്നത്.
കാര്ബണ്ഓക്സിജന് സംയുക്തങ്ങള്
ഉയര്ന്ന താപനിലയില് കാര്ബണ് ഓക്സിജനുമായി സംയോജിച്ച് കാര്ബണ് മോണോക്സൈഡ് (CO), കാര്ബണ് ഡൈ ഓക്സൈഡ് (CO2) എന്നിവ ഉണ്ടാകുന്നു. ഇവ കൂടാതെ, C3O2, C5O2, C12O9 എന്നീ തന്മാത്രാഫോര്മുലകളിലുള്ള മറ്റ് ഓക്സൈഡുകളും രേഖപ്പെടുത്തപ്പെട്ടിട്ടുണ്ട്. കാര്ബണ് സബ് ഓക്സൈഡ് (C3O2) മാലോണിക് അമ്ലത്തിന്റെ അന്ഹൈഡ്രഡാണ്. മലോണിക് അമ്ലത്തെ ഫോസ്ഫറസ് പെന്റോക്സൈഡ് (P2O5) ഉപയോഗിച്ച് നിര്ജലീകരിച്ച് കാര്ബണ് സബ് ഓക്സൈഡ് ഉണ്ടാക്കാം.
COOH
150OC
CH2 + 2P2O5 4HPO3 + C3O2
COOH
ഈ ഓക്സൈഡ് വായുവില് കത്തി CO2 ആകുന്നു.
C3O2 + 2O2 3CO2
കാര്ബണ് സബ് ഓക്സൈഡ് ജലവുമായി ചേര്ന്ന് മലോണിക് അമ്ലം ഉണ്ടാകുന്നു.
കാര്ബണ്സള്ഫര് സംയുക്തങ്ങള്
കാര്ബണ് മോണോസള്ഫൈഡ് (CS), കാര്ബണ് ഡൈസള്ഫൈഡ് (CS2) എന്നിവയാണ് കാര്ബണിന്റെ സള്ഫര് സംയുക്തങ്ങള്. ഇട അല്പായുസ്സാണ്. CS2വിനെ വിദ്യുത് ചാര്ജിനു വിധേയമാക്കുമ്പോള് CS ഉണ്ടാകുന്നു. ദുര്ഗന്ധവും ബാഷ്പശീലവുമുള്ള ഒരു ദ്രാവകമാണ് കാര്ബണ് ഡൈ സള്ഫൈഡ്. ഉരുകല് നില 111.6OC. തിളനില 46.3OC. സള്ഫര്ബാഷ്പവും ചൂടാക്കിയ കോക്കും തമ്മില് പ്രതിപ്രവര്ത്തിച്ച് കാര്ബണ് ഡൈ സള്ഫൈഡ് ഉണ്ടാകുന്നു.
C + 2S CS2
CS2 ഒരു ലായകമാണ്. കാര്ബണ് ടെട്രാക്ലോറൈഡിന്റെ (CCl4) നിര്മാണത്തിന് ഇത് ഉപയോഗിക്കുന്നു. കാര്ബണ് ഡൈ സള്ഫൈഡ് സോഡിയം ഹൈഡ്രാക്സൈഡ് ലായനിയില് അമീനുകളുമായി പ്രതിപ്രവര്ത്തിച്ച് ഡൈതയോകാര്ബമേറ്റുകളും (A) അമീനുകള്ക്കുപകരം ആല്ക്കോക്സൈഡ് ആണെങ്കില് സാന്ഥേറ്റുകളും (B) ഉണ്ടാകുന്നു.
R1 S S NC ROC R2 S S A B
കാര്ബണിന്റെ മറ്റൊരു സള്ഫര് സംയുക്തമാണ് കാര്ബണൈല് സള്ഫൈഡ് (COS). ചൂടാക്കിയ കുഴലിലൂടെ സള്ഫര് ബാഷ്പവും കാര്ബണ് മോണോക്സൈഡും കൂടി പ്രവഹിക്കുമ്പോള് ഇതുണ്ടാകുന്നു.
കാര്ബണ് ഹാലൈഡുകള്
കാര്ബണ് ഹാലജനുകളുമായി പ്രതിപ്രവര്ത്തിച്ച് ലഘു ഹാലൈഡുകള്, പ്രതിസ്ഥാപിത ഹാലൈഡുകള്, ഓക്സിഹാലൈഡുകള് എന്നിവ രൂപീകരിക്കുന്നു.
ചില കാര്ബണ് ഹാലൈഡുകളും അവയുടെ സ്വഭാവവും പട്ടികയില് കൊടുത്തിരിക്കുന്നു.
യൗഗികം ഉരുകല്നില തിളനില സ്വഭാവം OC OC CF4 185 128 വാതകം, സുസ്ഥിരം CCl4 22.9 76.7 ദ്രാവകം, തികച്ചും സുസ്ഥിരമല്ല CCl4 93 190 ഖരം, തിളയ്ക്കുമ്പോള് വിഘടിക്കുന്നു. CBr 171 _ ഖരം, തിളയ്ക്കുംമുമ്പ് വിഘടിക്കും; താണ മര്ദത്തില് ഉത്പതിക്കും COF2 114 83 ജലം ഇതിനെ വിഘടിപ്പിക്കുന്നു. COCl2 118 7.6 വിഷകരം (ഫോസ്ജിന് എന്നും പേരുണ്ട്) COBr2 _ 65 വായുവില് പുകയുന്നു
കാര്ബണ് ടെട്രാക്ലോറൈഡ് ഒരു പ്രധാന ഹാലൈഡ് ആണ്. കാര്ബണ് ഡൈ സള്ഫൈഡിനെ ക്ലോറിനീകരിച്ച് ഇതു നിര്മിക്കാം.
CS2 + 3Cl2 CCl4 + S2Cl2
നിറമില്ലാത്ത, സുഗന്ധമുള്ള ഒരു ദ്രാവകമാണിത്. ഉരുകല് നില: 22.9ºC. ഘനത്വം: 1.595 ഗ്രാം മില്ലിലിറ്റര് കൊഴുപ്പ്, ഗ്രീസ്, മെഴുക് എന്നിവയെ ലയിപ്പിക്കാന് ഫലവത്തായ ഒരു ലായകമാണിത്. തീ പിടിക്കാത്ത ദ്രാവകമായതിനാല് അഗ്നിശമനികളില് ഉപയോഗിക്കുന്നു. കാര്ബണ് ടെട്രാക്ലോറൈഡിനെ യഥാക്രമം അലുമിനിയം ബ്രാമൈഡ്, അലുമിനിയം അയൊഡൈഡ് എന്നിവയുമായി പ്രതിപ്രവര്ത്തിച്ച് കാര്ബണ് ടെട്രാബ്രാമൈഡും ടെട്രാ അയൊഡൈഡും നിര്മിക്കാം. ഉയര്ന്ന താപനിലകളില് ഈ രണ്ട് സംയുക്തങ്ങളും അസ്ഥിരമാണ്. കാര്ബണ് ടെട്രാ ബ്രാമൈഡ് മങ്ങിയ മഞ്ഞനിറത്തിലുള്ള ഒരു ഖരവസ്തുവാണ്.
കാര്ബണ് ടെട്രാഅയോഡൈഡ് ചുവപ്പുനിറത്തിലുള്ള പരലുകളായിട്ടാണ് കാണപ്പെടുന്നത്. ചൂടായ ലോഹത്തിന്റെ സാന്നിധ്യത്തില് കാര്ബണ് ടെട്രാക്ലോറൈഡ് (CCI4) ജലബാഷ്പവുമായി പ്രതിപ്രവര്ത്തനം നടത്തി കാര്ബണൈല് ക്ലോറൈഡ് (COCl2) ഉണ്ടാകുന്നു. കാര്ബണിന്റെ ഒരു പ്രധാന മിശ്രിത ഹാലൈഡാണ് ഡൈക്ലോറോ ഡൈഫ്ളൂറോ മീഥേന് (CCl2F2). ഇതിനെ ഫ്രിയോണ് എന്നു പറയുന്നു. ആന്റിമണി ക്ലോറൈഡിന്റെ സാന്നിധ്യത്തില് കാര്ബണ്ടെട്രാ ക്ലോറൈഡുമായി ഹൈഡ്രജന്ഫ്ളൂറൈഡ് പ്രതിപ്രവര്ത്തിപ്പിച്ചാണ് ഇത് നിര്മിക്കുന്നത്. ശീതികാരകം എന്ന നിലയില് ഈ സംയുക്തത്തിനു വലിയ പ്രാധാന്യം ഉണ്ട്. ടെഫ്ളോണ് എന്ന ഫ്ളൂറോകാര്ബണ് പ്രചാരമുള്ള ഒരുതരം പ്ലാസ്റ്റിക്കാണ്. ഉയര്ന്ന താപനിലകളില് ഇത് സുസ്ഥിരമാണ്. സാധാരണഗതിയില് റിയേജന്റുകളുമായി പ്രതിപ്രവര്ത്തിക്കുന്നുമില്ല.
കാര്ബോണിക് അമ്ലവും കാര്ബണേറ്റുകളും
കാര്ബണിന്റെ പ്രധാന സംയുക്തങ്ങളാണിവ. കാര്ബണ് ഡൈഓക്സൈഡ് ജലത്തില് ലയിപ്പിച്ചു കിട്ടുന്ന ലായനിയാണ് കാര്ബോണിക് അമ്ലം. ലായനി ചൂടാക്കിയാല് കാര്ബണ് ഡൈ ഓക്സൈഡ് പുറത്തുപോകുന്നു. കാര്ബോണിക് അമ്ലം ശക്തികുറഞ്ഞ ഒരു അമ്ലമാണ്. ലായനിയില് ഇത് H+ ആയും HCO3 ആയും അയോണീകരിക്കുന്നു. വളരെ കുറഞ്ഞ അളവില് CO32 അയോണ് രൂപീകരിക്കുന്നു.
ഒരു ദ്വിബേസിക അമ്ലമായ കാര്ബോണിക് അമ്ലം, രണ്ടു തരത്തിലുള്ള ലവണങ്ങള് രൂപീകരിക്കുന്നു. നോര്മല് ലവണങ്ങളും അമ്ലലവണങ്ങളും. നോര്മല് ലവണങ്ങളെ കാര്ബണേറ്റുകളെന്നും അമ്ലലവണങ്ങളെ ബൈകാര്ബണേറ്റുകളെന്നും വിളിക്കുന്നു.
കാര്ബൈഡുകള്
(നോ. കാര്ബൈഡുകള്)
കാര്ബണ്നൈട്രജന് സംയുക്തങ്ങള്
സയനൈഡ്, സയനേറ്റ്, തയോസയനേറ്റ്, സയനജന് എന്നിവയാണിവയില് പ്രമുഖം. സയനജന് (തന്മാത്രാ ഫോര്മുല: C2N2) സ്ഥിരതയുള്ളതും വിഷകരവുമായ ഒരു വാതകമാണ്. അമോണിയം ഓക്സലേറ്റ് ഫോസ്ഫറസ് പെന്റോക്സൈഡുമായി പ്രതിപ്രവര്ത്തിപ്പിച്ചാണ് ലബോറട്ടറിയില് സയനജന് നിര്മിക്കുന്നത്.
(COONH4)2 C2N2 + 4H2O
നിറമില്ലാത്തതും രൂക്ഷഗന്ധമുള്ളതുമായ സയനജന് ജലം, ആല്ക്കഹോള്, ഈഥര് എന്നിവയില് ലേയമാണ്. ജ്വലനശീലമുള്ള സയനജന് പര്പ്പിള് ജ്വാലയോടുകൂടി കത്തുന്നു. സയനജന് ഹാലൈഡുകളായ സയനജന് ബ്രാമൈഡ് (BrCN), സയനജന് ക്ലോറൈഡ് (CNCl), സയനജന് ഫ്ളൂറൈഡ് (CNF)എന്നിവ ശ്രദ്ധേയങ്ങളായ കാര്ബണ്നൈട്രജന് സംയുക്തങ്ങളാണ്. ഹൈഡ്രജന് സയനൈഡ് (തന്മാത്രാ ഫോര്മുല HCN) അത്യന്തം വിഷകരമായ നിറമില്ലാത്ത ഒരു വാതകമാണ്. 25.6OCല് ഇത് ഘനീഭവിച്ച് ദ്രാവകമായി മാറുന്നു. മീഥേഌം അമോണിയയും തമ്മിലുള്ള ഉല്പ്രരിത ഓക്സീകരണത്തിലൂടെയാണ് വ്യാവസായികമായി ഹൈഡ്രജന് സയനൈഡ് നിര്മിക്കുന്നത്.
2CH4 + 3O2 + 2 NH 2 HCN + 6 H2O
ഹൈഡ്രജന് സയനൈഡ് ജലത്തില് ലയിച്ച് വളരെ ദുര്ബലമായ ഹൈഡ്രാസയനിക് അമ്ലം ഉത്പാദിപ്പിക്കുന്നു. ഹൈഡ്രാസയനിക് അമ്ലത്തിന്റെ ലവണങ്ങളാണ് സയനൈഡുകള്. സയനൈഡുകളില് ഏറ്റവും പ്രധാനപ്പെട്ടത് സോഡിയത്തിന്റെയും പൊട്ടാസ്യത്തിന്റെയും സയനൈഡുകളാണ്. ഇവ സാധാരണയായി നിര്മിക്കുന്നത് കാസ്റ്റ്നര് പ്രക്രിയ വഴിയാണ്. സോഡിയമോ പൊട്ടാസിയമോ കാര്ബണുമായി ചേര്ത്ത് ചൂടാക്കുന്നു. ഉരുകിയ മിശ്രിതത്തിലൂടെ അമോണിയ വാതകം കടത്തിവിടുകയും താപനില 850OC വരെ ഉയര്ത്തുകയും ചെയ്യുന്നു. സയനൈഡിനുപുറമേ, ഹൈഡ്രജന് വാതകവും ഉത്പാദിപ്പിക്കപ്പെടുന്നു. സോഡിയം, പൊട്ടാസിയം സയനൈഡുകള് അത്യന്തം വിഷവസ്തുക്കളാണ്. സ്വര്ണവും വെള്ളിയും ലയിപ്പിക്കാനുള്ള കഴിവുള്ളതിനാല് ഇവയുടെ നിഷ്ക്കര്ഷപ്രക്രിയയില് സോഡിയം, പൊട്ടാസ്യം സയനൈഡുകള് വ്യാപകമായി ഉപയോഗിക്കുന്നു. സ്വര്ണം, വെള്ളി, കാഡ്മിയം, കോപ്പര് എന്നിവയുടെ ഇലക്ട്രാപ്ലേറ്റിങ്ങിലും ഛായാഗ്രഹണത്തിലും ഇവ ഉപയോഗിക്കുന്നുണ്ട്. സയനൈഡുകളുടെ ജലീയലായനിക്ക് ഓക്സീകരണം സംഭവിച്ചാണ് സയനേറ്റ് അയോണുകള് (OCN) ഉണ്ടാകുന്നത്.
PbO + KCN Pb + KOCN
ആല്ക്കലി സയനൈഡുകളെ സള്ഫറുമായി പ്രതിപ്രവര്ത്തിപ്പിച്ച് തയോസയനേറ്റുകളും (SCN) ഉണ്ടാക്കുന്നു.
കാര്ബണ്ഓക്സിജന് സംയുക്തങ്ങള്
ഉയര്ന്ന താപനിലയില് കാര്ബണ് ഓക്സിജനുമായി സംയോജിച്ച് കാര്ബണ് മോണോക്സൈഡ് (CO), കാര്ബണ് ഡൈ ഓക്സൈഡ് (CO2) എന്നിവ ഉണ്ടാകുന്നു. ഇവ കൂടാതെ, C3O2, C5O2, C12O9 എന്നീ തന്മാത്രാഫോര്മുലകളിലുള്ള മറ്റ് ഓക്സൈഡുകളും രേഖപ്പെടുത്തപ്പെട്ടിട്ടുണ്ട്. കാര്ബണ് സബ് ഓക്സൈഡ് (C3O2) മാലോണിക് അമ്ലത്തിന്റെ അന്ഹൈഡ്രഡാണ്. മലോണിക് അമ്ലത്തെ ഫോസ്ഫറസ് പെന്റോക്സൈഡ് (P2O5) ഉപയോഗിച്ച് നിര്ജലീകരിച്ച് കാര്ബണ് സബ് ഓക്സൈഡ് ഉണ്ടാക്കാം.
COOH
150OC
CH2 + 2P2O5 4HPO3 + C3O2
COOH
ഈ ഓക്സൈഡ് വായുവില് കത്തി CO2 ആകുന്നു.
C3O2 + 2O2 3CO2
കാര്ബണ് സബ് ഓക്സൈഡ് ജലവുമായി ചേര്ന്ന് മലോണിക് അമ്ലം ഉണ്ടാകുന്നു.
കാര്ബണ്സള്ഫര് സംയുക്തങ്ങള്
കാര്ബണ് മോണോസള്ഫൈഡ് (CS), കാര്ബണ് ഡൈസള്ഫൈഡ് (CS2) എന്നിവയാണ് കാര്ബണിന്റെ സള്ഫര് സംയുക്തങ്ങള്. ഇട അല്പായുസ്സാണ്. CS2വിനെ വിദ്യുത് ചാര്ജിനു വിധേയമാക്കുമ്പോള് CS ഉണ്ടാകുന്നു. ദുര്ഗന്ധവും ബാഷ്പശീലവുമുള്ള ഒരു ദ്രാവകമാണ് കാര്ബണ് ഡൈ സള്ഫൈഡ്. ഉരുകല് നില 111.6OC. തിളനില 46.3OC. സള്ഫര്ബാഷ്പവും ചൂടാക്കിയ കോക്കും തമ്മില് പ്രതിപ്രവര്ത്തിച്ച് കാര്ബണ് ഡൈ സള്ഫൈഡ് ഉണ്ടാകുന്നു.
C + 2S CS2
CS2 ഒരു ലായകമാണ്. കാര്ബണ് ടെട്രാക്ലോറൈഡിന്റെ (CCl4) നിര്മാണത്തിന് ഇത് ഉപയോഗിക്കുന്നു. കാര്ബണ് ഡൈ സള്ഫൈഡ് സോഡിയം ഹൈഡ്രാക്സൈഡ് ലായനിയില് അമീനുകളുമായി പ്രതിപ്രവര്ത്തിച്ച് ഡൈതയോകാര്ബമേറ്റുകളും (A) അമീനുകള്ക്കുപകരം ആല്ക്കോക്സൈഡ് ആണെങ്കില് സാന്ഥേറ്റുകളും (B) ഉണ്ടാകുന്നു.
R1 S S NC ROC R2 S S A B
കാര്ബണിന്റെ മറ്റൊരു സള്ഫര് സംയുക്തമാണ് കാര്ബണൈല് സള്ഫൈഡ് (COS). ചൂടാക്കിയ കുഴലിലൂടെ സള്ഫര് ബാഷ്പവും കാര്ബണ് മോണോക്സൈഡും കൂടി പ്രവഹിക്കുമ്പോള് ഇതുണ്ടാകുന്നു.
കാര്ബണ് ഹാലൈഡുകള്
കാര്ബണ് ഹാലജനുകളുമായി പ്രതിപ്രവര്ത്തിച്ച് ലഘു ഹാലൈഡുകള്, പ്രതിസ്ഥാപിത ഹാലൈഡുകള്, ഓക്സിഹാലൈഡുകള് എന്നിവ രൂപീകരിക്കുന്നു.
ചില കാര്ബണ് ഹാലൈഡുകളും അവയുടെ സ്വഭാവവും പട്ടികയില് കൊടുത്തിരിക്കുന്നു.
യൗഗികം ഉരുകല്നില തിളനില സ്വഭാവം OC OC CF4 185 128 വാതകം, സുസ്ഥിരം CCl4 22.9 76.7 ദ്രാവകം, തികച്ചും സുസ്ഥിരമല്ല CCl4 93 190 ഖരം, തിളയ്ക്കുമ്പോള് വിഘടിക്കുന്നു. CBr 171 _ ഖരം, തിളയ്ക്കുംമുമ്പ് വിഘടിക്കും; താണ മര്ദത്തില് ഉത്പതിക്കും COF2 114 83 ജലം ഇതിനെ വിഘടിപ്പിക്കുന്നു. COCl2 118 7.6 വിഷകരം (ഫോസ്ജിന് എന്നും പേരുണ്ട്) COBr2 _ 65 വായുവില് പുകയുന്നു
കാര്ബണ് ടെട്രാക്ലോറൈഡ് ഒരു പ്രധാന ഹാലൈഡ് ആണ്. കാര്ബണ് ഡൈ സള്ഫൈഡിനെ ക്ലോറിനീകരിച്ച് ഇതു നിര്മിക്കാം.
CS2 + 3Cl2 CCl4 + S2Cl2
നിറമില്ലാത്ത, സുഗന്ധമുള്ള ഒരു ദ്രാവകമാണിത്. ഉരുകല് നില: 22.9ºC. ഘനത്വം: 1.595 ഗ്രാം മില്ലിലിറ്റര് കൊഴുപ്പ്, ഗ്രീസ്, മെഴുക് എന്നിവയെ ലയിപ്പിക്കാന് ഫലവത്തായ ഒരു ലായകമാണിത്. തീ പിടിക്കാത്ത ദ്രാവകമായതിനാല് അഗ്നിശമനികളില് ഉപയോഗിക്കുന്നു. കാര്ബണ് ടെട്രാക്ലോറൈഡിനെ യഥാക്രമം അലുമിനിയം ബ്രാമൈഡ്, അലുമിനിയം അയൊഡൈഡ് എന്നിവയുമായി പ്രതിപ്രവര്ത്തിച്ച് കാര്ബണ് ടെട്രാബ്രാമൈഡും ടെട്രാ അയൊഡൈഡും നിര്മിക്കാം. ഉയര്ന്ന താപനിലകളില് ഈ രണ്ട് സംയുക്തങ്ങളും അസ്ഥിരമാണ്. കാര്ബണ് ടെട്രാ ബ്രാമൈഡ് മങ്ങിയ മഞ്ഞനിറത്തിലുള്ള ഒരു ഖരവസ്തുവാണ്.
കാര്ബണ് ടെട്രാഅയോഡൈഡ് ചുവപ്പുനിറത്തിലുള്ള പരലുകളായിട്ടാണ് കാണപ്പെടുന്നത്. ചൂടായ ലോഹത്തിന്റെ സാന്നിധ്യത്തില് കാര്ബണ് ടെട്രാക്ലോറൈഡ് (CCI4) ജലബാഷ്പവുമായി പ്രതിപ്രവര്ത്തനം നടത്തി കാര്ബണൈല് ക്ലോറൈഡ് (COCl2) ഉണ്ടാകുന്നു. കാര്ബണിന്റെ ഒരു പ്രധാന മിശ്രിത ഹാലൈഡാണ് ഡൈക്ലോറോ ഡൈഫ്ളൂറോ മീഥേന് (CCl2F2). ഇതിനെ ഫ്രിയോണ് എന്നു പറയുന്നു. ആന്റിമണി ക്ലോറൈഡിന്റെ സാന്നിധ്യത്തില് കാര്ബണ്ടെട്രാ ക്ലോറൈഡുമായി ഹൈഡ്രജന്ഫ്ളൂറൈഡ് പ്രതിപ്രവര്ത്തിപ്പിച്ചാണ് ഇത് നിര്മിക്കുന്നത്. ശീതികാരകം എന്ന നിലയില് ഈ സംയുക്തത്തിനു വലിയ പ്രാധാന്യം ഉണ്ട്. ടെഫ്ളോണ് എന്ന ഫ്ളൂറോകാര്ബണ് പ്രചാരമുള്ള ഒരുതരം പ്ലാസ്റ്റിക്കാണ്. ഉയര്ന്ന താപനിലകളില് ഇത് സുസ്ഥിരമാണ്. സാധാരണഗതിയില് റിയേജന്റുകളുമായി പ്രതിപ്രവര്ത്തിക്കുന്നുമില്ല.
കാര്ബോണിക് അമ്ലവും കാര്ബണേറ്റുകളും
കാര്ബണിന്റെ പ്രധാന സംയുക്തങ്ങളാണിവ. കാര്ബണ് ഡൈഓക്സൈഡ് ജലത്തില് ലയിപ്പിച്ചു കിട്ടുന്ന ലായനിയാണ് കാര്ബോണിക് അമ്ലം. ലായനി ചൂടാക്കിയാല് കാര്ബണ് ഡൈ ഓക്സൈഡ് പുറത്തുപോകുന്നു. കാര്ബോണിക് അമ്ലം ശക്തികുറഞ്ഞ ഒരു അമ്ലമാണ്. ലായനിയില് ഇത് H+ ആയും HCO3 ആയും അയോണീകരിക്കുന്നു. വളരെ കുറഞ്ഞ അളവില് CO32 അയോണ് രൂപീകരിക്കുന്നു.
ഒരു ദ്വിബേസിക അമ്ലമായ കാര്ബോണിക് അമ്ലം, രണ്ടു തരത്തിലുള്ള ലവണങ്ങള് രൂപീകരിക്കുന്നു. നോര്മല് ലവണങ്ങളും അമ്ലലവണങ്ങളും. നോര്മല് ലവണങ്ങളെ കാര്ബണേറ്റുകളെന്നും അമ്ലലവണങ്ങളെ ബൈകാര്ബണേറ്റുകളെന്നും വിളിക്കുന്നു.
കാര്ബൈഡുകള്
(നോ. കാര്ബൈഡുകള്)
കാര്ബണ്നൈട്രജന് സംയുക്തങ്ങള്
സയനൈഡ്, സയനേറ്റ്, തയോസയനേറ്റ്, സയനജന് എന്നിവയാണിവയില് പ്രമുഖം. സയനജന് (തന്മാത്രാ ഫോര്മുല: C2N2) സ്ഥിരതയുള്ളതും വിഷകരവുമായ ഒരു വാതകമാണ്. അമോണിയം ഓക്സലേറ്റ് ഫോസ്ഫറസ് പെന്റോക്സൈഡുമായി പ്രതിപ്രവര്ത്തിപ്പിച്ചാണ് ലബോറട്ടറിയില് സയനജന് നിര്മിക്കുന്നത്.
(COONH4)2 C2N2 + 4H2O
നിറമില്ലാത്തതും രൂക്ഷഗന്ധമുള്ളതുമായ സയനജന് ജലം, ആല്ക്കഹോള്, ഈഥര് എന്നിവയില് ലേയമാണ്. ജ്വലനശീലമുള്ള സയനജന് പര്പ്പിള് ജ്വാലയോടുകൂടി കത്തുന്നു. സയനജന് ഹാലൈഡുകളായ സയനജന് ബ്രാമൈഡ് (BrCN), സയനജന് ക്ലോറൈഡ് (CNCl), സയനജന് ഫ്ളൂറൈഡ് (CNF)എന്നിവ ശ്രദ്ധേയങ്ങളായ കാര്ബണ്നൈട്രജന് സംയുക്തങ്ങളാണ്. ഹൈഡ്രജന് സയനൈഡ് (തന്മാത്രാ ഫോര്മുല HCN) അത്യന്തം വിഷകരമായ നിറമില്ലാത്ത ഒരു വാതകമാണ്. 25.6OCല് ഇത് ഘനീഭവിച്ച് ദ്രാവകമായി മാറുന്നു. മീഥേഌം അമോണിയയും തമ്മിലുള്ള ഉല്പ്രരിത ഓക്സീകരണത്തിലൂടെയാണ് വ്യാവസായികമായി ഹൈഡ്രജന് സയനൈഡ് നിര്മിക്കുന്നത്.
2CH4 + 3O2 + 2 NH 2 HCN + 6 H2O
ഹൈഡ്രജന് സയനൈഡ് ജലത്തില് ലയിച്ച് വളരെ ദുര്ബലമായ ഹൈഡ്രാസയനിക് അമ്ലം ഉത്പാദിപ്പിക്കുന്നു. ഹൈഡ്രാസയനിക് അമ്ലത്തിന്റെ ലവണങ്ങളാണ് സയനൈഡുകള്. സയനൈഡുകളില് ഏറ്റവും പ്രധാനപ്പെട്ടത് സോഡിയത്തിന്റെയും പൊട്ടാസ്യത്തിന്റെയും സയനൈഡുകളാണ്. ഇവ സാധാരണയായി നിര്മിക്കുന്നത് കാസ്റ്റ്നര് പ്രക്രിയ വഴിയാണ്. സോഡിയമോ പൊട്ടാസിയമോ കാര്ബണുമായി ചേര്ത്ത് ചൂടാക്കുന്നു. ഉരുകിയ മിശ്രിതത്തിലൂടെ അമോണിയ വാതകം കടത്തിവിടുകയും താപനില 850OC വരെ ഉയര്ത്തുകയും ചെയ്യുന്നു. സയനൈഡിനുപുറമേ, ഹൈഡ്രജന് വാതകവും ഉത്പാദിപ്പിക്കപ്പെടുന്നു. സോഡിയം, പൊട്ടാസിയം സയനൈഡുകള് അത്യന്തം വിഷവസ്തുക്കളാണ്. സ്വര്ണവും വെള്ളിയും ലയിപ്പിക്കാനുള്ള കഴിവുള്ളതിനാല് ഇവയുടെ നിഷ്ക്കര്ഷപ്രക്രിയയില് സോഡിയം, പൊട്ടാസ്യം സയനൈഡുകള് വ്യാപകമായി ഉപയോഗിക്കുന്നു. സ്വര്ണം, വെള്ളി, കാഡ്മിയം, കോപ്പര് എന്നിവയുടെ ഇലക്ട്രാപ്ലേറ്റിങ്ങിലും ഛായാഗ്രഹണത്തിലും ഇവ ഉപയോഗിക്കുന്നുണ്ട്. സയനൈഡുകളുടെ ജലീയലായനിക്ക് ഓക്സീകരണം സംഭവിച്ചാണ് സയനേറ്റ് അയോണുകള് (OCN) ഉണ്ടാകുന്നത്.
PbO + KCN Pb + KOCN
ആല്ക്കലി സയനൈഡുകളെ സള്ഫറുമായി പ്രതിപ്രവര്ത്തിപ്പിച്ച് തയോസയനേറ്റുകളും (SCN) ഉണ്ടാക്കുന്നു.
കാര്ബണ്ചക്രം
കാര്ബണുമായി ബന്ധപ്പെട്ട പ്രധാനമായൊരു പ്രകൃതിപ്രതിഭാസമാണ് കാര്ബണ് ചക്രം (Carbon cycle). ചെടികള് അന്തരീക്ഷത്തിലെ കാര്ബണ് ഡൈ ഓക്സൈഡിനെ സ്വീകരിച്ച് സൂര്യപ്രകാശത്തിന്റെ സാന്നിധ്യത്തില് കാര്ബോഹൈഡ്രറ്റുകള് നിര്മിക്കുന്നു. ഈ സസ്യങ്ങളെ ഭക്ഷിക്കുന്ന ജന്തുക്കളുടെ ശരീരത്തില്വച്ച് കാര്ബോഹൈഡ്രറ്റുകള്ക്ക് ഉപാപചയം സംഭവിക്കുന്നു. അവയുടെ ഉച്ഛ്വാസത്തിലൂടെ കാര്ബണ് ഡൈ ഓക്സൈഡ് രൂപത്തില് കാര്ബണ് പുറത്തുവരുന്നു. ജന്തുക്കള് മരിച്ചു മണ്ണടിയുമ്പോള് അവയുടെ ശരീരത്തിലുള്ള കാര്ബണ് ബാക്റ്റീരിയയുടെ പ്രവര്ത്തനഫലമായി കാര്ബണ് ഡൈഓക്സൈഡായി അന്തരീക്ഷത്തില് തിരികെ എത്തുന്നു.
ജീവവസ്തുവിന്റെ പ്രധാന മൂലകമാണ് കാര്ബണ്. കാര്ബണിഌം അതിന്റെ മറ്റു രൂപങ്ങള്ക്കും കാര്ബണിന്റെ സംയുക്തങ്ങള്ക്കും വിവിധങ്ങളായ ഉപയോഗങ്ങളുണ്ട്. നോ. കാര്ബണ് ഡൈ ഓക്സൈഡ് ചക്രം, കാര്ബണേറ്റുകള്, കാര്ബൈഡുകള്
(ചുനക്കര ഗോപാലകൃഷ്ണന്; സ.പ.)