This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
കാര്ബണ്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
ഉള്ളടക്കം |
കാര്ബണ്
Carbon
ഖരരൂപത്തിലുള്ള ഒരു അലോഹമൂലകം. ആവര്ത്തനപ്പട്ടികയിലെ പതിനാലാം ഗ്രൂപ്പില് ഉള്പ്പെടുന്ന മൂലകമാണ് കാര്ബണ്. സിംബല്: C; അണുസംഖ്യ: 6; അണുഭാരം: 12.01115.
IS2, 2S2, 2P2 എന്ന ഇലക്ട്രാണിക വിന്യാസമുള്ള കാര്ബണ് സ്വതന്ത്രാവസ്ഥയിലും സംയുക്താവസ്ഥയിലും പ്രകൃതിയില് കാണപ്പെടുന്നു. വജ്രവും ഗ്രാഫൈറ്റും കല്ക്കരിയും ഇതിന്റെ സ്വതന്ത്രാവസ്ഥകളാണ്. അന്തരീക്ഷവായുവില് (0.03 ശ.മാ. വ്യാപ്ത അളവില്) കാര്ബണ്ഡൈഓക്സൈഡ് രൂപത്തില് കാര്ബണ് നിലനില്ക്കുന്നു. കുറഞ്ഞൊരളവില് കാര്ബണ് സംയുക്തങ്ങള് പ്രകൃതിജലത്തിലും കാണാന് കഴിയും. പെട്രാളിയം, പ്രകൃതിവാതകങ്ങള് എന്നിവയിലെ പ്രധാനഘടകം കാര്ബണ് ആണ്. ചുണ്ണാമ്പുകല്ല്, ഡോളോമൈറ്റ്, മാര്ബിള്, ചോക്ക് എന്നിവയില് കാര്ബണേറ്റ് രൂപത്തില് കാര്ബണ് കാണപ്പെടുന്നു.
ജൈവമണ്ഡലത്തിലെ എല്ലാ സുപ്രധാന സംയുക്തങ്ങളിലെയും മുഖ്യഘടകം കാര്ബണ് ആണ്. ഹീലിയത്തിന്റെ ജ്വലനത്തിലൂടെ ഒരു കോസ്മിക് ഉത്പന്നമായി കാര്ബണ് നിര്മിക്കപ്പെടുന്നുണ്ട്. പ്രകൃതിയുടെ എല്ലാ തലങ്ങളിലും കാര്ബണും കാര്ബണ് സംയുക്തങ്ങളും വിതരണം ചെയ്യപ്പെട്ടിട്ടുണ്ടെങ്കിലും അവയുടെ അളവ് താരതമ്യേനകുറവാണ്. ഭൂവല്കത്തില് കഷ്ടിച്ച് 0.032 ശ. മാ. മാത്രമേ കാര്ബണ് ഉള്ളൂ. എന്നാല്, കാര്ബണ് സംയുക്തങ്ങളുടെ എണ്ണം മറ്റു മൂലകങ്ങളുടെയെല്ലാം സംയുക്തങ്ങളുടെയും എണ്ണത്തെക്കാള് വളരെ കൂടുതലാണ്. പത്തുലക്ഷത്തില്പ്പരം കാര്ബണ് സംയുക്തങ്ങള് ഇതിനകം കണ്ടെത്തിയിട്ടുണ്ട്. കാര്ബണ്സംയുക്തങ്ങളുടെ എണ്ണം ദിനംപ്രതി വര്ധിച്ചുകൊണ്ടുമിരിക്കുന്നു. കാര്ബണിനുള്ളതുപോലെ വിവിധങ്ങളും സങ്കീര്ണങ്ങളുമായ സംയുക്തങ്ങള് മറ്റ് ഏറെ മൂലകങ്ങള്ക്കില്ല. ഇവയില് കാര്ബണ്, ഹൈഡ്രജന് സംയുക്തങ്ങളാണ് ഏറിയ പങ്കും. കാര്ബണ്സംയുക്തങ്ങളുടെ വൈപുല്യവും പ്രത്യേകതകളും സാധ്യതകളുംമൂലം "കാര്ബണികരസതന്ത്രം' (Organic chemistry) എന്നൊരു ശാഖതന്നെ രൂപംകൊണ്ടിട്ടുണ്ട്.
കാര്ബണിന്റെ സംയോജകത നാല് ആണ്. ഒന്നിനോടൊന്നു ഘടിപ്പിച്ചുകൊണ്ട് ദൈര്ഘ്യമേറിയ ശൃംഖലകള് ഉണ്ടാക്കാന് കാര്ബണ് അണുകങ്ങള്ക്കു കഴിയും. ഏറ്റവും ചെറിയ ശൃംഖലയില് രണ്ട് കാര്ബണ് അണുകങ്ങള് ഉണ്ടായിരിക്കും. ഉദാ. ഈഥേന് (H3C-CH3). എഴുപതില്പരം കാര്ബണ് അണുകങ്ങള് ബന്ധിച്ചുള്ള സംയുക്തങ്ങള് ലഭ്യമായിട്ടുണ്ട്. ബഹുലകങ്ങളിലെ (പോളിമര്) കാര്ബണ് ശൃംഖല ഇതിലും വളരെ വലുതാണ്. ശൃംഖലാരൂപീകരണത്തില് കാര്ബണിനെ അതിശയിക്കുന്ന മറ്റു മൂലകങ്ങളില്ല. രേഖീയമായി മാത്രമല്ല, ശാഖകളായി പിരിയുവാഌം സംവൃതവലയങ്ങളായി രൂപപ്പെടുവാഌം കാര്ബണ് ശൃംഖലകള്ക്കു കഴിയും.
അല്ലോട്രാപ്പുകള്
അണുകങ്ങള് വ്യത്യസ്തമായ രീതികളില് വിന്യസിച്ച് രൂപംകൊള്ളുന്ന വിവിധ തന്മാത്രീയ രൂപങ്ങള് ആണ് അല്ലോട്രാപ്പുകള്. കാര്ബണ് അല്ലോട്രാപ്പുകള് എന്നപേരില് അറിയപ്പെട്ടിരുന്നത് വജ്രം, ഗ്രാഫൈറ്റ്, അമോര്ഫസ് കാര്ബണ് എന്നിവയായിരുന്നു. കരി, കല്ക്കരി തുടങ്ങിയവയെയാണ് അമോര്ഫസ് അഥവാ അക്രിസ്റ്റലീയ കാര്ബണായി കണക്കാക്കിയിരുന്നത്. ഇവയ്ക്ക് നിയതമായ ക്രിസ്റ്റല് ഘടനയില്ലെങ്കിലും ചെറുപരിധിക്കുള്ളില് കൃത്യമായ അണുവിന്യാസം ഉണ്ട്. ഇവ യഥാര്ഥത്തില് ഗ്രാഫൈറ്റിന്റെയോ വജ്രത്തിന്റെയോ ക്രിസ്റ്റല്ഖണ്ഡങ്ങളെ തമ്മില് പിടിച്ചുനിര്ത്തുന്ന അമോര്ഫസ് കാര്ബണുകള് അടങ്ങുന്ന പോളിക്രിസ്റ്റലീയ/നാനോക്രിസ്റ്റലീയ രൂപങ്ങളാണെന്നും തെളിഞ്ഞിട്ടുണ്ട്. സമീപകാലത്തായി കണ്ടെത്തിയ കാര്ബണിന്റെ നാനോക്രിസ്റ്റലീയ അല്ലോട്രാപ്പുകളാണ് ഗ്രാഫീന്, ഫുള്ളറീന്, കാര്ബണ് നാനോട്യൂബ്, കാര്ബണ് നാനോബഡ്, കാര്ബണ് നാനോഫോം തുടങ്ങിയവ. കൂടാതെ ഗ്രാഫീന് അധിഷ്ഠിതമല്ലാത്ത അമോര്ഫസ് അല്ലോട്രാപ്പാണ് ഗ്ലാസ്സികാര്ബണ്.
വജ്രം
കാര്ബണിന്റെ ഏറ്റവും ശുദ്ധമായ രൂപം വജ്രമാണ്. അറിയപ്പെടുന്നതില് വച്ച് ഏറ്റവും കാഠിന്യമുള്ള പദാര്ഥമാണിത്. പ്രകൃതിയില് വളരെ അപൂര്വമായി മാത്രം കാണപ്പെടുന്നു. തെക്കേ ആഫ്രിക്കയിലും സൈബീരിയയിലും കോംഗോയിലും ബ്രസീലിലും ഇന്ത്യയിലും വജ്രത്തിന്റെ നിക്ഷേപങ്ങള് ഉണ്ട്. ശുദ്ധമായ വജ്രത്തിന് നിറമില്ല. എന്നാല് മാലിന്യങ്ങളുടെ സാന്നിധ്യംമൂലം ചുവപ്പ്, പച്ച, നീല, മഞ്ഞ എന്നീ നിറങ്ങളിലാണ് അത് കണ്ടുവരുന്നത്. മഞ്ഞ ഒഴികെയുള്ള വജ്രങ്ങള് വിലകൂടിയവയാണ്. "കറുത്ത വജ്രം' എന്നറിയപ്പെടുന്ന കാര്ബോനാഡോ ഉള്പ്പെടുന്ന വ്യാവസായിക വജ്രങ്ങള്ക്ക് രത്നം എന്ന നിലയില് മൂല്യമില്ല; എങ്കിലും ഡ്രില്ലിങ്, കട്ടിങ് ഉപകരണങ്ങളുടെ നിര്മാണത്തില് ഇവയ്ക്ക് അദ്വിതീയമായ പങ്കുണ്ട്.
വജ്രത്തിന്റെ ആപേക്ഷിക ഘനത്വം 3.51 ആണ്. പ്രകാശരശ്മികളെ വളരെ ശക്തിയായി അപവര്ത്തനവിധേയമാക്കുന്ന വജ്രത്തിന്റെ അപവര്ത്തനാങ്കം 2.4173 ആണ്. വജ്രം താപത്തിന്റെയോ വൈദ്യുതിയുടെയോ ചാലകമല്ല. എക്സ്കിരണങ്ങളെ കടത്തിവിടുന്നു. എല്ലാത്തരം വജ്രങ്ങള്ക്കും ഒരേ രൂപമല്ല. ബ്രസീലിയന് വജ്രത്തിന് ക്യൂബിക് രൂപമാണ്. തെക്കേ ആഫ്രിക്കയില് നിന്നുള്ളതിന് മുഖ്യമായും ഒക്ടാഹെഡ്രല് രൂപമാണുള്ളത്. "മോ' സ്കെയിലില് വജ്രത്തിന്റെ കാഠിന്യം 10 ആണ്. വജ്രത്തിന്റെ അനിതരസാധാരണമായ ഈ കാഠിന്യത്തിനുകാരണം അതിന്റെ സവിശേഷമായ ഘടനയാണ്. ഓരോ കാര്ബണ് അണുവും വേറെ നാലു കാര്ബണ് അണുകങ്ങളോട് ഒരു ക്രമ ചതുഷ്കോണത്തിന്റെ രൂപത്തില് സഹസംയോജകമായി ബന്ധിച്ചിട്ടുള്ള ഘടനയാണ് വജ്രത്തിന്റേത്. ഇഇ ബന്ധഅകലം 1.54ആണ്. ഇത്തരമൊരു ഘടനയെ തകര്ക്കണമെങ്കില് ധാരാളം ബന്ധങ്ങള് വിച്ഛേദിക്കേണ്ടതുണ്ട്. വജ്രത്തില് ഇലക്ട്രാണുകള് മുഴുവന് യുഗ്മങ്ങളായി (pairs) സ്ഥിതിചെയ്യുന്നതിനാലാണ് വിദ്യുത്ചാലകത ഇല്ലാത്തത്. വായുവില് 600800oC വരെ താപനിലയില് ചൂടാക്കിയാല് വജ്രം കത്തുന്നു. വജ്രം കൃത്രിമമായും നിര്മിക്കുന്നുണ്ട്. ഒരു ലക്ഷം അന്തരീക്ഷമര്ദത്തിലും ഏകദേശം 3,000oC താപനിലയിലും ഗ്രാഫൈറ്റ് സംസ്കരിച്ചാണ് കൃത്രിമ വജ്രം നിര്മിച്ചുവരുന്നത്. ഇപ്രകാരം ലഭിക്കുന്ന വജ്രം മഞ്ഞനിറത്തിലുള്ള ചെറിയ ക്രിസ്റ്റലുകളാണ്. ആഭരണനിര്മാണം, ഡ്രില്ലിങ്, കട്ടിങ് ഉപകരണങ്ങളുടെ നിര്മാണം എന്നിവയ്ക്കായി വജ്രം ഉപയോഗിച്ചുവരുന്നു.
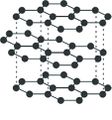
ഗ്രാഫൈറ്റ്
മൃദുത്വവും, ചാരനിറം കലര്ന്ന കറുപ്പുനിറവും തിളക്കവുമുള്ള ഒരു പദാര്ഥമാണ് ഗ്രാഫൈറ്റ്. തൊട്ടാല് തണുപ്പും പശിമയും തോന്നിക്കും. ശ്രീലങ്ക, സൈബീരിയ, യു.എസ്., ബൊഹീമിയ, ഇറ്റലി എന്നീ പ്രദേശങ്ങളില് ഗ്രാഫൈറ്റ് സ്വതന്ത്രാവസ്ഥയില് കാണപ്പെടുന്നു. 1779ല് ആണ് ഗ്രാഫൈറ്റ് ആദ്യം കണ്ടെത്തിയത്. "ഉരസുമ്പോള് കറുത്ത വര വീഴുന്ന' എന്ന് അര്ഥമുള്ള ഗ്രാഫീന് എന്ന ഗ്രീക് പദത്തില്നിന്നാണ് ഗ്രാഫൈറ്റ് എന്ന ഇംഗ്ലീഷ് പദം നിഷ്പന്നമായത്. ആദ്യകാലത്ത് ഈ പദാര്ഥത്തെ ലെഡ്, മോളിബ്ഡേറ്റ് ഖനിജം എന്നൊക്കെയാണ് കരുതിയിരുന്നത്.
===അമോര്ഫസ് കാര്ബണ്===
|
===ഫുള്ളറീന്===
|
||
====ബക്ക് മിനിസ്റ്റര് ഫുള്ളറീന്====
|
====കാര്ബണ് നാനോട്യൂബ്====
|
====കാര്ബണ് നാനോബഡ്====
|
===കാര്ബണ് നാനോഫോം===
|
===ഗ്ലാസ്സികാര്ബണ്===
|
===വജ്രം===
|
===ഗ്രാഫൈറ്റ്===
|
===അമോര്ഫസ് കാര്ബണ്===
|
===ഫുള്ളറീന്===
|
====ബക്ക് മിനിസ്റ്റര് ഫുള്ളറീന്====
|
====കാര്ബണ് നാനോട്യൂബ്====
|
====കാര്ബണ് നാനോബഡ്====
|
====ബക്ക് മിനിസ്റ്റര് ഫുള്ളറീന്====
|
====കാര്ബണ് നാനോട്യൂബ്====
|
====കാര്ബണ് നാനോബഡ്====
|
===കാര്ബണ് നാനോഫോം===
|
===ഗ്ലാസ്സികാര്ബണ്===
|
==ഐസോടോപ്പുകള്==
|
==ഭൗതിക, രാസഗുണധര്മങ്ങള്==
|
==കാര്ബണ് സംയുക്തങ്ങള്==
|
===കാര്ബണ്ഓക്സിജന് സംയുക്തങ്ങള്===
|
COOH
|
150OC
|
CH2 + 2P2O5 4HPO3 + C3O2
|
COOH
|
ഈ ഓക്സൈഡ് വായുവില് കത്തി CO2 ആകുന്നു.
|
കാര്ബണ് സബ് ഓക്സൈഡ് ജലവുമായി ചേര്ന്ന് മലോണിക് അമ്ലം ഉണ്ടാകുന്നു.
|
===കാര്ബണ്സള്ഫര് സംയുക്തങ്ങള്===
|
===കാര്ബണ് ഹാലൈഡുകള്===
|
ചില കാര്ബണ് ഹാലൈഡുകളും അവയുടെ സ്വഭാവവും പട്ടികയില് കൊടുത്തിരിക്കുന്നു.
|
CS2 + 3Cl2 CCl4 + S2Cl2
|
===കാര്ബോണിക് അമ്ലവും കാര്ബണേറ്റുകളും===
|
===കാര്ബൈഡുകള്===
|
(നോ. കാര്ബൈഡുകള്)
|
===കാര്ബണ്നൈട്രജന് സംയുക്തങ്ങള്===
|
2CH4 + 3O2 + 2 NH 2 HCN + 6 H2O
|
സയനൈഡുകളുടെ ജലീയലായനിക്ക് ഓക്സീകരണം സംഭവിച്ചാണ് സയനേറ്റ് അയോണുകള് (OCN) ഉണ്ടാകുന്നത്.
|
PbO + KCN Pb + KOCN
|
===കാര്ബണ്ഓക്സിജന് സംയുക്തങ്ങള്===
|
COOH
|
150OC
|
CH2 + 2P2O5 4HPO3 + C3O2
|
COOH
|
ഈ ഓക്സൈഡ് വായുവില് കത്തി CO2 ആകുന്നു.
|
കാര്ബണ് സബ് ഓക്സൈഡ് ജലവുമായി ചേര്ന്ന് മലോണിക് അമ്ലം ഉണ്ടാകുന്നു.
|
===കാര്ബണ്സള്ഫര് സംയുക്തങ്ങള്===
|
===കാര്ബണ് ഹാലൈഡുകള്===
|
ചില കാര്ബണ് ഹാലൈഡുകളും അവയുടെ സ്വഭാവവും പട്ടികയില് കൊടുത്തിരിക്കുന്നു.
|
CS2 + 3Cl2 CCl4 + S2Cl2
|
===കാര്ബോണിക് അമ്ലവും കാര്ബണേറ്റുകളും===
|
===കാര്ബൈഡുകള്===
|
(നോ. കാര്ബൈഡുകള്)
|
===കാര്ബണ്നൈട്രജന് സംയുക്തങ്ങള്===
|
2CH4 + 3O2 + 2 NH 2 HCN + 6 H2O
|
സയനൈഡുകളുടെ ജലീയലായനിക്ക് ഓക്സീകരണം സംഭവിച്ചാണ് സയനേറ്റ് അയോണുകള് (OCN) ഉണ്ടാകുന്നത്.
|
PbO + KCN Pb + KOCN
|
==കാര്ബണ്ചക്രം==
|
(ചുനക്കര ഗോപാലകൃഷ്ണന്; സ.പ.)
|