This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ഓസോണ്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
Mksol (സംവാദം | സംഭാവനകള്) (പുതിയ താള്: == ഓസോണ് == == Ozone == ഓക്സിജന്റെ അപരരൂപം (allotrope). ഫോർമുല :O3. മൂന്ന് ഓക്...) |
Mksol (സംവാദം | സംഭാവനകള്) (→Ozone) |
||
| (ഇടക്കുള്ള 3 പതിപ്പുകളിലെ മാറ്റങ്ങള് ഇവിടെ കാണിക്കുന്നില്ല.) | |||
| വരി 5: | വരി 5: | ||
== Ozone == | == Ozone == | ||
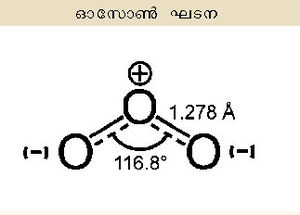
| - | ഓക്സിജന്റെ അപരരൂപം (allotrope). | + | ഓക്സിജന്റെ അപരരൂപം (allotrope). ഫോര്മുല :O<sub>3</sub>. മൂന്ന് ഓക്സിജന് അണുകങ്ങള് അടങ്ങുന്ന ഈ അലോട്രാപിക രൂപം ദ്വിഅണുകരൂപ (O<sub>2</sub>)ത്തെയപേക്ഷിച്ച് കൂടുതല് സക്രിയവും അസ്ഥിരവും ആണ്. ഓസോണ് ആണ് ഒരു രാസമൂലകത്തിന്റെ അലോട്രാപിക രൂപം എന്ന നിലയില് ആദ്യമായി അംഗീകരിക്കപ്പെട്ട തന്മാത്ര. 1840-ല് ക്രിസ്റ്റ്യന് ഫ്രഡറീക്ക് ഷോണ്ബെയ്ന് എന്ന ജര്മ്മന്-സ്വിസ് രസതന്ത്രജ്ഞന് ജലത്തിന്റെ വിദ്യുത് വിശ്ലേഷണ പരീക്ഷണങ്ങള് നടത്തവേ ഒരു പ്രത്യേക ഗന്ധം അനുഭവിച്ചറിയുകയും ഇത് ഒരു സവിശേഷ വാതകത്തിന്റെ ഗന്ധമാണെന്നും വെള്ളഫോസ്ഫറസിന്റെ സാവധാനത്തിലുള്ള ഓക്സീകരണ വേളയിലും ഈ ഗന്ധമുണ്ടാകുന്നുണ്ടെന്നും കണ്ടെത്തി. "മണക്കുക' (to smell) എന്ന ക്രിയാപദമായ ഒസൈല് എന്ന ഗ്രീക് വാക്കില്നിന്നും നിഷ്പാദിപ്പിച്ച ഓസോണ് എന്ന പേര് നല്കി ഈ വാതകത്തെ അദ്ദേഹം നാമകരണം ചെയ്തു. ഹൈഡ്രജന്റെ ഒരു ഓക്സൈഡാണ് ഈ വാതകമെന്നാണ് അന്ന് കരുതിയിരുന്നത്. തുടര്ന്ന് 1865-ല് ജാക്വിസ് ലൂയിസോററ്റ് എന്ന സ്വിസ് രസതന്ത്രജ്ഞന് ഈ വാതകം ഓക്സിജന്റെ ഒരു അപരരൂപമാണെന്നും തന്മാത്രാഫോര്മുല O<sub>3</sub> ആണെന്നും സമര്ഥിച്ചു. |
| - | + | [[ചിത്രം:Vol5_868_image.jpg|300px]] | |
| + | |||
| + | ഭൗമോപരിതലത്തില്നിന്ന് 10-50 കി.മീ. വരെ ഉയരത്തിലുള്ള അന്തരീക്ഷത്തിലാണ് ഓസോണിന്റെ സാന്ദ്രത ഏറ്റവും അധികമായി ഉള്ളത്. ഈ മേഖലയാണ് ഓസോണ്പാളി അഥവാ ഓസോണോസ്ഫിയര് എന്നാണറിയപ്പെടുന്നത്. ഇവിടെ കുറഞ്ഞ തരംഗ നീളത്തിലുള്ള സൗര-വികിരണങ്ങള് ഏറ്റ് ഓക്സിജന് തന്മാത്രകള് വിഘടിതമാകുകയും അങ്ങനെ കിട്ടുന്ന അണുക്കള് O<sub>2</sub> തന്മാത്രകളോട് സംയോജിച്ച് O<sub>3</sub> തന്മാത്രകള് ഉണ്ടാകുകയും ചെയ്യുന്നു. 2420Å-ല് കുറഞ്ഞ തരംഗനീളമുള്ള അള്ട്രാവയലറ്റ് വികിരണങ്ങളാണ് ഇവിടെ പ്രഭാവം ചെലുത്തുന്നത്. എന്നാല് O<sub>3</sub> ഉണ്ടായിക്കഴിയുമ്പോള് അവ 3000Å-ന് അടുത്ത തരംഗനീളമുള്ള വികിരണങ്ങള് അവശോഷണം ചെയ്തു വിഘടിതമാകുകയും ചെയ്യുന്നു. അങ്ങനെ ഒരു ഫോട്ടോ-രാസ-സന്തുലനം സ്ഥാപിക്കപ്പെടുന്നു. ഇത്തരത്തിലുണ്ടാകുന്ന ഓസോണ് പടലം ഭൂമിയെ സൂര്യനില് നിന്നുള്ള ദോഷകാരികളായ വികിരണത്തില്നിന്ന് രക്ഷിച്ച് ജീവന് നിലനിര്ത്തുന്നു എന്നത് പ്രകൃതിയിലെ അദ്ഭുതകരമായ ഒരു പ്രതിഭാസമാണ്. | ||
ഓക്സിജന് അണുവും തന്മാത്രയും തമ്മിലുള്ള സംയോജനം താപമോചകമാകുന്നു. ഈ താപത്തെ ചിതറിക്കാനായി മൂന്നാമതൊരു തന്മാത്രയോ ഉത്പ്രരക പ്രതലമോ ആവശ്യമാണ്. | ഓക്സിജന് അണുവും തന്മാത്രയും തമ്മിലുള്ള സംയോജനം താപമോചകമാകുന്നു. ഈ താപത്തെ ചിതറിക്കാനായി മൂന്നാമതൊരു തന്മാത്രയോ ഉത്പ്രരക പ്രതലമോ ആവശ്യമാണ്. | ||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | + | [[ചിത്രം:Vol5_869_formula.jpg|400px]] | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | താപാവശോഷകമായതിനാല് ഓസോണാകല് ഉയര്ന്ന താപനിലയില് സരളമാണെന്നു തോന്നാമെങ്കിലും വിഘടനം എളുപ്പമാകയാല് വാസ്തവത്തില് താപീയമായ ഓസോണ് നിര്മാണം എളുപ്പമല്ല. | |
| - | + | സീമെന്സ് 1857-ല് ഉപയോഗിച്ച തന്ത്രമാണ് ഓസോണ് നിര്മാണത്തിന് ഏറ്റവും അനുയോജ്യമായത്. ഈ പ്രക്രിയയില് ഒന്നിനുള്ളില് ഒന്നായി വച്ചിട്ടുള്ള രണ്ടു ഗ്ലാസ്കുഴലുകള്ക്കിടയിലെ സ്ഥലത്തുകൂടി വായു അഥവാ ഓക്സിജന് കടത്തിവിടുന്നു. ഉള്ക്കുഴലിന്റെ ഉള്വശവും പുറംകുഴലിന്റെ പുറവും ലോഹത്തകിടുകൊണ്ട് പൊതിഞ്ഞിരിക്കും. ഈ തകിടുകള് ഇലക്ട്രാഡുകളാക്കി അവ തമ്മില് അത്യുന്നതമായ പൊട്ടന്ഷ്യല് വ്യത്യാസം സൃഷ്ടിച്ചുകൊണ്ട് കുഴലുകള്ക്കിടയിലെ ഇടുങ്ങിയ ഇടയില്ക്കൂടി വായുവോ ഓക്സിജനോ കടത്തിവിടുമ്പോള് ഒരു ഉയര്ന്ന വിദ്യുത്-ക്ഷേത്രത്തിന് വിധേയമായി O<sub>2</sub> തന്മാത്രകള് O<sub>3</sub> ആകുന്നു. | |
| - | + | [[ചിത്രം:Vol5_869_formula2.jpg|400px]] | |
| - | + | ||
| - | + | സ്ഫുലിംഗങ്ങള് ഇല്ലാതെയുള്ള ഈ ഡിസ്ചാര്ജിന് നിശ്ശബ്ദ-ഡിസ്ചാര്ജ് എന്നു പറയുന്നു. മൂന്നു മുതല് എട്ടുവരെ ശതമാനം പരിവര്ത്തനം ഈ രീതിയില് സാധിക്കുന്നു. ഓസോണീകരിച്ച വായു അഥവാ ഓക്സിജന് ആണ് സാധാരണ ഉപയോഗിക്കുന്നത്. | |
| - | + | ||
| - | + | ||
| - | ഓസോണോളിസിസ്. അപൂരിത യൗഗികങ്ങളുമായി ഓസോണ് സംയോജിച്ചുകിട്ടുന്ന ഓസോണൈഡിന്റെ ജലവിശ്ലേഷണമോ ഹൈഡ്രജനീകരണമോ ആണ് ഓസോണോളിസിസ്. ഓസോണൈഡിന്റെ | + | [[ചിത്രം:Vol5_869_image.jpg|400px]] |
| + | |||
| + | സീമെന്സ് ഉപകരണത്തിന്റെ തത്ത്വം തന്നെ ഉപയോഗിച്ച് വന്തോതിലും ഓസോണീകരണം സാധിക്കുന്നുണ്ട്. വായുവിനുപകരം ശുദ്ധമായ ഓക്സിജന് ഉപയോഗിക്കുമ്പോള് പരിവര്ത്തനത്തിന്റെ അളവ് കൂടിയിരിക്കും. | ||
| + | |||
| + | ലോഹത്തകിടുകള്ക്കു പകരം ഇലക്ട്രാലൈറ്റ് ലായനികള് (സാധാരണയായി കോപ്പര്സള്ഫേറ്റ്) ഉപയോഗിച്ചുള്ള ഉപകരണങ്ങളും ഉണ്ട് (ബ്രാഡിയുടെ ഓസോണൈസര്, 1872). | ||
| + | |||
| + | കുറഞ്ഞ താപനിലയിലും ഉയര്ന്ന വിദ്യുദ്ധാരാസാന്ദ്രത ഉപയോഗിച്ചും ജലം വിദ്യുദ്വിശ്ലേഷണം ചെയ്ത് ഓസോണീകൃത-ഓക്സിജന് നിര്മിക്കാവുന്നതാണ്. 80 ആംപിയര് സെ.മീ.2 ധാരാസാന്ദ്രതയിലും 7.8 വോള്ട്ടിലുമുള്ള ധാര കൊണ്ട് 1.223-1.07 ആപേക്ഷിക ഘനത്വമുള്ള നേര്ത്ത സള്ഫ്യൂറിക് അമ്ലത്തെ പ്ലാറ്റിനം ഇലക്ട്രാഡുകളുപയോഗിച്ച് ഇലക്ട്രാളിസിനു വിധേയമാക്കി 23-28 ശതമാനം ഓസോണീകൃതമായ ഓക്സിജന് കിട്ടിയിട്ടുണ്ട് (1907). | ||
| + | ചെറിയ തോതില് വായു ഓസോണീകരിക്കാന് അള്ട്രാവയലറ്റ് ദീപങ്ങള് ഉപയോഗിക്കുന്നു. | ||
| + | |||
| + | സാധാരണ ആവശ്യത്തിനു ശുദ്ധഓസോണിനുപകരം ഓസോണീകൃതമായ ഓക്സിജനോ വായുവോ ആണ് ഉപയോഗിക്കപ്പെടുന്നത്. എന്നാല് ശുദ്ധമായ ഓസോണ് ഈ വാതകമിശ്രിതത്തില് നിന്നു വേര്തിരിച്ചെടുക്കാന് പല ഉപായങ്ങളുമുണ്ട്. ഉദാഹരണമായി ഓസോണീകൃത-ഓക്സിജന് ദ്രവീകരിക്കുമ്പോള് കിട്ടുന്ന ദ്രാവകം രണ്ടു പടലങ്ങളായി വേര്പെട്ടിരിക്കും. മുകള് ഭാഗത്തുള്ള നീലദ്രാവകം ദ്രാവക ഓക്സിജനിലെ ഓസോണിന്റെ ലായനിയാകുന്നു. ചുവടെയുള്ള വയലറ്റ് ദ്രാവകം ഓക്സിജന്റെ ഓസോണിലുള്ള ലായനിയാണ്. ഇതില് 70 ശതമാനവും ഓസോണ് ആണ് (183ºC-ല്). ഈ ദ്രാവകത്തിന്റെ ആംശിക-സ്വേദനത്താല് ശുദ്ധമായ ഓസോണ് നിര്മിക്കാം. എന്നാല് ഈ പ്രക്രിയ അപകടം പിടിച്ചതും പ്രയാസമേറിയതുമാണ്. | ||
| + | |||
| + | ഓസോണീകൃതവായു അഥവാ ഓക്സിജന് 90ബ്ബഇ വരെ തണുപ്പിച്ച സിലിക്കാജെല്ലില്ക്കൂടി കടത്തിവിടുമ്പോള് ഓസോണ് അധിശോഷണം ചെയ്യപ്പെടുന്നു. സിലിക്കയുടെ ഭാരത്തിന്റെ ആറ് ശതമാനത്തോളം ഓസോണ് വഹിച്ചിരിക്കുന്ന ജെല് താണ മര്ദത്തിനു വിധേയമാക്കിയാല് അതിലെ ഓസോണ് വിമുക്തമായിത്തീരുന്നു. | ||
| + | |||
| + | ശുദ്ധമായ ഓസോണ് 112ºC-ല്-ല് ദ്രവീഭവിച്ച് കിട്ടുന്നത് നിലനിറമുള്ള ദ്രാവകമാണ്. 251.4ºC-ല് അത് ഖരരൂപമാകുന്നു. | ||
| + | വാതകത്തിനും നീലിമയുണ്ട്. ക്ലോറിന്റേതുപോലുള്ള പ്രത്യേക ഗന്ധമുണ്ട്. കുറഞ്ഞ സാന്ദ്രതയില്പ്പോലും O<sub>3</sub> വാതകം മൃദുചര്മങ്ങളെ തരിപ്പിക്കുന്നു. വളരെ താണഅളവില് ഓസോണ് കലര്ന്നവായു ഉന്മേഷകരമാണ്. കടല്ക്കരയിലെ വായുവില് ഓസോണ് അടങ്ങിയിരിക്കുന്നതിനാലാണ് ഈ കാറ്റ് ഉന്മേഷം നല്കുന്നത്. സക്രിയമായ ഈ വാതകം എളുപ്പത്തില് വിഘടിച്ച് O<sub>2</sub> + O ആയിത്തീരുന്നു. തന്മൂലം സമര്ഥമായ ഒരു ഓക്സിഡൈസിങ് ഏജന്റാണ് ഓസോണ്. ഇതേ കാരണത്താല് വസ്ത്രങ്ങളെയും മറ്റും വെളുപ്പിക്കുകയും (bleaching) അണുജീവികളെ നശിപ്പിക്കുകയും ചെയ്യുന്നു. 100ºC-നു മുകളില് O<sub>3</sub> വിഘടിച്ച് ഓക്സിജനാകുന്നു. ഉത്പ്രരകങ്ങള് ഉണ്ടെങ്കില് വിഘടനം സാധാരണ താപനിലയിലും നടക്കുന്നു. | ||
| + | |||
| + | ജലത്തില് വളരെ കുറഞ്ഞ ലേയത്വമുള്ള ഓസോണ് അനേകം കാര്ബണികലായകങ്ങളില് അവശോഷിതമാകുന്നു. ഉദാ. ടര്പ്പന്റൈന്, സിന്നാമണ്തൈലം. ഈ തൈലങ്ങളില് അപൂരിത യൗഗികങ്ങളുണ്ട്; അവയുമായി ഓസോണ് സംയോജിക്കുന്നതിനാലാണ് അവശോഷിതമാകുന്നത്. റബ്ബറിനെ ഓസോണ് ആക്രമിച്ച് പൊടിഞ്ഞുപോകുന്ന ഒരു സങ്കലന-യൗഗികമാക്കുന്നു. അതിനാല് ഓസോണിന്റെ സാന്നിധ്യമുള്ള ഇടങ്ങളില് റബ്ബര് ഉപയോഗിക്കാവുന്നതല്ല. ഫോസ്ഫറസ്, സള്ഫര്, ആര്സനിക്, അയഡിന് എന്നിവ അവയുടെ ആസിഡ് അന്ഹൈഡ്രഡുകളായി ഓക്സിഡൈസ് ചെയ്യപ്പെടുന്നു. ഹൈഡ്രജന് പെറോക്സൈഡുമായി പ്രവര്ത്തിച്ച് നിരോക്സീകരിക്കപ്പെടുന്നു. | ||
| + | |||
| + | [[ചിത്രം:Vol5_869_formula3.jpg|400px]] | ||
| + | |||
| + | സള്ഫൈഡുകളെ സല്ഫേറ്റ് ആയും മാങ്ഗനീസ് ലവണ ലായനികളെ മാങ്ഗനീസ് ഡൈ ഓക്സൈഡായും ഓസോണ് ഓക്സിഡൈസ് ചെയ്യുന്നു. | ||
| + | |||
| + | ഓസോണോളിസിസ്. അപൂരിത യൗഗികങ്ങളുമായി ഓസോണ് സംയോജിച്ചുകിട്ടുന്ന ഓസോണൈഡിന്റെ ജലവിശ്ലേഷണമോ ഹൈഡ്രജനീകരണമോ ആണ് ഓസോണോളിസിസ്. ഓസോണൈഡിന്റെ ജലവിശ്ലേഷണത്താല് ഒരു കീറ്റോണും ഒരു അമ്ലവും കിട്ടുന്നു. ഹൈഡ്രജനീകരണത്താല് രണ്ടു കീറ്റോണുകള് (അഥവാ ആല്ഡിഹൈഡുകള്) കിട്ടുന്നു. ഈ ഉത്പന്നങ്ങള് ഏതെന്നു നിര്ണയിച്ചാല് ഓസോണൈഡ് തരുന്ന അപൂരിത യൗഗികത്തിലെ ദ്വിബന്ധത്തിന്റെ സ്ഥാനം നിശ്ചയിക്കാവുന്നതാണ്. സംരചനാപരമായ പഠനങ്ങളില് ഈ ഉപായം വളരെ പ്രയോജനപ്പെടുന്നു. ടെര്പ്പീനുകളില്നിന്നും മറ്റും അനേകം കാര്ബണികയൗഗികങ്ങള് നിര്മിക്കാനും ഓസോണോളിസിസ് ഉപയോഗിക്കപ്പെടുന്നു. | ||
ഒരു ഗ്രാം തന്മാത്രാഭാരം യൗഗികം എത്ര ഗ്രാം തന്മാത്രാഭാരം ഓസോണുമായി സംയോജിക്കുന്നു എന്നറിഞ്ഞ് യൗഗികത്തിലുള്ള ദ്വിബന്ധങ്ങളുടെ എണ്ണം തിട്ടപ്പെടുത്താവുന്നതുമാണ്. | ഒരു ഗ്രാം തന്മാത്രാഭാരം യൗഗികം എത്ര ഗ്രാം തന്മാത്രാഭാരം ഓസോണുമായി സംയോജിക്കുന്നു എന്നറിഞ്ഞ് യൗഗികത്തിലുള്ള ദ്വിബന്ധങ്ങളുടെ എണ്ണം തിട്ടപ്പെടുത്താവുന്നതുമാണ്. | ||
| - | |||
| - | |||
| - | |||
| - | |||
| - | |||
| - | (ഡോ.കെ.പി. | + | ഓസോണ് അടങ്ങിയ വായുവുമായി ഒരുതുള്ളി മെര്ക്കുറി ഒരു ഗ്ലാസ്കുഴലില് എടുത്തു കുലുക്കിയാല് മെര്ക്കുറിയുടെ "ചഞ്ചലത' നഷ്ടപ്പെട്ട് കുഴല്ഭിത്തിയില് അത് "വാലുകള്' (tails) പോലെ പറ്റിച്ചേരുന്നു. |
| + | |||
| + | പൊട്ടാസ്യം അയഡൈഡ് ലായനിയില്നിന്ന് ഓസോണ്, അയഡിനെ മുക്തമാക്കുന്നു. ഈ അയഡിന് തയോ സള്ഫേറ്റ് ലായനികൊണ്ട് അനുമാപനം ചെയ്ത് ഓസോണിന്റെ പരിമാണ നിര്ണയം നടത്താവുന്നതാണ്. | ||
| + | |||
| + | ദശലക്ഷത്തില് 0.1 ഭാഗം വരെയുള്ള അളവിലും അനുഭവപ്പെടുന്ന പ്രത്യേകഗന്ധം, 2537Å തരംഗ നീളത്തിലുള്ള വികിരണങ്ങളുടെ തീവ്രമായ അവശോഷണം എന്നിവയാല് ഓസോണിന്റെ സാന്നിധ്യം അഭിദര്ശിക്കാവുന്നതാണ്. | ||
| + | |||
| + | ജലത്തിന്റെയും വായുവിന്റെയും അണുജീവി നാശനത്തിന് ഓസോണ് ഉപയോഗിക്കുന്നു. ജലത്തിലും വായുവിലുമുള്ള ദുര്ഗന്ധത്തെയും ഓസോണ് നശിപ്പിക്കുന്നു. അതുപോലെ മലിനജലത്തിന്റെ ഉപചരണ(treatment)ത്തിനും ഓസോണ് പ്രയോജനപ്പെടുത്താം. ചെറിയതോതില് വെളുപ്പിക്കലിന് ഓസോണ് ഉപയോഗിച്ചുവരുന്നുണ്ട്. കാര്ബണിക രസതന്ത്രത്തിലെ അനുപേക്ഷണീയമായ ഒരു അഭികാരകം (reagent) ആണ് ഓസോണ്. എഥിലീനിക യൗഗികങ്ങളില്നിന്ന് ബന്ധപ്പെട്ട ആസിഡുകള് നിര്മിക്കാന് ഓസോണ് ഉപയോഗിക്കുന്നുണ്ട്. ദ്രവീകരിച്ച O<sub>3</sub> O<sub>2</sub> മിശ്രിതം (25 ശ.മാ. ഓസോണ്) റോക്കറ്റുകളില് ഉപയോഗിച്ചിട്ടുണ്ട്. ഓക്സിഡൈസിങ് ഏജന്റായി ജലശുദ്ധീകരണത്തിനും ഭൂഗര്ഭ റെയില്വേകളിലും ടണലുകളിലും ഖനികളിലും ഓസോണ് ഉപയോഗിച്ചുവരുന്നു. ശീതഗൃഹങ്ങളിലും മറ്റും പൂപ്പലുകളെയും ബാക്റ്റീരിയകളെയും നശിപ്പിക്കാന് ഓസോണുപയോഗിക്കാറുണ്ട്. | ||
| + | |||
| + | ചുരുക്കം ചില രാസപ്രവര്ത്തനങ്ങളിലും ഓസോണ് ഉണ്ടാകുന്നുണ്ട്. ഫ്ളൂറിന് ജലവുമായി പ്രതിപ്രവര്ത്തിക്കുമ്പോള് കിട്ടുന്ന ഓക്സിജനില് ധാരാളം ഓസോണ് അടങ്ങിയിരിക്കും. അതുപോലെ ഫോസ്ഫറസ് സാവധാനം ഓക്സിജനുമായി പ്രതിപ്രവര്ത്തിക്കുമ്പോള് ഓസോണുകളുണ്ടാകുന്നു. പെര്മാങഗനേറ്റുകള്, ഡൈക്രാമേറ്റുകള് എന്നിവയ്ക്ക് സള്ഫ്യൂറിക് അമ്ലം മൂലം വിയോജനം സംഭവിക്കുമ്പോഴും ഓസോണ് ഉണ്ടാകുന്നു. ക്വാര്ട്സ് മെര്ക്കുറി ദീപങ്ങള്ക്കു ചുറ്റുമുള്ള വായുവില് ഓസോണ് എപ്പോഴുമുണ്ടായിരിക്കും. ദീപത്തില്നിന്നു പുറപ്പെടുന്ന അള്ട്രാവയലറ്റ് രശ്മികള് വായുവിലെ ഓക്സിജനെ ഓസോണായി മാറ്റുന്നതുകൊണ്ടാണ് അങ്ങനെ സംഭവിക്കുന്നത്. | ||
| + | |||
| + | (ഡോ.കെ.പി. ധര്മരാജയ്യര്) | ||
Current revision as of 05:18, 18 ഓഗസ്റ്റ് 2014
ഓസോണ്
Ozone
ഓക്സിജന്റെ അപരരൂപം (allotrope). ഫോര്മുല :O3. മൂന്ന് ഓക്സിജന് അണുകങ്ങള് അടങ്ങുന്ന ഈ അലോട്രാപിക രൂപം ദ്വിഅണുകരൂപ (O2)ത്തെയപേക്ഷിച്ച് കൂടുതല് സക്രിയവും അസ്ഥിരവും ആണ്. ഓസോണ് ആണ് ഒരു രാസമൂലകത്തിന്റെ അലോട്രാപിക രൂപം എന്ന നിലയില് ആദ്യമായി അംഗീകരിക്കപ്പെട്ട തന്മാത്ര. 1840-ല് ക്രിസ്റ്റ്യന് ഫ്രഡറീക്ക് ഷോണ്ബെയ്ന് എന്ന ജര്മ്മന്-സ്വിസ് രസതന്ത്രജ്ഞന് ജലത്തിന്റെ വിദ്യുത് വിശ്ലേഷണ പരീക്ഷണങ്ങള് നടത്തവേ ഒരു പ്രത്യേക ഗന്ധം അനുഭവിച്ചറിയുകയും ഇത് ഒരു സവിശേഷ വാതകത്തിന്റെ ഗന്ധമാണെന്നും വെള്ളഫോസ്ഫറസിന്റെ സാവധാനത്തിലുള്ള ഓക്സീകരണ വേളയിലും ഈ ഗന്ധമുണ്ടാകുന്നുണ്ടെന്നും കണ്ടെത്തി. "മണക്കുക' (to smell) എന്ന ക്രിയാപദമായ ഒസൈല് എന്ന ഗ്രീക് വാക്കില്നിന്നും നിഷ്പാദിപ്പിച്ച ഓസോണ് എന്ന പേര് നല്കി ഈ വാതകത്തെ അദ്ദേഹം നാമകരണം ചെയ്തു. ഹൈഡ്രജന്റെ ഒരു ഓക്സൈഡാണ് ഈ വാതകമെന്നാണ് അന്ന് കരുതിയിരുന്നത്. തുടര്ന്ന് 1865-ല് ജാക്വിസ് ലൂയിസോററ്റ് എന്ന സ്വിസ് രസതന്ത്രജ്ഞന് ഈ വാതകം ഓക്സിജന്റെ ഒരു അപരരൂപമാണെന്നും തന്മാത്രാഫോര്മുല O3 ആണെന്നും സമര്ഥിച്ചു.
ഭൗമോപരിതലത്തില്നിന്ന് 10-50 കി.മീ. വരെ ഉയരത്തിലുള്ള അന്തരീക്ഷത്തിലാണ് ഓസോണിന്റെ സാന്ദ്രത ഏറ്റവും അധികമായി ഉള്ളത്. ഈ മേഖലയാണ് ഓസോണ്പാളി അഥവാ ഓസോണോസ്ഫിയര് എന്നാണറിയപ്പെടുന്നത്. ഇവിടെ കുറഞ്ഞ തരംഗ നീളത്തിലുള്ള സൗര-വികിരണങ്ങള് ഏറ്റ് ഓക്സിജന് തന്മാത്രകള് വിഘടിതമാകുകയും അങ്ങനെ കിട്ടുന്ന അണുക്കള് O2 തന്മാത്രകളോട് സംയോജിച്ച് O3 തന്മാത്രകള് ഉണ്ടാകുകയും ചെയ്യുന്നു. 2420Å-ല് കുറഞ്ഞ തരംഗനീളമുള്ള അള്ട്രാവയലറ്റ് വികിരണങ്ങളാണ് ഇവിടെ പ്രഭാവം ചെലുത്തുന്നത്. എന്നാല് O3 ഉണ്ടായിക്കഴിയുമ്പോള് അവ 3000Å-ന് അടുത്ത തരംഗനീളമുള്ള വികിരണങ്ങള് അവശോഷണം ചെയ്തു വിഘടിതമാകുകയും ചെയ്യുന്നു. അങ്ങനെ ഒരു ഫോട്ടോ-രാസ-സന്തുലനം സ്ഥാപിക്കപ്പെടുന്നു. ഇത്തരത്തിലുണ്ടാകുന്ന ഓസോണ് പടലം ഭൂമിയെ സൂര്യനില് നിന്നുള്ള ദോഷകാരികളായ വികിരണത്തില്നിന്ന് രക്ഷിച്ച് ജീവന് നിലനിര്ത്തുന്നു എന്നത് പ്രകൃതിയിലെ അദ്ഭുതകരമായ ഒരു പ്രതിഭാസമാണ്.
ഓക്സിജന് അണുവും തന്മാത്രയും തമ്മിലുള്ള സംയോജനം താപമോചകമാകുന്നു. ഈ താപത്തെ ചിതറിക്കാനായി മൂന്നാമതൊരു തന്മാത്രയോ ഉത്പ്രരക പ്രതലമോ ആവശ്യമാണ്.
താപാവശോഷകമായതിനാല് ഓസോണാകല് ഉയര്ന്ന താപനിലയില് സരളമാണെന്നു തോന്നാമെങ്കിലും വിഘടനം എളുപ്പമാകയാല് വാസ്തവത്തില് താപീയമായ ഓസോണ് നിര്മാണം എളുപ്പമല്ല.
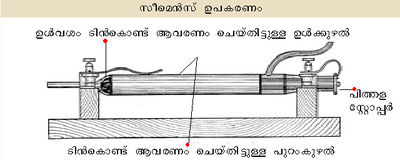
സീമെന്സ് 1857-ല് ഉപയോഗിച്ച തന്ത്രമാണ് ഓസോണ് നിര്മാണത്തിന് ഏറ്റവും അനുയോജ്യമായത്. ഈ പ്രക്രിയയില് ഒന്നിനുള്ളില് ഒന്നായി വച്ചിട്ടുള്ള രണ്ടു ഗ്ലാസ്കുഴലുകള്ക്കിടയിലെ സ്ഥലത്തുകൂടി വായു അഥവാ ഓക്സിജന് കടത്തിവിടുന്നു. ഉള്ക്കുഴലിന്റെ ഉള്വശവും പുറംകുഴലിന്റെ പുറവും ലോഹത്തകിടുകൊണ്ട് പൊതിഞ്ഞിരിക്കും. ഈ തകിടുകള് ഇലക്ട്രാഡുകളാക്കി അവ തമ്മില് അത്യുന്നതമായ പൊട്ടന്ഷ്യല് വ്യത്യാസം സൃഷ്ടിച്ചുകൊണ്ട് കുഴലുകള്ക്കിടയിലെ ഇടുങ്ങിയ ഇടയില്ക്കൂടി വായുവോ ഓക്സിജനോ കടത്തിവിടുമ്പോള് ഒരു ഉയര്ന്ന വിദ്യുത്-ക്ഷേത്രത്തിന് വിധേയമായി O2 തന്മാത്രകള് O3 ആകുന്നു.
സ്ഫുലിംഗങ്ങള് ഇല്ലാതെയുള്ള ഈ ഡിസ്ചാര്ജിന് നിശ്ശബ്ദ-ഡിസ്ചാര്ജ് എന്നു പറയുന്നു. മൂന്നു മുതല് എട്ടുവരെ ശതമാനം പരിവര്ത്തനം ഈ രീതിയില് സാധിക്കുന്നു. ഓസോണീകരിച്ച വായു അഥവാ ഓക്സിജന് ആണ് സാധാരണ ഉപയോഗിക്കുന്നത്.
സീമെന്സ് ഉപകരണത്തിന്റെ തത്ത്വം തന്നെ ഉപയോഗിച്ച് വന്തോതിലും ഓസോണീകരണം സാധിക്കുന്നുണ്ട്. വായുവിനുപകരം ശുദ്ധമായ ഓക്സിജന് ഉപയോഗിക്കുമ്പോള് പരിവര്ത്തനത്തിന്റെ അളവ് കൂടിയിരിക്കും.
ലോഹത്തകിടുകള്ക്കു പകരം ഇലക്ട്രാലൈറ്റ് ലായനികള് (സാധാരണയായി കോപ്പര്സള്ഫേറ്റ്) ഉപയോഗിച്ചുള്ള ഉപകരണങ്ങളും ഉണ്ട് (ബ്രാഡിയുടെ ഓസോണൈസര്, 1872).
കുറഞ്ഞ താപനിലയിലും ഉയര്ന്ന വിദ്യുദ്ധാരാസാന്ദ്രത ഉപയോഗിച്ചും ജലം വിദ്യുദ്വിശ്ലേഷണം ചെയ്ത് ഓസോണീകൃത-ഓക്സിജന് നിര്മിക്കാവുന്നതാണ്. 80 ആംപിയര് സെ.മീ.2 ധാരാസാന്ദ്രതയിലും 7.8 വോള്ട്ടിലുമുള്ള ധാര കൊണ്ട് 1.223-1.07 ആപേക്ഷിക ഘനത്വമുള്ള നേര്ത്ത സള്ഫ്യൂറിക് അമ്ലത്തെ പ്ലാറ്റിനം ഇലക്ട്രാഡുകളുപയോഗിച്ച് ഇലക്ട്രാളിസിനു വിധേയമാക്കി 23-28 ശതമാനം ഓസോണീകൃതമായ ഓക്സിജന് കിട്ടിയിട്ടുണ്ട് (1907). ചെറിയ തോതില് വായു ഓസോണീകരിക്കാന് അള്ട്രാവയലറ്റ് ദീപങ്ങള് ഉപയോഗിക്കുന്നു.
സാധാരണ ആവശ്യത്തിനു ശുദ്ധഓസോണിനുപകരം ഓസോണീകൃതമായ ഓക്സിജനോ വായുവോ ആണ് ഉപയോഗിക്കപ്പെടുന്നത്. എന്നാല് ശുദ്ധമായ ഓസോണ് ഈ വാതകമിശ്രിതത്തില് നിന്നു വേര്തിരിച്ചെടുക്കാന് പല ഉപായങ്ങളുമുണ്ട്. ഉദാഹരണമായി ഓസോണീകൃത-ഓക്സിജന് ദ്രവീകരിക്കുമ്പോള് കിട്ടുന്ന ദ്രാവകം രണ്ടു പടലങ്ങളായി വേര്പെട്ടിരിക്കും. മുകള് ഭാഗത്തുള്ള നീലദ്രാവകം ദ്രാവക ഓക്സിജനിലെ ഓസോണിന്റെ ലായനിയാകുന്നു. ചുവടെയുള്ള വയലറ്റ് ദ്രാവകം ഓക്സിജന്റെ ഓസോണിലുള്ള ലായനിയാണ്. ഇതില് 70 ശതമാനവും ഓസോണ് ആണ് (183ºC-ല്). ഈ ദ്രാവകത്തിന്റെ ആംശിക-സ്വേദനത്താല് ശുദ്ധമായ ഓസോണ് നിര്മിക്കാം. എന്നാല് ഈ പ്രക്രിയ അപകടം പിടിച്ചതും പ്രയാസമേറിയതുമാണ്.
ഓസോണീകൃതവായു അഥവാ ഓക്സിജന് 90ബ്ബഇ വരെ തണുപ്പിച്ച സിലിക്കാജെല്ലില്ക്കൂടി കടത്തിവിടുമ്പോള് ഓസോണ് അധിശോഷണം ചെയ്യപ്പെടുന്നു. സിലിക്കയുടെ ഭാരത്തിന്റെ ആറ് ശതമാനത്തോളം ഓസോണ് വഹിച്ചിരിക്കുന്ന ജെല് താണ മര്ദത്തിനു വിധേയമാക്കിയാല് അതിലെ ഓസോണ് വിമുക്തമായിത്തീരുന്നു.
ശുദ്ധമായ ഓസോണ് 112ºC-ല്-ല് ദ്രവീഭവിച്ച് കിട്ടുന്നത് നിലനിറമുള്ള ദ്രാവകമാണ്. 251.4ºC-ല് അത് ഖരരൂപമാകുന്നു. വാതകത്തിനും നീലിമയുണ്ട്. ക്ലോറിന്റേതുപോലുള്ള പ്രത്യേക ഗന്ധമുണ്ട്. കുറഞ്ഞ സാന്ദ്രതയില്പ്പോലും O3 വാതകം മൃദുചര്മങ്ങളെ തരിപ്പിക്കുന്നു. വളരെ താണഅളവില് ഓസോണ് കലര്ന്നവായു ഉന്മേഷകരമാണ്. കടല്ക്കരയിലെ വായുവില് ഓസോണ് അടങ്ങിയിരിക്കുന്നതിനാലാണ് ഈ കാറ്റ് ഉന്മേഷം നല്കുന്നത്. സക്രിയമായ ഈ വാതകം എളുപ്പത്തില് വിഘടിച്ച് O2 + O ആയിത്തീരുന്നു. തന്മൂലം സമര്ഥമായ ഒരു ഓക്സിഡൈസിങ് ഏജന്റാണ് ഓസോണ്. ഇതേ കാരണത്താല് വസ്ത്രങ്ങളെയും മറ്റും വെളുപ്പിക്കുകയും (bleaching) അണുജീവികളെ നശിപ്പിക്കുകയും ചെയ്യുന്നു. 100ºC-നു മുകളില് O3 വിഘടിച്ച് ഓക്സിജനാകുന്നു. ഉത്പ്രരകങ്ങള് ഉണ്ടെങ്കില് വിഘടനം സാധാരണ താപനിലയിലും നടക്കുന്നു.
ജലത്തില് വളരെ കുറഞ്ഞ ലേയത്വമുള്ള ഓസോണ് അനേകം കാര്ബണികലായകങ്ങളില് അവശോഷിതമാകുന്നു. ഉദാ. ടര്പ്പന്റൈന്, സിന്നാമണ്തൈലം. ഈ തൈലങ്ങളില് അപൂരിത യൗഗികങ്ങളുണ്ട്; അവയുമായി ഓസോണ് സംയോജിക്കുന്നതിനാലാണ് അവശോഷിതമാകുന്നത്. റബ്ബറിനെ ഓസോണ് ആക്രമിച്ച് പൊടിഞ്ഞുപോകുന്ന ഒരു സങ്കലന-യൗഗികമാക്കുന്നു. അതിനാല് ഓസോണിന്റെ സാന്നിധ്യമുള്ള ഇടങ്ങളില് റബ്ബര് ഉപയോഗിക്കാവുന്നതല്ല. ഫോസ്ഫറസ്, സള്ഫര്, ആര്സനിക്, അയഡിന് എന്നിവ അവയുടെ ആസിഡ് അന്ഹൈഡ്രഡുകളായി ഓക്സിഡൈസ് ചെയ്യപ്പെടുന്നു. ഹൈഡ്രജന് പെറോക്സൈഡുമായി പ്രവര്ത്തിച്ച് നിരോക്സീകരിക്കപ്പെടുന്നു.
സള്ഫൈഡുകളെ സല്ഫേറ്റ് ആയും മാങ്ഗനീസ് ലവണ ലായനികളെ മാങ്ഗനീസ് ഡൈ ഓക്സൈഡായും ഓസോണ് ഓക്സിഡൈസ് ചെയ്യുന്നു.
ഓസോണോളിസിസ്. അപൂരിത യൗഗികങ്ങളുമായി ഓസോണ് സംയോജിച്ചുകിട്ടുന്ന ഓസോണൈഡിന്റെ ജലവിശ്ലേഷണമോ ഹൈഡ്രജനീകരണമോ ആണ് ഓസോണോളിസിസ്. ഓസോണൈഡിന്റെ ജലവിശ്ലേഷണത്താല് ഒരു കീറ്റോണും ഒരു അമ്ലവും കിട്ടുന്നു. ഹൈഡ്രജനീകരണത്താല് രണ്ടു കീറ്റോണുകള് (അഥവാ ആല്ഡിഹൈഡുകള്) കിട്ടുന്നു. ഈ ഉത്പന്നങ്ങള് ഏതെന്നു നിര്ണയിച്ചാല് ഓസോണൈഡ് തരുന്ന അപൂരിത യൗഗികത്തിലെ ദ്വിബന്ധത്തിന്റെ സ്ഥാനം നിശ്ചയിക്കാവുന്നതാണ്. സംരചനാപരമായ പഠനങ്ങളില് ഈ ഉപായം വളരെ പ്രയോജനപ്പെടുന്നു. ടെര്പ്പീനുകളില്നിന്നും മറ്റും അനേകം കാര്ബണികയൗഗികങ്ങള് നിര്മിക്കാനും ഓസോണോളിസിസ് ഉപയോഗിക്കപ്പെടുന്നു.
ഒരു ഗ്രാം തന്മാത്രാഭാരം യൗഗികം എത്ര ഗ്രാം തന്മാത്രാഭാരം ഓസോണുമായി സംയോജിക്കുന്നു എന്നറിഞ്ഞ് യൗഗികത്തിലുള്ള ദ്വിബന്ധങ്ങളുടെ എണ്ണം തിട്ടപ്പെടുത്താവുന്നതുമാണ്.
ഓസോണ് അടങ്ങിയ വായുവുമായി ഒരുതുള്ളി മെര്ക്കുറി ഒരു ഗ്ലാസ്കുഴലില് എടുത്തു കുലുക്കിയാല് മെര്ക്കുറിയുടെ "ചഞ്ചലത' നഷ്ടപ്പെട്ട് കുഴല്ഭിത്തിയില് അത് "വാലുകള്' (tails) പോലെ പറ്റിച്ചേരുന്നു.
പൊട്ടാസ്യം അയഡൈഡ് ലായനിയില്നിന്ന് ഓസോണ്, അയഡിനെ മുക്തമാക്കുന്നു. ഈ അയഡിന് തയോ സള്ഫേറ്റ് ലായനികൊണ്ട് അനുമാപനം ചെയ്ത് ഓസോണിന്റെ പരിമാണ നിര്ണയം നടത്താവുന്നതാണ്.
ദശലക്ഷത്തില് 0.1 ഭാഗം വരെയുള്ള അളവിലും അനുഭവപ്പെടുന്ന പ്രത്യേകഗന്ധം, 2537Å തരംഗ നീളത്തിലുള്ള വികിരണങ്ങളുടെ തീവ്രമായ അവശോഷണം എന്നിവയാല് ഓസോണിന്റെ സാന്നിധ്യം അഭിദര്ശിക്കാവുന്നതാണ്.
ജലത്തിന്റെയും വായുവിന്റെയും അണുജീവി നാശനത്തിന് ഓസോണ് ഉപയോഗിക്കുന്നു. ജലത്തിലും വായുവിലുമുള്ള ദുര്ഗന്ധത്തെയും ഓസോണ് നശിപ്പിക്കുന്നു. അതുപോലെ മലിനജലത്തിന്റെ ഉപചരണ(treatment)ത്തിനും ഓസോണ് പ്രയോജനപ്പെടുത്താം. ചെറിയതോതില് വെളുപ്പിക്കലിന് ഓസോണ് ഉപയോഗിച്ചുവരുന്നുണ്ട്. കാര്ബണിക രസതന്ത്രത്തിലെ അനുപേക്ഷണീയമായ ഒരു അഭികാരകം (reagent) ആണ് ഓസോണ്. എഥിലീനിക യൗഗികങ്ങളില്നിന്ന് ബന്ധപ്പെട്ട ആസിഡുകള് നിര്മിക്കാന് ഓസോണ് ഉപയോഗിക്കുന്നുണ്ട്. ദ്രവീകരിച്ച O3 O2 മിശ്രിതം (25 ശ.മാ. ഓസോണ്) റോക്കറ്റുകളില് ഉപയോഗിച്ചിട്ടുണ്ട്. ഓക്സിഡൈസിങ് ഏജന്റായി ജലശുദ്ധീകരണത്തിനും ഭൂഗര്ഭ റെയില്വേകളിലും ടണലുകളിലും ഖനികളിലും ഓസോണ് ഉപയോഗിച്ചുവരുന്നു. ശീതഗൃഹങ്ങളിലും മറ്റും പൂപ്പലുകളെയും ബാക്റ്റീരിയകളെയും നശിപ്പിക്കാന് ഓസോണുപയോഗിക്കാറുണ്ട്.
ചുരുക്കം ചില രാസപ്രവര്ത്തനങ്ങളിലും ഓസോണ് ഉണ്ടാകുന്നുണ്ട്. ഫ്ളൂറിന് ജലവുമായി പ്രതിപ്രവര്ത്തിക്കുമ്പോള് കിട്ടുന്ന ഓക്സിജനില് ധാരാളം ഓസോണ് അടങ്ങിയിരിക്കും. അതുപോലെ ഫോസ്ഫറസ് സാവധാനം ഓക്സിജനുമായി പ്രതിപ്രവര്ത്തിക്കുമ്പോള് ഓസോണുകളുണ്ടാകുന്നു. പെര്മാങഗനേറ്റുകള്, ഡൈക്രാമേറ്റുകള് എന്നിവയ്ക്ക് സള്ഫ്യൂറിക് അമ്ലം മൂലം വിയോജനം സംഭവിക്കുമ്പോഴും ഓസോണ് ഉണ്ടാകുന്നു. ക്വാര്ട്സ് മെര്ക്കുറി ദീപങ്ങള്ക്കു ചുറ്റുമുള്ള വായുവില് ഓസോണ് എപ്പോഴുമുണ്ടായിരിക്കും. ദീപത്തില്നിന്നു പുറപ്പെടുന്ന അള്ട്രാവയലറ്റ് രശ്മികള് വായുവിലെ ഓക്സിജനെ ഓസോണായി മാറ്റുന്നതുകൊണ്ടാണ് അങ്ങനെ സംഭവിക്കുന്നത്.
(ഡോ.കെ.പി. ധര്മരാജയ്യര്)