This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ഖരം
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
ഖരം
Solid
ദ്രവ്യത്തിന്റെ മൂന്ന് അവസ്ഥകളില് ഒന്ന്. മൂലകങ്ങളും സംയുക്തങ്ങളും ഖരം, ദ്രാവകം, വാതകം എന്നീ അവസ്ഥകളില് കാണപ്പെടുന്നു. നിശ്ചിതരൂപവും നിശ്ചിതവ്യാപ്തവും ഉള്ള അണുപുഞ്ജമാണ് ഖരം. സാധാരണയില് അധികം കവിയാത്ത മര്ദവും ബലവും പ്രയോഗിച്ചാല്പ്പോലും ഖരത്തിന് തനതായ രൂപവും വ്യാപ്തവും പരിരക്ഷിക്കാന് കഴിയും. അസമ്മര്ദനീയത, ദൃഢത, യാന്ത്രികബലം തുടങ്ങിയവ ഖരത്തിന്റെ പ്രത്യേകതകളാണ്. ഖരങ്ങള്ക്ക് പൊതുവേ ഘനത്വം കൂടുതലാണ്. ഖരങ്ങളുടെ സ്വഭാവം അനുസരിച്ച് ദൃഢത മാറിക്കൊണ്ടിരിക്കും. വേണ്ടത്ര ബലം പ്രയോഗിച്ചാല് ചിലതരം ഖരങ്ങള് പൊട്ടിത്തകരുന്നു. ഇതിന് ഭംഗുരത (brittleness) എന്നു പറയും. ചില ഖരങ്ങളെ ബലംകൊണ്ട് പാളികളാക്കി മാറ്റാം. ഇതിനെ ആഘാതവര്ധനീയത (malleability) എന്നാണ് പറയുന്നത്. ഖരത്തില് പ്രയോഗിക്കുന്ന ബലം നീക്കുമ്പോള്, ഖരം പൂര്വസ്ഥിതിയിലേക്ക് രൂപമാറ്റം ഇല്ലാതെ മടങ്ങുന്നതിനെ ഇലാസ്തികത (elasticity) എന്നു പറയുന്നു. താപചാലകതയും വിദ്യുത്ചാലകതയും ഖരങ്ങളില് വ്യത്യസ്തമായിരിക്കും. ലോഹങ്ങള് പൊതുവേ നല്ല ചാലകങ്ങളാണ്.
ഖരങ്ങളെ നിയത ജ്യാമിതീയരൂപം ഉള്ളവയെന്നും ഇല്ലാത്തവയെന്നും രണ്ടായി തിരിക്കാം. ജ്യാമിതീയരൂപം ഉള്ളവയെ ക്രിസ്റ്റല് എന്നും ഇല്ലാത്തവയെ രൂപരഹിതം എന്നര്ഥം വരുന്ന അമോര്ഫസ് എന്നും പറയുന്നു. ക്രിസ്റ്റലുകളില് ആറ്റം, തന്മാത്ര അല്ലെങ്കില് അയോണ് ഇവ ക്രമമായി ആവര്ത്തന ത്രിമാനരൂപത്തില് അടുക്കിയിരിക്കുന്നു. അതിനാല് ക്രിസ്റ്റലില് ദീര്ഘപരാസക്രമം (long range order) ഉണ്ട്. ആറ്റം, തന്മാത്ര, അയോണ് എന്നിവ ക്രമമായി അടുക്കിയിട്ടില്ലാത്ത ഖരത്തെ അമോര്ഫസ് എന്നു വിളിക്കുന്നു. ഇവയില് ഹ്രസ്വപരാസക്രമം (short range order) ആണുള്ളത്. ഇക്കാരണത്താല് അമോര്ഫസ് വസ്തുക്കളെ അതിശീതിതദ്രാവകമായി പരിഗണിക്കുന്നു. ഇവയുടെ ദൃഢതയ്ക്ക് ഹേതു ഉയര്ന്ന ശ്യാനത (viscosity)യാണ്. ഗ്ലാസ്, ഉരുകിയ സിലിക്ക, പലതരം പ്ലാസ്റ്റിക്സ് തുടങ്ങിയവ അമോര്ഫസ് ഖരങ്ങള്ക്ക് ഉദാഹരണങ്ങളാണ്.
ക്രിസ്റ്റലില് രാസബന്ധം തുല്യബലമുള്ളവ ആയതിനാല് അതിന് കൃത്യമായ ഉരുകല്നില (melting point)യുണ്ട്. അമോര്ഫസ് ഖരങ്ങള്ക്ക് കൃത്യമായ ഉരുകല്നിലയില്ല. രേഖീയ വികസനഗുണാങ്കം, അപവര്ത്തനാങ്കം തുടങ്ങിയ അമോര്ഫസ് ഖരങ്ങളില് സമദൈശിക (isotropic)വും ക്രിസ്റ്റലുകളില് വിഷമദൈശിക(anisotropic)വും ആണ്. കൂടാതെ, ക്രിസ്റ്റലുകള്ക്ക് കൃത്യമായ വിദളനതല (Cleavage planes)ങ്ങളും ഉണ്ട്. ക്രിസ്റ്റലുകളെ അയോണികം, സഹസംയോജകം, ലോഹം, താന്മാത്രികം എന്നിങ്ങനെ നാലായി തിരിച്ചിരിക്കുന്നു.
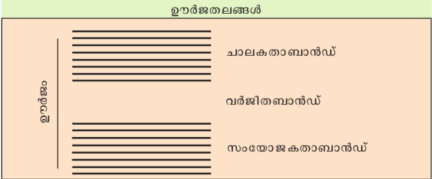
ഖരങ്ങളിലെ ഊര്ജബാന്ഡ്. ഒറ്റപ്പെട്ട ആറ്റങ്ങള് ഒരുമിച്ചുച്ചേര്ന്ന് ക്രിസ്റ്റലുകള് രൂപപ്പെടുമ്പോള് ആറ്റങ്ങള് തമ്മില് ഏതെങ്കിലും തരത്തിലുള്ള ഇലക്ട്രോണ് പങ്കുവയ്ക്കല് നടക്കുന്നു. ഇതിന്റെ ഫലമായുണ്ടാകുന്ന അന്യോന്യ ബന്ധന ഊര്ജത്തിന്റെ അളവാണ് മുന്പറഞ്ഞ നാലുതരം ക്രിസ്റ്റല് വിഭാഗങ്ങളെയും വ്യതിരിക്തമാക്കുന്നത്. അയോണികക്രിസ്റ്റലുകളില് ബന്ധനം താരതമ്യേന ദുര്ബലവും സഹസംയോജകക്രിസ്റ്റലുകളിലും ലോഹങ്ങളിലും കൂടുതല് ശക്തവും ആയിരിക്കും. ആറ്റങ്ങളുടെ അന്യോന്യ പ്രതിപ്രവര്ത്തനത്തിന്റെ ഫലമായി അവയുടെ വാലന്സ് ഇലക്ട്രോണുകള്ക്ക് ലഭ്യമാകുന്ന ഊര്ജതലങ്ങള് വിഭജിച്ച്, തൊട്ടുതൊട്ട് ഊര്ജനിലകളുള്ള ഒരു ബാന്ഡ്പോലെ ആകുന്നു. ഈ സംയോജകതാ ബാന്ഡിനു (valence band) മുകളില് ഇലക്ട്രോണുകളില്ലാത്ത ഒരു ചാലകതാ ബാന്ഡും (conduction band) ഉണ്ടായിരിക്കും. ഈ രണ്ടു ബാന്ഡുകള്ക്കിടയില് ഒരു ഊര്ജവിടവ് (energy gap) ഉണ്ടായെന്നുവരാം.
ലഭ്യമായ ബാന്ഡുകളില് ഇലക്ട്രോണ്കൊണ്ട് പൂരിതമാകുന്നത് പൗളി അപവര്ജകത്വം (Pauli exclusion principle) അനുസരിച്ചാരിക്കും. ഒരു ബഹു ഇലക്ട്രോണ് ആറ്റത്തില് ഇലക്ട്രോണ് പ്രവേശിക്കുന്നതുപോലെയാണിത്. സംയോജകതാ ഇലക്ട്രോണുകള് വസിക്കുന്ന ഉയര്ന്ന ഊര്ജതലത്തെ സംയോജകതാ ബാന്ഡ് (valence hand) എന്നും അതിനുമുകളില് ഇലക്ട്രോണ് വസിക്കാത്ത ബാന്ഡിനെ ചാലകതാ ബാന്ഡ് (conduction band) എന്നും പറയുന്നു. ഈ രണ്ടു ബാന്ഡുകള്ക്കിടയില് ആണ് വര്ജിത ബാന്ഡ് (forbidden band). ഈ മൂന്നു ബാന്ഡുകളും കാണിച്ചിരിക്കുന്നു.
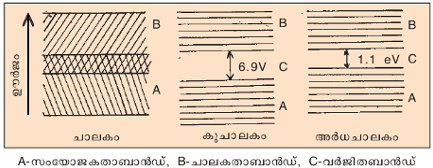
ഖരങ്ങളെ ചാലകങ്ങള്, കുചാലകങ്ങള്, അര്ധചാലകങ്ങള് എന്നിങ്ങനെ മൂന്നായി തിരിക്കാം. ചാലകത്തില് സംയോജകതാബാന്ഡും ചാലകതാ ബാന്ഡും അതിവ്യാപനം ചെയ്തിരിക്കുന്നു. കുചാലകത്തില് ഈ ബാന്ഡുകള്ക്കിടയ്ക്കുള്ള ഊര്ജവിടവ് ഏകദേശം ആറ് ഇലക്ട്രോണ് വോള്ട്ട് (eV) ആണ്. അര്ധചാലകത്തില് ഇത് 1.1 ഇലക്ട്രോണ് വോള്ട്ടിനടുത്തും (ചിത്രം-2), സംയോജകതാ ബാന്ഡില്നിന്ന് ഇലക്ട്രോണുകള് ചാലകബാന്ഡിലേക്ക് പ്രവഹിക്കുമ്പോഴാണ് ചാലകത ഉണ്ടാകുന്നത്.
(ഡോ. പി.എം. മധുസൂദനന്, പ്രൊഫ.കെ. പാപ്പൂട്ടി)