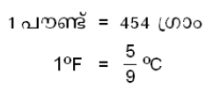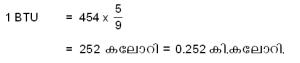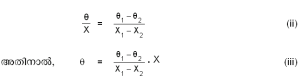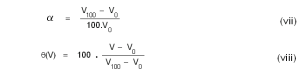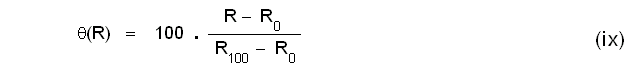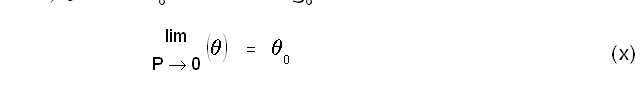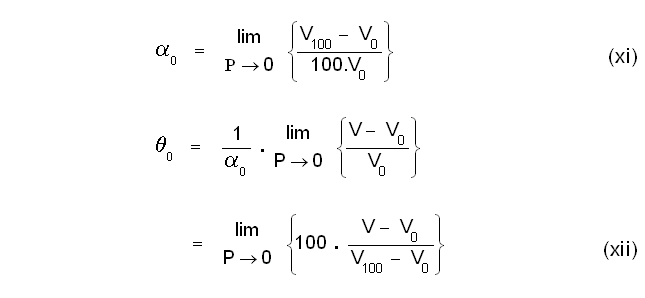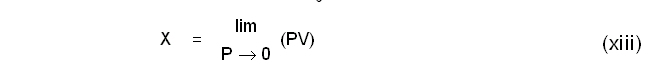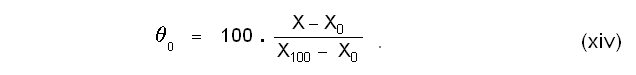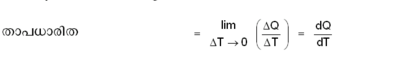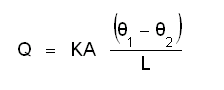This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
താപം
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
ഉള്ളടക്കം |
താപം
Heat
ഊര്ജത്തിന്റെ ഒരു രൂപം. താപനിലയിലുള്ള വ്യത്യാസം കൊണ്ട്, സ്രോതസ്സില് നിന്ന് സിങ്കി(sink)ലേക്കുള്ള ഊര്ജ പ്രവാഹത്തെയാണ് താപം എന്നതുകൊണ്ട് പൊതുവായി വിവക്ഷിക്കുന്നത്. എന്നാല്, താപം എന്ന സംജ്ഞയ്ക്ക് കുറേക്കൂടി വിശാലമായ അര്ഥമാണ് ശാസ്ത്രീയമായി കല്പിക്കുന്നത്. ചാലനം (conduction), സംവഹനം (convection), വികിരണം (radiation) എന്നീ വിവിധ താപപ്രവാഹ പ്രക്രിയകള്, താപമിതി, താപീയ വികാസം, കലോറിമിതി, പ്രാവസ്ഥാ രൂപാന്തരണങ്ങള് (phase transformation) എന്നിവയെക്കുറിച്ചുള്ള അറിവുകള് ഇവയെയെല്ലാം ഇന്ന് 'താപ'ത്തിന്റെ പരിധിയില് ഉള്പ്പെടുത്തിയാണ് പരിഗണിക്കുന്നത്. എങ്കിലും താഴെപ്പറയുന്ന വ്യത്യസ്ത ആശയങ്ങളിലും താപം എന്ന പദം സാധാരണമായി ഉപയോഗിക്കാറുണ്ട്.
1.ചൂടിന്റെ സംവേദനം
2.താപനില അഥവാ ചൂടിന്റെ അളവ്
3.താപോര്ജത്തിന്റെ പരിമാണം
4.വികിരണതാപം (വികിരണോര്ജം അഥവാ വിദ്യുത് കാന്തിക തരംഗങ്ങള്)
ആമുഖം
18-ാം ശ.-ത്തിന്റെ അവസാനംവരെയും 'താപം' എന്നത്, ഭാരം ഇല്ലാത്തതും അദൃശ്യവുമായ കലോറിക്ക് (caloric) എന്ന ഒരു തരം ദ്രാവകം ആണെന്നു കരുതപ്പെട്ടിരുന്നു. ഒരു വസ് തുവിനെ ചൂടാക്കുമ്പോള് ഈ ദ്രാവകം ഉത്പാദിപ്പിക്കപ്പെടുന്നു വെന്നും, രണ്ടു വസ്തുക്കള് പരസ്പരം സമ്പര്ക്കത്തിലേര്പ്പെടു മ്പോള് ചൂടുകൂടിയ വസ്തുവില് നിന്ന് ചൂടു കുറഞ്ഞ വസ്തുവിലേക്ക് അത് പ്രവഹിക്കുന്നുവെന്നും ആയിരുന്നു സങ്കല്പം. രണ്ടു വസ്തുക്കള് കൂട്ടിയിടിക്കുമ്പോള് ചൂടുണ്ടാകുന്നതിന് കാരണം, പ്രസ്തുത ക്രിയയില്, പ്രകൃത്യാ സംഘനിത(condensed)മായി വര്ത്തിക്കുന്ന താപദ്രാവകത്തിന്റെ ഒരംശം സ്വതന്ത്രമാകുന്നതാണത്രെ.
പില്ക്കാലത്ത് ഭൌതികശാസ്ത്രത്തിനുണ്ടായ വളര്ച്ചയില് കലോറിക് സിദ്ധാന്തം തിരസ്കൃതമായി. താപത്തിന്റെ പ്രകൃതത്തെപ്പറ്റി ഇന്ന് നമുക്കുള്ള സങ്കല്പം മുഖ്യമായും കൌണ്ട് റംഫോര്ഡ് (Count Rumford, 17531814), ഹംഫ്രി ഡേവി (Humphry Davy, 17781826), സര് ജയിംസ് പ്രെസ്കോട്ട് ജൂള് (Sir James Prescott Joule, 181889) എന്നിവരുടെ നിരീക്ഷണ ഫലങ്ങളെ അടിസ്ഥാനമാക്കിയുള്ളതാണ്.
ഗവണ്മെന്റിനുവേണ്ടി പീരങ്കി നിര്മാണത്തിന്റെ മേല്നോട്ടം വഹിച്ചിരുന്ന റംഫോര്ഡ്, ഭാരിച്ച ലോഹദണ്ഡുകള് തുളയ്ക്കു മ്പോഴുണ്ടാകുന്ന അത്യധികമായ ചൂടിന് തൃപ്തികരമായ വിശദീ കരണം നല്കാന് കലോറിക് സിദ്ധാന്തം പര്യാപ്തമല്ലെന്ന് സ്ഥാപിച്ചു. താപം ഒരുതരം ചലനമായിരിക്കാമെന്ന നിഗമനത്തില് അദ്ദേഹം എത്തിച്ചേര്ന്നു.
തുടര്ന്ന് 1799-ല് ഹംഫ്രി ഡേവി നടത്തിയ പരീക്ഷണങ്ങള് പുതിയ ചിന്താഗതിക്കനുകൂലമായി ഭവിച്ചു. 'ഘര്ഷണം' (friction) കൊണ്ടോ ആഘാതം കൊണ്ടോ പാദാര്ഥങ്ങളുടെ കണങ്ങള് നിശ്ചയമായും ചലിക്കുകയോ കമ്പനം കൊള്ളുകയോ ചെയ്യുന്നുണ്ടാകണം എന്നായിരുന്നു തന്റെ പരീക്ഷണഫലങ്ങളില് നിന്നുമുള്ള ഡേവിയുടെ നിഗമനം.
റംഫോര്ഡിന്റേയും ഡേവിയുടേയും പരീക്ഷണങ്ങളില് നിന്ന് താപത്തെ സംബന്ധിച്ചിടത്തോളം കേവലം ഗുണാത്മകമായ (qualitative) വിവരം മാത്രമേ ലഭ്യമായുള്ളൂ. എന്നു വരികിലും, താപ വര്ധനവും അതിന് ഹേതുഭൂതമായ യാന്ത്രിക പ്രവൃത്തിയും തമ്മില് ഒരു നിശ്ചിത ബന്ധം ഉണ്ടായിരിക്കണമെന്ന് ഇവര് രണ്ടുപേരും മനസ്സിലാക്കിയിരുന്നെന്ന് കരുതുന്നതില് തെറ്റില്ല. ഈ ബന്ധത്തിന്റെ യഥാര്ഥ സ്വഭാവമെന്തെന്നു പഠിക്കുന്നതിനുവേണ്ടി 1843 മുതല് 78 വരെ ജൂള് നടത്തിയ ശ്രദ്ധേയമായ പരീക്ഷണങ്ങളുടെ ഫലമായി താപവും പ്രവൃത്തിയും ഊര്ജത്തിന്റെ രണ്ട് വ്യത്യസ്ത രൂപങ്ങള് മാത്രമാണെന്നും, താപത്തില് നിന്ന് പ്രവൃത്തിയും പ്രവൃത്തിയില് നിന്ന് താപവും വ്യുത്പാദിപ്പിക്കാന് കഴിയുമെന്നും സ്ഥാപിക്കപ്പെട്ടു.
താപത്തിന്റെ പരിമാണം
Quantity of heat
താപത്തിന്റെ അളവും താപനിലയും ഒന്നുതന്നെയാണെന്ന് പ്രത്യക്ഷത്തില് ചിലര്ക്ക് തോന്നിയെന്നു വരാം. ഇതു ശരിയല്ലെന്ന് താഴെ കൊടുത്തിരിക്കുന്ന ഉദാഹരണങ്ങളില് നിന്ന് മനസ്സിലാക്കാം. 100 ഗ്രാം ഭാരമുള്ള ഒരു ഈയക്കട്ടയുടെ താപനില 100ºC വര്ധിപ്പിക്കുന്നതിന് ആവശ്യമായ താപത്തിന്റെ അളവ്, അത്രയുംതന്നെ ഭാരമുള്ള ഒരു ഉരുക്കുകട്ടയില് അത്രയും താപനില വര്ധനവ് വരുത്തുന്നതിന് വേണ്ട താപത്തിന്റെ ഏതാണ്ട് നാലിലൊരംശം മാത്രമാണ്. ഒരേ അളവ് താപം രണ്ടു വസ്തുക്കളില് വ്യത്യസ്തമായ താപനിലാ വ്യത്യാസമാണുളവാക്കുന്നത്.
മറ്റേതൊരു ഭൗതികരാശിയേയുംപോലെ താപത്തേയും അളക്കുന്നതിന് നിര്ദിഷ്ട മാത്രകള് ഉണ്ട്. താപം അളക്കുന്നതിന് സാധാരണയായി ഉപയോഗിക്കുന്ന മാത്രകള് കലോറി (calorie), കിലോ കലോറി, ബ്രിട്ടിഷ് തെര്മല് യൂണിറ്റ് (BTU) എന്നിവയാണ്.
ഒരു ഗ്രാം വെള്ളത്തിന്റെ താപനില 1ºC ഉയര്ത്തുന്നതിനാവ ശ്യമായ താപത്തിന്റെ അളവാണ് 1 കലോറി. ഇത് കലോറിയുടെ ഒരു സാമാന്യമായ നിര്വചനം മാത്രമാണ്. നിര്വചനം സാങ്കേതികമായി പൂര്ണമാകണമെങ്കില് വെള്ളത്തിന്റെ പ്രാരംഭ താപനില എത്രയെന്ന് സൂചിപ്പിക്കേണ്ടതുണ്ട്. ഇതനുസരിച്ച്, 1 ഗ്രാം വെള്ള ത്തിന്റെ താപനില 14.5ºC ല് നിന്ന് 15.5ºC ലേക്ക് ഉയര്ത്തുന്നതി നാവശ്യമായ താപം ഒരു പ്രമാണ കലോറി അഥവാ 15º കലോറി ആയി അംഗീകരിച്ചിരിക്കുന്നു. 1 ഗ്രാം വെള്ളത്തിന്റെ താപനില 0ºC ല് നിന്ന് 100ºC വരെ ഉയര്ത്തുന്നതിനാവശ്യമായ താപത്തിന്റെ 1/100 അംശത്തിനെ ശരാശരി കലോറി (mean calorie) എന്നു പറയുന്നു.
ഒരു കിലോഗ്രാം വെള്ളത്തിന്റെ താപനില 1ºC ഉയര്ത്തുന്നതി നുവേണ്ട താപത്തിന്റെ അളവ് ഒരു കിലോഗ്രാം-കലോറി, അഥവാ കിലോ-കലോറി എന്നറിയപ്പെടുന്നു. ഇതിനെ ബൃഹദ്കലോറി (large calorie) എന്നും പറയാറുണ്ട്.
1 കിലോ കലോറി = 1000 കലോറി.
ഒരു പൗണ്ട് വെള്ളത്തിന്റെ താപനില 1ºF വര്ധിപ്പിക്കുന്നതിന് ആവശ്യമായ താപത്തിന്റെ പരിമാണമാണ് 1 ബ്രിട്ടിഷ് തെര്മല് യൂണിറ്റ് (BTU). ബ്രിട്ടിഷ് സമ്പ്രദായത്തില് പ്രമാണമായി അംഗീകരിച്ചിട്ടുള്ള താപനിലയുടെ അന്തരാളം 63ºF മുതല് 64ºF വരെയാണ്.
ആയതിനാല് 1 BTU നെ, 454 ഗ്രാം വെള്ളത്തിന്റെ താപനില 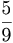 ºC ഉയര്ത്തുന്നതിനുവേണ്ട താപം എന്ന് നിര്വചിക്കാവുന്നതാണ്. ഇതനുസരിച്ച്
ºC ഉയര്ത്തുന്നതിനുവേണ്ട താപം എന്ന് നിര്വചിക്കാവുന്നതാണ്. ഇതനുസരിച്ച്
താപനില
temperature
താപനിലയെപ്പറ്റി മുമ്പ് പല പ്രാവശ്യം പരാമര്ശിച്ചുവെങ്കിലും അതിനെ സാങ്കേതികമായി നിര്വചിക്കുകയുണ്ടായില്ല. താപനിലയ്ക്ക് കൃത്യമായ ഒരു നിര്വചനം നല്കുക പ്രയാസമാണ്. ഒരു പദാര്ഥം 'ചൂടുള്ള'(hot)തോ, 'തണുത്ത'(cold)തോ എന്ന് സ്പര്ശമാത്രയില് അറിയാന് കഴിയും. ചൂടും (hotness), തണുപ്പും (coldness) ഇന്ദ്രിയ വിഷയകമാണെന്നു സാരം. വസ്തുവിന്റെ അവസ്ഥയെ സൂചിപ്പിക്കുന്ന 'ചൂട്', 'തണുപ്പ്' എന്നീ പദങ്ങള് കേവലം വിവരണാത്മകം മാത്രമാണ്. ഇന്ദ്രിയ പ്രത്യക്ഷമായ അറിവ് ചൂടിന്റെ അഥവാ തണുപ്പിന്റെ മാത്ര(degree)യെപ്പറ്റി സൂക്ഷ്മമായ വിവരം നല്കുന്നില്ല. ശാസ്ത്രീയമായ പഠനത്തിന് ബന്ധപ്പെട്ട വിഷയത്തെപ്പറ്റി വസ്തുനിഷ്ഠമായ ബോധം ഉണ്ടാകേണ്ടതാവശ്യമാണ്. താപനിലയെ സംബന്ധിച്ചിടത്തോളം ഇതെങ്ങനെ സാധ്യമാണെന്നു പരിശോധിക്കാം.
ഉയര്ന്ന താപനിലയിലുള്ള ഒരു വസ്തു, താണ താപനിലയി ലുള്ള ഒരു വസ്തുവുമായി സമ്പര്ക്കത്തില് വച്ചിരുന്നാല് ക്രമേണ ആദ്യത്തേതിന്റെ ചൂട് കുറയുകയും രണ്ടാമത്തേതിന്റെ ചൂട് കൂടുകയും ഒടുവില് രണ്ടും ഒരേ താപനിലയെ പ്രാപിക്കുകയും ചെയ്യുമെന്നാണ് അനുഭവം. ഈ സ്ഥിതിയില് പ്രസ്തുത വസ്തുക്കള്ക്കിടയില് താപസംതുലനം (thermal equilibrium) നിലനില്ക്കുന്നുവെന്നു പറയാം. താപസംതുലനത്തില് വര്ത്തിക്കുന്ന രണ്ടു വസ്തുക്കളുടെ താപനില തുല്യമായിരിക്കും. താപനില നിര്ണയിക്കുന്നതിന് ഉപയോഗപ്പെടുത്തുന്ന അടിസ്ഥാന തത്ത്വമിതാണ്.
താപനിലയുടെ മാപനം
Measurement of temperature
താപനിലയെ പരിമാണാത്മകമായി തിട്ടപ്പെടുത്തേണ്ടതുണ്ട്. ഇതിനായി, നിഷ്പ്രയാസം പുനരാവിഷ്കരിക്കാന് കഴിയുന്ന രണ്ട് സ്ഥിര താപനിലകള്ക്കിടയ്ക്കുള്ള ഒരു പ്രമാണ അന്തരാളം (standard intervel) തിരഞ്ഞെടുക്കുകയാണ് ആദ്യം ചെയ്യേണ്ടത്. താപത്തെ ആശ്രയിച്ചുള്ള ഏതെങ്കിലും ഗുണധര്മത്തെ (property) അടിസ്ഥാനമാക്കി ഇതിനെ സൗകര്യപൂര്വം ചെറിയ അംശങ്ങളായി ഭാഗിക്കുകയും ഓരോ അംശത്തേയും ഒരു ഡിഗ്രി (1º) ആയി സങ്കല്പിക്കുകയുമാണ് അടുത്ത പടി. താപനില അളക്കാനുപയുക്തമായ ഉപാധിയെ തെര്മോമീറ്റര് (thermometer) എന്നു പറയുന്നു.
പ്രധാനമായി അഞ്ചിനം തെര്മോമീറ്ററുകളാണ് നിലവിലുള്ളത്. ഇവ താഴെപ്പറയുന്ന താപമിതീയ ഗുണധര്മങ്ങളെ (thermometric properties) ആധാരമാക്കി നിര്മിച്ചിട്ടുള്ളവയാണ്.
1. ഒരു ദ്രാവകനാളത്തിന്റെ നീളം (L)
2. ഒരു വാതകത്തിന്റെ മര്ദം (P)
3. ഒരു വാതകത്തിന്റെ വ്യാപ്തം (V)
4. ഒരു വസ്തുവിന്റെ വൈദ്യുതരോധം (R)
5. താപ വിദ്യുത് ചാലക ബലം (ε) (thermo e.m.f)
ഈ ഗുണധര്മങ്ങളില് ഏതെങ്കിലും ഒന്നിനെ X കൊണ്ട് സൂചിപ്പിച്ചാല്, തെര്മോമീറ്ററിന്റേയും അതുമായി സംതുലനത്തില് വര്ത്തിക്കുന്ന വസ്തുക്കളുടേയും താപനില (θ), അതിന്റെ ഒരു രേഖീയ ഫലനം (linear function) ആയിരിക്കും.
θ α X
നിഷ്പ്രയാസം പുനരാവിഷ്കരിക്കാന് കഴിയുന്ന സ്ഥിരതാപ നിലകള് θ1, θ2 എന്നിവയും, അവയ്ക്കു സമാനമായ X-ന്റെ മൂല്യങ്ങള് യഥാക്രമം X1, X2 എന്നിവയും ആണെങ്കില്
θ1- θ2 എന്ന താപനിലയുടെ അന്തരാളത്തെ യഥേഷ്ടം എത്ര യെങ്കിലും ഡിഗ്രികളായി വിഭജിക്കാവുന്നതാണ്. θ1- θ2 അറിയാമെങ്കില് X,X1, X2 എന്നീ നിരീക്ഷണ ഫലങ്ങളില് നിന്ന് നിര്ദിഷ്ട താപനില θ കണ്ടുപിടിക്കാം.
താപനിലത്തോതുകള്
Scales of temperature
ഒരു വസ്തുവിന്റെ താപനില എത്രയെന്നുള്ളത് ഉപയോഗിക്കുന്ന താപനിലത്തോതിനെ ആശ്രയിച്ചിരിക്കും. ഉദാഹരണമായി അന്തരീക്ഷമര്ദത്തില് തിളയ്ക്കുന്ന വെള്ളത്തിന്റെ താപനില സെല്ഷ്യസ് തോതില് 100 ഡിഗ്രി ആണെങ്കില് ഫാരെന്ഹൈറ്റ് തോതില് അത് 212 ഡിഗ്രിയും കെല്വിന് സ്കെയിലില് ~373 ഡിഗ്രിയും ആണ്. താപനില കൃത്യമായി മാപനം ചെയ്യുന്നതിന് യോജിച്ച ഒരു താപനിലത്തോത് തിരഞ്ഞെടുക്കുകയെന്നുള്ളത് എത്രയും ദുഷ്കരമായ കാര്യമാണ്. താപനിലയുടെ അത്യധിക താഴ്ന്ന മേഖലകളില് ഉപയോഗയോഗ്യമായ ഒരു സാര്വലൌകിക താപനിലത്തോത് ഇനിയും കണ്ടുപിടിക്കേണ്ടിയിരിക്കുന്നു. വളരെ ഉയര്ന്ന താപനിലകളിലെ കഥയും വ്യത്യസ്തമല്ല. ഒരു താപനിലത്തോതിന്റെ തിരഞ്ഞെടുക്കല് ഏറെക്കുറെ സ്വേച്ഛാപര(arbitrary)മാണെന്നുവേണം പറയുവാന്. സൌകര്യാര്ഥം രേഖീയ തോതുകള് (linear scales) ആണ് സാധാരണയായി ഉപയോഗിക്കാറുള്ളത്. ഒരു രേഖീയ താപനിലത്തോത് നിര്വചിക്കുന്നതിന് ഒരു പൂജ്യനിലയും (zero point) ഒരു സ്കെയില് യൂണിറ്റും (scale unit) സ്വേച്ഛാപരമായി തിരഞ്ഞെടുക്കേണ്ടിയിരിക്കുന്നു.
സെല്ഷ്യസ് (Celsius), ഫാരെന്ഹൈറ്റ് (Fahrenheit) സ്കെയ് ല്
ആദ്യകാലത്ത് പൂജ്യനിലയും സ്കെയില് യൂണിറ്റും നിശ്ചയിക്കുന്നതിന് താഴെപ്പറയുന്ന രണ്ട് സ്ഥിരം താപനിലകള് കണക്കിലെടുത്തിരുന്നു:
i. ശുദ്ധമായ ഹിമത്തിന്റെ 'സാധാരണ ഉരുകല് നില' (normal melting point).
ii. ശുദ്ധജലത്തിന്റെ 'സാധാരണ തിളനില' (normal boiling point).
പ്രസ്തുത താപനിലകള് തമ്മിലുള്ള അന്തരം സെല്ഷ്യസ് അഥവാ സെന്റിഗ്രേഡ് താപനിലത്തോതില് 100º ആയി കണക്കാ ക്കപ്പെടുന്നു (അളവുകളും തൂക്കങ്ങളും സംബന്ധിച്ച് 1948-ല് നടന്ന 9-ാം അന്താരാഷ്ട്ര സമ്മേളനം ആണ് 'സെന്റിഗ്രേഡ്' എന്നതിനെ 'സെല്ഷ്യസ്' എന്നാക്കി മാറ്റണമെന്ന് തീരുമാനിച്ചത്). സെല്ഷ്യസ് താപനിലത്തോതില് ഹിമത്തിന്റെ ഉരുകല്നില 0ºC ആയി കണക്കാക്കുന്നു. ഇതാണ് ഈ സ്കെയിലിന്റെ പൂജ്യ നില. അതനുസരിച്ച് ജലത്തിന്റെ തിളനില 100ºC ആണ്.
ഫാരെന്ഹൈറ്റ് താപനിലത്തോതിലാകട്ടെ ഹിമത്തിന്റെ ഉരുകല്നില 32ºC എന്നും ജലത്തിന്റെ തിളനില 212ºC എന്നും ആണ് നിര്വചിച്ചിട്ടുള്ളത്. അങ്ങനെ സ്ഥിരം താപനിലകളുടെ വ്യത്യാസം സെല്ഷ്യസ് തോതില് 100ºC ആണെങ്കില് ഫാരെന്ഹൈറ്റ് തോതില് അത് 180º ആണ്. അതിനാല് സെല്ഷ്യസ് സ്കെയിലിലെ 180/100,9/5 ഒരു ഡിഗ്രി, ഫാരെന്ഹൈറ്റ് സ്കെയിലിലെ , അഥവാ ഡിഗ്രിക്ക് തുല്യമായിരിക്കും. ഒരു വസ്തുവിന്റെ താപനില സെല്ഷ്യസ്, ഫാരെന്ഹൈറ്റ് സ്കെയിലുകളില് θc,θF എന്നിങ്ങനെയാണെങ്കില്
എന്നതാണ് അവ തമ്മിലുള്ള ബന്ധം.
1954-ല് പാരിസില് കൂടിയ അളവുകളും തൂക്കങ്ങളും സംബന്ധിച്ച പത്താമത് പൊതുസമ്മേളനം താപനിലത്തോത് നിര്വചിക്കുന്നതിന് നിലവിലിരുന്ന സമ്പ്രദായം പരിഷ്കരിക്കുകയും മേലില് ഇതിനായി ഒരേ ഒരു സ്ഥിരതാപനിലയെ മാത്രം കണക്കി ലെടുത്താല് മതിയെന്ന് തീരുമാനിക്കുകയും ചെയ്തു. ഈ സ്ഥിര താപനില ജലത്തിന്റെ 'ത്രികനില'(Triple point) ആയിരിക്കണമെന്നും തീരുമാനിക്കപ്പെട്ടു. മഞ്ഞുകട്ടയും ജലവും ജലബാഷ്പവും സന്തുലിതമായി സഹവര്ത്തിക്കുന്ന അവസ്ഥയെ പ്രതിനിധാനം ചെയ്യുന്ന ത്രികബിന്ദുവിലെ താപനില 273.16 ഡിഗ്രി കെല്വിന് (273.16 K) ആയി അംഗീകരിക്കപ്പെടുകയുണ്ടായി. എന്നാല് പ്രായോഗികാവശ്യങ്ങള്ക്ക് ഹിമത്തിന്റെ ഉരുകല് നിലയും ജലത്തിന്റെ തിളനിലയും തമ്മിലുള്ള അന്തരം 100 ഡിഗ്രിയായി കണക്കാക്കുന്ന സമ്പ്രദായം തുടരുന്നതിനും വ്യവസ്ഥയുണ്ട്.
തെര്മോമീറ്ററുകള്
സെല്ഷ്യസ് സ്കെയിലില് തെര്മോമീറ്ററിന്റെ നിര്മാണത്തിന് ഒരു വാതകത്തിന്റേയൊ ദ്രാവകത്തിന്റേയൊ മര്ദത്തിനോ വ്യാപ്തത്തിനോ താപനിലയുടെ വ്യത്യാസം മൂലമുണ്ടാകുന്ന വിചരണം ഉപയോഗപ്പെടുത്താവുന്നതാണ്. താപമിതീയ ഗുണധര്മ (Thermometric property)മായി മര്ദമാണ് തിരഞ്ഞെടുക്കുന്നതെങ്കില് പൂജ്യനില P0, 0ºC -ലെ മര്ദം ആയിരിക്കും. സ്കെയില് യൂണിറ്റിനെ താഴെ കാണുംപ്രകാരം നിര്വചിക്കാം.
ഇവിടെ P100 എന്നത് 100ºC-ലെ മര്ദത്തെ സൂചിപ്പിക്കുന്നു. ഇതില്നിന്നും മര്ദം P ആയിരിക്കുമ്പോഴത്തെ താപനില
എന്നു കിട്ടുന്നു.
നേരെ മറിച്ച്, മര്ദം സ്ഥിരമായിരിക്കെ, വ്യാപ്തത്തിനുണ്ടാകുന്ന വിചരണത്തെ അടിസ്ഥാനമാക്കിയാണ് തെര്മോമീറ്ററിന്റെ നിര്മാണമെങ്കില് (v), (vi)എന്നിവയുടെ സ്ഥാനത്ത് താഴെക്കൊടുത്തിരിക്കുന്ന സമീകരണങ്ങളാണ് ഉപയോഗിക്കേണ്ടത്.
സമീകരണം (viii) മെര്ക്കുറിയോ ആല്ക്കഹോളോ ഉള്ക്കൊള്ളുന്ന ദ്രാവക തെര്മോമീറ്ററിനും ഹൈഡ്രജനോ ഹീലിയമോ ഉള്ക്കൊള്ളുന്ന വാതക തെര്മോമീറ്ററിനും ബാധകമാണ്. ലബോറട്ടറിയില് സാധാരണയായി ഉപയോഗിക്കുന്ന മെര്ക്കുറി തെര്മോമീറ്ററുകളിലും മനുഷ്യശരീരത്തിന്റെ താപനില അളക്കാനുപയോഗിക്കുന്ന ക്ലിനിക്കല് തെര്മോമീറ്ററുകളിലും താപനിലയ്ക്കനുസരിച്ച് ദ്രാവകനാളത്തിന്റെ നീളത്തിനുണ്ടാകുന്ന വിചരണമാണ് അളക്കുന്നത്. അതിനാല് (viii)ല് V, V0,V100 എന്നിവയുടെ സ്ഥാനത്ത് യഥാക്രമം L, L0,L100 ഇവ ചേര്ക്കണം.
വൈദ്യുതരോധത്തിന്റെ വിചരണത്തെ അടിസ്ഥാനമാക്കി നിര്മിക്കുന്ന തെര്മോമീറ്ററുകള്ക്കു ബാധകമായ സമീകരണം ഇതാണ്.
ഇവിടെ R0,R100,R എന്നിവ ഒരു പ്ലാറ്റിനം കമ്പിയുടെ 0ºC, 100ºC,θ(വസ്തുവിന്റെ താപനില) എന്നീ താപനിലകളിലെ വൈദ്യുതരോധമാണ്.
താപനിലയുടെ സംഖ്യാത്മക മൂല്യം (numerical value) തെര്മോമീറ്റര് നിര്മാണത്തിനുപയോഗിക്കുന്ന പദാര്ഥത്തേയും നിര്മാണത്തിനാധാരമായ താപമിതീയ ഗുണധര്മത്തേയും ആശ്രയിച്ച് അല്പമായി വ്യത്യാസപ്പെട്ടു കാണാറുണ്ട്. മറ്റു തെര്മോമീറ്ററുകളെ അപേക്ഷിച്ച് വാതക തെര്മോമീറ്ററുകളില് ഈ ന്യൂനത നിസ്സാരമായതിനാല് തെര്മോമീറ്റര് നിര്മാണത്തിനുള്ള പ്രമാണവസ്തുവായി വാതകത്തെയാണ് തിരഞ്ഞെടുത്തിട്ടുള്ളത്.
ആദര്ശ വാതക താപനിലത്തോത്
Ideal Gas scale of temperature
വ്യാപ്തം താപമിതീയ ഗുണധര്മമായിട്ടുള്ള ഒരു വാതക തെര്മോമീറ്ററിലെ വാതകത്തിന്റെ മര്ദം സ്ഥിരമായിരിക്കും. ഈ സ്ഥിരമര്ദത്തിന്റെ മൂല്യം സ്വേച്ഛാപരമായി നിജപ്പെടുത്താവുന്നതാണ്. എന്നാല്, രണ്ട് വ്യത്യസ്ത മര്ദങ്ങളില് പ്രവര്ത്തിക്കുന്ന രണ്ട് സ്ഥിരമര്ദ വാതക തെര്മോമീറ്ററുകള് (constant pressure gas thermometers) ഒരേ വസ്തുവിന്റെ താപനില അല്പമാത്രമെങ്കിലും വ്യത്യസ്തമായിട്ടായിരിക്കും കാണിക്കുക. പക്ഷേ, മര്ദം പൂജ്യമായിരുന്നാല് താപനില ഒരു സീമാന്തമൂല്യം (limiting value) പ്രാപിക്കുമെന്ന് കണ്ടിട്ടുണ്ട്. അതായത്
θo-ന്റെ മൂല്യം വാതകത്തിന്റെ സ്വഭാവത്തെ ആശ്രയിച്ചു വ്യത്യാസപ്പെടുന്നതല്ലെന്നു സാരം. ഈ തത്ത്വത്തെ ആസ്പദമാക്കി നിര്വചിക്കപ്പെട്ടിട്ടുള്ളതാണ് ആദര്ശവാതക താപനിലത്തോത്. സമീകരണങ്ങള് (vii),(viii) എന്നിവ ഉപയോഗിച്ച് ഒരു സെല്ഷ്യസ് ആദര്ശവാതക താപനിലത്തോത് നിര്വചിക്കാം:
കേവല താപനിലത്തോത്
Absolute scale of temperature
വാതകത്തിന്റെ സ്വാഭാവത്തെ ആശ്രയിക്കാത്ത ഒരു കേവല താപനിലത്തോത് ആവിഷ്കരിക്കുന്നതിന് സെല്ഷ്യസ് ആദര്ശ വാതക താപനിലത്തോത് ഉപയോഗപ്പെടുത്താവുന്നതാണ്. കേവല താപനിലത്തോതിനടിസ്ഥാനമാക്കാവുന്ന ഒരു താപമാപീയ ഗുണധര്മം ബോയ് ല് നിയമ(Boyle's Law)ത്തിന്റെ സഹായത്തോടെ താഴെ കാണുംപ്രകാരം നിര്വചിക്കാം.
ഇവിടെ ത വാതകത്തിന്റെ മര്ദത്തെയോ വ്യാപ്തത്തെയോ ആശ്രയിക്കുന്നില്ല, മറിച്ച് താപനിലയെ മാത്രമേ ആശ്രയിക്കുന്നുള്ളൂ. സമീകരണം (xii) താഴെ കാണുംപ്രകാരം പരിഷ്കരിച്ചെഴുതാം:
ആദര്ശ വാതക സെല്ഷ്യസ് താപനിലത്തോതില് ഹിമനില (ice point) 0º ആണ്. കേവല താപനിലത്തോതില് ഇതിനെ T0 എന്നു സൂചിപ്പിക്കാം. രണ്ട് സമ്പ്രദായങ്ങളിലും 'ഡിഗ്രി'യുടെ മാത്ര (magnitude)തുല്യമായിട്ടെടുത്തിരിക്കുന്നതിനാല് അവ കാണിക്കുന്ന താപനിലകള് തമ്മിലുള്ള ബന്ധം ഇപ്രകാരം നിര്വചിക്കാം:
T = T0 + θo
എന്നതിനു പകരം എന്നെഴുതിയാല്
T = T0 + t
T,T0 എന്നീ താപനിലകള്ക്കു സമാനമായ X-ന്റെ മൂല്യം യഥാക്രമം X, X എന്നിവയാണെങ്കില്
[[Image:
(xvi), (xvii) സമീകരണങ്ങളില് നിന്നും
ഠ = ഠ0 + ഠ0 ?0 എന്നു കിട്ടുന്നു. (ഃ്ശശശ)
അതുകൊണ്ട്, ഠ0 = ? (ഃശഃ)
നിരവധി പരീക്ഷണങ്ങളിലൂടെ ലഭിച്ചിട്ടുള്ള ?0-യുടെ മൂല്യവും 0.0036608 ആണ്. ഇതില്നിന്ന് കേവല താപനിലത്തോതിലെ ഹിമനില
(ഃഃ)
എന്നു ലഭിക്കുന്നു. പല ഘട്ടങ്ങളില് വിവിധ ലാബോറട്ടറികളില് നടത്തിയിട്ടുള്ള പരീക്ഷണങ്ങള് അല്പം വ്യത്യസ്തമായ ഫലങ്ങളാണ് നല്കിയിട്ടുള്ളത്. ഇതെല്ലാം കണക്കിലെടുത്തു കൊണ്ടാണ് അളവുകളും തൂക്കങ്ങളും സംബന്ധിച്ച പത്താമതു പൊതുസമ്മേളനം (1954) ഈ വിഷയത്തില് ഒരവസാനതീര്പ്പ് കല്പിച്ചത്. അതനുസരിച്ച് മുകളില് പറഞ്ഞതുപോലെ ജലത്തിന്റെ 'ത്രികനില' (ൃശുഹല ുീശി) 273.16 ഡിഗ്രിയായും ജലത്തിന്റെ ഹിമനില ഇതില്നിന്ന് 0.01 ഡിഗ്രി താഴെയായും നിജപ്പെടുത്തിയിരിക്കുന്നു. അങ്ങനെ ഠ, ഇവ തമ്മിലുള്ള ബന്ധം താഴെ കാണും പ്രകാരം എഴുതാം.
T = 273.15 + t
ഇതില് t = -273.15 എന്നെടുത്താല് T = 0 എന്നു കിട്ടുന്നു. ഈ താപനിലയെ (-273.15ºC) താപനിലയുടെ കേവലപൂജ്യം(absolute zero) എന്നു വിളിക്കുന്നു.
കെല്വിന് താപനിലത്തോത്
താപഗതിക തത്ത്വങ്ങളെ അടിസ്ഥാനമാക്കി പിന്നീട് കെല്വിന് ആവിഷ്കരിച്ച താപനിലത്തോത്, ഇവിടെ വിവരിച്ച കേവല താപനിലത്തോതുമായി പൂര്ണമായും യോജിക്കുന്ന ഒന്നാണ്. താപനിലയെ സൂചിപ്പിക്കുന്നതിന് 'കെല്വിന്' (K) എന്ന യൂണിറ്റാണ് ഇപ്പോള് ശാസ്ത്രലോകം അംഗീകരിച്ചിട്ടുള്ളത്.
ഇതനുസരിച്ച്
273.15ºC = 0K
0ºC = 273.15K
tºC = (273.15 +t )K
താപധാരിതയും വിശിഷ്ട താപവും
ഒരു വസ്തുവിന്റെ താപനില 1ºC ഉയര്ത്തുന്നതിന് ആവശ്യമായ താപം ആ വസ്തുവിന്റെ താപധാരിത (heat capacity) എന്നറിയപ്പെടുന്നു.
ഒരു വസ്തുവിന്റെ താപനില T1-ല് നിന്ന് T2-ലേക്ക് ഉയര്ത്തുന്നതിന് ആവശ്യമായ താപത്തിന്റെ അളവ് ΛQ ആണെങ്കില്, ![]()
T1-ല് തുടങ്ങി T2 വരെയുള്ള ശരാശരി താപനിലയിലെ താപധാരിതയാണ് മുകളില് നിര്വചിച്ചത്. ഒരു പ്രത്യേക താപനിലയിലെ താപധാരിത നിര്വചിക്കുന്നുതിന് താപനിലയുടെ അന്തരാളത്തെ ആകാവുന്നത്ര ചെറുതാക്കുകയാണു വേണ്ടത്. എന്നിട്ട് ΔQ/ΔTയുടെ സീമാന്തമൂല്യം കാണണം:
കലോറിയുടെ നിര്വചനത്തില് നിന്ന് 1 ഗ്രാം ജലത്തിന്റെ താപധാരിത 1 കലോറിയാണെന്നു മനസ്സിലാക്കാവുന്നതാണ്; അതുപോലെ 1 കി.ഗ്രാം ജലത്തിന്റെ താപധാരിത 1 കിലോ കലോറിയെന്നും. എന്നാല് താപധാരിതയുടെ ഏകകം (unit) ആയി ഇപ്പോള് കലോറിയും കിലോ കലോറിയും ഉപയോഗിക്കാറില്ല; പകരം യാന്ത്രികോര്ജത്തിന്റെ ഏകകമായ ജൂള് (Joule) ആണ് സര്വസാധാരണയായി ഉപയോഗിക്കുന്നത്. ഈ ഏകകങ്ങള് തമ്മിലുള്ള ബന്ധം നിരവധി പരീക്ഷണങ്ങളിലൂടെ ജയിംസ് ജൂള് സ്ഥാപിക്കുകയുണ്ടായി. താപം യാന്ത്രികോര്ജത്തിന് തുല്യാങ്കം (equivalent) ആണെന്നു സ്ഥാപിച്ചതോടെ രണ്ടിനും ഒരേ യൂണിറ്റ് ഉപയോഗിച്ചാല് മതിയെന്നു വന്നു. SI മാത്രാ പദ്ധതിയില് 'ജൂള്' ആണ് യാന്ത്രിക ഊര്ജത്തിന്റേയും താപത്തിന്റേയും മൌലികമായ യൂണിറ്റ്. കലോറിയും ജൂളും തമ്മിലുള്ള ബന്ധം താഴെ കൊടുക്കുന്നു.
1 കലോറി = 4.2 ജൂള് (J)
1 കിലോകലോറി = 4200 J
അങ്ങനെ 1 കി.ഗ്രാം ജലത്തിന്റെ താപധാരിത 4200 J/K ആണ്.
താപധാരിത വസ്തുവിന്റെ ദ്രവ്യമാനത്തിന് ആനുപാതികമായതിനാല് ദ്രവ്യമാനവുമായി ബന്ധപ്പെടുത്തി താപധാരിത നിര്വചിക്കുക സാധാരണമാണ്. ദ്രവ്യമാനം ഒരു കിലോഗ്രാം എന്നെടുക്കുകയാണ് സര്വസാധാരണമായ രീതി. ഇങ്ങനെ നിര്വചിക്കപ്പെടുന്ന താപധാരിതയെ 'വിശിഷ്ട താപധാരിത' (Specific heat capacity) അഥവാ 'വിശിഷ്ട താപം' (specific heat) എന്നു പറയുന്നു. വിശിഷ്ട താപത്തെ ഇപ്രകാരം നിര്വചിക്കാം:
1 കി.ഗ്രാം പദാര്ഥത്തിന്റെ താപനില 1º ഉയര്ത്തുന്നതിനാവ ശ്യമായ താപം ആ പദാര്ഥത്തിന്റെ വിശിഷ്ടതാപം എന്നറിയപ്പെ ടുന്നു.
താപധാരിതയെ ദ്രവ്യമാനം കൊണ്ട് ഹരിച്ചാല് വിശിഷ്ടതാപം ലഭിക്കുന്നു.
വിശിഷ്ട താപം (C) =
ഇതിന്റെ യൂണിറ്റ് : ജൂള്/കി.ഗ്രാം K (J/ kgK)
അഥവാ, കലോറി/കി.ഗ്രാം K (Cal/kgK)
1 കലോറി/കി.ഗ്രാം K = 4200 ജൂള്/കി.ഗ്രാം K
താപധാരിതയെ ഗ്രാം തന്മാത്ര(gram molecule)യുമായി ബന്ധപ്പെടുത്തി നിര്വചിക്കപ്പെട്ടിട്ടുള്ളതാണ് 'മോളാര് താപധാരിത' (molar heat capacity).ഒരു ഗ്രാം തന്മാത്ര അളവ് വസ്തുവിന്റെ താപനില 1ºC വര്ധിപ്പിക്കുന്നതിനുവേണ്ട താപമാണ് 'മോളാര് താപധാരിത' അഥവാ 'ഗ്രാം തന്മാത്രാ താപധാരിത'. വിശിഷ്ടതാപത്തെ തന്മാത്രാ ഭാരം (molecular weight)കൊണ്ട് ഗുണിച്ചാല് വസ്തുവിന്റെ മോളാര് താപധാരിത ലഭിക്കുന്നതാണ്.
അതിനാല്, വിശ്ഷ്ടതാപം =
വിശിഷ്ടതാപത്തെ അണുഭാരം (atomic weight) കൊണ്ടുഗുണിച്ചു കിട്ടുന്ന രാശിയെ ബന്ധപ്പെട്ട വസ്തുവിന്റെ അണു താപധാരിത(atomatic heat capacity) അഥവാ അണു താപം(atomaic heat) എന്നു പറയുന്നു.
മോളാര് താപധാരിതയുടെ യൂണിറ്റ്: ജൂള്/മോള്. K (J/mol.K.)
അഥവാ, കലോറി/മോള് K (cal/mol.K.)
ഒരു വ്യൂഹ(systtem)ത്തിന്റെ താപധാരിത ഒന്നുകില് പരീക്ഷണം വഴി നിര്ണയിക്കാം; അല്ലെങ്കില് ദ്രവ്യത്തിന്റെ തന്മാത്രാ സിദ്ധാന്തം ഉപയോഗിച്ചു കണ്ടുപിടിക്കാം. ഇതിനുള്ള പരീക്ഷണങ്ങള് ഏറിയ കൂറും വ്യൂഹം ഒരു സ്ഥിര മര്ദത്തിനു വിധേയമായി വര്ത്തിക്കുന്ന സാഹചര്യങ്ങളിലായിരിക്കും നടത്തപ്പെടുന്നത്. സാധാരണ ലബോറട്ടറി പരീക്ഷണങ്ങളില് ഇത് അന്തരീക്ഷമര്ദം തന്നെ ആയിരിക്കും. സ്ഥിരമര്ദത്തിന്റെ പശ്ചാത്തലത്തില് നിര്ണയിക്കപ്പെടുന്ന താപധാരിതയെ 'സ്ഥിരമര്ദ താപധാരിത'(heat capacity at constant pressure) എന്നു പറയുന്നു.
എന്നാല് വ്യാപ്തം സ്ഥിരമായിരിക്കുകയും താപനിലയ്ക്കൊപ്പം മര്ദം വിചരണപ്പെടുകയും ചെയ്യുന്നുവെന്നിരിക്കട്ടെ. ഈ സാഹചര്യത്തില് നിര്ണയിക്കപ്പെടുന്ന താപധാരിതയെ 'സ്ഥിരവ്യാപ്ത താപധാരിത' (heat capacity at constant volume) എന്നാണു പറയുന്നത്.
സ്ഥിരമര്ദ താപധാരിതയെ Cp എന്നും, സ്ഥിരവ്യാപ്ത താപ ധാരിതയെ Cv എന്നും ആണ് സൂചിപ്പിക്കുന്നത്.
വാതകങ്ങളുടെ താപധാരിത
ഒരു ആദര്ശ വാതകത്തിന്റെ താപധാരിത അതിന്റെ താപനം സ്ഥിരമര്ദ സാഹചര്യത്തിലോ സ്ഥിരവ്യാപ്ത സാഹചര്യത്തിലോ സംഭവിക്കുന്നത് എന്നതിനെ ആശ്രയിച്ചിരിക്കുന്നു. അങ്ങനെ, അതിന് Cp , Cv എന്ന് രണ്ട് താപധാരിതകള് നിര്വചിക്കപ്പെട്ടിരിക്കുന്നു. ഇവയില് Cp എല്ലാ വാതകങ്ങള്ക്കും Cv -യേക്കാള് കൂടുതലാണ്.
Cp - Cv = R
എന്നതാണ് ഇവ തമ്മിലുള്ള ബന്ധം. ഇതിനെ 'മേയര് സംബന്ധം' (Meyer's relation) എന്നു പറയുന്നു. ഇവിടെ Cp യും Cp മോളാര് താപധാരിതകളായിരുന്നാല് R എന്നത് സാര്വലൗകിക (universal) വാതക സ്ഥിരാങ്കമായിരിക്കും (universal gas constant). R = 8.31 J/mol.K
ലീനതാപം
Latent heat
പദാര്ഥങ്ങള് ചൂടാക്കിയാല് അവയുടെ താപനില ഉയരുമെന്നതിനു പുറമേ, അവയ്ക്ക് അവസ്ഥാന്തരം (phase change) സംഭവിക്കാനും സാധ്യതയുണ്ട്. ഖരാവസ്ഥയില് നിന്നു ദ്രവാവസ്ഥയിലേക്കും ദ്രവാവസ്ഥയില് നിന്നു വാതകാവസ്ഥയിലേക്കും മാറ്റം സംഭവിക്കാം. അതുപോലെ തന്നെ തണുപ്പിച്ചാല് വിപരീതദിശയിലും മാറ്റങ്ങളുണ്ടാകാം. അതായത് വാതകാവസ്ഥയില് നിന്ന് ദ്രവാവസ്ഥയിലേക്കും, ദ്രവാവസ്ഥയില് നിന്ന് ഖരാവസ്ഥയിലേക്കും മാറ്റം ഉണ്ടാകാം.
ഖരവസ്തു ഉരുകി ദ്രവമാകുന്നത് ഒരു നിശ്ചിത സ്ഥിര താപ നിലയിലാണ്. ഈ താപനിലയെ അതിന്റെ 'ഉരുകല് നില' (melting point) എന്നു പറയുന്നു. ഉരുകല് നില മര്ദത്തിനനുസരിച്ച് അല്പം വ്യത്യാസപ്പെടാറുണ്ട്. സാധാരണ അന്തരീക്ഷമര്ദത്തില് മഞ്ഞുകട്ടയുടെ ഉരുകല്നില 0º, അഥവാ ~ 273 k ആണ്. വെള്ളം ഘനീഭവിച്ച് മഞ്ഞുകട്ട ആകുന്നതും ഇതേ താപനിലയിലാണ്. മര്ദം കൂട്ടിയാല് ഹിമത്തിന്റെ ഉരുകല്നില കുറയും.
ദ്രാവകം വാതകാവസ്ഥയിലേക്കു രൂപാന്തരപ്പെടുന്നതും ഒരു സ്ഥിരതാപനിലയിലാണ്. ഇതിനെ 'തിളനില'(boiling point) എന്നു പറയുന്നു. വാതകം ഘനീഭവിച്ച് ദ്രവാവസ്ഥയെ പ്രാപിക്കുന്നതും ഇതേ താപനിലയില്ത്തന്നെ. മര്ദം കൂടുകയോ കുറയുകയോ ചെയ്യുന്നതിനനുസരിച്ച് തിളനില വ്യത്യാസപ്പെടാറുണ്ട്. സാധാരണ അന്തരീക്ഷമര്ദത്തില് ജലത്തിന്റെ തിളനില 100º</sub>, അഥവാ ~373 K ആണ്. മര്ദം കൂട്ടിയാല് തിളനില കൂടുകയും മര്ദം കുറച്ചാല് ഇത് കുറയുകയും ചെയ്യുന്നു. ഇക്കാരണത്താല് പ്രഷര്കുക്കറില് ജലത്തിന്റെ തിളനില 100ºC-ല് കൂടുതലായിരിക്കും. ഒപ്പം ഇന്ധനത്തിന്റെ ദക്ഷത(efficiency)യും കൂടുന്നു. ഉയര്ന്ന പര്വത പ്രദേശങ്ങളില് അന്തരീക്ഷമര്ദം കുറവായതിനാല് 80<su>º-ലോ, അതിലും വളരെ താഴ്ന്ന താപനിലയിലോ വെള്ളം തിളയ്ക്കാറുണ്ട്. ഇന്ധനത്തിന്റെ ദക്ഷത ഇവിടങ്ങളില് കുറവായിരിക്കും.
അവസ്ഥാന്തരം സംഭവിക്കുന്നതിന് ഉരുകല് നിലയോ തിളനിലയോ എത്തിക്കഴിഞ്ഞാല് ദ്രവ്യമാനത്തിന് ആനുപാതികമായി ഒരു നിശ്ചിത അളവ് താപം പ്രദാനം ചെയ്യേണ്ടതുണ്ട്. ഇതിനെ ലീനതാപം (Latent heat) എന്നു പറയുന്നു. ഒരു കിലോഗ്രാമിനു വേണ്ട ലീനതാപം 'വിശിഷ്ട ലീനതാപം' (specific latent heat) എന്നറിയപ്പെടുന്നു. m കിലോഗ്രാമിനാവശ്യമായ ലീനതാപം
Q = mL .
ഹിമത്തിന്റെ ഉരുകല് ലീനതാപം അഥവാ ജലത്തിന്റെ സംഘനന ലീനതാപം=3.36 x 105 J/kg (80 cal/g) ആണ്. ഒരു കിലോഗ്രാം മഞ്ഞുകട്ട 0ºC താപനിലയില് ഉരുകി അതേ താപനിലയില് ജലമാകുന്നതിന് 3.36 X 105 J താപം ആവശ്യമാണ്. അതുപോലെതന്നെ ഒരു കിലോഗ്രാം ജലം 0ºC-ല് ഉറഞ്ഞു മഞ്ഞുകട്ടയാകാന് അതില് നിന്നും 3.36 X 105 J താപം നീക്കം ചെയ്യേണ്ടതുണ്ട്.
100º</sub>C ല് 1 കി.ഗ്രാം ജലം ആവിയായി മാറാന് വേണ്ട ലീനതാപം 2.26 X 106J/Kg (540 cal/g) ആണ്. അതായത്, 100ºC-ല് തിളയ്ക്കുന്ന ഒരു കിലോഗ്രാം ജലത്തിന് അതേ താപനിലയില് ആവി ആയി മാറാന് 2.26 X 106 J താപം ആവശ്യമാണ്. മറിച്ച് 100º-ലുള്ള ഒരു കി.ഗ്രാം നീരാവി ഘനീഭവിച്ച് അതേ താപനിലയില് ജലമായി മാറാന് അതില്നിന്നും 2.26 X 106J താപം പുറന്തള്ളേണ്ടതുണ്ട്.
അവസ്ഥാന്തരം സംഭവിച്ചുകൊണ്ടിരിക്കുന്ന സമയമത്രയും താപനില സ്ഥിരമായി നില്ക്കുമെന്ന കാര്യം ശ്രദ്ധേയമാണ്.
വികസനീയത
Expansive
ഒരു വസ്തുവിനെ ചൂടാക്കിയാല് അതു വികസിക്കുന്നു. വസ്തുവിന്റെ സ്വഭാവമനുസരിച്ചാണ് വികാസത്തിന്റെ അളവ്. ലോഹങ്ങള്ക്ക് മറ്റു ഖരവസ്തുക്കളേക്കാള് കൂടുതല് വികാസം സംഭവിക്കുന്നു. ഖര, ദ്രവ പദാര്ഥങ്ങളെ അപേക്ഷിച്ച് വാതകങ്ങളുടെ വികാസം വളരെ അധികമാണ്.
ഒരു നേര്ത്ത ദണ്ഡിനെ സംബന്ധിച്ചാണെങ്കില് താപനം കൊണ്ട് അതിന്റെ നീളത്തിനാണ് കാര്യമായ വര്ധനവുണ്ടാകുന്നത്. വണ്ണത്തില് വലിയ മാറ്റം ഉണ്ടാകുന്നില്ല. ഇതിനെ രേഖീയ വികാസം (linear expansion) എന്നു പറയാം. ദ്രാവകങ്ങള്ക്കും വാതകങ്ങള്ക്കും വ്യാപ്തവികാസം മാത്രമേ കണക്കിലെടുക്കേണ്ടതുള്ളൂ.
1 മീ. നീളമുള്ള ദണ്ഡിന്റെ താപനില 1 ഡിഗ്രി വര്ധിപ്പിച്ചാല് അതിന്റെ നീളത്തിനുണ്ടാകുന്ന വര്ധനവിനെ രേഖീയ വികസ നാങ്കം അഥവാ രേഖീയ വികസനീയത (linear expansivity) എന്നു പറയുന്നു. L നീളവും,α രേഖീയ വികസനീയതയുമുള്ള ഒരു ദണ്ഡിന്റെ താപനിലയില് Δθവര്ധനവുണ്ടായാല്, അതിന്റെ നീളത്തിനുണ്ടാകുന്ന വര്ധനവ് ΔL = α.L.Δθ
അതുപോലെതന്നെ, V വ്യാപ്തവും β വ്യാപ്ത വികസനീയത (volume expansivity)യുമുള്ള ഒരു വസ്തുവിന്റെ താപനില Δθ വര്ധിച്ചാല് അതിന്റെ വ്യാപ്തത്തില് ΔV =.V. Δθവര്ധനവുണ്ടാകും.
വാതകങ്ങളുടെ ഗതികസിദ്ധാന്തം
Kinetic theory of gases
എല്ലാ പദാര്ഥങ്ങളും തന്മാത്രകളാല് നിര്മിതമാണ്. താപമാകട്ടെ തന്മാത്രകളുടെ ചലനത്തില് നിന്നാണുദ്ഭവിക്കുന്നത്. ഈ സങ്കല്പത്തെ അടിസ്ഥാനമാക്കി ആവിഷ്കരിക്കപ്പെട്ടിട്ടുള്ള സിദ്ധാന്തമാണ് വാതകങ്ങളുടെ ഗതികസിദ്ധാന്തം. വാതകങ്ങളില് തന്മാത്രകള് അവ്യവസ്ഥിതമായ രീതിയില് ദിശാബോധമില്ലാതെ നിരന്തരം ചലനഗതിയിലാണ്. ഈ ചലനഗതി നേരിട്ട് നിരീക്ഷിക്കാവുന്നതാണ്.
ബ്രോമിന് ഉള്ക്കൊള്ളുന്ന പാത്രത്തിനു മുകളില് കാര്ബണ് ഡൈഓക്സൈഡ് നിറച്ച പാത്രം കമഴ്ത്തിപ്പിടിച്ചാല് കാര്ബണ് ഡൈഓക്സൈഡ് തന്മാത്രകള് ബ്രോമിനിലേക്കു കടന്ന് അതില് വ്യാപിക്കുന്നതു കാണാന് കഴിയും. വെള്ളത്തില് പൊങ്ങിക്കിടക്കുന്ന പൂമ്പൊടികള് യാതൊരു ക്രമവുമില്ലാതെ നിരന്തരം ചലിക്കുന്നതായി കാണാം. ചെറിയ കൊളോയ്ഡിയ പദാര്ഥങ്ങള് ഒരു ദ്രാവകത്തില് കലര്ത്തി ശക്തിയേറിയ മൈക്രോസ്കോപ്പിലൂടെ നോക്കിയാലും ഇതേ ചലനം നിരീക്ഷിക്കാനാകും. ഇപ്രകാരമുള്ള ക്രമരഹിത ചലനത്തിന് ബ്രൌണിയന് ചലനം എന്നു പറയുന്നു. ചെറിയ കണങ്ങളില് ദ്രാവകതന്മാത്രകള് വന്നിടിക്കുന്നതുമൂലം ഉണ്ടാകുന്ന അസന്തുലിത ബലമാണ് ഇത്തരം ചലനത്തിനു കാരണമെന്ന് ഈ നിരീക്ഷണങ്ങള് സമര്ഥിക്കുന്നു.
വാതകങ്ങളുടെ മര്ദം, താപനില, അവസ്ഥാന്തരണം, വാതക നിയമങ്ങള് തുടങ്ങിയവയ്ക്കെല്ലാം തൃപ്തികരമായ വിശദീകരണം നല്കാന് ഗതികസിദ്ധാന്തം പര്യാപ്തമാണ്. ഊര്ജത്തിന്റെ സമവിഭജനതത്ത്വം (principle of equipartition of energy), അതിനെ അടിസ്ഥാനമാക്കി വാതകങ്ങളുടെ വിശിഷ്ട താപം കണക്കാക്കുന്നതിനുള്ള സൂത്രവാക്യങ്ങള് എന്നിവയും ഗതികസിദ്ധാന്തത്തില് നിന്നു ലഭ്യമാക്കാം.
താപചാലകത
Thermal conductivity
ഒരു ദണ്ഡിന്റെ ഒരറ്റം ചൂടാക്കിയാല് താപം ക്രമേണ മറ്റേ അറ്റത്തേക്കു വ്യാപിക്കും. അതിനാല് ആ അറ്റത്തിന്റെ താപനില ഉയരുന്നതാണ്. എത്രമാത്രം എന്നും എത്രവേഗത്തില് എന്നും ഉള്ളത് പദാര്ഥത്തിന്റെ താപചാലകസ്വഭാവത്തേയും ദണ്ഡിന്റെ നീളം, കനം എന്നീ പ്രത്യേകതകളേയും താപനത്തേയും ആശ്രയിച്ചിരിക്കും. ചൂടാക്കുന്ന അറ്റത്തിന്റെ താപനില ഉയരുന്നതനുസരിച്ച് മറ്റേ അറ്റത്തിന്റെ താപനിലയും ആദ്യമൊക്കെ ഉയരുമെങ്കിലും ഒടുവില് ഒരു താപസന്തുലനം നിലവില് വരും. പിന്നീട് ദണ്ഡിലെ നിശ്ചിത അകലത്തിലുള്ള രണ്ടു ബിന്ദുക്കളിലെ താപനില സ്ഥിരമായി നിലനില്ക്കും. ആ സ്ഥിതിയില് താപനില കൂടിയ ബിന്ദുവില് നിന്ന് കുറഞ്ഞ ബിന്ദുവിലേക്ക് പ്രവഹിക്കുന്ന താപോര്ജത്തിന്റെ അളവ് ബിന്ദുക്കള് തമ്മിലുള്ള താപനിലാവ്യത്യാസത്തിനും ദണ്ഡിന്റെ മുറിപാട് വിസ്തീര്ണ(cross sectional area)ത്തിനും സമയത്തിനും ആനുപാതികവും, ബിന്ദുക്കള് തമ്മിലുള്ള അകലത്തിന് വിപരീതാനുപാതികവും ആയിരിക്കും.
ഇവിടെ K എന്ന സ്ഥിരരാശി പദാര്ഥത്തിന്റെ താപചാലകത എന്നറിയപ്പെടുന്നു.
പൊതുവേ നല്ല വൈദ്യുതചാലകങ്ങള് നല്ല താപചാലകങ്ങ ളുമായിരിക്കും. ലോഹങ്ങളെല്ലാംതന്നെ ഉയര്ന്ന താപചാലകത യുള്ളവയാണ്. റബ്ബര്, ഗ്ളാസ്, തടി തുടങ്ങിയവ കുറഞ്ഞ താപചാലകതയുള്ള പദാര്ഥങ്ങളാണ്.
താപവികിരണം
എല്ലാ വസ്തുക്കളും താപ വികിരണങ്ങളുടെ സ്രോതസ്സാണ്. വസ്തുവിന്റെ താപനില ഉയരുമ്പോഴും വികിരണോര്ജത്തിന്റെ ഉത്സര്ജനനിരക്കും ഉയരുന്നു. താപവികിരണം വിദ്യുത്കാന്തിക (electromagnetic) വികിരണമാണ്. ഇലക്ട്രോമാഗ്നറ്റിക് സ്പെക്ട്രത്തില് ഇന്ഫ്രാറെഡ് മേഖലയില് വരുന്ന വികിരണങ്ങളാണ് താപവികിരണങ്ങള്. ഇവ ദൃശ്യപ്രകാശത്തേക്കാള് തരംഗദൈര്ഘ്യം കൂടിയവയാണ്. ഒരു പ്രതലത്തില് പതിക്കുന്ന താപവികിരണങ്ങള് പ്രതിഫലനത്തിനും അവശോഷണത്തിനും വിധേയമാണ്. നല്ല മിനുസവും തിളക്കവുമുള്ള പ്രതലത്തിന് വര്ധിച്ച പ്രതിഫലനശേഷിയും ഇരുണ്ട പരുക്കന് പ്രതലത്തിന് വര്ധിച്ച അവശോഷണശേഷിയും സ്വായത്തമാണ്.
സ്വപ്രതലത്തില് പതിക്കുന്ന എല്ലാ വികിരണങ്ങളേയും അവ ശോഷണം ചെയ്യാന് കഴിവുള്ള വസ്തുവിനെ 'കൃഷ്ണിക' (Black body) എന്നു പറയുന്നു. അത്തരമൊരു വസ്തുവിനെ ചൂടാക്കിയാല് താപനിലയ്ക്കനുസരിച്ച് വിവിധ തരംഗദൈര്ഘ്യമുള്ള എല്ലാവിധ വികിരണങ്ങളേയും പുറപ്പെടുവിക്കാന് അതിനു കഴിയും. സാമാന്യമായിപ്പറഞ്ഞാല് നല്ല അവശോഷണശേഷിയുള്ള വസ്തു നല്ല ഉത്സര്ജനശേഷിയുള്ളതും ആയിരിക്കും.
(ഡോ. എം.എന്. ശ്രീധരന് നായര്, സ.പ.)