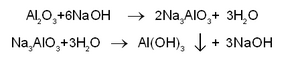This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
അലുമിനിയം
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
ഉള്ളടക്കം |
അലുമിനിയം
Aluminium
ഒരു ലോഹമൂലകം; സിംബല് അഹ; അണുസംഖ്യ 13; അ.ഭാ. 26.98. ഭൂവല്ക്കത്തിന്റെ 7 ശതമാനത്തോളം വരുന്ന ഈ ലോഹം സമൃദ്ധിയില് ഇരുമ്പിന്റെ ഇരട്ടിയുണ്ടെന്നു കണക്കാക്കപ്പെട്ടിരിക്കുന്നു.
പ്രധാന അയിരുകള്
സിലിക്കേറ്റ്, ഓക്സൈഡ്, ഫ്ളൂറൈഡ് എന്നീ യൗഗികങ്ങളായിട്ടാണ് അലുമിനിയം പ്രകൃതിയില് കണ്ടുവരുന്നത്. ഫെല്സ്പാര് (പൊട്ടാസിയം അലുമിനിയം സിലിക്കേറ്റ്), അഭ്രം (മൈക്ക), കളിമണ്ണ് (ക്ലേ), സ്ലേറ്റ് എന്നിവ പ്രസ്തുത ലോഹത്തിന്റെ സിലിക്കേറ്റ് അയിരുകളാണ്. പ്രധാന ഓക്സൈഡ് അയിരുകളില് ബോക്സൈറ്റ് (ഹൈഡ്രേറ്റഡ് അലുമിനിയം ഓക്സൈഡ്), കൊറണ്ടം എന്നിവ ഉള്പ്പെടുന്നു. സോഡിയം ഫ്ളൂറൈഡും അലുമിനിയം ഫ്ളൂറൈഡും ചേര്ന്നുണ്ടാകുന്ന ക്രയൊലൈറ്റ് ആണ് മുഖ്യമായ ഫ്ളൂറൈഡ് അയിര്.
ചരിത്രം
അലുമിനിയം എന്ന വാക്കിന്റെ വ്യുത്പത്തി 'ആലം' എന്നര്ഥമുള്ള അലുമെന് (alumen) എന്ന ലത്തീന് പദത്തില്നിന്നാണ്. ചുണ്ണാമ്പില്നിന്നും വ്യത്യസ്തമായ ഒരു ഓക്സൈഡ് ആണ് അലുമിന എന്ന് 1754-ല് മാര്ഗ്രാഫ് അഭിപ്രായപ്പെട്ടു. 1807-ല് സര് ഹംഫ്രി ഡേവി അലുമിനയില്നിന്ന് അതിലടങ്ങിയിട്ടുള്ള ലോഹം വേര്തിരിച്ചെടുക്കുവാന് ശ്രമിക്കയുണ്ടായി. 1825-ല് ഹാന്സ് ക്രിസ്ത്യന് ഒയര്സ്റ്റെഡ് ആദ്യമായി അലുമിനിയം വേര്തിരിച്ചെടുത്തു. ഇദ്ദേഹം അലുമിനിയം ക്ലോറൈഡ് എന്ന പദാര്ഥത്തെ പൊട്ടാസിയം അമാല്ഗം ചേര്ത്തു ചൂടാക്കിയശേഷം മെര്ക്കുറിയെ പൂര്ണമായും ബാഷ്പീകരിച്ചു മാറ്റി. അവശേഷിച്ച തിളക്കമുള്ള വസ്തു അലുമിനിയം ചൂര്ണമാണെന്നു മനസ്സിലാക്കി. 1845-ല് ഫ്രെഡറിക് വോളര് (Wohler) പൊട്ടാസിയം ഉപയോഗിച്ചു മേല് വിവരിച്ച പരീക്ഷണം ആവര്ത്തിച്ചു. തത്ഫലമായി മുന് പറഞ്ഞപോലുള്ള അലുമിനിയം ചൂര്ണം ഇദ്ദേഹത്തിനും ലഭിക്കുകയുണ്ടായി. പൊട്ടാസിയത്തിനു പകരം താരതമ്യേന വില കുറഞ്ഞ സോഡിയം ഉപയോഗിച്ചാലും അലുമിനിയം ലഭിക്കുമെന്ന് 1854-ല് എച്ച്. സെന്റ് ക്ലെയര്, ഡി. വൈല് എന്നീ ശാസ്ത്രജ്ഞന്മാര് തെളിയിച്ചു. 1886-ല് ചാള്സ് മാര്ട്ടിന് ഹാള് (Charles Martin Hall) ഉരുകിയ ക്രയൊലൈറ്റില് അലുമിന (അലുമിനിയം ഓക്സൈഡ്) ലയിപ്പിച്ച് അതിലൂടെ വൈദ്യുതി കടത്തിവിട്ട് അലുമിനിയം ഉത്പാദിപ്പിക്കാമെന്നു കണ്ടുപിടിച്ചു. ഏതാണ്ട് ഇതേ അവസരത്തില് യൂറോപ്പില് പോള് എല്.റ്റി. ഹെറോള്ട് (Paul.L.T.Heroult) എന്ന ശാസ്ത്രജ്ഞനും മേല് പ്രസ്താവിച്ച രീതിയില് അലുമിനിയം ഉത്പാദിപ്പിക്കുവാനുള്ള വിധി സ്വതന്ത്രമായി കണ്ടുപിടിക്കുകയുണ്ടായി.
ലോഹനിഷ്കര്ഷണം (Extraction)
അലുമിനിയത്തിന്റെ അയിരുകളില് ഏറ്റവും പ്രധാനം ബോക്സൈറ്റ് (bauxite) ആണ്. ബോക്സൈറ്റ് എന്നത് ജലയോജിത (hydrated) അലുമിനിയം ഓക്സൈഡ് ആണ്. സാധാരണയായി അത് അലുമിനിയം ഓക്സൈഡിന്റെ ട്രൈ ഹൈഡ്രേറ്റോ (ഉദാ. ജിപ്സൈറ്റ്, Al2O3.3H2O), മോണോ ഹൈഡ്രേറ്റോ (ഉദാ. ബോമൈറ്റ്-bohmite-Al2O3.H2O) ഇവ രണ്ടും ചേര്ന്നുള്ള മിശ്രിതമോ ആയിരിക്കും. ഇവയില് ഇരുമ്പ്, സിലിക്കണ്, ടൈറ്റാനിയം എന്നീ മൂലകങ്ങളുടെ ഓക്സൈഡുകള് മാലിന്യങ്ങളായി ഉണ്ടായിരിക്കും.ബോക്സൈറ്റിന്റെ (ട്രൈ ഹൈഡ്രേറ്റ്) ഏകദേശരാസസംയോഗം ഇങ്ങനെയാണ്; ജലം 30 ശ.മാ., അലുമിന 58 ശ.മാ., ഫെറിക് ഓക്സൈഡ് 5 ശ.മാ., സിലിക്ക 5 ശ.മാ., ടൈറ്റാനിയം ഓക്സൈഡ് 2 ശ.മാ.
ഫ്രാന്സ്, അയര്ലന്ഡ്, യു.എസ്., ഹംഗറി, യുഗോസ്ലാവിയ, ഇറ്റലി, ഗ്രീസ് തുടങ്ങിയ രാജ്യങ്ങളില് ബോക്സൈറ്റ് നിക്ഷേപങ്ങള് സുലഭമാണ്. ഇന്ത്യയില് മഹാരാഷ്ട്ര, തമിഴ്നാട്, മധ്യപ്രദേശ്, ജമ്മു കാശ്മീര്, ഒറീസാ, കര്ണാടക മുതലായ സംസ്ഥാനങ്ങളില് ബോക്സൈറ്റ് നിക്ഷേപങ്ങളുണ്ട്. അലുമിനിയം വന്തോതില് ഉത്പാദിപ്പിക്കുന്നതിനുള്ള ആധുനികരീതി ആവിഷ്കരിച്ചത് മുന്പറഞ്ഞ ഹെറോള്ട്, ഹാള് എന്നീ ശാസ്ത്രജ്ഞന്മാരാണ്. ബോക്സൈറ്റിന്റെ വിദ്യുത്പഘടനം വഴിയാണ് അലുമിനിയം ലോഹം ഉത്പാദിപ്പിക്കുന്നത്. ഇപ്രകാരം ലോഹം ഉണ്ടാക്കുന്നതിനു താരതമ്യേന കുറഞ്ഞ ചെലവില് വൈദ്യുതി ലഭിക്കണം; അയിരും സുലഭമായിരിക്കണം. ക്രയോലൈറ്റ്, ഇലക്ട്രോഡുകള് ഉണ്ടാക്കുന്നതിനുള്ള കാര്ബണ്, കാസ്റ്റിക് സോഡ, ചുണ്ണാമ്പ്, സോഡിയം കാര്ബണേറ്റ് എന്നിവയും ആവശ്യമാണ്. അലുമിനിയം ഉത്പാദനത്തിന്റെ അളവ് മേല്പറഞ്ഞവയുടെ ലഭ്യതയെ ആശ്രയിച്ചിരിക്കും. ലോഹനിര്മാണപ്രക്രിയയില് ആദ്യത്തെ ഘട്ടം ബോക്സൈറ്റിന്റെ ശുദ്ധീകരണമാണ്; അതിന് അനേകം രീതികള് ഉണ്ട്.
ബോക്സൈറ്റിന്റെ ശുദ്ധീകരണരീതികള്
(i) ഹാള്. ബോക്സൈറ്റ് പൊടിയും സോഡിയം കാര്ബണേറ്റും ചേര്ത്തുണ്ടാക്കിയ മിശ്രിതം ശക്തിയായി ചൂടാക്കി ഉരുക്കുന്നു. അപ്പോള് ഉഭയധര്മി ആയ അലുമിനിയം ഓക്സൈഡ് മാത്രം സോഡിയം കാര്ബണേറ്റുമായി യോജിച്ച് സോഡിയം അലുമിനേറ്റ് ഉണ്ടാകുന്നു. ഇരുമ്പ്, സിലിക്കണ് മുതലായവയുടെ ഓക്സൈഡുകള് അതേപടി അവശേഷിക്കുന്നു.
Al2O3+3Na2CO3→ 2Na 3AlO3 +3CO2
അങ്ങനെ ഉരുക്കിക്കിട്ടിയ ദ്രാവകം ജലത്തില് ചേര്ത്തിളക്കുന്നു; സോഡിയം അലുമിനേറ്റ് മാത്രം ലയിക്കുന്നു. അലേയ മാലിന്യങ്ങളെ അരിച്ചു നീക്കം ചെയ്തശേഷം ലായനി 50-60°C വരെ ചൂടാക്കി അതിലൂടെ കാര്ബണ് ഡൈഓക്സൈഡ് വാതകം കടത്തിവിടുമ്പോള് സോഡിയം അലുമിനേറ്റിന് ജലീയവിശ്ലേഷണം സംഭവിച്ച് അലുമിനിയം ഹൈഡ്രോക്സൈഡ്-അവക്ഷിപ്തം ലഭിക്കുന്നു. അത് അരിച്ചെടുത്ത് ഉണക്കുന്നു.
2Na3AlO3+3H2O+3CO2→ 2Al(OH)3↓+3Na2CO3
(ii) ബെയര് രീതി (Baeyer's method). നന്നായി പൊടിച്ച ബോക്സൈറ്റ്, വെള്ളം ഉപയോഗിച്ചു നല്ലവണ്ണം കഴുകി അതിലെ കളിമണ്ണിന്റെ അംശം പരമാവധി നീക്കം ചെയ്തെടുത്ത് കാസ്റ്റിക് സോഡാ ലായനിയില് ചേര്ത്ത് ഒരു ആട്ടോക്ലേവില് (autoclave) വച്ച് 150°C-ല് ഏതാനും മണിക്കൂര് ചൂടാക്കുമ്പോള് അലുമിനിയം ഓക്സൈഡ് ലയിച്ച് സോഡിയം അലുമിനേറ്റ് ലായനി ലഭ്യമാകുന്നു. മാലിന്യങ്ങള് അതേപടി അവശേഷിക്കുകയും ചെയ്യുന്നു. അനന്തരം ലായനി വേര്തിരിച്ചെടുത്ത് വലിയ അവക്ഷേപണടാങ്കുകളിലാക്കി അല്പം അലുമിനിയം ഹൈഡ്രോക്സൈഡ് ചേര്ത്ത് നന്നായിളക്കുന്നു. അപ്പോള് സോഡിയം അലുമിനേറ്റ് ജലീയവിശ്ളേഷണവിധേയമായി അലുമിനിയം ഹൈഡ്രോക്സൈഡ്-അവക്ഷിപ്തം തരുന്നു.
അവക്ഷിപ്തം അരിച്ചെടുത്തു നന്നായിക്കഴുകി ഉണക്കുന്നു. ലായനി സാന്ദ്രീകരിച്ചെടുത്താല് കാസ്റ്റിക് സോഡ വീണ്ടും ഉപയോഗിക്കത്തക്കവിധം കിട്ടുന്നതാണ്. അയിരില്നിന്നു കളിമണ്ണ് നിശ്ശേഷം കളയേണ്ടത് ഈ രീതിയില് വരാനിടയുള്ള പാഴ്ച്ചെലവുകള് പരിഹരിക്കാന് അത്യാവശ്യമാണ്. കളിമണ്ണിലെ സിലിക്ക, അലുമിനിയം ഓക്സൈഡുമായി യോജിച്ച് അലുമിനിയം സിലിക്കേറ്റ് ഉണ്ടായി അലേയമായ മാലിന്യങ്ങളുടെ കൂട്ടത്തില് കിടക്കും.
(iii) സെര്പക് രീതി. സിലിക്ക അധികമുള്ള ബോക്സൈറ്റ് ശുദ്ധീകരിക്കാന് അനുയോജ്യമായ രീതിയാണ് ഇത്. അയിരിന്റെ പൊടി കാര്ബണുമായി കലര്ത്തി ചൂടാക്കുന്നു, ചൂടാക്കിക്കൊണ്ടിരിക്കുന്ന ഈ മിശ്രിതത്തിനു മീതെ കൂടി നൈട്രജന് വാതകം കടത്തിവിടുന്നു. തന്മൂലമുണ്ടാകുന്ന അലുമിനിയം നൈട്രൈഡ് ജലവിശ്ലേഷണത്തിനു വിധേയമാക്കിയാല് അലുമിനിയം ഹൈഡ്രോക്സൈഡ് ലഭിക്കും.
ആദ്യത്തെ രണ്ടു രീതിയില് എന്നതുപോലെ അലുമിനിയം ഹൈഡ്രോക്സൈഡ് അരിച്ചെടുത്ത് ഉണക്കുന്നു.
അലുമിനിയം ഹൈഡ്രോക്സൈഡിന്റെ നിസ്താപനം (calcination)
അരിച്ചെടുത്തുണക്കിക്കിട്ടിയ അലുമിനിയം ഹൈഡ്രോക്സൈഡ് ഒരു തിരിയുന്ന ചൂളയില് (rotary furnace) വച്ച് 1500°C-ല് തപിപ്പിക്കുന്നു. അതിന്റെ ഫലമായി അലുമിനിയം ഹൈഡ്രോക്സൈഡില്നിന്ന് അലുമിനിയം ഓക്സൈഡ് ലഭിക്കുന്നു. ഇതു ശുദ്ധമായ നിര്ജല-അലുമിന ആണ്. 2Al(OH)3→Al2 O3+3H2O
നിര്ജല-അലുമിനയുടെ വിദ്യുദപഘടനം
ശുദ്ധമായ അലുമിന വൈദ്യുതവാഹിയല്ലാത്തതിനാല് അലുമിനയെ ഉരുക്കിയ ക്രയോലൈറ്റില് ലയിപ്പിച്ചാണ് വിദ്യുദപഘടനനിരോക്സീകരണം നടത്തുന്നത്. ഇതിനുപയോഗിക്കുന്ന ചൂള ദീര്ഘചതുരാകൃതിയും ഉരുക്കുപ്ലേറ്റുനിര്മിതവും ആണ്. ചൂളയുടെ വലുപ്പം ഉപയോഗിക്കുന്ന കറണ്ടിനെ ആശ്രയിച്ചിരിക്കും. സെല്ലിന്റെ ഉള്ഭാഗം ഉച്ചതാപസഹ-ഇഷ്ടികകള്കൊണ്ടു പൊതിഞ്ഞിട്ടുണ്ട്. അതിനു മീതെ ഒരടി കനത്തില് കരികൊണ്ടുള്ള ഒരു ആവരണമുണ്ട്. വൈദ്യുതി സെല്ലിലേക്ക് ആവഹിപ്പിക്കുവാനായി കാര്ബണ് ആവരണത്തിന്റെ അടിഭാഗത്തുകൂടി ഉരുക്കുദണ്ഡുകള് ഉറപ്പിച്ചുനിര്ത്തിയിരിക്കുന്നു. സെല്ലിനകത്തുള്ള കാര്ബണ് ആവരണമാണ് കാഥോഡ് ആയി പ്രവര്ത്തിക്കുന്നത് (ചിത്രം നോക്കുക).
സെല്ലിനുള്ളില് ഉറപ്പിച്ചു നിര്ത്തിയിട്ടുള്ള കാര്ബണ് ദണ്ഡുക ളുടെ നിരയാണ് ആനോഡ്. ഈ ദണ്ഡുകള് സമചതുരാകൃതിയോ ദീര്ഘചതുരാകൃതിയോ ആയിരിക്കും. ആവശ്യാനുസരണം ഉയര്ത്താനും താഴ്ത്താനും സാധിക്കത്തക്കവണ്ണം ഒരു പ്രത്യേകരീതിയിലാണ് ആനോഡ് ദണ്ഡുകള് സെല്ലില് ഘടിപ്പിച്ചിട്ടുള്ളത്. ഈ ദണ്ഡുകള് കോക്ക്, പിച്ച്, ടാര് എന്നിവ ചേര്ത്തു പ്രത്യേക രീതിയില് തയ്യാറാക്കുന്നവയുമാണ്.
ഉരുക്കിയ ക്രയോലൈറ്റില് ലയിപ്പിച്ച അലുമിനയാണ് ഇലക്ട്രോലൈറ്റ്. വൈദ്യുതി കടത്തിവിടുമ്പോള് പ്രവര്ത്തിച്ചു നഷ്ടപ്പെട്ടുപോകുന്ന ക്രയോലൈറ്റിനു പകരമായി ഇടയ്ക്കിടെ ക്രയോലൈറ്റ് പൌഡര് ചൂളയിലിട്ടുകൊണ്ടിരിക്കണം. താപനില 950-1000°C-നുള്ളില് സ്ഥിരമാക്കി ക്രമപ്പെടുത്തിവയ്ക്കുന്നു. വൈദ്യുതിപ്രവര്ത്തനം മൂലം അലുമിനിയം ഓക്സൈഡിന് നിരോക്സീകരണം സംഭവിച്ച് അലുമിനിയവും ഓക്സിജനും ലഭിക്കുന്നു. ഓക്സിജന് ആനോഡിലെത്തി കാര്ബണുമായി പ്രവര്ത്തിച്ച് കാര്ബണ് മോണോക്സൈഡ്, കാര്ബണ് ഡൈഓക്സൈഡ് എന്നീ രൂപത്തില് ബഹിര്ഗമിക്കുന്നു. അതോടൊപ്പം ക്രയോലൈറ്റിനെക്കാള് ഘനത്വം കൂടിയ അലുമിനിയം ദ്രവരൂപത്തില് സെല്ലിന്റെ അടിഭാഗത്ത് കാഥോഡില് നിക്ഷേപിക്കപ്പെടുന്നു. ആനോഡായി വര്ത്തിക്കുന്ന കാര്ബണ് ദണ്ഡുകള് ഓക്സിജനുമായി പ്രവര്ത്തിച്ച് തേഞ്ഞുപോകുന്നതിനാല് യഥാകാലം പുതിയ കാര്ബണ് ദണ്ഡുകള് ഉപയോഗിക്കേണ്ടിവരും. ഒരു കി.ഗ്രാം അലുമിനിയം ഉണ്ടാകുമ്പോള് 2/3 കി.ഗ്രാം കാര്ബണ് നഷ്ടപ്പെടുന്നു എന്നാണ് കണക്ക്. സെല്ലിന്റെ അടിഭാഗത്ത് നിക്ഷേപിക്കപ്പെടുന്ന ദ്രവരൂപത്തിലുള്ള അലുമിനിയം പ്രത്യേക ടാപ്പു വഴി വെളിയിലേക്കെടുക്കാം. ഇങ്ങനെ ലഭിക്കുന്ന ലോഹം ഏതാണ്ട് 99.8 ശ.മാ. വരെ ശുദ്ധമായിരിക്കും. വിദ്യുദപഘടനം കൊണ്ടു ശുദ്ധീകരിച്ച് 99.99 ശ.മാ. ശുദ്ധമായ അലുമിനിയം ലഭ്യമാക്കാം. 1924-ല് ഹൂപ്സ് എന്ന ശാസ്ത്രജ്ഞന് ആവിഷ്കരിച്ച രീതിയാണ് അതിന് ഉപയോഗിക്കാറുള്ളത്.
താപവൈദ്യുതനിരോക്സീകരണം (Thermo electrolytic reduction)
ചെമ്പ്, നാകം, ഇരുമ്പ് തുടങ്ങിയ ലോഹങ്ങള് തയ്യാറാക്കുന്നതുപോലെ, അലുമിനിയം ഓക്സൈഡിനെ കാര്ബണ് ഉപയോഗിച്ചു നിരോക്സീകരിച്ച് അലുമിനിയം ലോഹമുത്പാദിപ്പിക്കുവാന് ചില പ്രായോഗികവൈഷമ്യങ്ങളുണ്ട്. നിരോക്സീകരണം സാധിക്കണമെങ്കില് താപനില കുറഞ്ഞത് 1800ബ്ബഇ എങ്കിലും ആവശ്യമാണ്. ഈ ഊഷ്മാവും അലുമിനിയത്തിന്റെ തിളനിലയും തമ്മില് വലിയ അന്തരമില്ലാത്തതിനാല് ഈ പരിതഃസ്ഥിതിയില് ലോഹത്തിന്റെ ബാഷ്പമര്ദം വളരെ കൂടുതലായിരിക്കും. കരിയുടെ ഓക്സീകരണം മൂലമുണ്ടാകുന്ന വാതകങ്ങളുടെ വ്യാപ്തവും വളരെ ബൃഹത്തായിരിക്കും. ഇതിന്റെയെല്ലാം ഫലമായി അലുമിനിയം വേര്തിരിച്ചെടുക്കാന് സാധ്യമല്ലാതാകുന്നു. ചെമ്പ്, ഇരുമ്പ്, സിലിക്കണ് മുതലായ മൂലകങ്ങള് ദ്രവരൂപത്തിലാക്കി അതില് പ്രസ്തുത അലുമിനിയം അവശോഷിപ്പിച്ച് എടുക്കാനേ സാധ്യമാകൂ. അലുമിനിയത്തിന്റെ കൂട്ടുലോഹങ്ങള് വേണമെങ്കില് അങ്ങനെ നിര്മിക്കാം.
ഗുണധര്മങ്ങള്
ഭൗതികം
നീലകലര്ന്ന വെള്ളനിറമുള്ളതും തിളക്കമുള്ളതുമായ ഒരു ലോഹമാണ് അലുമിനിയം. എന്നാല് ശുദ്ധമായ അലുമിനിയത്തിന്റേത് വെള്ളിയുടെ നിറമാണ്. വായുവില് തുറന്നിരുന്നാല് നിറം മങ്ങുന്നതായിരിക്കും. അലുമിനിയം ഓക്സൈഡിന്റെ ഒരു ആവരണം ഉണ്ടാകുന്നതുകൊണ്ടാണത്. കനംകുറഞ്ഞ ഈ ലോഹത്തെ അടിച്ചുപരത്തി ലോലമായ തകിടുകള് ഉണ്ടാക്കാം. ഇത് താപവാഹകവും വൈദ്യുതിവാഹകവുമാണ്. അലുമിനിയം അണുവിന്റെ ഇലക്ട്രോണ് വിന്യാസം 2, 8, 3 ആയതിനാല് അതിന്റെ സംയോജകത 3 ആണ്. ദ്ര. അ. 660.2°C. തിളനില 2450°C. റേഡിയോ ഐസോടോപ്പുകള് ഉണ്ട്.
രാസികം
ഈര്പ്പരഹിതമായ വായുവുമായി അലുമിനിയം പ്രതിപ്രവര്ത്തിക്കുകയില്ല. എന്നാല് ഈര്പ്പമുള്ള വായുവിന്റെ സാന്നിധ്യത്തില് ഈ ലോഹത്തിനുമേല് അതിന്റെ ഓക്സൈഡിന്റെ (അലുമിനിയം ഓക്സൈഡ്) ലോലമായ ഒരു ആവരണം ഉണ്ടാകുന്നു. ഈ ആവരണത്തിന് ഒരിഞ്ചിന്റെ പത്തു ലക്ഷത്തില് ഒരംശം മാത്രമേ കട്ടിയുള്ളുവെങ്കിലും അതു തീര്ത്തും അപ്രവേശ്യവും സംരക്ഷകവുമാണ്. ചൂടാക്കുമ്പോള് ഈ ആവരണത്തിന് കനം വര്ധിക്കും. അലുമിനിയം ഉരുക്കുമ്പോള് ഈ ഓക്സൈഡ് ആവരണം ദ്രവരൂപത്തിലുള്ള ലോഹത്തിന്റെ മീതെ സ്ഥിതിചെയ്യുകയും ലോഹത്തിനു വീണ്ടും ഓക്സീകരണം സംഭവിക്കാതെ സംരക്ഷിക്കുകയും ചെയ്യുന്നു. അലുമിനിയം ജ്വലിച്ചു നഷ്ടപ്പെടാതിരിക്കാന് അങ്ങനെ അതു സഹായകമായിത്തീരുന്നു.
അലുമിനിയം ഓക്സിജനില് കത്തിക്കുമ്പോള് ശോഭയുള്ള നാളത്തോടുകൂടി ജ്വലിച്ച് അലുമിനിയം ഓക്സൈഡ് ഉണ്ടാകുന്നു. താപം മോചിക്കപ്പെടും.
അലുമിനിയവും ഓക്സിജനുമായുള്ള ഈ അഭിക്രിയ താപമോചക (exothermic) മാണ്. ഇതില് അടങ്ങിയ തത്ത്വമുപയോഗപ്പെടുത്തിയാണ് ക്രോമിയം, മാങ്ഗനീസ്, അയണ് തുടങ്ങിയ ചില ലോഹങ്ങളുടെ ഓക്സൈഡുകളെ അലുമിനൊ-തെര്മൈറ്റ് പ്രോസസ്സി(Alumino Thermite Process)ലൂടെ നിരോക്സീകരിക്കുന്നത്. അലുമിനിയം പൗഡര് ഒരു പ്രത്യേകാനുപാതത്തില് വായുവുമായി ചേരുമ്പോള് സ്ഫോടകക്ഷമമായ ഒരു മിശ്രിതമുണ്ടാകും.
അലുമിനിയവും ജലവുമായുള്ള അഭിക്രിയ പ്രധാനപ്പെട്ട ഒന്നാണ്. ഇവിടെയും മേല് പ്രസ്താവിച്ച രീതിയിലുള്ള ഓക്സൈഡ്-ആവരണം ഉണ്ടാകുന്നതുകൊണ്ട് പ്രവര്ത്തനം ഇടയ്ക്കു നിന്നു പോകാനിടയുണ്ട്. അലുമിനിയം തിളയ്ക്കുന്ന ജലത്തെ വിഘടിപ്പിക്കുന്നു. അലുമിനിയം-അമാല്ഗം ജലവുമായി പ്രവര്ത്തിക്കുമ്പോള് ലോഹത്തിന്റെ ഹൈഡ്രോക്സൈഡും ഹൈഡ്രജനും ലഭ്യമാകുന്നതാണ്. സാധാരണ താപനിലയില്തന്നെ ഈ വിഘടനപ്രക്രിയ നടക്കുന്നതുകൊണ്ട് അലുമിനിയം-അമാല്ഗം ഒരു നിരോക്സീകാരിയാണ്.
അലുമിനിയത്തിന് അമ്ലങ്ങളുമായുള്ള പ്രവര്ത്തനത്തില് വൈവിധ്യമുണ്ട്. എന്നാല് സാന്ദ്രഹൈഡ്രൊക്ലോറിക് അമ്ലവുമായി വളരെ വേഗം പ്രവര്ത്തിക്കും. നേര്ത്ത അമ്ളവുമായുള്ള പ്രവര്ത്തനം മന്ദമാണ്. താപനം പ്രവര്ത്തനവേഗം വര്ധിപ്പിക്കും.
നേര്പ്പിച്ച സള്ഫ്യൂറിക് അമ്ലത്തില് അലുമിനിയം പ്രവര്ത്തിക്കുമ്പോള് ഹൈഡ്രജനും ചൂടുള്ള സാന്ദ്ര സള്ഫ്യൂറിക് അമ്ലത്തില് പ്രവര്ത്തിക്കുമ്പോള് സള്ഫര് ഡൈഓക്സൈഡും ലഭിക്കുന്നു. ശീതസാന്ദ്ര സള്ഫ്യൂറിക് അമ്ലത്തില് അലുമിനിയത്തിനു പ്രവര്ത്തനമില്ല.
സാന്ദ്ര നൈട്രിക് അമ്ലം അലുമിനിയവുമായി പ്രവര്ത്തിക്കുകയില്ല. ഈ അമ്ലം ഓക്സീകാരകമായതുകൊണ്ട് ലോഹത്തിന് മീതെ ഓക്സൈഡ് ആവരണം ഉണ്ടാവുകയും അത് ഒരു സംരക്ഷകകവചമായി പ്രവര്ത്തിക്കുകയും ചെയ്യുന്നു. എന്നാല് ഈ ആവരണം ഉണ്ടാകാത്ത രീതിയില് പരിതഃസ്ഥിതികള് ക്രമീകരിച്ചാല് രാസപ്രവര്ത്തനം നടക്കും. ഉദാഹരണമായി അലുമിനിയം-അമാല്ഗം നൈട്രിക് അമ്ലവുമായി പ്രതിപ്രവര്ത്തിച്ച് അലുമിനിയം നൈട്രേറ്റ് ലഭ്യമാക്കുന്നു.
കാസ്റ്റിക് സോഡ, കാസ്റ്റിക് പൊട്ടാഷ് എന്നിവയുടെ ലായനികളില് അലുമിനിയം വിലയിക്കുന്നു. ഹൈഡ്രജനും അലുമിനേറ്റുകളുമാണ് ഉത്പന്നങ്ങള്.
2Al+2H2O+2Na OH →2NaAlO+3H2
Na AlO2 എന്നത് സോഡിയം മെറ്റാ അലുമിനേറ്റ് ആണ്.
തപിപ്പിച്ച അലുമിനിയം പൗഡറിനുമീതെ ക്ലോറിന്, ബ്രോമിന് ബാഷ്പം എന്നിവ കടത്തിവിട്ടാല് അവ ലോഹവുമായി സംയോജിച്ച് അതാതു ഹാലൈഡുകള് ഉണ്ടാക്കുന്നു.
ഉയര്ന്ന ഊഷ്മാവില് ഓക്സിജന്റെ അസാന്നിധ്യത്തില് അലുമിനിയം മറ്റു പല മൂലകങ്ങളും യൌഗികങ്ങളുമായി രാസപ്രവര്ത്തനത്തിലേര്പ്പെടുന്നുണ്ട്. നൈട്രജനുമായി ചേരുമ്പോള് നൈട്രൈഡും സള്ഫറുമായി പ്രവര്ത്തിക്കുമ്പോള് സള്ഫൈഡും ഫോസ്ഫറസുമായി ഫോസ്ഫൈഡും ഉണ്ടാകുന്നു. അലുമിനിയവും ഫെറസ് സള്ഫൈഡും തമ്മില് പ്രവര്ത്തിക്കുമ്പോള് അലുമിനിയം സള്ഫൈഡ്, അയണ് എന്നിവ ലഭിക്കുന്നു. ഉയര്ന്ന ഊഷ്മാവില് കാര്ബണുമായി പ്രവര്ത്തിച്ച് അലുമിനിയം കാര്ബൈഡ് ഉണ്ടാകുന്നു:
അലുമിനിയംപൗഡറും ഫെറിക് ഓക്സൈഡും ചേര്ത്തുണ്ടാക്കിയ മിശ്രിതം ജ്വലിപ്പിച്ചാല് അതിതീവ്രമായ രാസപ്രവര്ത്തനം നടക്കും. തത്ഫലമായി ധാരാളം താപം മോചിക്കപ്പെടും.
ഉപയോഗങ്ങള്
ഭാരക്കുറവ്, സങ്കരാവസ്ഥയിലുള്ള ഉറപ്പ്, ക്ഷാരണപ്രതിരോധം, വൈദ്യുതചാലകത, താപചാലകത, പ്രകാശപ്രതിഫലനീയത എന്നീ സവിശേഷഗുണങ്ങളുള്ള അലുമിനിയം പ്രായോഗികജീവിതത്തില് പലവിധത്തിലും പ്രയോജനപ്പെടുന്നുണ്ട്. രാസവ്യവസായങ്ങളിലും ഭക്ഷ്യപദാര്ഥങ്ങള് തയ്യാറാക്കുന്ന വ്യവസായങ്ങളിലും ഈ ലോഹം ഉപയോഗപ്പെടുത്തിവരുന്നു. (നോ: അലുമിനിയം വ്യവസായം). ഈ ലോഹം, ശക്തിയുള്ള ഒരു നിരോക്സീകാരിയാകയാല്, ദ്രവരൂപത്തിലുള്ള ഉരുക്കില്നിന്നും യൌഗികാവസ്ഥയില് ബന്ധപ്പെട്ടുകിടക്കുന്ന ഓക്സിജനെ നിര്മാര്ജനം ചെയ്യാന് ഉപയോഗിക്കുന്നു. ഇരുമ്പ്, ക്രോമിയം, മാങ്ഗനീസ് എന്നീ ലോഹങ്ങളുടെ നിഷ്കര്ഷണത്തിനും ഈ ലോഹം പ്രയോജനപ്പെടുത്താം. തെര്മൈറ്റ് വിധിപ്രകാരം ലോഹങ്ങളുടെ വെല്ഡനത്തിനും അലുമിനിയം പ്രയോജനപ്പെടുന്നു.
വിമാനങ്ങള്, ട്രക്കുകള്, മോട്ടോര്വാഹനങ്ങള്, കപ്പലുകള് മുതലായവയുടെ നിര്മാണത്തിന് അലുമിനിയം ആവശ്യമാണ്. ഈ ലോഹത്തെ അതിലോലമായ തകിടുകളായി അടിച്ചുപരത്തുവാന് സാധിക്കും. ഇത്തരം തകിടുകള് ചോക്കലേറ്റ്, സിഗരറ്റ് മുതലായവ പൊതിയാന് ഉപയോഗിക്കാറുണ്ട്. ഇന്ഡക്ഷന് (induction) മോട്ടോറുകളില് വാര്പ്പ്-അലുമിനിയംകൊണ്ടുള്ള വൈന്ഡിങ്ങുകളാണ് (winding) ഉപയോഗിക്കുന്നത്. വൈദ്യുതകമ്പികളുടെ നിര്മാണത്തില് പ്രസ്തുത ലോഹത്തിന്റെ പ്രയോജനം വ്യാപകമായിത്തീര്ന്നിട്ടുണ്ട്. അലുമിനിയംചൂര്ണം ഉപയോഗിച്ചു പെയിന്റുകള് ഉണ്ടാക്കാം. ഈര്പ്പത്തിന്റെ ആക്രമണം തടയുവാന് ഈ പെയിന്റുകള് സഹായിക്കും. കരിമരുന്നുപ്രയോഗങ്ങളില് അലുമിനിയംചൂര്ണം സാധാരണമായി ഉപയോഗിച്ചുവരുന്നു. നൈട്രേറ്റുകള്, ക്ലോറേറ്റുകള് തുടങ്ങിയ ഓക്സീകാരകവസ്തുക്കളുമായി പ്രസ്തുത ലോഹം പ്രവര്ത്തിക്കുമ്പോള് ശോഭയുള്ള ധവളപ്രകാശം ഉണ്ടാകുന്നതാണ്. സ്ഫോടകവസ്തുക്കള്, അലുമിനിയം ക്ലോറൈഡ്, അലുമിനിയം സള്ഫേറ്റ് മുതലായ യൗഗികങ്ങള് എന്നിവയുടെ നിര്മാണത്തിനും ഈ ലോഹം ആവശ്യമാണ്. കൂട്ടുലോഹനിര്മാണത്തില് അലുമിനിയത്തിന്റെ പങ്ക് അത്യന്തം പ്രാധാന്യം വഹിക്കുന്നു. മഗ്നേലിയം, അലുമിനിയം ബ്രോണ്സ്, ഡൂറാലുമിന് മുതലായവ അലുമിനിയത്തിന്റെ ചില പ്രധാന കൂട്ടുലോഹങ്ങളാണ്. ക്ലോറൊമൈസറ്റിന്, സ്ട്രെപ്റ്റൊമൈസിന് തുടങ്ങിയ ആന്റിബയോട്ടിക്കുകളുടെ നിര്മാണത്തില് അധിശോഷകങ്ങളായും അലുമിനിയം ഉപയുക്തമാകുന്നുണ്ട്.
തെര്മൈറ്റ് വെല്ഡനം
മൂന്നു ഭാഗം ഫെറിക് ഓക്സൈഡും ഒരു ഭാഗം അലുമിനിയം ചൂര്ണവും ചേര്ന്ന മിശ്രിതമാണ് തെര്മൈറ്റ്. ഈ മിശ്രിതത്തിന്റെ ജ്വലനം മൂലം ലോഹങ്ങളുടെ വെല്ഡനം സാധിക്കാമെന്ന് 1905-ല് ഗോള്ഡ്ഷ്മിഡ്ത് (Goldschmidt) എന്ന ശാസ്ത്രജ്ഞന് കണ്ടുപിടിച്ചു. ഇദ്ദേഹം സംവിധാനം ചെയ്ത പ്രസ്തുത പ്രക്രിയയെയാണ് അലുമിനൊ-തെര്മൈറ്റ് വിധി എന്നു പറയുന്നത്. അകവശത്തു മഗ്നീഷ്യം ഓക്സൈഡിന്റെ ഒരു ആവരണമുള്ളതും അടിയില് താത്കാലികമായി അടച്ചിട്ടുള്ള ഒരു ദ്വാരമുള്ളതുമായ ഒരു ക്രൂസിബിള് (crucible) ആണ് ഈ വിധി സാധിപ്പിക്കുവാന് ഉപയോഗിക്കുന്ന ഭാജനം. ഫെറിക് ഓക്സൈഡും അലുമിനിയം പൗഡറും 3:1 എന്ന അനുപാതത്തില് കലര്ത്തിയ തെര്മൈറ്റ്-മിശ്രിതം ക്രൂസിബിളില് എടുക്കുന്നു. ജ്വലനത്തെ സഹായിക്കുവാനായി അല്പം ബേരിയം പെര്ഓക്സൈഡും ഇതില് ചേര്ക്കുന്നു. മിശ്രിതത്തില് ഒരു മഗ്നീഷ്യം റിബണ് കുത്തിനിറുത്തുന്നു. വെല്ഡനം ചെയ്യേണ്ട യന്ത്രഭാഗങ്ങള് (അഥവാ ലോഹക്കഷണങ്ങള്) നന്നായി തുടച്ച് വൃത്തിയാക്കി അഗ്നിസഹമണ്ണു (fire clay) കൊണ്ടുള്ള ഒരു മൂശയിലാക്കുന്നു.
മഗ്നീഷ്യം റിബണ് കത്തിച്ച് തെര്മൈറ്റ്-മിശ്രിതത്തെ ജ്വലിപ്പിക്കുന്നു. ഇരുമ്പിന്റെ ഓക്സൈഡിനെ നിരോക്സീകരിച്ച് ഇരുമ്പുണ്ടാകുന്നു. ഈ പ്രക്രിയ താപോന്മോചകമാകയാല് താപനില ഏകദേശം 2500°C വരെ ഉയരുന്നു. ദ്രവ ഇരുമ്പ് ക്രൂസിബിളിന്റെ അടിയിലുള്ള സുഷിരംവഴി ലോഹത്തിന്റെ വെല്ഡനം ചെയ്യേണ്ട ഭാഗത്തേക്ക് ഒഴിക്കുന്നു. തണുപ്പിച്ച ശേഷം വിളക്കിയ ഭാഗം രാകി ശരിയാക്കുന്നു. ഇതാണു തെര്മൈറ്റ് വെല്ഡനത്തിന്റെ രൂപരേഖ.
അലോയ്കള്
സാധാരണ അലുമിനിയത്തില് ഒരു ശ.മാ.വരെ ഇരുമ്പ്, ചെമ്പ് തുടങ്ങിയ മൂലകങ്ങള് അടങ്ങിയിട്ടുണ്ട്. ഇവ അതിന്റെ ഉറപ്പും കാഠിന്യവും വര്ധിപ്പിക്കുന്നു. അലുമിനിയവുമായി സംയോജിപ്പിച്ച് അലോയ്കള് ഉണ്ടാകുവാന് പര്യാപ്തമായ മൂലകങ്ങള് നാല്പതോളം വരും. അലുമിനിയത്തില് മറ്റു മൂലകങ്ങള് ചേര്ക്കുമ്പോള് അവ സങ്കരാവസ്ഥയില് വിവിധ രൂപത്തിലാണു സ്ഥിതിചെയ്യുന്നത്. ചിലത് അതാതു മൂലകങ്ങളുടെ കണികകളായിത്തന്നെ ഇരിക്കുന്നു. മറ്റു ചിലവ അലുമിനിയവുമായി ഖരലായനികളുണ്ടാക്കുന്നു. വേറെ ചില മൂലകങ്ങളാകട്ടെ അന്തര്ലോഹയൗഗികങ്ങള് (intermetallic compounds) ഉണ്ടാക്കുന്നു. വാര്ക്കലിനുപയോഗിക്കുന്ന അലുമിനിയം അലോയ്കളെ രണ്ടു വര്ഗങ്ങളായി തിരിക്കാം: ഒന്നാമത്തെ വര്ഗത്തില്പ്പെട്ട കൂട്ടുലോഹങ്ങളുടെ ഉറപ്പും കടുപ്പവും അവ സങ്കരപ്രക്രിയയില് ഏര്പ്പെടുന്നതുകൊണ്ടു മാത്രം ലഭിക്കുന്നതാണ്. രണ്ടാമത്തെ വര്ഗത്തില്പ്പെടുന്നവയുടെ ഗുണധര്മങ്ങള് അവയുടെ സംഘടനത്തെയും ഊഷ്മാഭിക്രിയയെയും ആശ്രയിച്ചിരിക്കും. അലുമിനിയത്തിന്റെ വാണിജ്യപ്രാധാന്യമുള്ള ബൈനറി അലോയ്കളില് മുഖ്യമായവ കോപ്പര്-അലുമിനിയം അലോയ്കളും അലുമിനിയം-സിലിക്കണ് അലോയ്കളുമാണ്. മൂന്നോ അതില് കൂടുതലോ മൂലകങ്ങള് ചേര്ന്ന സങ്കരങ്ങളും അലുമിനിയത്തില് നിന്ന് ഉത്പാദിപ്പിക്കുന്നുണ്ട്. നൂറ്റിയന്പതിലധികം അലുമിനിയം അലോയ്കള് ഇന്നു പ്രചാരത്തിലുള്ളതായിട്ടറിയുന്നു.
താപോപചാരംകൊണ്ട് അലുമിനിയത്തിന്റെ പല അലോയ്കളുടെയും ഗുണധര്മങ്ങള് മെച്ചപ്പെടുത്താന് കഴിയും. ചെമ്പും അലുമിനിയവും ചേര്ന്നുള്ള കൂട്ടുലോഹങ്ങള് ആ ഇനത്തില് പ്പെട്ടവയാണ്. പ്രസ്തുത സങ്കരങ്ങളെ 350-530°C മധ്യേയുള്ള താപനിലയില് പരമാവധി ഘനലായനി ഉണ്ടാകുന്നതുവരെ തപിപ്പിക്കുന്നു. അനന്തരം അതിനെ ദ്രുത ശീതളനത്തിനു (quick freezing) വിധേയമാക്കുന്നു. അപ്പോള് ഒരു അസ്ഥിരഖരലായനി ഉണ്ടാകുകയും അതില്നിന്നു ലയിച്ചുചേരാത്ത ഘടകം സ്വതഃപ്രവര്ത്തിതമായോ, 100-120°C ചൂടാക്കുമ്പോഴോ വേര്തിരിയുന്നതുമാണ്. ഈ പ്രക്രിയ അലോയ്കളുടെ കടുപ്പവും ഉറപ്പും വര്ധിപ്പിക്കുന്നു. ഉദാഹരണമായി സാധാരണ ഡുറാലുമിനിയത്തിന്റെ വലിവുറപ്പ് (tensile strength) 25,000 പൗണ്ട്/ച. ഇഞ്ചായിരിക്കുമ്പോള് താപോപചാരത്തിനു വിധേയമാക്കിയ ഡുറാലുമിനിയത്തിന്റെ വലിവുറപ്പ് 50,000 പൗണ്ട്/ച. ഇഞ്ചായി വര്ധിക്കും. കൂട്ടുലോഹങ്ങളെ മെച്ചപ്പെടുത്താനുള്ള വേറെയും മാര്ഗങ്ങള് ഇന്നു നിലവില് വന്നിട്ടുണ്ട്.
ചെമ്പിന്റെ ഒരു അലോയ് ആണ് അലുമിനിയം ഓട് (aluminium bronze) എന്നു പറയുന്നത്. ഇതില് ഏകദേശം 11 ശ.മാ. വരെ അലുമിനിയം അടങ്ങിയിട്ടുണ്ട്. ഈ കൂട്ടുലോഹം നൈട്രിക് അമ്ലം ഒഴികെയുള്ള അമ്ളമാധ്യമങ്ങളില് ക്ഷാരണപ്രതിരോധശക്തി പ്രദര്ശിപ്പിക്കുന്നതാണ്. സ്വര്ണനിറമുള്ള ഇവ നാണയനിര്മാണത്തിനും പാത്രങ്ങള്, ആഭരണങ്ങള് എന്നിവയുണ്ടാക്കുന്നതിനും ഉപയോഗിക്കുന്നു. കൂടുതല് ഉറപ്പു ലഭിക്കുന്നതിനുവേണ്ടി ഈ അലോയ്കളില് ഇരുമ്പ്, നിക്കല്, മാങ്ഗനീസ് എന്നിവയും ചേര്ക്കാറുണ്ട്. കടുപ്പം കുറയണമെന്നുണ്ടെങ്കില് സിലിക്കണും ചേര്ക്കാം.
ചില പ്രധാന യൗഗികങ്ങള്
സാധാരണ അലുമിനിയം-യൗഗികങ്ങളില് അലുമിനിയത്തിന്റെ സംയോജകത മൂന്നാണ്. ആകയാല് X എന്നത് ഒരു എകസംയോജക റാഡിക്കല് ആണെങ്കില് AlX3 എന്നത് അലുമിനിയം യൗഗികങ്ങളുടെ പ്രരൂപം (type) ആയി കണക്കാക്കാം. (അടുത്ത കാലത്ത് വൈബര്ഗ് (Wiberg) എന്ന ശാസ്ത്രജ്ഞന് കണ്ടുപിടിച്ച അലുമിനിയം ഹൈഡ്രൈഡ് (AlH3)y ഇതിന് ഒരു അപവാദമാണ്.)
അലുമിനിയത്തിന്റെ ഓക്സിജന്-യൗഗികങ്ങളില് ഏറ്റവും മുഖ്യം അലുമിനിയം ഓക്സൈഡ് (അലുമിന) ആണ്. ലോഹത്തെ ഓക്സിജനില് കത്തിച്ചും അലുമിനിയം ഹൈഡ്രോക്സൈഡ് അഥവാ ചില അലുമിനിയം യൗഗികങ്ങള് തപിപ്പിച്ചും ഇതു ലഭ്യമാക്കാം. വെളുത്തതും അക്രിസ്റ്റലീയവുമായ ഖരപദാര്ഥമാണ് ഇത്. ജലത്തില് അലേയമാണ്. ഉച്ചതപ്തമാക്കിയാല് അമ്ലത്തിലും അലേയമായിരിക്കും. പ്രകൃതിയില് ഉപസ്ഥിതമാണ് (കൊറണ്ടം എന്ന പേരില് ഇത് അറിയപ്പെടുന്നു). ഈ ഖനിജം കടുപ്പത്തിനു പേരു കേട്ടതാണ്. മാണിക്യം, പദ്മരാഗം, ഇന്ദ്രനീലം എന്നീ രത്നക്കല്ലുകള് അപദ്രവ്യങ്ങള് കലര്ന്ന കൊറണ്ടമാണ്. കൊറണ്ടം സംശ്ലേഷണം കൊണ്ട് ഉത്പാദിപ്പിക്കാവുന്നതാകയാല് മേല്പറഞ്ഞവയും മരതകം മുതലായ മറ്റുകല്ലുകളും കൃത്രിമമായി ഉണ്ടാക്കാം. അയണ് ഓക്സൈഡ്, ക്വാര്ട്സ് എന്നിവ അപദ്രവ്യങ്ങളായി കലര്ന്ന പ്രാകൃതിക-അലുമിനയാണ് എമറി എന്ന വസ്തു. കൊറണ്ടം, എമറി എന്നീ രൂപങ്ങളില് അലുമിനിയം ഓക്സൈഡ് അപഘര്ഷകമായും പോളിഷിങ് ഏജന്റായും ഉപയോഗിക്കപ്പെടുന്നു. ചൂളകളില് അകവശത്ത് ഉച്ചതാപസഹമായ ആസ്തരം നിര്മിക്കുന്നതിന് കൊറണ്ടം പ്രയോജനപ്പെടുത്താറുണ്ട്. AlO, Al2O എന്നിങ്ങനെ അലുമിനിയത്തിന് ചില പ്രത്യേകപരിതഃസ്ഥിതിയില് രണ്ടു സബ് ഓക്സൈഡുകള് ലഭ്യമാക്കാവുന്നതാണ്. അലുമിനിയത്തിന്റെ മെറ്റാ ഹൈഡ്രോക്സൈഡ് - (AlO(OH)), ഓര്ഥോ ഹൈഡ്രോക്സൈഡ് - Al (OH)3 എന്നിവയും സോഡിയം, പൊട്ടാസിയം എന്നിവയുടെ അലുമിനേറ്റുകളും ഈ ലോഹത്തിന്റെ മറ്റു ചില ഓക്സിജന് യൗഗികങ്ങളാണ്.
അലുമിനിയത്തിന്റെ ഹാലജന് യൗഗികങ്ങളില് മുഖ്യം അലുമിനിയം ക്ലോറൈഡ് ആണ്; ഫോര്മുല AlCl3. അലുമിനിയം തകിടുകളിന്മേല് അല്ലെങ്കില് അലുമിനയും കരിപ്പൊടിയും കലര്ത്തിയുണ്ടാക്കിയ ഗാഢമിശ്രിതത്തിന്മേല് ക്ലോറിന് വാതകം പ്രവഹിപ്പിച്ചാണ് പ്രസ്തുത യൗഗികം പരീക്ഷണശാലകളില് ഉണ്ടാക്കുന്നത്. അലുമിന-കരിപ്പൊടി മിശ്രിതത്തെ ക്ളോറിന് ധാരയില് തപിപ്പിക്കുകയാണ് വ്യാവസായിക രീതി.
മേല്പറഞ്ഞ രീതിയില് ലഭിക്കുന്നത് നിര്ജല അലുമിനിയം ക്ലോറൈഡ് ആണ്. കാര്ബണിക രസതന്ത്രത്തില് പല യൗഗികങ്ങളുടെയും നിര്മാണത്തില് ഇത് പ്രയോജനപ്പെടുത്തിവരുന്നു. ഫ്രീഡല്-ക്രാഫ്ട്സ് അഭിക്രിയ ദൃഷ്ടാന്തങ്ങളാണ്. ബെന്സീന്വലയത്തില് ഒരു മീഥൈല് റാഡിക്കല് ചേര്ക്കാന് ബെന്സീനും മീഥൈല് ക്ലോറൈഡും നിര്ജല-അലുമിനിയം ക്ലോറൈഡിന്റെ സാന്നിധ്യത്തില് പ്രവര്ത്തിപ്പിച്ചാല് മതി.
CH3Cl + C6H6 →C6H5 CH3+HCl
കണ്ടന്സേഷന് (Condensation), ഹാലജനേഷന്, ഡിഹൈഡ്രജനേഷന് (dehydrogenation) തുടങ്ങിയ പ്രവര്ത്തനങ്ങളില് ഉത്പ്രേരകമായും ചായം, എസ്സന്സുകള് എന്നിവയുടെ വ്യവസായത്തിലും പെട്രോളിയംക്രാക്കിങ് പ്രക്രിയയിലും അലുമിനിയം ക്ലോറൈഡ് ഉപയുക്തമാകുന്നുണ്ട്. ഇതു നിറമില്ലാത്തതും പ്രസ്വേദിയും 200°Cല് ഉത്പതിക്കുന്നതുമായ ഒരു ഖരവസ്തുവാണ്. ജലീയലായനിയില് ഇതിനു ജലീയവിശ്ലേഷണം സംഭവിക്കുകയും അലുമിനിയം ഹൈഡ്രോക്സൈഡ് ലഭിക്കുകയും ചെയ്യുന്നു. AlCl3.6H2O എന്നത് അലുമിനിയം ക്ലോറൈഡിന്റെ ഹെക്സാഹൈഡ്രേറ്റ് ആണ്. ലോഹമോ, ഓക്സൈഡോ ഹൈഡ്രോക്ലോറിക് അമ്ളത്തില് അലിയിച്ച് ലായനി വറ്റിച്ച് പരലുകളായി ഇതുണ്ടാക്കിയെടുക്കാം. ഫ്ളൂറിന്, ബ്രോമിന്, അയഡിന് എന്നിവയുമായി സംയോജിച്ചും അലുമിനിയം ഹാലൈഡുകള് ഉണ്ടാക്കുന്നുണ്ട്.
അലുമിനിയത്തിന്റെ സള്ഫര്-യൗഗികങ്ങളില് പ്രധാനം അലുമിനിയം സള്ഫേറ്റ്, ആലങ്ങള് (alums) എന്നിവയാണ്. നിര്ജല-അലുമിനിയം സള്ഫേറ്റ്, Al2 (SO4)3 വെളുത്ത പൊടിയായി ലഭിക്കുന്നു. ജലീയലായനിയില് നിന്ന് അതു 18 ജലതന്മാത്രകളോടുകൂടി ക്രിസ്റ്റലുകളായി വേര്പിരിയുന്നു. അതിന്റെ ഫോര്മുല, Al2(SO4)3. 18H2O. അതിന് ചവര്പ്പുരുചിയാണ്, നിറമില്ല. വ്യവസായരംഗത്ത് അലുമിനിയം സള്ഫേറ്റിന് ധാരാളം പ്രയോജനങ്ങളുണ്ട്-വിശേഷിച്ചും കടലാസുവ്യവസായത്തില്. തുകല്, ചായവ്യവസായങ്ങളിലും മറ്റു പല അലുമിനിയം യൌഗികങ്ങള് നിര്മിക്കുന്നതിനുള്ള പ്രാരംഭവസ്തുവായും അലുമിനിയം സള്ഫേറ്റ് പ്രയോജനപ്പെടുത്തി വരുന്നു. ഇരുമ്പിന്റെ അംശലേശംപോലുമില്ലാത്ത ശുദ്ധലോഹം ചുടുസാന്ദ്രസള്ഫ്യൂറിക് അമ്ലത്തിലലിയിച്ച് അലുമിനിയം സള്ഫേറ്റ് ലഭ്യമാക്കാം.
അലുമിനിയം സള്ഫേറ്റും ആല്ക്കലി ലോഹസള്ഫേറ്റുകളും യോജിച്ച് ഉത്പന്നമാകുന്ന യൗഗികങ്ങളാണ് ആലങ്ങള്. സാധാരണയായി ആലം എന്നു പറഞ്ഞുവരുന്നത് പൊട്ടാസിയം അലുമിനിയം സള്ഫേറ്റ് എന്ന യൗഗികത്തെയാണ്; ഫോര്മുല, KAI(SO4)2 I2H2O(അഥവാ,K2SO4.AI2 (SO4)3 .24 H2o) ആലംസ്റ്റോണ് അല്ലെങ്കില് അലുനൈറ്റ് എന്നറിയപ്പെടുന്ന ഖനിജം നിസ്തപ്തമാക്കി (calcined) സള്ഫ്യൂറിക് അമ്ലംകൊണ്ടുപചരിച്ചശേഷം ലായനിയിലേക്ക് കണക്കു പ്രകാരമുള്ള പൊട്ടാസിയം സള്ഫേറ്റ് ചേര്ത്ത് ലായനി ബാഷ്പീകരിച്ചാണ് പൊട്ടാസിയം അലുമിനിയം സള്ഫേറ്റ് ക്രിസ്റ്റലീകരിക്കുന്നത്. ഇതു വെള്ളത്തിലലിയുന്ന നിറമില്ലാത്ത പരലുകളാണിത്. ലായനിക്കു ചവര്പ്പുരുചിയുണ്ട്. അല്പം പുളിയുമുണ്ടായിരിക്കും. ചൂടാക്കുമ്പോള് അത് ഉരുകി വിഘടിച്ച് വെളുത്ത അവശിഷ്ടം ലഭ്യമാക്കുന്നു. ചായമിടുന്ന വ്യവസായങ്ങള്, ഔഷധവ്യവസായം, തുകല്വ്യവസായം, ജലശുദ്ധീകരണം, കാലിക്കൊ പ്രിന്റിങ് എന്നീ രംഗങ്ങളില് ആലം ഉപയോഗിക്കപ്പെടുന്നു.
ഓര്ഗാനൊ മെറ്റാലിക് യൗഗികങ്ങളില് ചിലത് അലുമിനിയത്തിന്റേതാണ്. അലുമിനിയത്തിന്റെ മൂന്നു വാലന്സികളിലായി മീഥൈല്, ഈഥൈല് മുതലായ ആല്ക്കൈല് ഗ്രൂപ്പുകള് മൂന്ന് എണ്ണം യോജിച്ച് അലുമിനിയം ആല്ക്കൈലുകള് (aluminium alkyls) ഉണ്ടാകുന്നു. ഇവ പൊതുവില് നിറമില്ലാത്ത ദ്രവങ്ങളാണ്. വായുവില് സ്വയം കത്തിപ്പിടിക്കും. ജലവുമായി തീവ്രപ്രവര്ത്തനം നടത്തി അലുമിനിയം ഹൈഡ്രോക്സൈഡും സംഗതങ്ങളായ ഹൈഡ്രൊ കാര്ബണ് യൗഗികങ്ങളും തരുന്നു. ഉയര്ന്ന തന്മാത്രാഭാരമുള്ള പാരഫിനുകളും ഒളിഫീനുകളും സംശ്ലേഷണം ചെയ്തുണ്ടാക്കുന്നതിന് ഈ യൗഗികങ്ങള് പ്രയോജനപ്പെടുത്താം.
അലുമിനിയം ഹൈഡ്രജനുമായി യോജിച്ച് അലുമിനിയം ഹൈഡ്രൈഡ് ഉണ്ടാകുന്നതാണ്. ഇതിനു ലിഥിയം-അലുമിനിയം-ഹൈഡ്രൈഡ് (lithium aluminium hydride) പോലുള്ള സങ്കീര്ണ ഹൈഡ്രൈഡുകള് ലഭ്യമാക്കുവാന് കഴിവുണ്ട്. കാര്ബണിക-അകാര്ബണിക രസതന്ത്രങ്ങളില് വിപുലമായി പ്രയോജനമുള്ള ഒരു യൗഗികമാണ് ലിഥിയം അലുമിനിയം ഹൈഡ്രൈഡ്,
Li Al H4
ഇവയ്ക്കു പുറമേ അലുമിനിയം നൈട്രേറ്റ്, അലുമിനിയം നൈട്രൈഡ്, അലുമിനിയം തയൊ സയനേറ്റ്, അലുമിനിയം അസറ്റേറ്റ്, അലുമിനിയം സള്ഫൈഡ്, അലുമിനിയം കാര്ബൈഡ് മുതലായ പല യൗഗികങ്ങളും പ്രസ്തുത ലോഹത്തിന്റേതായിട്ടുണ്ട്. നോ: അലിന്ഡ്; അലുമിനിയം വ്യവസായം; അലുനൈറ്റ്; അലോയ്
(ഡോ. പി.ടി. ജോസഫ്; സ.പ.)