This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
തന്മാത്ര
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
തന്മാത്ര
ങീഹലരൌഹല
ഒരു രാസപദാര്ഥത്തിന്റെ, സ്വതന്ത്രാസ്തിത്വമുള്ള ഏറ്റവും ചെറിയ കണിക. ഒരു മൂലകത്തിന്റെ ഒന്നോ അതിലധികമോ അണുകങ്ങളോ വിവിധ മൂലകങ്ങളുടെ അണുകങ്ങളോ അടങ്ങുന്നതായിരിക്കും ഒരു തന്മാത്ര. മൂലകങ്ങളുടെ തന്മാത്രകള് ഏകഅണുകമോ ദ്വിഅണുകമോ ബഹുഅണുകമോ ആകാം. നിഷ്ക്രിയ വാതകങ്ങളായ ഹീലിയം, നിയോണ്, ആര്ഗോണ്, ക്രിപ്റ്റോണ്, സെനോണ്, റാഡോണ് എന്നിവ ഏകഅണുക (ാീിീ മീാശര) തന്മാത്രകളായാണ് സ്ഥിതിചെയ്യുന്നത്. ഈ മൂലകങ്ങളുടെ അണുകങ്ങള് തമ്മില് പ്രതിപ്രവര്ത്തിക്കുന്നില്ല. അതിനാല് ഈ മൂലകങ്ങളെ സംബന്ധിച്ചിടത്തോളം അണുവും തന്മാത്രയും ഒന്നുതന്നെ. സാധാരണ വാതക മൂലകങ്ങളെല്ലാം തന്നെ (ഉദാ. ഹൈഡ്രജന് - ഒ2, ഓക്സിജന് - ഛ2, ക്ളോറിന് - ഇഹ2) ഒരേ മൂലകത്തിന്റെ രണ്ട് അണുകങ്ങള് അടങ്ങുന്നതാണ്. ഈ തന്മാത്രകളെ ദ്വിഅണുക തന്മാത്രകളെന്നു പറയാം. എന്നാല് ഒന്നിലധികം മൂലകങ്ങളുടെ അണുകങ്ങള് അടങ്ങുന്നതാണ് സംയുക്തങ്ങളുടെ തന്മാത്രകള് (ഉദാ. ജലം ഒ2ഛ, കാര്ബണ് മോണോക്സൈഡ് ഇഛ, അമോണിയ ചഒ3).
ഹൈഡ്രജന് തന്മാത്രയാണ് ഏറ്റവും ചെറിയ തന്മാത്ര. 2.3-2.4 അബ്ബ ആണ് വ്യാസം (1 അബ്ബ = 108രാ). സങ്കീര്ണ ജൈവതന്മാത്രകളായ പ്രോട്ടീന്, ഡിഎന്എ എന്നിവ വലിയ തന്മാത്രകളാണ്. ആയി രത്തിലധികം അണുകങ്ങളടങ്ങുന്ന ഈ തന്മാത്രകളുടെ ഭാരം ഹൈഡ്രജന് തന്മാത്രയുടേതിനെയപേക്ഷിച്ച് അനേകം ദശലക്ഷം അധികമാണ്.
തന്മാത്രാസഞ്ചയങ്ങള് ഖര-ദ്രവ-വാതകാവസ്ഥയിലേതിലെ ങ്കിലും സ്ഥിതിചെയ്യുന്നു. മറ്റെല്ലാ സാഹചര്യങ്ങളും ഒന്നായിരിക്കു മ്പോള് തന്മാത്രയുടെ ഭാരവും വലുപ്പവും കൂടുന്നതനുസരിച്ച് ബാഷ്പീകരണസ്വഭാവം കുറയുന്നു. ഉദാ. സാധാരണ ഋജു ശ്രേണി ഹൈഡ്രോകാര്ബണുകളായ മീഥേന് ഇഒ4 മുതല് ബ്യൂട്ടേന് ഇ4ഒ10 വരെയുള്ള തന്മാത്രകള് സാധാരണ ഊഷ്മാവില് വാതകങ്ങളാണ്. പെന്റേന് ഇ5ഒ12 മുതല് പെന്റാഡെക്കേന് ഇ15ഒ32 വരെയുള്ള തന്മാത്രകള് ദ്രാവകാവസ്ഥയിലും ഹെക്സാഡെക്കേന് ഇ16ഒ34 മുതലുള്ള ഖനതന്മാത്രകള് ഖരാവസ്ഥയിലുമാണ് സ്ഥിതി ചെയ്യുന്നത്. തന്മാത്രാഭാരത്തിനു പുറമേ താപനിലയും തന്മാത്രകള് തമ്മിലുള്ള ആകര്ഷണ ശക്തിയുമാണ് ഒരു രാസപദാര്ഥത്തിന്റെ ഭൌതികാവസ്ഥയ്ക്കു നിദാനമാകുന്ന ഘടകങ്ങള്. തന്മാത്രകള് തമ്മില് ദുര്ബലമായ വാന്ഡര്വാള് ബലങ്ങളായിരിക്കും ഉണ്ടായിരിക്കുക.
രാസസംയുക്തങ്ങളില് രണ്ട് വിധത്തിലാണ് അണുകങ്ങള് തമ്മില് ബന്ധിക്കപ്പെട്ടിരിക്കുന്നത്. രണ്ടിലും അണുകങ്ങളിലെ ഇലക്ട്രോണുകളാണു പങ്കെടുക്കുന്നത്; എന്നാല് ഇതില് ഒരു വിധത്തിലുള്ള രാസബന്ധങ്ങള്ക്കു മാത്രമേ തന്മാത്രകള് രൂപീകരിക്കാനാകൂ. അയോണിക അഥവാ ഇലക്ട്രോവാലന്റ് ബന്ധങ്ങള് വഴി തന്മാത്രകളില്ലാത്ത സംയുക്തങ്ങളാണുണ്ടാകുന്നത്. ഉദാ. വിദ്യുത്ധന സോഡിയം ലോഹം, വിദ്യുത്ഋണ ക്ളോറിന് വാതകാന്തരീക്ഷത്തില് ചൂടാക്കുമ്പോള് സോഡിയം അണുവില് നിന്ന് ഒരു ഇലക്ട്രോണ് ക്ളോറിന് അണുവിലേക്ക് പ്രതിസ്ഥാപിക്കപ്പെടുന്നു. തത്ഫലമായി രണ്ട് അണുകങ്ങള്ക്കും സ്ഥിരതയുള്ള ഇലക്ട്രോണ് വിന്യാസം ഉണ്ടാകുന്നു. ഇപ്രകാരമുണ്ടാകുന്ന സോഡിയം ക്ളോറൈഡ് (ചമഇഹ) സംയുക്തത്തില് സോഡിയം, ക്ളോറിന് അണുകങ്ങള് സ്ഥിരവൈദ്യുതാകര്ഷണം വഴി പരല് ഘടന രൂപീകരിക്കുന്നു എന്നല്ലാതെ ചമഇഹ എന്ന തന്മാത്രയുണ്ടാകുന്നില്ല.
തന്മാത്രകളുണ്ടാകുന്ന ബന്ധങ്ങളാണ് സഹസംയോജക (ര്ീമഹലി) ബന്ധങ്ങള്. അലോഹമൂലകാണുകങ്ങള് തമ്മില് ഇലക് ട്രോണുകള് പങ്കുവയ്ക്കുന്നതല്ലാതെ ഒരു അണുവില് നിന്ന് മറ്റൊ ന്നിലേക്ക് ഇലക്ട്രോണുകള് പ്രതിസ്ഥാപിക്കപ്പെടുന്നില്ല. സഹ സംയോജക ബന്ധങ്ങള് രൂപീകരിക്കുന്ന അണുകങ്ങളുടെ ഊനാ ധാനത ഏകദേശം ഒരുപോലെയായതിനാല് അണുകങ്ങള് ഇലക് ട്രോണുകള് പങ്കുവച്ച് സ്ഥിരത നേടുന്നു.
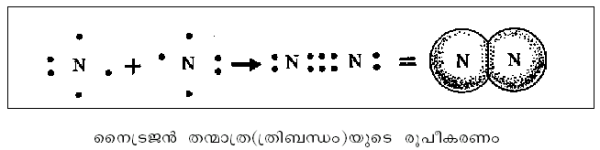
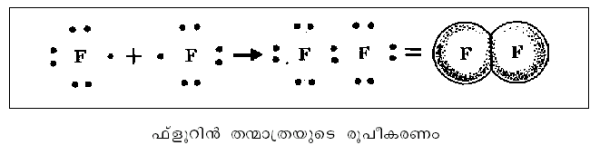 ഓരോ അണുവും ഒരു ഇലക്ട്രോണ് വീതം പങ്കുവയ്ക്കുന്നതു വഴി ഒരു ഏകബന്ധ(ശിെഴഹല യീിറ)വും രണ്ടും മൂന്നും ഇലക്ട്രോണുകള് പങ്കുവയ്ക്കുന്നതു വഴി യഥാക്രമം ദ്വിബന്ധ(റീൌയഹല യീിറ)വും ത്രിബന്ധ(ൃശുഹല യീിറ)വും ഉണ്ടാകുന്നു.
ഓരോ അണുവും ഒരു ഇലക്ട്രോണ് വീതം പങ്കുവയ്ക്കുന്നതു വഴി ഒരു ഏകബന്ധ(ശിെഴഹല യീിറ)വും രണ്ടും മൂന്നും ഇലക്ട്രോണുകള് പങ്കുവയ്ക്കുന്നതു വഴി യഥാക്രമം ദ്വിബന്ധ(റീൌയഹല യീിറ)വും ത്രിബന്ധ(ൃശുഹല യീിറ)വും ഉണ്ടാകുന്നു.
 താരതമ്യേന ശക്തിയുള്ള സഹസംയോജക ബന്ധങ്ങള് വഴിയുണ്ടാകുന്ന തന്മാത്രകള് സ്വതന്ത്രാസ്തിത്വമുള്ള കണിക കളാണ്. ഒരു സംയുക്തത്തില് തന്മാത്രകള് വാന്ഡര്വാള് ബല ങ്ങള് കൊണ്ട് ദുര്ബലമായി ബന്ധിക്കപ്പെട്ടിരിക്കുന്നു. ഈ സംയു ക്തങ്ങള് വിദ്യുത്ചാലകങ്ങളല്ല, കൂടാതെ അയോണിക സംയുക്ത ങ്ങളെ അപേക്ഷിച്ച് താഴ്ന്ന ഉരുകല്നിലയും തിളനിലയുമാണ് ഉള്ളത്.
താരതമ്യേന ശക്തിയുള്ള സഹസംയോജക ബന്ധങ്ങള് വഴിയുണ്ടാകുന്ന തന്മാത്രകള് സ്വതന്ത്രാസ്തിത്വമുള്ള കണിക കളാണ്. ഒരു സംയുക്തത്തില് തന്മാത്രകള് വാന്ഡര്വാള് ബല ങ്ങള് കൊണ്ട് ദുര്ബലമായി ബന്ധിക്കപ്പെട്ടിരിക്കുന്നു. ഈ സംയു ക്തങ്ങള് വിദ്യുത്ചാലകങ്ങളല്ല, കൂടാതെ അയോണിക സംയുക്ത ങ്ങളെ അപേക്ഷിച്ച് താഴ്ന്ന ഉരുകല്നിലയും തിളനിലയുമാണ് ഉള്ളത്.
വ്യത്യസ്ത മൂലകങ്ങളുടെ അണുകങ്ങള് വ്യത്യസ്ത വിദ്യുത്ഋണതയുള്ളവയാകയാല് ശുദ്ധമായ സഹസംയോജക ബന്ധങ്ങളുണ്ടാകുന്നില്ല. രണ്ട് അണുകങ്ങള് തമ്മില് വിദ്യുത്ഋണതയില് ഒരു അയോണിക ബന്ധം ഉണ്ടാകാന് വേണ്ടത്ര വ്യത്യാസം ഇല്ലെങ്കില് ഇലക്ട്രോണുകള് ഒരു അണുവിലേക്ക് പ്രതിസ്ഥാപിക്കപ്പെടുന്നില്ല. മറിച്ച്, സഹസംയോജക ബന്ധം രൂപീകരിക്കുന്ന ഇലക്ട്രോണുകള് ഒരു അണുവിലേക്ക് കൂടുതല് അടുത്തിരിക്കും. ഉദാ. ഒഇക തന്മാത്ര. ഹൈഡ്രജനും ക്ളോറിനും തമ്മില് പങ്കുവയ്ക്കപ്പെടുന്ന ഇലക്ട്രോണുകള് ക്ളോറിന്റെ അടുത്തേക്കു വിന്യസിക്കുന്നു. ഇതിനാല് ഒഇഹ തന്മാത്ര ഊനമോ ആധിയോ പ്രദര്ശിപ്പിക്കുന്നില്ലെങ്കിലും തന്മാത്രയുടെ ഹൈഡ്രജന് അഗ്രത്തിനെയപേക്ഷിച്ച് ക്ളോറിന് അഗ്രം ഊനമായിരിക്കും. ഇപ്രകാരം ഭാഗികമായി അയോണിക സ്വഭാവം പ്രദര്ശിപ്പിക്കുന്ന തന്മാത്രകളാണ് ധ്രുവ തന്മാത്രകള്.
 തന്മാത്രാഘടനയും, ഘടക അണുകങ്ങളുടെ ഇലക്ട്രോണ് വിന്യാസവും തമ്മിലുള്ള പരസ്പര സംബന്ധം വ്യക്തമാക്കുന്ന രണ്ട് വ്യത്യസ്ത സമീപനങ്ങളുണ്ട്. തന്മാത്രയുടേയോ അണുവി ന്റേയോ ഇലക്ട്രോണ് പഥങ്ങളെ ആസ്പദമാക്കിയുള്ള ക്വാണ്ടം ബലതന്ത്ര സമീപനമാണ് ഒന്ന്. മറ്റൊന്ന് വിദ്യുത്സ്ഥിതതന്ത്ര (ലഹലരൃീമെേശേര) സമീപനമാണ്; ഇതാണ് വാലന്സ് ഷെല് ഇലക്ട്രോണ് പെയര് റിപ്പള്ഷന് (ഢ ട ഋ ജ ഞ) സിദ്ധാന്തം എന്ന പേരിലറിയപ്പെ ടുന്നത്. വെര്ണര് ഹെയ്സന്ബര്ഗ് (ണലൃിലൃ ഒലശലിെയലൃഴ), ഇര്വിന് ഷ്രോഡിന്ഗര് (ഋൃംശി ടരവൃീറശിഴലൃ), പി.എ.എം. ഡിറാക്ക് (ജ.അ.ങ. ഉശൃമര) എന്നീ മൂന്ന് ഭൌതികശാസ്ത്രജ്ഞരാണ് ക്വാണ്ടം ബല തന്ത്രസിദ്ധാന്തങ്ങള് വികസിപ്പിച്ചെടുത്തത്. ക്വാണ്ടം ബലതന്ത്രമനുസരിച്ച് ഇലക്ട്രോണുകളെ വ്യക്തമായ സ്ഥാനമുള്ള ഒരു കണികയായല്ല മറിച്ച്, വ്യാപിച്ചു കിടക്കുന്ന ഋണ വൈദ്യുത ചാര്ജായാണ് (ലഹലരൃീി രഹീൌറ) ചിത്രീകരിക്കുന്നത്. ഒരു ഇലക്ട്രോണിന്റെ സ്ഥാനവും വേഗവും ഒരേസമയം കൃത്യമായി കണക്കാക്കാനാവുകയില്ല എന്ന ഹെയ്സന്ബര്ഗിന്റെ സിദ്ധാന്ത(ഒലശലിെയലൃഴ ഡിരലൃമേശിശ്യ ുൃശിരശുഹല)ത്തില് നിന്നാണ്
തന്മാത്രാഘടനയും, ഘടക അണുകങ്ങളുടെ ഇലക്ട്രോണ് വിന്യാസവും തമ്മിലുള്ള പരസ്പര സംബന്ധം വ്യക്തമാക്കുന്ന രണ്ട് വ്യത്യസ്ത സമീപനങ്ങളുണ്ട്. തന്മാത്രയുടേയോ അണുവി ന്റേയോ ഇലക്ട്രോണ് പഥങ്ങളെ ആസ്പദമാക്കിയുള്ള ക്വാണ്ടം ബലതന്ത്ര സമീപനമാണ് ഒന്ന്. മറ്റൊന്ന് വിദ്യുത്സ്ഥിതതന്ത്ര (ലഹലരൃീമെേശേര) സമീപനമാണ്; ഇതാണ് വാലന്സ് ഷെല് ഇലക്ട്രോണ് പെയര് റിപ്പള്ഷന് (ഢ ട ഋ ജ ഞ) സിദ്ധാന്തം എന്ന പേരിലറിയപ്പെ ടുന്നത്. വെര്ണര് ഹെയ്സന്ബര്ഗ് (ണലൃിലൃ ഒലശലിെയലൃഴ), ഇര്വിന് ഷ്രോഡിന്ഗര് (ഋൃംശി ടരവൃീറശിഴലൃ), പി.എ.എം. ഡിറാക്ക് (ജ.അ.ങ. ഉശൃമര) എന്നീ മൂന്ന് ഭൌതികശാസ്ത്രജ്ഞരാണ് ക്വാണ്ടം ബല തന്ത്രസിദ്ധാന്തങ്ങള് വികസിപ്പിച്ചെടുത്തത്. ക്വാണ്ടം ബലതന്ത്രമനുസരിച്ച് ഇലക്ട്രോണുകളെ വ്യക്തമായ സ്ഥാനമുള്ള ഒരു കണികയായല്ല മറിച്ച്, വ്യാപിച്ചു കിടക്കുന്ന ഋണ വൈദ്യുത ചാര്ജായാണ് (ലഹലരൃീി രഹീൌറ) ചിത്രീകരിക്കുന്നത്. ഒരു ഇലക്ട്രോണിന്റെ സ്ഥാനവും വേഗവും ഒരേസമയം കൃത്യമായി കണക്കാക്കാനാവുകയില്ല എന്ന ഹെയ്സന്ബര്ഗിന്റെ സിദ്ധാന്ത(ഒലശലിെയലൃഴ ഡിരലൃമേശിശ്യ ുൃശിരശുഹല)ത്തില് നിന്നാണ്
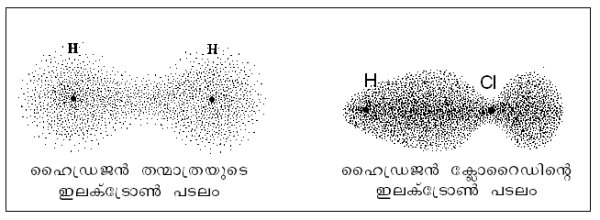 ഇലക്ട്രോണ് പടലം എന്ന സങ്കല്പം ഉരുത്തിരിഞ്ഞിട്ടുള്ളത്. ഒരു സ്ഥാനത്ത്, ഇലക്ട്രോണ് ഉണ്ടായിരിക്കാനുള്ള സാധ്യത അവിടത്തെ ഇലക്ട്രോണ് പടലത്തിന്റെ സാന്ദ്രതയുമായി ആനുപാതികമായിരിക്കും. ഷ്രോഡിന്ഗര് തരംഗസമവാക്യം (ടരവൃീിറശിഴലൃ ംമ്ല ലൂൌമശീിേ) നിര്ധാരണം ചെയ്തു ലഭിക്കുന്ന തരംഗ ഫലനത്തില് (ംമ്ല ളൌിരശീിേ) നിന്ന് ഇലക്ട്രോണ് സാന്ദ്രത കണക്കാക്കാം.
ഇലക്ട്രോണ് പടലം എന്ന സങ്കല്പം ഉരുത്തിരിഞ്ഞിട്ടുള്ളത്. ഒരു സ്ഥാനത്ത്, ഇലക്ട്രോണ് ഉണ്ടായിരിക്കാനുള്ള സാധ്യത അവിടത്തെ ഇലക്ട്രോണ് പടലത്തിന്റെ സാന്ദ്രതയുമായി ആനുപാതികമായിരിക്കും. ഷ്രോഡിന്ഗര് തരംഗസമവാക്യം (ടരവൃീിറശിഴലൃ ംമ്ല ലൂൌമശീിേ) നിര്ധാരണം ചെയ്തു ലഭിക്കുന്ന തരംഗ ഫലനത്തില് (ംമ്ല ളൌിരശീിേ) നിന്ന് ഇലക്ട്രോണ് സാന്ദ്രത കണക്കാക്കാം.
സംയോജക ഇലക്ട്രോണ് ദ്വന്ദ്വങ്ങള് പരസ്പരം വികര്ഷിക്കു ന്നതിനാല് അവ തമ്മില് വളരെ അകലം ഉണ്ടാകുന്ന വിധത്തില് വിന്യസിക്കുന്നു എന്നാണ് 'വാലന്സ് ഷെല് ഇലക്ട്രോണ് പെയര് റിപ്പള്ഷന്' സിദ്ധാന്തം നിര്ദേശിക്കുന്നത്. അമോണിയ (ചഒ3), ബോറോണ് ട്രൈഫ്ളൂറൈഡ് (ആഎ3), സള്ഫര് ഹെക്സാഫ്ളൂറൈഡ് (ടഎ6) എന്നിങ്ങനെയുള്ള ലഘു തന്മാത്രകളുടെ ഘടന പ്രവചിക്കാന് ഈ സിദ്ധാന്തം ഉപയോഗപ്രദമാണ്.
തന്മാത്രകള് തമ്മിലുള്ള ബലങ്ങള്. തന്മാത്രകള് തമ്മില് ആകര്ഷണ-വികര്ഷണ ബലങ്ങളുണ്ട്. ഒരു പദാര്ഥത്തിന്റെ തന്മാത്രകള് വളരെയടുത്തുവരുമ്പോള് (ഏതാനും അബ്ബ അകലത്തില്) ഇലക്ട്രോണ് പടലങ്ങള് തമ്മില് വികര്ഷിക്കുന്നു. എന്നാല് അകലം കൂടുമ്പോള് ആകര്ഷണ ബലങ്ങള്ക്ക് ശക്തിയേറുന്നു. താപത്തിനും മര്ദത്തിനും അനുസൃതമായി തന്മാത്രകളെ തമ്മില് ഒന്നിച്ച് നിര്ത്തുന്ന വിധത്തില് ആകര്ഷണ ബലങ്ങള് പ്രവര്ത്തിക്കുന്നു. ഒരു പദാര്ഥത്തിന്റെ ഭൌതികാവസ്ഥ നിര്ണയിക്കുന്നത് തന്മാത്രകള് തമ്മിലുള്ള ബലങ്ങളാണ്.
തന്മാത്രകളുടെ ചലനം. തന്മാത്രകള് മൂന്നു വിധത്തില് ചലിക്കാറുണ്ട്-സ്ഥാനിക ചലനം (ൃമിഹെമശീിേമഹ ാീശീിേ), ഭ്രമണ ചലനം (ൃീമേശീിേമഹ ാീശീിേ), കമ്പനചലനം (്ശയൃമശീിേമഹ ാീശീിേ). തന്മാത്രകള് യഥാസ്ഥാനങ്ങളില് നിന്ന് മാറുന്നതാണ് ആദ്യത്തേത്. ഭ്രമണചലനത്തില് തന്മാത്രയുടെ ഒരു ഭാഗം മറ്റേ ഭാഗത്തിന് ചുറ്റും കറങ്ങുകയാണ് ചെയ്യുന്നത്. തന്മാത്രയിലെ അണുകങ്ങളെ തമ്മില് ബന്ധിപ്പിക്കുന്ന ബോണ്ട് ഒരു സ്പ്രിങ് ആണെങ്കിലെന്ന പോലെ അണുകങ്ങള് സ്പന്ദിക്കുന്നതാണ് കമ്പന ചലനം. ഈ ചലനംമൂലം അണുകങ്ങള് തമ്മിലുള്ള അകലം ഇടവിട്ട് കൂടുകയും കുറയുകയും ചെയ്യുന്നു (ൃലരേവശിഴ ്ശയൃമശീിേ); അതുപോലെ ബോണ്ടുകള് തമ്മിലുള്ള കോണവും കൂടുകയും കുറയുകയും ചെയ്യുന്നു (യലിറശിഴ ്ശയൃമശീിേ).
പദാര്ഥത്തിന്റെ താപോര്ജമാണ് തന്മാത്രകളുടെ ചലനത്തിന്റെ സ്വഭാവവും തോതും നിര്ണയിക്കുന്നത്. താഴ്ന്ന ഊഷ്മാവില് തന്മാത്രകള് തമ്മില് വളരെ ചേര്ന്നിരിക്കുമ്പോള് അണുകങ്ങളുടെ കമ്പനം മാത്രമാണു നടക്കുന്നത്. അപ്പോള് പദാര്ഥം ഖരാവസ്ഥയിലായിരിക്കും. കുറേക്കൂടി ഉയര്ന്ന താപനിലയില് തന്മാത്രകള് കറങ്ങുകയും സ്പന്ദിക്കുകയും ചെയ്യുമെങ്കിലും യഥാസ്ഥാനത്തു നിന്ന് മാറ്റം ഉണ്ടാവാത്തതിനാല് പദാര്ഥം ഖരാവസ്ഥയില്ത്തന്നെ തുടരുന്നു. വീണ്ടും താപം ഉയരുമ്പോള് തന്മാത്രകള്ക്ക് സ്ഥാന ചലനം സംഭവിക്കുന്നതിനാല് പദാര്ഥം ദ്രാവകാവസ്ഥയിലേക്കു മാറുന്നു. കൂടുതല് ഉയര്ന്ന താപനിലകളില് തന്മാത്രകള് തമ്മിലുള്ള അകലം പിന്നെയും വര്ധിക്കുന്നതോടെ അവ സ്വതന്ത്രമായി ചലിക്കുകയും പദാര്ഥം വാതകാവസ്ഥയിലെത്തുകയും ചെയ്യുന്നു.
സങ്കീര്ണ തന്മാത്രാ ഘടനകള്
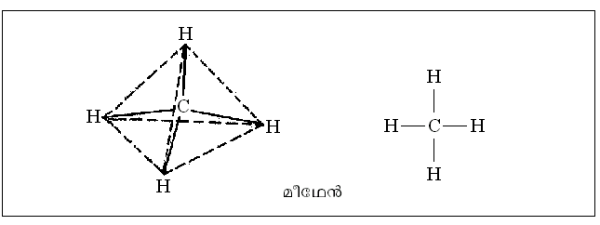
ഋജു ശൃംഖല. ഋജു ശൃംഖലാതന്മാത്രകള്ക്ക് ഏറ്റവും നല്ല ഉദാഹരണമാണ് മീഥേനില് തുടങ്ങുന്ന ഹൈഡ്രോകാര്ബണ് ശ്രേണി. മീഥേന് ടെട്രാഹീഡ്രല് ഘടനയുള്ള ഒരു തന്മാത്രയാണ്. മീഥേന് തന്മാത്രയെ സാധാരണ ചിത്രീകരിക്കുന്നത് ചിത്രത്തില് കാണിച്ചിരിക്കുന്നതുപോലെയാണ്. മീഥേനിലെ ഒരു ഹൈഡ്രജനു പകരം മീഥൈല് ഗ്രൂപ്പാ(ഇഒ3)ണെങ്കില് ശ്രേണിയിലെ
 അടുത്ത അംഗമായ ഈഥേന് (ഇ2ഒ6) ഉണ്ടാകുന്നു. അടുത്ത അംഗം പ്രൊപ്പേന് ഇ3ഒ8 ആണ്. ഇപ്രകാരം ഒരു ഇഒ2-വിന്റെ വ്യത്യാസത്തില് അസംഖ്യം അംഗങ്ങള് ഈ ശ്രേണിയിലുണ്ടാകും. ഈ ഹൈഡ്രോകാര്ബണ് ശൃംഖല യഥാര്ഥത്തില് ഋജുവല്ല. അടുത്തടുത്തുള്ള കാര്ബണ് അണുകങ്ങള് തമ്മിലുള്ള കോണം ടെട്രാഹീഡ്രല് (109ബ്ബ 28') ആയതിനാല് യഥാര്ഥത്തില് ഈ തന്മാത്രകള്ക്ക് ഒരു വളഞ്ഞുപുളഞ്ഞ ഘടനയാണുള്ളത്. ഈ തന്മാത്രകള്ക്ക് അടഞ്ഞ ചാക്രിക ഘടനയില്ലാത്തതിനാലാണ് ഇവയെ ഋജു ശൃംഖലാതന്മാത്രകള് എന്നു പറയുന്നത്.
അടുത്ത അംഗമായ ഈഥേന് (ഇ2ഒ6) ഉണ്ടാകുന്നു. അടുത്ത അംഗം പ്രൊപ്പേന് ഇ3ഒ8 ആണ്. ഇപ്രകാരം ഒരു ഇഒ2-വിന്റെ വ്യത്യാസത്തില് അസംഖ്യം അംഗങ്ങള് ഈ ശ്രേണിയിലുണ്ടാകും. ഈ ഹൈഡ്രോകാര്ബണ് ശൃംഖല യഥാര്ഥത്തില് ഋജുവല്ല. അടുത്തടുത്തുള്ള കാര്ബണ് അണുകങ്ങള് തമ്മിലുള്ള കോണം ടെട്രാഹീഡ്രല് (109ബ്ബ 28') ആയതിനാല് യഥാര്ഥത്തില് ഈ തന്മാത്രകള്ക്ക് ഒരു വളഞ്ഞുപുളഞ്ഞ ഘടനയാണുള്ളത്. ഈ തന്മാത്രകള്ക്ക് അടഞ്ഞ ചാക്രിക ഘടനയില്ലാത്തതിനാലാണ് ഇവയെ ഋജു ശൃംഖലാതന്മാത്രകള് എന്നു പറയുന്നത്.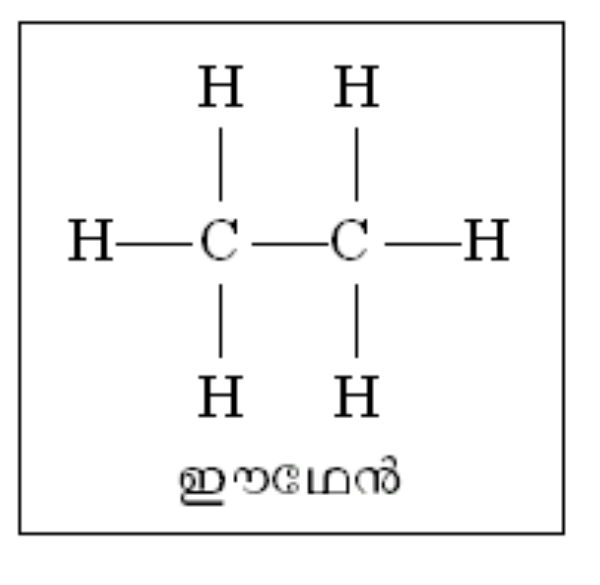
ചാക്രിക ഘടന. ഋജുശൃംഖലാതന്മാത്രകള്ക്ക് ടെട്രാഹീ ഡ്രല് കോണമുള്ളതിനാല് ശൃംഖലയുടെ രണ്ട് അഗ്രങ്ങള് തമ്മില് ചേര്ന്നാല് ചാക്രികഘടനയുണ്ടാകുന്നു. ഉദാ. സൈക്ളോഹെക് സേന് ഇ6ഒ12. ഈ തന്മാത്രയുടെ വ്യത്യസ്ത വിന്യാസങ്ങള് ചിത്രത്തില് കാണിച്ചിരിക്കുന്നു. ചാക്രിക കാര്ബണിക സംയുക്തങ്ങളില്
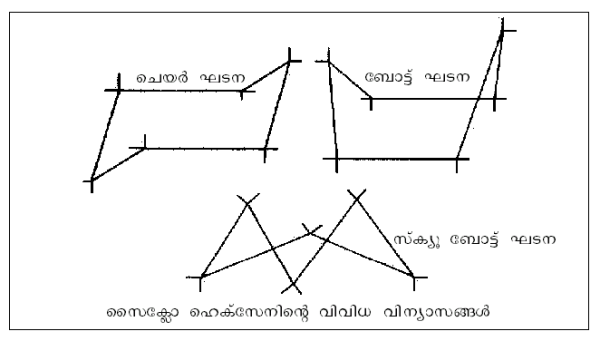 ഏറ്റവും പ്രാധാന്യമുള്ളത് ആരോമാറ്റിക സംയുക്തങ്ങളാണ്. ഈ വിഭാഗത്തിലെ ഏറ്റവും ലഘു തന്മാത്ര ആണ് ബെന്സീന് ഇ6ഒ6. ഒന്നിലേറെ റിങ്ങുകള് സംയോജിച്ചിരിക്കുന്ന സങ്കീര്ണ ഘടനയുള്ളവയാണ് ജീവകങ്ങള്, ഹോര്മോണുകള് തുടങ്ങിയ ജൈവ തന്മാത്രകള്. അകാര്ബണിക സംയുക്തങ്ങള്ക്കും ചാക്രിക ഘടനയുണ്ട്. ഉദാ. ബോറസീന് അഥവാ അകാര്ബണിക ബെന്സീന്. ഒന്നിലധികം ഡോണര് ഗ്രൂപ്പുകളുള്ള ലിഗാന്റുകളടങ്ങുന്ന കോ-ഓര്ഡിനേഷന് സംയുക്തങ്ങള് ചാക്രിക തന്മാത്രകളുടെ ഒരു പ്രധാന വിഭാഗമാണ്.
ഏറ്റവും പ്രാധാന്യമുള്ളത് ആരോമാറ്റിക സംയുക്തങ്ങളാണ്. ഈ വിഭാഗത്തിലെ ഏറ്റവും ലഘു തന്മാത്ര ആണ് ബെന്സീന് ഇ6ഒ6. ഒന്നിലേറെ റിങ്ങുകള് സംയോജിച്ചിരിക്കുന്ന സങ്കീര്ണ ഘടനയുള്ളവയാണ് ജീവകങ്ങള്, ഹോര്മോണുകള് തുടങ്ങിയ ജൈവ തന്മാത്രകള്. അകാര്ബണിക സംയുക്തങ്ങള്ക്കും ചാക്രിക ഘടനയുണ്ട്. ഉദാ. ബോറസീന് അഥവാ അകാര്ബണിക ബെന്സീന്. ഒന്നിലധികം ഡോണര് ഗ്രൂപ്പുകളുള്ള ലിഗാന്റുകളടങ്ങുന്ന കോ-ഓര്ഡിനേഷന് സംയുക്തങ്ങള് ചാക്രിക തന്മാത്രകളുടെ ഒരു പ്രധാന വിഭാഗമാണ്.
പഞ്ജര (കേജ്) ഘടന. വെള്ള ഫോസ്ഫറസ് (ജ4)-ന്റേതാണ് ഏറ്റവും ലഘുവായ പഞ്ജര ഘടന. ജ4ഛ6,ജ4ഛ10 എന്നീ ഓക്സൈഡുകള്ക്കും പഞ്ജര ഘടനയാണുള്ളത്. ബോറോണിന്റെ കേജ് സംയുക്തങ്ങള്ക്ക് ഐകോസാഹീഡ്രല് ഘടനയാണ്.
സാന്ഡ്വിച്ച് ഘടന. രണ്ട് ഹൈഡ്രോകാര്ബണ് റിങ്ങുകള്ക്കിടയില് ഒരു ലോഹാണു സാന്ഡ്വിച്ച് ചെയ്തിട്ടുള്ള അനേകം ജൈവലോഹ സംയുക്തങ്ങളുണ്ട്. ഉദാ. ഫെറോസീന് (എലൃൃീരലില).
സമമൂലകങ്ങള് (ഐസോമറുകള്). സമാന രാസയോഗവും തന്മാത്രാഭാരവുമുള്ളവയെങ്കിലും വ്യത്യസ്ത സ്വഭാവങ്ങള് പ്രദര്ശിപ്പിക്കുന്ന തന്മാത്രകളാണ് സമമൂലകങ്ങള്. ഘടനാ-ഐസോമറുകള് അണുകങ്ങളുടെ എണ്ണത്തിലും വിധത്തിലും സമാനമാണെങ്കിലും അണുകങ്ങള് തമ്മിലുള്ള ബോണ്ടിങ്ങില് വ്യത്യസ്തമാണ്. സ്റ്റീരിയോ ഐസോമറുകളാകട്ടെ ബോണ്ടിങ്ങിലും സമാനമാണ്. അണുകങ്ങളുടെ വിന്യാസത്തില് ആണ് വ്യത്യാസം.
ബൃഹത് തന്മാത്രകള്. ഒരുപോലെയുള്ള അനേകം ലഘു തന്മാത്രകള് സഹസംയോജക ബന്ധങ്ങള് വഴി ബന്ധിക്കപ്പെട്ടാണ് ബൃഹത് തന്മാത്രകള് അഥവാ പോളിമറുകള് ഉണ്ടാകുന്നത്. പോളിമര് തന്മാത്രകള് ഏകമാനമോ (ഉദാ. റബ്ബര്, സില്ക്ക്, ആസ്ബസ്റ്റോസ്, പോളിഎതിലീന്, ദ്രവ സിലിക്കോണുകള്) ദ്വിമാനമോ (ഉദാ. മൈക്ക, ഗ്രാഫൈറ്റ്, വള്ക്കനൈസ് ചെയ്ത റബ്ബര്) ത്രിമാനമോ (ഉദാ. ക്വാര്ട്സ്, വജ്രം.) ആകാം.
വ്യക്തിഗത ബൃഹത് തന്മാത്രകളാണ് പോളിമറുകളുടെ ഗുണ ധര്മങ്ങള് നിര്ണയിക്കുന്നത്. ഉദാഹരണത്തിന് ദ്രവ സിലിക്കോണ്, മൈക്ക, ക്വാര്ട്സ് എന്നീ മൂന്ന് പദാര്ഥങ്ങളിലും സിലിക്കോണ്-ഓക്സിജന് ബന്ധങ്ങളാണുള്ളതെങ്കിലും അവ യഥാക്രമം ഏകമാനവും ദ്വിമാനവും ത്രിമാനവും ആണ്. ഇതാണ് പദാര്ഥ സ്വഭാവം വ്യത്യസ്തമാകാന് കാരണം. കാര്ബണ് അണുകങ്ങള് മാത്രം അടങ്ങിയിട്ടുള്ള ഗ്രാഫൈറ്റിന്റേയും വജ്രത്തിന്റേയും വിരുദ്ധ സ്വഭാവങ്ങള് മറ്റൊരു ഉദാഹരണമാണ്. ഗ്രാഫൈറ്റില് അണുകങ്ങള് ദ്വിമാന പാളികളായാണ് വിന്യസിച്ചിരിക്കുന്നത്. പാളികള് തമ്മില് വളരെ ദുര്ബലമായ ആകര്ഷണബലം മാത്രമാണുള്ളത്. ഈ പാളികള്ക്ക് അന്യോന്യം തെന്നി മാറാനാവുന്നതിനാല് ഗ്രാഫൈറ്റ് വളരെ മൃദുവുമാണ്. എന്നാല് വജ്രത്തിലാകട്ടെ അണുകങ്ങള് ത്രിമാന പരലായാണു ബന്ധിക്കപ്പെട്ടിട്ടുള്ളത്. ഈ പരല്ഘടനയാണ് വജ്രത്തിനെ ഏറ്റവും കാഠിന്യമുള്ള പദാര്ഥമാക്കുന്നത്.
ഗ്ളൈക്കോജന്, സ്റ്റാര്ച്ച്, സെല്ലുലോസ്, പ്രോട്ടീനുകള് എന്നിവ ജൈവപോളിമര് തന്മാത്രകളാണ്.

