This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
അണുകേന്ദ്രം
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
അണുകേന്ദ്രം
Nucleus
അണുവില് ധനചാര്ജ് (positive charge) ഉള്ളഭാഗം. 1912-ല് റഥര്ഫോര്ഡ് അതിനു 'ന്യൂക്ളിയസ്' (Nucleus) എന്നു പേരിട്ടു. അണുവിനെക്കുറിച്ചുള്ള പഠനം ഇന്നു മിക്കവാറും ന്യൂക്ളിയസ്സിനെക്കുറിച്ചുമാത്രമാണ്.
ചാഡ്വിക് എന്ന ശാസ്ത്രജ്ഞന് 1932-ല് ന്യൂട്രോണ് കണം കണ്ടുപിടിച്ചതോടെയാണ് അണുകേന്ദ്രം ന്യൂട്രോണും പ്രോട്ടോണും കൊണ്ടു നിര്മിതമായിരിക്കാമെന്ന് ശാസ്ത്രജ്ഞര് ഊഹിച്ചത്.
അണുകേന്ദ്രം ന്യൂക്ളിയോണുകള് (Nucleons) എന്നറിയപ്പെടുന്ന A കണങ്ങള്കൊണ്ടു കെട്ടിപ്പടുത്തിരിക്കുന്നു. അവയില് പ്രോട്ടോണുകളെ z എന്നും ന്യൂട്രോണുകളെ z എന്നും സൂചിപ്പിക്കുന്നു. മൂലകത്തിന്റെ ദ്രവ്യമാനസംഖ്യ (Mass number) A എന്നും അണുസംഖ്യ (Atomic number) z എന്നും പറയാം. z-പ്രോട്ടോണുകള് അണുകേന്ദ്രത്തിനു (z x e) ധനചാര്ജ് നല്കുന്നു. അണുവില് z കക്ഷീയ ഇലക്ട്രോണുകള് (Orbital electrons) ഉള്ളതുകൊണ്ട് z x e ഋണചാര്ജ് അവയില്നിന്നു ലഭിക്കുന്നു. അതിനാല് മൊത്തമായി അണുവിനു ചാര്ജില്ലാതാകുന്നു.
അണുകേന്ദ്ര പരിമാണം (Nuclear size). 1911-ല് ഗൈഗര്, മാര്സ്ഡല് എന്നീ ശാസ്ത്രജ്ഞന്മാര് ഭാരമേറിയ അണുകേന്ദ്രങ്ങളാല് ആല്ഫാകണങ്ങള് എപ്രകാരം പ്രകീര്ണനം (scattering) ചെയ്യപ്പെടുന്നു എന്നറിയാന് ചില ഗവേഷണങ്ങള് നടത്തി. അതില്നിന്നു ലഭിച്ച വിവരങ്ങളില്നിന്ന് അണുകേന്ദ്രത്തിന് ഉദ്ദേശം 10-12 സെ.മീ. വ്യാസാര്ധമുണ്ടെന്നു റഥര്ഫോര്ഡ് അനുമാനിച്ചു. അണുകേന്ദ്രങ്ങളുടെ വ്യാസാര്ധം r = r0A1/310-13 സെ.മീ. എന്ന സമീകരണംകൊണ്ടു പ്രകടമാക്കാവുന്നതാണ്. ഇതില് r0 ഒരു സ്ഥിരാങ്കവും A ദ്രവ്യമാനസംഖ്യയുമാണ്. അണുകേന്ദ്രത്തിന്റെ വ്യാസാര്ധം അണുവിന്റേതിനോടു താരതമ്യപ്പെടുത്തുമ്പോള് തുലോം ചെറുതാണ്. ഉദാ. ആര്ഗണ് അണുകേന്ദ്രത്തിനു 4.1 x 10-13 സെ.മീ. വ്യാസാര്ധമുണ്ട്; അണുവിനു 1.5 x 10-8 സെ.മീ., അതായത് ഏകദേശം
4 x 104 മടങ്ങു വ്യാസാര്ധമാണുള്ളത്. അണുവില് അണുകേന്ദ്രമിരിക്കുന്ന സ്ഥലത്തെ അപേക്ഷിച്ചു വളരെയധികം സ്ഥലം ശൂന്യമായി കിടക്കുന്നു എന്ന് ഇതില്നിന്നു മനസ്സിലാക്കാം. അതിനാല് ചാര്ജില്ലാത്ത ന്യൂട്രോണുകള് യാതൊരു വിഷമവും കൂടാതെ കട്ടിയുള്ള ദ്രവ്യത്തില് കൂടി കടന്നുപോകുന്നതില് അസ്വാഭാവികത ഒന്നുമില്ല. അണുകേന്ദ്രത്തിന്റെ ഘനമാനം 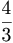 πr3 ഘ.സെ.മീ. ആണ്. അണുകേന്ദ്രത്തിന്റെ ദ്രവ്യമാനം മിക്കവാറും ദ്രവ്യമാനസംഖ്യക്ക് ആനുപാതികമാണ്. അതിനാല് അണുകേന്ദ്ര സാന്ദ്രത എല്ലാ അണുകേന്ദ്രങ്ങളിലും ഒന്നുതന്നെയായിരിക്കും. ഇത് ഉദ്ദേശം 7.4 x 1011 കി.ഗ്രാം/ഘ. സെ.മീ. എന്ന വലിയ തുകയാണ്.
πr3 ഘ.സെ.മീ. ആണ്. അണുകേന്ദ്രത്തിന്റെ ദ്രവ്യമാനം മിക്കവാറും ദ്രവ്യമാനസംഖ്യക്ക് ആനുപാതികമാണ്. അതിനാല് അണുകേന്ദ്ര സാന്ദ്രത എല്ലാ അണുകേന്ദ്രങ്ങളിലും ഒന്നുതന്നെയായിരിക്കും. ഇത് ഉദ്ദേശം 7.4 x 1011 കി.ഗ്രാം/ഘ. സെ.മീ. എന്ന വലിയ തുകയാണ്.
അണുകേന്ദ്രത്തിന്റെ ദ്രവ്യമാനം. ആധുനിക ദ്രവ്യമാനസ്പെക്ട്രോസ്കോപി (Mass Spectroscopy) എന്ന ശാസ്ത്രശാഖയുടെ സഹായത്തോടെ അണുക്കളുടെ ദ്രവ്യമാനം 6-7 ഗണനീയ അങ്കങ്ങളോളം കണിശമായി നിര്ണയിക്കാന് കഴിഞ്ഞിട്ടുണ്ട്. ഭൗതികശാസ്ത്രത്തില് അണുദ്രവ്യമാനമാത്രയായി (atomic mass unit=amu) എടുത്തിട്ടുള്ളത് 1.6599 X 10-21 ഗ്രാം ആണ്. ഇത് ഓക്സിജന്-16 (16O) ദ്രവ്യമാനത്തിന്റെ 16-ല് ഒരംശമാണ്. രസതന്ത്രത്തില് സ്വീകരിച്ചിരിക്കുന്ന ദ്രവ്യമാനമാത്രയെക്കാള് ഇതു 0.03 ശ.മാ. കുറവാണ്. ഈ നിര്വചനപ്രകാരം പ്രോട്ടോണിന്റെ ദ്രവ്യമാനം 1.007595 amu എന്നും ന്യൂട്രോണിന്റേതു 1.008987 amu എന്നും സിദ്ധിക്കുന്നു. ഒരു amu = 1.492 X 103 എര്ഗ് () അഥവാ 93 കോടി 12 ലക്ഷം ഇലക്ട്രോണ് വോള്ട്ട് ഊര്ജം എന്നു കണക്കാക്കാം.
അണുകേന്ദ്രബലം (Nuclear force). അണുകേന്ദ്രം കെട്ടിപ്പടുത്തിട്ടുള്ള ന്യൂക്ളിയോണുകളെ കൂട്ടിച്ചേര്ത്തുവച്ചിരിക്കുന്നത് ആകര്ഷണബലങ്ങളുടെ പ്രേരണയാലാണ്; ആ ബലങ്ങള് ചെയ്ത പ്രവൃത്തി (work) ഊര്ജമായി മോചിക്കപ്പെടുകയും ചെയ്യും. ഈ ബലങ്ങള് വൈദ്യുതമാകാന് തരമില്ല. വൈദ്യുതബലം ഉള്ളതുതന്നെ പ്രോട്ടോണുകള് തമ്മിലുള്ള വികര്ഷണമാണ്. ഗുരുത്വാകര്ഷണം തുലോം തുച്ഛമാണ്. ഈ അണുകേന്ദ്രബലങ്ങളുടെ പ്രത്യേകത, അതു ന്യൂക്ളിയോണുകളുടെ പ്രകൃതിയെ ആശ്രയിച്ചിരിക്കുന്നില്ലെന്നുള്ളതാണ്. അതായത്, പ്രോട്ടോണും പ്രോട്ടോണും, പ്രോട്ടോണും ന്യൂട്രോണും ന്യൂട്രോണും ന്യൂട്രോണും തമ്മിലുള്ള വികര്ഷണം മിക്കവാറും തുല്യമാണ്. പ്രോട്ടോണുകള് തമ്മിലുള്ള വൈദ്യുതവികര്ഷണശക്തിയെക്കാള് വളരെ കൂടുതലാണ് അവ തമ്മിലുള്ള അണുകേന്ദ്രബലം.
അണുകേന്ദ്രബലങ്ങള് തന്മാത്രാബന്ധങ്ങള് (molecular bonds) പോലെയാണ്. അവയ്ക്കു ഭാഗികമായിട്ടെങ്കിലും ഒരു വിനിമയ സവിശേഷതയുണ്ടായിരിക്കണം. തന്മാത്രാ ബന്ധങ്ങളുണ്ടാകാന് (ഉദാ. ഹൈഡ്രജന് തന്മാത്ര) ആവശ്യത്തിനുള്ള സംയോജകത ഇലക്ട്രോണ് വിനിമയ(exchange)ത്തിനുണ്ട്. ഹൈഡ്രജന് തന്മാത്രയിലുള്ള അണുക്കള് ആകര്ഷണത്തിനു വിധേയമായി ബന്ധപ്പെടാനിടവരുന്നത് ഒരു അണുവിന്റെ ഇലക്ട്രോണ് മറ്റേ അണുവിനു കൈമാറുമ്പോഴാണ്. ന്യൂക്ളിയോണുകള് തമ്മില് വിനിമയം ചെയ്യുന്ന കണങ്ങള് ഇലക്ട്രോണുകളാകാന് തരമില്ല. കാരണങ്ങള്: (1) അണുകേന്ദ്രത്തില് ഇലക്ട്രോണുകളില്ലെന്നതിനു തെളിവുകളുണ്ട്; (2) ഇലക്ട്രോണുകള് കൈമാറിയാല് തന്നെയും അതിലുണ്ടാകുന്ന ആകര്ഷണബലം ബന്ധനോര്ജത്തിനു മതിയാകുന്നതല്ല. (നോ: അണുകേന്ദ്രവിജ്ഞാനീയം) ഇലക്ട്രോണിന്റെ ഏകദേശം 200 മടങ്ങു ദ്രവ്യമാനമുള്ള മെസോണ് എന്ന കണമാണ് കൈമാറ്റം ചെയ്യുന്നതെന്ന് 1935-ല് യൂക്കാവാ എന്ന ജപ്പാന് ശാസ്ത്രജ്ഞന് താത്ത്വികമായി നിര്ദേശിച്ചു. അക്കാലത്ത് അത്തരം ഒരു കണത്തെക്കുറിച്ചു യാതൊരു അറിവുമുണ്ടായിരുന്നില്ല. എന്നാല് പില്ക്കാലത്ത് കോസ്മികകിരണങ്ങളില് അവ കണ്ടെത്തുവാനിടയായി.
ഒരു വിദ്യുത്കാന്തിക മണ്ഡലത്തില് (electro magnetic field) ഏതുവിധത്തില് ബലം പ്രേഷണം ചെയ്യുന്ന കണം (force transmitting particle) ആയി ഫോട്ടോണ് (photon) വര്ത്തിക്കുന്നുവോ അതുപോലെ അണുകേന്ദ്രമണ്ഡലത്തില് (nuclear field) മെസോണ് ബലം പ്രേഷണം ചെയ്യുന്ന കണമായിവര്ത്തിക്കുന്നു. ഫോട്ടോണുകളുടെ അവശോഷണവും (absorption) പുനരുത്സര്ജനവും (re-emission)കൊണ്ട് ആവേശിതകണങ്ങള് (charged particles) തമ്മിലുള്ള കൂളൂംബലം (Coulomb force) ഉണ്ടാകുന്നതുപോലെ മെസോണുകളുടെ അവശോഷണവും പുനരുത്സര്ജനവുംകൊണ്ട് ന്യൂക്ളിയോണുകള് തമ്മിലുള്ള ആകര്ഷണബലം സംജാതമാകുന്നു. ഈ ബലത്തിന്റെ സീമ (range)parse ചെയ്യുവാന് പരാജയപ്പെട്ടു (Missing texvc executable;
please see math/README to configure.): {h}{2\pimc}
ആണ്. ഇതില് h, പ്ളാങ്കു സ്ഥിരാങ്കം (plank's constant), m മെസോണിന്റെ ദ്രവ്യമാനം, c പ്രകാശവേഗം. മെസോണിനെ വമിക്കുന്ന പ്രോട്ടോണ് അതിനെ വീണ്ടും സ്വീകരിക്കാതെ ഏറ്റവും സമീപത്തുള്ള ന്യൂട്രോണ് അവശോഷണം ചെയ്യുന്നുവെങ്കില്, ഈ ന്യൂട്രോണ് പ്രോട്ടോണായി മാറുകയും മറ്റേ കണം ന്യൂട്രോണായിത്തീരുകയും ചെയ്യും. ഫലത്തില്, ന്യൂട്രോണും പ്രോട്ടോണും സ്വസ്ഥാനങ്ങള് പരസ്പരം കൈമാറുന്നു. മൈസോണിന്റെ സ്ഥാനത്തിനു വരുന്ന വ്യത്യാസം കൊണ്ടുണ്ടാകുന്ന ന്യൂക്ളിയോണുകള് തമ്മിലുള്ള ബന്ധമാണ് വിനിമയബലമായി (exchange force)ത്തീരുന്നത്. കോസ്മിക കിരണങ്ങളില് ഋണധന ചാര്ജുകളുള്ള രണ്ടുതരം മെസോണുകളെ 1937-ല് നെതര്മേയറും ആന്ഡേഴ്സണും കണ്ടെത്തി. അവയെ μ+_മെസോണുകളെന്നു വിളിച്ചുവരുന്നു. എന്നാല്, യൂക്കാവാ താത്വികമായി കണക്കാക്കി എടുത്തതില് കുറവായിരുന്നു ഈ കണങ്ങളുടെ ദ്രവ്യമാനം. 1947-ല് മെസോണിന്റെ കണ്ടുപിടിത്തത്തോടെ ഈ വൈരുധ്യം അപ്രത്യക്ഷമായി. അവയ്ക്കു യൂക്കാവാ കണത്തിനുവേണ്ട ദ്രവ്യമാനവും ചാര്ജും ഉള്ളതായി കണ്ടു. നോ: അണു, അണുകേന്ദ്രവിജ്ഞാനീയം, അണുശബ്ദാവലി
(പ്രൊഫ. എസ്. ഗോപാലമേനോന്)

