This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
തിളനില
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
തിളനില
Boiling Point
ഒരു ദ്രാവകത്തിന്റെ ബാഷ്പ മര്ദം അന്തരീക്ഷ മര്ദത്തിനു തുല്യ മാകുന്ന താപനില. ഈ താപനിലയില് ദ്രാവകവും വാതകവും തമ്മില് ഒരു സമതുലിതാവസ്ഥ നിലവില് വരും. ദ്രാവകാന്തര്ഭാഗത്ത് രൂപീകൃതമാകുന്ന വാതക കുമിളകള് ഉപരിതലത്തിലേക്കുയരുകയും പൊട്ടുകയും ചെയ്യുമ്പോള് ദ്രാവകത്തിലുണ്ടാവുന്ന വിക്ഷോഭം ആണ് തിള. ദ്രവാവസ്ഥയില് നിന്ന് വാതകാവസ്ഥയിലേക്കുള്ള മാറ്റം തന്നെയാണ് ബാഷ്പീകരണത്തിലും സംഭവിക്കുന്നതെങ്കിലും ഇത് തിളയില് നിന്ന് തികച്ചും വ്യത്യസ്തമാണ്. തിള ദ്രാവകത്തിലുടനീളം സംഭവിക്കുന്നുവെങ്കില് ബാഷ്പീകരണം ദ്രാവകത്തിന്റെ പ്രതലത്തില് മാത്രം നടക്കുന്ന ഒരു പ്രക്രിയയാണ്. ബാഷ്പീകരണം എല്ലാ താപനിലകളിലും നടക്കും; പക്ഷേ തിളയ്ക്കല് തിളനിലയില് മാത്രമേ സംഭവിക്കുന്നുള്ളൂ. ഒരു നിശ്ചിത ബാഹ്യമര്ദത്തില് ദ്രാവകത്തിന്റെ തിളനില സ്ഥിരമായിരിക്കും. ബാഹ്യമര്ദത്തില് വ്യതിയാനം വരുത്തി ദ്രാവകത്തിന്റെ തിളനില ഉയര്ത്തുവാനും താഴ്ത്തുവാനും സാധിക്കും. ഉദാഹരണത്തിന് സാധാരണ അന്തരീക്ഷ മര്ദത്തില് (1 atm) 100ºC-ല് തിളയ്ക്കുന്ന ജലം അന്തരീക്ഷ മര്ദം കുറഞ്ഞ്??0.5atms ആകുമ്പോള് 86ºC-ല് തിളയ്ക്കും. ബാഹ്യമര്ദത്തിനനുസൃതമായി തിളനിലയിലുണ്ടാകുന്ന മാറ്റത്തെ ഗുണകരമായി വിനിയോഗിക്കുന്നതാണ് പ്രഷര്കുക്കറിന്റെ പ്രവര്ത്തന തത്ത്വം. കുക്കറിനുള്ളിലെ മര്ദത്തിനൊപ്പം തിളനിലയും കൂടുന്നതിനാല് ഭക്ഷണം പാകമാകാന് ആവശ്യമായ ഊര്ജം വളരെ ചുരുങ്ങിയ സമയം കൊണ്ട് ലഭ്യമാവുന്നു. സമുദ്ര നിരപ്പില് നിന്നുള്ള ഉയരം കൂടുന്തോറും മര്ദം കുറയുന്നതിനാല് ജലത്തിന്റെ തിളനില കുറയുന്നു. തത്ഫലമായി പര്വതപ്രദേശങ്ങളില് വച്ച് ഭക്ഷണം പാകം ചെയ്യാന് വേണ്ട സമയം വര്ധിക്കുന്നു.
തിളനില(Tb)യും മര്ദ(P)വും തമ്മിലുള്ള ബന്ധം ക്ലാപിറോണ് സമവാക്യത്തില്നിന്ന് മനസ്സിലാക്കാം.
=
dP എന്ന വളരെ ചെറിയ മര്ദവ്യത്യാസത്തില് തിളനിലയിലുണ്ടാകുന്ന വളരെ ചെറിയ വ്യത്യാസമാണ് d Tb
ΔVv - ദ്രാവകം വാതകമാകുമ്പോള് വ്യാപ്തത്തിലുണ്ടാവുന്ന മാറ്റം.
ΔHv - ബാഷ്പീകരണ പ്രക്രിയയില് ആഗിരണം ചെയ്യപ്പെടുന്ന താപം.
Tb - തിളനില കെല്വിന് സ്കെയിലില്.
മര്ദത്തിനനുസൃതമായി തിളനില കൂടുന്നുവെങ്കിലും തിളനില അനന്തമായി വര്ധിപ്പിക്കുക സാധ്യമല്ല. ക്രാന്തിക താപനില (critical temperature) എന്ന ഒരു നിശ്ചിത താപനിലയ്ക്കു മുകളില് ഒരു പദാര്ഥത്തിന് ദ്രവാവസ്ഥയില് നിലനില്ക്കാനാവില്ല. ജലത്തിന്റെ ക്രാന്തിക താപനില 374ºC ആണ്. ഈ താപനിലയില് ജലത്തെ ദ്രാവകാവസ്ഥയില് നിലനിര്ത്താന് വേണ്ട മര്ദം 217 അറ്റ്മസ്ഫീറാണ്. ഇതിലും ഉയര്ന്ന താപനിലകളില് എത്ര ഉയര്ന്ന മര്ദം പ്രയോഗിച്ചാലും ജലം വാതകമായിരിക്കും. മര്ദം 4.55 റ്റോര് (1atm = 760 torr) ആയി താഴുമ്പോള് ജലം 0ºC-ല് തിളയ്ക്കും.
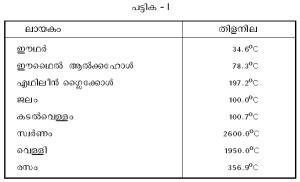
മാലിന്യങ്ങള് മൂലവും തിളനിലയില് മാറ്റം സംഭവിക്കാം. കൂടുതല് ബാഷ്പശീലമുള്ള ഒരു പദാര്ഥം ലയിപ്പിക്കുക വഴി ദ്രാവക ത്തിന്റെ തിളനില കുറയ്ക്കാനും മറിച്ച് ബാഷ്പശീലമില്ലാത്ത പദാര്ഥങ്ങളുപയോഗിച്ച് തിളനില കൂട്ടുവാനും സാധിക്കും. ഒന്നിലധികം ഘടകങ്ങളുള്ള ലായകങ്ങളുടെ തിളനില ഒരു താപമേഖലയില് വ്യാപിച്ചിരിക്കും. വിവിധ ലായകങ്ങളുടെ തിളനില പട്ടിക I-ല് കാണിച്ചിരിക്കുന്നു.
ദ്രാവക തന്മാത്രകളുടെ സ്ഥിതികോര്ജത്തിന്റെ അളവാണ് തിളനില. തന്മാത്രകള് തമ്മില് വളരെ മൃദുവായി മാത്രം ബന്ധിക്കപ്പെട്ടിട്ടുള്ള ദ്രാവകങ്ങളുടെ തിളനില കുറവും ദൃഢമായ അന്തര് തന്മാത്രാ ബന്ധങ്ങളുള്ള ദ്രാവകങ്ങളുടെ തിളനില കൂടുതലുമായിരിക്കും. ഒരു ദ്രാവകത്തില് പരസ്പരം ആകര്ഷിക്കുന്ന ബന്ധങ്ങളുള്ള തന്മാത്രകള് വളരെ അടുത്ത് സ്ഥിതിചെയ്യുന്നു. താപോര്ജം ഉള്ക്കൊണ്ട് തന്മാത്രകളുടെ ഗതികോര്ജം വര്ധിക്കുകയും ക്രമേണ ആകര്ഷണ ശക്തികളെ അതിജീവിച്ച് വാതകാവസ്ഥയിലേക്ക് മാറുകയും ചെയ്യുന്നു. ഒരു ദ്രാവകത്തിനുള്ളില്, വാതകാവസ്ഥയിലേയ്ക്ക് മാറാന് കഴിവുള്ള തന്മാത്രകള് ചെലുത്തുന്ന മര്ദമാണ് സമതുലിത ബാഷ്പമര്ദം. താപനില കൂടുന്നതിനനുസരിച്ച് സമതുലിത ബാഷ്പമര്ദം കൂടുന്നു. കൂടുതല് തന്മാത്രകള് വാതകാവസ്ഥയിലേക്ക് മാറുവാനുള്ള ഊര്ജം കൈവരിക്കുന്നതാണ് ഇതിനു കാരണം.
ദ്രാവകാവസ്ഥയില്നിന്ന് വാതകാവസ്ഥയിലേക്കു മാറുന്നതി നാവശ്യമായ താപോര്ജത്തെ ബാഷ്പീകരണ ലീനതാപം (latent heat of vapourisation) എന്നാണു പറയുന്നത്. കാരണം ദ്രാവകം തിളയ്ക്കുമ്പോള് താപനിലയില് മാറ്റം സംഭവിക്കുന്നില്ല. ദ്രാവകം വാതാകാവസ്ഥയിലെത്തുമ്പോള് തന്മാത്രകള് തമ്മിലുള്ള അകലം കൂടുന്നതിനാല് സ്ഥിതികോര്ജത്തില് വര്ധനയുണ്ടാവുന്നു.
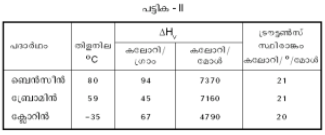
പദാര്ഥത്തിന്റെ ഒരു മോള് (1 mole) അതായത് 6.023 X 1023 തന്മാത്രകള്ക്ക് വാതകാവസ്ഥയിലേക്ക് മാറുന്നതിനാവശ്യമായ താപോര്ജത്തെ മോളാര് ബാഷ്പ ലീനതാപം എന്നു പറയുന്നു. ദ്രാവകം തിളയ്ക്കുമ്പോഴുള്ള ഈ ലീനതാപവും സാമാന്യ തിളനിലയും തമ്മിലുള്ള അനുപാതം 20-21 കലോറി/º/മോള് ആയിരിക്കും എന്ന് ട്രൗട്ടണ്സ് നിയമം (Trouton's rule) പറയുന്നു. (പട്ടിക II)
തിളയുടെ വിവിധ ഘട്ടങ്ങള്. ദ്രാവകം ഉള്ക്കൊള്ളുന്ന പാത്രം ചൂടാക്കുമ്പോള് ചൂടായ പ്രതലത്തില് നിന്നു ദ്രാവകം താപം ആഗിരണം ചെയ്ത് ദ്രാവകത്തിന്റെ മറ്റു ഭാഗങ്ങളിലേക്ക് സംവഹിക്കുന്നു. എന്നാല് ഇതേ സമയംതന്നെ വികിരണം വഴിയും ദ്രാവക പ്രതലത്തില് നിന്നുള്ള ബാഷ്പീകരണം വഴിയും താപോര്ജം നഷ്ടപ്പെടുന്നുമുണ്ട്. ദ്രാവകത്തിന്റെ താപനില വര്ധിച്ച് തിളനിലയിലെത്തുന്നതോടെ താപനില സ്ഥിരമായിരിക്കുകയും അധിക ഊര്ജം വികിരണത്തിലൂടേയും പ്രതല ബാഷ്പീകരണത്തിലൂടേയും വ്യയമാവുകയും ചെയ്യുന്നു. നിവേശിത താപോര്ജം വ്യയം ചെയ്യപ്പെടുന്ന ഊര്ജത്തെ അതിജീവിക്കാന് പര്യാപ്തമാവുമ്പോള് ദ്രാവകം തിളയ്ക്കുന്നു.
അഞ്ച് ഘട്ടങ്ങളുള്ള ഒരു പ്രക്രിയയാണ് തിള. ചൂടാക്കുന്ന പ്രതലത്തിന്റെ താപനില(TH)യും തിളനില(TB)യും തമ്മിലുള്ള വ്യത്യാസ(ΔT)മാണ് ഓരോ ഘട്ടത്തിന്റേയും സവിശേഷത. ബാഹ്യമര്ദം, പാത്രത്തിന്റെ പ്രതലം, പ്രതല വലിവ് (surface tension), ദ്രാവകത്തിന്റെ ശ്യാനത (viscosity) എന്നിവയാണ് ഓരോ ഘട്ടത്തിന്റേയും താപനിലയെ നിയന്ത്രിക്കുന്ന ഘടകങ്ങള്. ആദ്യഘട്ടത്തില്, ചൂടാക്കുന്ന പ്രതലത്തില്നിന്നു ലഭിക്കുന്ന താപം ദ്രാവകത്തിനുള്ളില് കുമിളകളുണ്ടാകാന് പര്യാപ്തമല്ല. സംവഹനം വഴി താപം നഷ്ടമാകുന്നു. രണ്ടാം ഘട്ടമാകുമ്പോള് ചൂടാക്കുന്ന പ്രതലവുമായി തൊട്ടിരിക്കുന്ന ദ്രാവകത്തില് വളരെ ചെറിയ കുമിളകള് രൂപീകൃതമാകുമെങ്കിലും അവ വളരുകയോ വാതകാവസ്ഥയെ പ്രാപിക്കുകയോ ചെയ്യുന്നതിനു മുമ്പുതന്നെ പൊട്ടിപ്പോകുന്നു. മൂന്നാം ഘട്ടത്തിലാകട്ടെ കുമിളകള് മുകളിലേക്കുയരുകയും വലുപ്പം വയ്ക്കുകയും ചെയ്യുന്നു. ചൂടാവുന്ന പ്രതലത്തിനോടു ചേര്ന്ന് വാതകത്തിന്റെ ഒരു പാടയുണ്ടാവുന്നതാണ് നാലാം ഘട്ടം. ഈ പാട ഇടയ്ക്കിടെ പ്രതലത്തില്നിന്ന് വേര്പെടുകയോ പൊട്ടുകയോ ചെയ്യുന്നു. ഈ പാടയിലൂടെയുള്ള താപചാലനം നേരിട്ട് പ്രതലത്തില് നിന്നുള്ളതിനേക്കാള് കുറവായതിനാല് പാട പൊട്ടുന്ന സന്ദര്ഭങ്ങളിലൊഴിച്ച് തിളയുടെ തോത് കുറയുന്നു. എന്നാല് പാട പൊട്ടുമ്പോഴാകട്ടെ ദ്രാവകത്തിലേക്ക്
പൊടുന്നനെ ഊര്ജം കൈമാറ്റം ചെയ്യപ്പെടുകയും വലിയ കുമിളകളുണ്ടായി പാത്രത്തില് നിന്ന് ദ്രാവകം തെറിച്ചു പോവുകയും ചെയ്യുന്നു. പ്രതലം വളരെ മിനുസമുള്ളതായിരിക്കുമ്പോഴും മറ്റു ഖര പദാര്ഥങ്ങളൊന്നുമില്ലെങ്കിലുമാണ് ഇത്തരത്തിലുള്ള പാട ഉണ്ടാകാനും വെള്ളം തെറിച്ചു പോകാനും കൂടുതല് സാധ്യത. നല്ലവണ്ണം ഇളക്കുക വഴി ദ്രാവകം തെറിക്കുന്നതൊഴിവാക്കാനാകും. അഞ്ചാം ഘട്ടത്തില്, ചൂടാകുന്ന പ്രതലത്തോടു ചേര്ന്ന് ബാഷ്പത്തിന്റെ സ്ഥിരതയുള്ള ഒരു പാടയുണ്ടാവുകയും ദ്രാവകത്തിലേക്ക് വികിരണം വഴി താപം കൈമാറ്റം ചെയ്യപ്പെടുകയും ചെയ്യുന്നു. ചൂടുള്ള ലോഹങ്ങള് താപാനുശീതനത്തിനായി ദ്രാവകത്തിലേക്ക് നിക്ഷേപിക്കുന്നതുപോലെയുള്ള സന്ദര്ഭങ്ങ
ളില് മാത്രമാണ് വികിരണം മൂലമുള്ള തിളയുണ്ടാകുന്നത്. വെള്ളവും മറ്റു സാധാരണ ദ്രാവകങ്ങളും തിളയ്ക്കുമ്പോള് ആദ്യത്തെ മൂന്ന് ഘട്ടങ്ങളും കാണാനാകും. എന്നാല് നാലും അഞ്ചും ഘട്ടങ്ങള് വളരെ സവിശേഷ സാഹചര്യങ്ങളില് മാത്രമേ കണ്ടുവരുന്നുള്ളൂ.