This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ചാല്ക്കോജനുകള്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
(പുതിയ താള്: ==ചാല്ക്കോജനുകള്== ആവര്ത്തനപ്പട്ടികയില് VI A ഗ്രൂപ്പില് റ...) |
(→ചാല്ക്കോജനുകള്) |
||
| വരി 8: | വരി 8: | ||
പ്രബല അമ്ലങ്ങളുമായി പ്രതിപ്രവര്ത്തിച്ച് ലവണം ഉണ്ടാകുന്നതുമാത്രമാണ് സെലീനിയത്തിന്റെയും ടെലൂറിയത്തിന്റെയും ഏകലോഹസ്വഭാവം. പക്ഷേ, ഈ ലവണങ്ങളും അത്ര സ്ഥായിയല്ല. ഓക്സിജന് മറ്റ് ചാല്ക്കോജനുകളില്നിന്ന് വിഭിന്നമാണ്; മറ്റ് അംഗങ്ങള് ഖരാവസ്ഥയിലിരിക്കെ ഓക്സിജന് മാത്രം വാതകരൂപത്തില് കാണപ്പെടുന്നു. ഓക്സിജന് എല്ലായ്പ്പോഴും ഡയാറ്റോമിക് (diatomic) ആണ്. ഇക്കാരണത്താല് ഓക്സിജന് യൗഗികങ്ങളുടെയും മറ്റ് ചാല്ക്കോജന് യൗഗികങ്ങളുടെയും ഗുണധര്മങ്ങള് തമ്മില് വ്യത്യാസം കാണുന്നു. സള്ഫര്, സെലീനിയം, ടെലൂറിയം എന്നീ ചാല്ക്കോജനുകളുടെ ഏറ്റവും കൂടിയ സംയോജകത 6 ആണ്. എന്നാല് ഓക്സിജന്റെ കൂടിയ അയോണീകരണ പൊട്ടെന്ഷ്യല്(അയണന വിഭവം)മൂലം ബാഹ്യകവചത്തിലെ ഇലക്ട്രോണുകള്പോലും അണുകേന്ദ്രത്തോട് പ്രതിബദ്ധമാണ്. ഇതിനാല് ഓക്സിജനില്നിന്ന് ഇലക്ട്രോണ് അപാകര്ഷണം ചെയ്യാന് മറ്റൊരു മൂലകത്തിനും കഴിയില്ല. അതിനാല് എല്ലാ അയോണിക യൗഗികങ്ങളിലും ഓക്സിജന് ഋണാങ്കം ആണ്. ഓക്സിജന്, ഫ്ളൂറിന് എന്നീ ഉയര്ന്ന വിദ്യുത്ഋണതയുള്ള മൂലകങ്ങളുമായി സംയോജിക്കുമ്പോള് സള്ഫറിന്റെ സംയോജകത 6 ആണ്. സെലീനിയവും ടെലൂറിയവും, ഫ്ളൂറിനുമായി സംയോജിക്കുമ്പോള് ഷഡ്സംയോജകത പ്രദര്ശിപ്പിക്കുന്നു. എന്നാല് ഓക്സിജനുമായി പ്രതിപ്രവര്ത്തിക്കുമ്പോള് സംയോജകത 4 ആണ്. ഓക്സിജന് ഒഴികെയുള്ള മറ്റ് ചാല്ക്കോജനുകള് തമ്മില് വ്യക്തമായ സാദൃശ്യമുണ്ട്. ഉയര്ന്ന വിദ്യുത്ഋണതയും അപരരൂപതയും ചാല്ക്കോജനുകളുടെ പ്രത്യേക സ്വഭാവമാണ്. ചാല്ക്കോജനുകളുടെ മുഖ്യഗുണധര്മങ്ങള് ഇപ്രകാരമാണ്. | പ്രബല അമ്ലങ്ങളുമായി പ്രതിപ്രവര്ത്തിച്ച് ലവണം ഉണ്ടാകുന്നതുമാത്രമാണ് സെലീനിയത്തിന്റെയും ടെലൂറിയത്തിന്റെയും ഏകലോഹസ്വഭാവം. പക്ഷേ, ഈ ലവണങ്ങളും അത്ര സ്ഥായിയല്ല. ഓക്സിജന് മറ്റ് ചാല്ക്കോജനുകളില്നിന്ന് വിഭിന്നമാണ്; മറ്റ് അംഗങ്ങള് ഖരാവസ്ഥയിലിരിക്കെ ഓക്സിജന് മാത്രം വാതകരൂപത്തില് കാണപ്പെടുന്നു. ഓക്സിജന് എല്ലായ്പ്പോഴും ഡയാറ്റോമിക് (diatomic) ആണ്. ഇക്കാരണത്താല് ഓക്സിജന് യൗഗികങ്ങളുടെയും മറ്റ് ചാല്ക്കോജന് യൗഗികങ്ങളുടെയും ഗുണധര്മങ്ങള് തമ്മില് വ്യത്യാസം കാണുന്നു. സള്ഫര്, സെലീനിയം, ടെലൂറിയം എന്നീ ചാല്ക്കോജനുകളുടെ ഏറ്റവും കൂടിയ സംയോജകത 6 ആണ്. എന്നാല് ഓക്സിജന്റെ കൂടിയ അയോണീകരണ പൊട്ടെന്ഷ്യല്(അയണന വിഭവം)മൂലം ബാഹ്യകവചത്തിലെ ഇലക്ട്രോണുകള്പോലും അണുകേന്ദ്രത്തോട് പ്രതിബദ്ധമാണ്. ഇതിനാല് ഓക്സിജനില്നിന്ന് ഇലക്ട്രോണ് അപാകര്ഷണം ചെയ്യാന് മറ്റൊരു മൂലകത്തിനും കഴിയില്ല. അതിനാല് എല്ലാ അയോണിക യൗഗികങ്ങളിലും ഓക്സിജന് ഋണാങ്കം ആണ്. ഓക്സിജന്, ഫ്ളൂറിന് എന്നീ ഉയര്ന്ന വിദ്യുത്ഋണതയുള്ള മൂലകങ്ങളുമായി സംയോജിക്കുമ്പോള് സള്ഫറിന്റെ സംയോജകത 6 ആണ്. സെലീനിയവും ടെലൂറിയവും, ഫ്ളൂറിനുമായി സംയോജിക്കുമ്പോള് ഷഡ്സംയോജകത പ്രദര്ശിപ്പിക്കുന്നു. എന്നാല് ഓക്സിജനുമായി പ്രതിപ്രവര്ത്തിക്കുമ്പോള് സംയോജകത 4 ആണ്. ഓക്സിജന് ഒഴികെയുള്ള മറ്റ് ചാല്ക്കോജനുകള് തമ്മില് വ്യക്തമായ സാദൃശ്യമുണ്ട്. ഉയര്ന്ന വിദ്യുത്ഋണതയും അപരരൂപതയും ചാല്ക്കോജനുകളുടെ പ്രത്യേക സ്വഭാവമാണ്. ചാല്ക്കോജനുകളുടെ മുഖ്യഗുണധര്മങ്ങള് ഇപ്രകാരമാണ്. | ||
| + | |||
| + | [[ചിത്രം:Pg830 scree.png]] | ||
| - | ചാല്ക്കോജന് സംയുക്തങ്ങള്. വിദ്യുത്ധന മൂലകങ്ങളുമായി സംയോജിച്ചുണ്ടാകുന്ന സംയുക്തങ്ങളെ ചാല്ക്കോജനൈഡുകള് എന്നുപറയുന്നു. ഇവയ്ക്ക് പ്രത്യേക ക്രിസ്റ്റല് ഘടനയാണ്. M"x" എന്ന പൊതുഫോര്മുലയുള്ള ചാല്ക്കോജനൈഡുകളുടെ ക്രിസ്റ്റല് ഘടന, അതിന് സമാന്തരമായ ഹാലൈഡുകള്ക്ക് (M' x') സമാനമാണ്. | + | '''ചാല്ക്കോജന് സംയുക്തങ്ങള്.''' വിദ്യുത്ധന മൂലകങ്ങളുമായി സംയോജിച്ചുണ്ടാകുന്ന സംയുക്തങ്ങളെ ചാല്ക്കോജനൈഡുകള് എന്നുപറയുന്നു. ഇവയ്ക്ക് പ്രത്യേക ക്രിസ്റ്റല് ഘടനയാണ്. M"x" എന്ന പൊതുഫോര്മുലയുള്ള ചാല്ക്കോജനൈഡുകളുടെ ക്രിസ്റ്റല് ഘടന, അതിന് സമാന്തരമായ ഹാലൈഡുകള്ക്ക് (M' x') സമാനമാണ്. |
| - | 1. ഹൈഡ്രെഡുകള് (H<sub>2</sub>R). ഓക്സിജന്റെ ഹൈഡ്രൈഡായ H<sub>2</sub> (ജലം) ഒഴിച്ച് മറ്റ് മൂന്ന് ഹൈഡ്രൈഡുകളും വാതകരൂപത്തിലാണ്. H<sup>2</sup>O ഗന്ധഹീനവും, നിഷ്ക്രിയവുമായ ഒരു ദ്രവമാണ്. മറ്റു മൂന്ന് ഹൈഡ്രൈഡുകളും ദുര്ഗന്ധമുള്ളതും അല്പാമ്ലതയുള്ളതുമായ വാതകങ്ങളാണ്. തന്മാത്രാഭാരം വര്ധിക്കുന്തോറും ഈ ഹൈഡ്രെഡുകളുടെ സ്ഥിരതയും രൂപീകരണ ഊഷ്മാവും (heat of formation) കുറയുന്നു. | + | '''1. ഹൈഡ്രെഡുകള്''' (H<sub>2</sub>R). ഓക്സിജന്റെ ഹൈഡ്രൈഡായ H<sub>2</sub> (ജലം) ഒഴിച്ച് മറ്റ് മൂന്ന് ഹൈഡ്രൈഡുകളും വാതകരൂപത്തിലാണ്. H<sup>2</sup>O ഗന്ധഹീനവും, നിഷ്ക്രിയവുമായ ഒരു ദ്രവമാണ്. മറ്റു മൂന്ന് ഹൈഡ്രൈഡുകളും ദുര്ഗന്ധമുള്ളതും അല്പാമ്ലതയുള്ളതുമായ വാതകങ്ങളാണ്. തന്മാത്രാഭാരം വര്ധിക്കുന്തോറും ഈ ഹൈഡ്രെഡുകളുടെ സ്ഥിരതയും രൂപീകരണ ഊഷ്മാവും (heat of formation) കുറയുന്നു. |
| - | 2. ഓക്സൈഡുകള് (RO<sub>2</sub>). ഓസോണിനെ (O.O<sub>2</sub>) ഓക്സിജന്റെ ഓക്സൈഡായി കണക്കാക്കാം. സള്ഫര്, സെലീനിയം, ടെലൂറിയം ഇവയുടെ ഓക്സൈഡുകള് അമ്ലസ്വഭാവം ഉള്ളവയാണ്. അമ്ലതയും സ്ഥിരതയും താന്മാത്രാഭാരം വര്ധിക്കുന്തോറും കുറയുന്നതായി കാണാം. | + | '''2. ഓക്സൈഡുകള്''' (RO<sub>2</sub>). ഓസോണിനെ (O.O<sub>2</sub>) ഓക്സിജന്റെ ഓക്സൈഡായി കണക്കാക്കാം. സള്ഫര്, സെലീനിയം, ടെലൂറിയം ഇവയുടെ ഓക്സൈഡുകള് അമ്ലസ്വഭാവം ഉള്ളവയാണ്. അമ്ലതയും സ്ഥിരതയും താന്മാത്രാഭാരം വര്ധിക്കുന്തോറും കുറയുന്നതായി കാണാം. |
| - | 3. ഓക്സി അമ്ലങ്ങള്. സള്ഫര്, സെലീനിയം, ടെലൂറിയം ഇവ സമാനമായ ഓക്സിഅമ്ലങ്ങളും ലവണങ്ങളും ഉണ്ടാക്കുന്നു. | + | '''3. ഓക്സി അമ്ലങ്ങള്.''' സള്ഫര്, സെലീനിയം, ടെലൂറിയം ഇവ സമാനമായ ഓക്സിഅമ്ലങ്ങളും ലവണങ്ങളും ഉണ്ടാക്കുന്നു. |
| + | |||
| + | [[ചിത്രം:Pg 830 scree05.png]] | ||
സള്ഫേറ്റിനും, സെലിനേറ്റിനും ഒരേ അളവിലാണ് ക്രിസ്റ്റലന ജലമുള്ളത്. ഇവയുടെ ഇരട്ട ലവണങ്ങളും, പടിക്കാരങ്ങളും സമരൂപികളാണ്. | സള്ഫേറ്റിനും, സെലിനേറ്റിനും ഒരേ അളവിലാണ് ക്രിസ്റ്റലന ജലമുള്ളത്. ഇവയുടെ ഇരട്ട ലവണങ്ങളും, പടിക്കാരങ്ങളും സമരൂപികളാണ്. | ||
ആധുനിക സാങ്കേതികയുഗത്തിന്റെ ആരംഭത്തോടുകൂടി ചാല്ക്കോജനുകളുടെ വ്യാവസായിക ഉപഭോഗത്തിന് പ്രാധാന്യമേറി. മുഖ്യമായും ഉയര്ന്നതരം പോളിമറുകള്, പ്രകാശവൈദ്യുത ഉപകരണങ്ങള് എന്നിവയുടെ നിര്മാണത്തിന് ഇവ ധാരാളമായി ഉപയോഗിക്കുന്നു. കൂടാതെ ഔഷധങ്ങള്, ചായങ്ങള്, വെടിമരുന്ന് എന്നിവയുടെ വ്യാവസായികോത്പാദനത്തിലും ചാല്ക്കോജനുകള് ഉപയോഗിക്കപ്പെടുന്നു. | ആധുനിക സാങ്കേതികയുഗത്തിന്റെ ആരംഭത്തോടുകൂടി ചാല്ക്കോജനുകളുടെ വ്യാവസായിക ഉപഭോഗത്തിന് പ്രാധാന്യമേറി. മുഖ്യമായും ഉയര്ന്നതരം പോളിമറുകള്, പ്രകാശവൈദ്യുത ഉപകരണങ്ങള് എന്നിവയുടെ നിര്മാണത്തിന് ഇവ ധാരാളമായി ഉപയോഗിക്കുന്നു. കൂടാതെ ഔഷധങ്ങള്, ചായങ്ങള്, വെടിമരുന്ന് എന്നിവയുടെ വ്യാവസായികോത്പാദനത്തിലും ചാല്ക്കോജനുകള് ഉപയോഗിക്കപ്പെടുന്നു. | ||
Current revision as of 17:28, 20 ജനുവരി 2016
ചാല്ക്കോജനുകള്
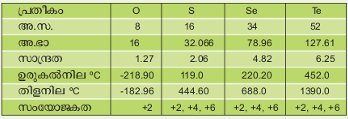
ആവര്ത്തനപ്പട്ടികയില് VI A ഗ്രൂപ്പില് റേഡിയോ ആക്റ്റീവ് മൂലകമായ പൊളോണിയം (Po) ഒഴികെയുള്ള ഓക്സിജന് (O), സള്ഫര് (S), സെലീനിയം (Se), ടെലൂറിയം (Te) എന്നീ നാലു മൂലകങ്ങള്ക്കുള്ള പൊതുനാമം.
ചാല്ക്കോസ് (ചെമ്പ്), ജെന് (ജനിപ്പിക്കുന്ന) എന്നീ ഗ്രീക്കുപദങ്ങളില്നിന്നാണ് ചാല്ക്കോജന് എന്ന പദം നിഷ്പന്നമായിട്ടുള്ളത്. ചെമ്പിന്റെ അയിരുകള് സാധാരണയായി സള്ഫൈഡ്, ഓക്സൈഡ് എന്നിവയായിട്ടാണ് കാണപ്പെടുന്നത്. ഉദാ. ചാല്ക്കോസൈറ്റ് Cu2S, കോവിലൈറ്റ് CuS, കുപ്രൈറ്റ് Cu2O. ഈ അയിരുകളില് സെലീനിയത്തിന്റെയും ടെലൂറിയത്തിന്റെയും ചെറിയൊരംശം അടങ്ങിയിരിക്കുന്നു. ഇക്കാരണത്താലാണ് ഈ നാല് മൂലകങ്ങളെ ചാല്ക്കോജനുകള് എന്നു പറയുന്നത്.
ചാല്ക്കോജനുകളില് പ്രഥമ സ്ഥാനത്ത് നില്ക്കുന്നത് ഓക്സിജനാണ്. ഓക്സിജനും സള്ഫറും അലോഹങ്ങളാണ്. സെലീനിയവും ടെലൂറിയവും ലോഹങ്ങള്ക്കും അലോഹങ്ങള്ക്കും ഇടയ്ക്ക് സ്ഥിതിചെയ്യുന്നു. സെലീനിയം മൂലകാവസ്ഥയില് ലോഹമായും, അലോഹമായും സ്ഥിതിചെയ്യുന്നു. എന്നാല് ടെലൂറിയം ഒരു ലോഹമൂലകമാണ്. രാസപ്രവര്ത്തനങ്ങളില് ഏര്പ്പെടുമ്പോള് ഇവ രണ്ടും അലോഹസ്വഭാവം മാത്രമേ കാണിക്കുന്നുള്ളൂ.
പ്രബല അമ്ലങ്ങളുമായി പ്രതിപ്രവര്ത്തിച്ച് ലവണം ഉണ്ടാകുന്നതുമാത്രമാണ് സെലീനിയത്തിന്റെയും ടെലൂറിയത്തിന്റെയും ഏകലോഹസ്വഭാവം. പക്ഷേ, ഈ ലവണങ്ങളും അത്ര സ്ഥായിയല്ല. ഓക്സിജന് മറ്റ് ചാല്ക്കോജനുകളില്നിന്ന് വിഭിന്നമാണ്; മറ്റ് അംഗങ്ങള് ഖരാവസ്ഥയിലിരിക്കെ ഓക്സിജന് മാത്രം വാതകരൂപത്തില് കാണപ്പെടുന്നു. ഓക്സിജന് എല്ലായ്പ്പോഴും ഡയാറ്റോമിക് (diatomic) ആണ്. ഇക്കാരണത്താല് ഓക്സിജന് യൗഗികങ്ങളുടെയും മറ്റ് ചാല്ക്കോജന് യൗഗികങ്ങളുടെയും ഗുണധര്മങ്ങള് തമ്മില് വ്യത്യാസം കാണുന്നു. സള്ഫര്, സെലീനിയം, ടെലൂറിയം എന്നീ ചാല്ക്കോജനുകളുടെ ഏറ്റവും കൂടിയ സംയോജകത 6 ആണ്. എന്നാല് ഓക്സിജന്റെ കൂടിയ അയോണീകരണ പൊട്ടെന്ഷ്യല്(അയണന വിഭവം)മൂലം ബാഹ്യകവചത്തിലെ ഇലക്ട്രോണുകള്പോലും അണുകേന്ദ്രത്തോട് പ്രതിബദ്ധമാണ്. ഇതിനാല് ഓക്സിജനില്നിന്ന് ഇലക്ട്രോണ് അപാകര്ഷണം ചെയ്യാന് മറ്റൊരു മൂലകത്തിനും കഴിയില്ല. അതിനാല് എല്ലാ അയോണിക യൗഗികങ്ങളിലും ഓക്സിജന് ഋണാങ്കം ആണ്. ഓക്സിജന്, ഫ്ളൂറിന് എന്നീ ഉയര്ന്ന വിദ്യുത്ഋണതയുള്ള മൂലകങ്ങളുമായി സംയോജിക്കുമ്പോള് സള്ഫറിന്റെ സംയോജകത 6 ആണ്. സെലീനിയവും ടെലൂറിയവും, ഫ്ളൂറിനുമായി സംയോജിക്കുമ്പോള് ഷഡ്സംയോജകത പ്രദര്ശിപ്പിക്കുന്നു. എന്നാല് ഓക്സിജനുമായി പ്രതിപ്രവര്ത്തിക്കുമ്പോള് സംയോജകത 4 ആണ്. ഓക്സിജന് ഒഴികെയുള്ള മറ്റ് ചാല്ക്കോജനുകള് തമ്മില് വ്യക്തമായ സാദൃശ്യമുണ്ട്. ഉയര്ന്ന വിദ്യുത്ഋണതയും അപരരൂപതയും ചാല്ക്കോജനുകളുടെ പ്രത്യേക സ്വഭാവമാണ്. ചാല്ക്കോജനുകളുടെ മുഖ്യഗുണധര്മങ്ങള് ഇപ്രകാരമാണ്.
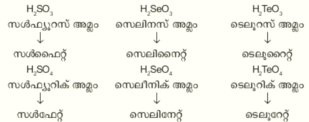
ചാല്ക്കോജന് സംയുക്തങ്ങള്. വിദ്യുത്ധന മൂലകങ്ങളുമായി സംയോജിച്ചുണ്ടാകുന്ന സംയുക്തങ്ങളെ ചാല്ക്കോജനൈഡുകള് എന്നുപറയുന്നു. ഇവയ്ക്ക് പ്രത്യേക ക്രിസ്റ്റല് ഘടനയാണ്. M"x" എന്ന പൊതുഫോര്മുലയുള്ള ചാല്ക്കോജനൈഡുകളുടെ ക്രിസ്റ്റല് ഘടന, അതിന് സമാന്തരമായ ഹാലൈഡുകള്ക്ക് (M' x') സമാനമാണ്.
1. ഹൈഡ്രെഡുകള് (H2R). ഓക്സിജന്റെ ഹൈഡ്രൈഡായ H2 (ജലം) ഒഴിച്ച് മറ്റ് മൂന്ന് ഹൈഡ്രൈഡുകളും വാതകരൂപത്തിലാണ്. H2O ഗന്ധഹീനവും, നിഷ്ക്രിയവുമായ ഒരു ദ്രവമാണ്. മറ്റു മൂന്ന് ഹൈഡ്രൈഡുകളും ദുര്ഗന്ധമുള്ളതും അല്പാമ്ലതയുള്ളതുമായ വാതകങ്ങളാണ്. തന്മാത്രാഭാരം വര്ധിക്കുന്തോറും ഈ ഹൈഡ്രെഡുകളുടെ സ്ഥിരതയും രൂപീകരണ ഊഷ്മാവും (heat of formation) കുറയുന്നു.
2. ഓക്സൈഡുകള് (RO2). ഓസോണിനെ (O.O2) ഓക്സിജന്റെ ഓക്സൈഡായി കണക്കാക്കാം. സള്ഫര്, സെലീനിയം, ടെലൂറിയം ഇവയുടെ ഓക്സൈഡുകള് അമ്ലസ്വഭാവം ഉള്ളവയാണ്. അമ്ലതയും സ്ഥിരതയും താന്മാത്രാഭാരം വര്ധിക്കുന്തോറും കുറയുന്നതായി കാണാം.
3. ഓക്സി അമ്ലങ്ങള്. സള്ഫര്, സെലീനിയം, ടെലൂറിയം ഇവ സമാനമായ ഓക്സിഅമ്ലങ്ങളും ലവണങ്ങളും ഉണ്ടാക്കുന്നു.
സള്ഫേറ്റിനും, സെലിനേറ്റിനും ഒരേ അളവിലാണ് ക്രിസ്റ്റലന ജലമുള്ളത്. ഇവയുടെ ഇരട്ട ലവണങ്ങളും, പടിക്കാരങ്ങളും സമരൂപികളാണ്.
ആധുനിക സാങ്കേതികയുഗത്തിന്റെ ആരംഭത്തോടുകൂടി ചാല്ക്കോജനുകളുടെ വ്യാവസായിക ഉപഭോഗത്തിന് പ്രാധാന്യമേറി. മുഖ്യമായും ഉയര്ന്നതരം പോളിമറുകള്, പ്രകാശവൈദ്യുത ഉപകരണങ്ങള് എന്നിവയുടെ നിര്മാണത്തിന് ഇവ ധാരാളമായി ഉപയോഗിക്കുന്നു. കൂടാതെ ഔഷധങ്ങള്, ചായങ്ങള്, വെടിമരുന്ന് എന്നിവയുടെ വ്യാവസായികോത്പാദനത്തിലും ചാല്ക്കോജനുകള് ഉപയോഗിക്കപ്പെടുന്നു.