This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
കാര്ബോണിയം അയോണ്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
Mksol (സംവാദം | സംഭാവനകള്) (പുതിയ താള്: == കാര്ബോണിയം അയോണ് == == Carbonium Ion == പോസിറ്റീവ് ചാര്ജ് വഹിക്കുന...) |
Mksol (സംവാദം | സംഭാവനകള്) (→Carbonium Ion) |
||
| വരി 3: | വരി 3: | ||
പോസിറ്റീവ് ചാര്ജ് വഹിക്കുന്ന കാര്ബണ് അയോണ്. ഇലക്ട്രാ നെഗറ്റീവത കൂടിയ ഒരു ആറ്റമോ ഗ്രൂപ്പോ കാര്ബണുമായി രൂപീകരിക്കുന്ന ബന്ധനം ഹെറ്ററോളിറ്റികമായി വിഛേദിക്കപ്പെടുമ്പോള് പ്രസ്തുത ആറ്റം / ഗ്രൂപ്പ് ബന്ധന ഇലക്ട്രാണ് ജോടിയെ സ്വന്തമാക്കുന്നതിനാല് കാര്ബണ് ഒരു ഇലക്ട്രാണ് നഷ്ടപ്പെട്ട് പോസിറ്റീവ് ചാര്ജുള്ള അയോണായി മാറുന്നു. ഇപ്രകാരം രൂപീകരിക്കപ്പെടുന്ന കാറ്റയോണിക സ്പീഷീസിനെ കാര്ബോണിയം അയോണ് എന്നു പറയുന്നു (ഇപ്പോള് കാര്ബോ കാറ്റയോണ് എന്നറിയപ്പെടുന്നു). | പോസിറ്റീവ് ചാര്ജ് വഹിക്കുന്ന കാര്ബണ് അയോണ്. ഇലക്ട്രാ നെഗറ്റീവത കൂടിയ ഒരു ആറ്റമോ ഗ്രൂപ്പോ കാര്ബണുമായി രൂപീകരിക്കുന്ന ബന്ധനം ഹെറ്ററോളിറ്റികമായി വിഛേദിക്കപ്പെടുമ്പോള് പ്രസ്തുത ആറ്റം / ഗ്രൂപ്പ് ബന്ധന ഇലക്ട്രാണ് ജോടിയെ സ്വന്തമാക്കുന്നതിനാല് കാര്ബണ് ഒരു ഇലക്ട്രാണ് നഷ്ടപ്പെട്ട് പോസിറ്റീവ് ചാര്ജുള്ള അയോണായി മാറുന്നു. ഇപ്രകാരം രൂപീകരിക്കപ്പെടുന്ന കാറ്റയോണിക സ്പീഷീസിനെ കാര്ബോണിയം അയോണ് എന്നു പറയുന്നു (ഇപ്പോള് കാര്ബോ കാറ്റയോണ് എന്നറിയപ്പെടുന്നു). | ||
| - | + | ||
| - | + | ||
| - | + | [[ചിത്രം:Vol7_323_formula1.jpg|300px]] | |
| - | + | ||
| - | + | ||
| - | + | ||
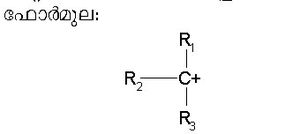
R1, R2, R3 എന്നിവ ഏകസംയോജക ആറ്റങ്ങളോ ഗ്രൂപ്പുകളോ ആണ്. പോസിറ്റീവ് ചാര്ജ് വഹിക്കുന്ന കാര്ബണ് ആറ്റത്തെ അടിസ്ഥാനമാക്കി കാര്ബോണിയം അയോണുകളെ പ്രമറി (1º), സെക്കന്ഡറി (2º), ടെര്ഷ്യറി (3º) എന്നിങ്ങനെ മൂന്നായി തിരിക്കാം. | R1, R2, R3 എന്നിവ ഏകസംയോജക ആറ്റങ്ങളോ ഗ്രൂപ്പുകളോ ആണ്. പോസിറ്റീവ് ചാര്ജ് വഹിക്കുന്ന കാര്ബണ് ആറ്റത്തെ അടിസ്ഥാനമാക്കി കാര്ബോണിയം അയോണുകളെ പ്രമറി (1º), സെക്കന്ഡറി (2º), ടെര്ഷ്യറി (3º) എന്നിങ്ങനെ മൂന്നായി തിരിക്കാം. | ||
| - | + | ||
| - | + | [[ചിത്രം:Vol7_323_formula2.jpg|300px]] | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
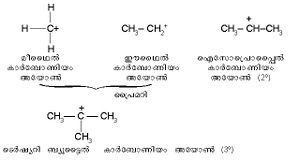
ഇത്തരം അയോണുകള് കാര്ബണിക സംയുക്തങ്ങളുടെ പ്രതിപ്രവര്ത്തനങ്ങളില് മാധ്യസ്പീഷീസുകളാണെന്ന് തെളിയിക്കപ്പെട്ടിട്ടുണ്ട്. ന്യൂക്ലിയോ ഫിലികപ്രതിസ്ഥാപനങ്ങളുടെ ക്രിയാവിധി വ്യാഖ്യാനിക്കുന്നതിന് ഇത്തരം കാര്ബോണിയം അയോണുകളുടെ അസ്തിത്വം ആവശ്യമായിവരുന്നു. ഇലക്ട്രാണ്ദാരിദ്യ്രം ഉള്ളവയാകയാല് കാര്ബോണിയം അയോണുകള് പ്രബലമായ ഇലക്ട്രാഫിലികത പ്രദര്ശിപ്പിക്കുന്നുണ്ട്. തന്മൂലം ഇവ ഉള്പ്പെടുന്ന പ്രതിപ്രവര്ത്തനങ്ങള് അമ്ലങ്ങളാല് ഉത്പ്രരിതമായിരിക്കും. | ഇത്തരം അയോണുകള് കാര്ബണിക സംയുക്തങ്ങളുടെ പ്രതിപ്രവര്ത്തനങ്ങളില് മാധ്യസ്പീഷീസുകളാണെന്ന് തെളിയിക്കപ്പെട്ടിട്ടുണ്ട്. ന്യൂക്ലിയോ ഫിലികപ്രതിസ്ഥാപനങ്ങളുടെ ക്രിയാവിധി വ്യാഖ്യാനിക്കുന്നതിന് ഇത്തരം കാര്ബോണിയം അയോണുകളുടെ അസ്തിത്വം ആവശ്യമായിവരുന്നു. ഇലക്ട്രാണ്ദാരിദ്യ്രം ഉള്ളവയാകയാല് കാര്ബോണിയം അയോണുകള് പ്രബലമായ ഇലക്ട്രാഫിലികത പ്രദര്ശിപ്പിക്കുന്നുണ്ട്. തന്മൂലം ഇവ ഉള്പ്പെടുന്ന പ്രതിപ്രവര്ത്തനങ്ങള് അമ്ലങ്ങളാല് ഉത്പ്രരിതമായിരിക്കും. | ||
കാര്ബണ് അണുവിലെ ചാര്ജ് കേന്ദ്രീകരണം അസ്ഥിരതയുണ്ടാക്കുന്നതുകൊണ്ട് ചാര്ജ് വിസ്ഥാനീകരണ (charge spreading) സാധ്യതയുണ്ടെങ്കിലേ കാര്ബോണിയം അയോണുകള്ക്ക് അസ്തിത്വം ലഭിക്കുകയുള്ളൂ. ചാര്ജ്വിസ്ഥാനീകരണത്തിന്റെ വര്ധനവിനനുസരിച്ച് സ്ഥിരതയും വര്ധിക്കുന്നു. ഇന്ഡക്റ്റീവ് പ്രഭാവവും (+I effect) സംരചനാധിഷ്ഠിതമായ മറ്റു ചില കാരണങ്ങളും(ഉദാ. അനുനാദം)കൊണ്ട് ഈ അയോണുകള്ക്ക് സ്ഥിരത കിട്ടുന്നു. കേന്ദ്രകാര്ബണിനു ചുറ്റുമുള്ള ആല്ക്കൈല് ഗ്രൂപ്പുകളുടെ എണ്ണം കൂടുന്തോറും കാര്ബോണിയം അയോണിന്റെ സ്ഥിരത കൂടുന്നു. | കാര്ബണ് അണുവിലെ ചാര്ജ് കേന്ദ്രീകരണം അസ്ഥിരതയുണ്ടാക്കുന്നതുകൊണ്ട് ചാര്ജ് വിസ്ഥാനീകരണ (charge spreading) സാധ്യതയുണ്ടെങ്കിലേ കാര്ബോണിയം അയോണുകള്ക്ക് അസ്തിത്വം ലഭിക്കുകയുള്ളൂ. ചാര്ജ്വിസ്ഥാനീകരണത്തിന്റെ വര്ധനവിനനുസരിച്ച് സ്ഥിരതയും വര്ധിക്കുന്നു. ഇന്ഡക്റ്റീവ് പ്രഭാവവും (+I effect) സംരചനാധിഷ്ഠിതമായ മറ്റു ചില കാരണങ്ങളും(ഉദാ. അനുനാദം)കൊണ്ട് ഈ അയോണുകള്ക്ക് സ്ഥിരത കിട്ടുന്നു. കേന്ദ്രകാര്ബണിനു ചുറ്റുമുള്ള ആല്ക്കൈല് ഗ്രൂപ്പുകളുടെ എണ്ണം കൂടുന്തോറും കാര്ബോണിയം അയോണിന്റെ സ്ഥിരത കൂടുന്നു. | ||
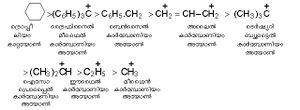
ചില കാര്ബാനയോണുകളുടെ സ്ഥിരതാക്രമം താഴെപറയും പ്രകാരമാണ്. | ചില കാര്ബാനയോണുകളുടെ സ്ഥിരതാക്രമം താഴെപറയും പ്രകാരമാണ്. | ||
| + | |||
| + | |||
| + | [[ചിത്രം:Vol7_323_formula3.jpg|300px]] | ||
ഇവയെ സാമാന്യവത്കരിച്ചാല് ടെര്ഷ്യറി > സെക്കണ്ടറി > പ്രമറി, കാര്ബോണിയം അയോണ്. | ഇവയെ സാമാന്യവത്കരിച്ചാല് ടെര്ഷ്യറി > സെക്കണ്ടറി > പ്രമറി, കാര്ബോണിയം അയോണ്. | ||
| വരി 26: | വരി 24: | ||
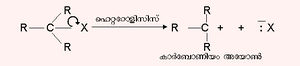
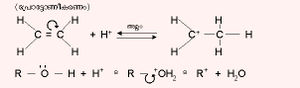
(i) ഒരു രാസബന്ധത്തിന്റെ ഹിറ്ററോളിറ്റികമായ വിച്ഛേദം | (i) ഒരു രാസബന്ധത്തിന്റെ ഹിറ്ററോളിറ്റികമായ വിച്ഛേദം | ||
| - | + | ||
| - | + | [[ചിത്രം:Vol7_324_formula1.jpg|300px]] | |
| - | + | ||
| - | + | (ii) ഒരു സ്വതന്ത്ര റാഡിക്കലില്നിന്ന് ഇലക്ട്രാണ് നീക്കം ചെയ്യപ്പെടല് (b) R + M<sup>n+</sup> → R<sup>+</sup> + M<sup>(n-1)+</sup> | |
| - | + | ||
| - | (ii) ഒരു സ്വതന്ത്ര റാഡിക്കലില്നിന്ന് ഇലക്ട്രാണ് നീക്കം ചെയ്യപ്പെടല് (b) R + | + | |
(iii) പ്രാട്ടോണ്പോലെ അനുയോജ്യമായ ഒരു ചാര്ജിതകണം തന്മാത്രകളില് നടത്തുന്ന ആക്രമണം. | (iii) പ്രാട്ടോണ്പോലെ അനുയോജ്യമായ ഒരു ചാര്ജിതകണം തന്മാത്രകളില് നടത്തുന്ന ആക്രമണം. | ||
| - | + | ||
| - | + | [[ചിത്രം:Vol7_324_formula2.jpg|300px]] | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
ടെര്ഷ്യറി കാര്ബണ് ആറ്റമുള്ള സംയുക്തങ്ങളുടെ (ഉദാ. ടെര്ഷ്യറി ബ്യൂട്ടൈല് ഹാലൈഡുകള്) പ്രതിസ്ഥാപന പ്രക്രിയകളില് എല്ലാം കാര്ബോണിയം അയോണ് മാധ്യമമായുള്ള ക്രിയാവിധിയാണുള്ളത്. ഉദാ. | ടെര്ഷ്യറി കാര്ബണ് ആറ്റമുള്ള സംയുക്തങ്ങളുടെ (ഉദാ. ടെര്ഷ്യറി ബ്യൂട്ടൈല് ഹാലൈഡുകള്) പ്രതിസ്ഥാപന പ്രക്രിയകളില് എല്ലാം കാര്ബോണിയം അയോണ് മാധ്യമമായുള്ള ക്രിയാവിധിയാണുള്ളത്. ഉദാ. | ||
| - | + | ||
| - | + | [[ചിത്രം:Vol7_324_formula3.jpg|300px]] | |
| - | + | ||
| - | + | ||
ഒരേ തന്മാത്രയില്ത്തന്നെ രണ്ടു വ്യത്യസ്ത കാര്ബണ് ആറ്റങ്ങളില് ധനചാര്ജ് ഉള്ള ബിസ്കാര്ബോണിയം അയോണുകളും കണ്ടുപിടിക്കപ്പെട്ടിട്ടുണ്ട്. | ഒരേ തന്മാത്രയില്ത്തന്നെ രണ്ടു വ്യത്യസ്ത കാര്ബണ് ആറ്റങ്ങളില് ധനചാര്ജ് ഉള്ള ബിസ്കാര്ബോണിയം അയോണുകളും കണ്ടുപിടിക്കപ്പെട്ടിട്ടുണ്ട്. | ||
| - | + | ||
| + | [[ചിത്രം:Vol7_324_formula4.jpg|300px]] | ||
| + | |||
കാര്ബോണിയം അയോണുകള് മൂന്നുതരം അഭിക്രിയകളില് പങ്കെടുക്കുന്നു. | കാര്ബോണിയം അയോണുകള് മൂന്നുതരം അഭിക്രിയകളില് പങ്കെടുക്കുന്നു. | ||
1. ഒരു ന്യൂക്ലിയോഫൈലുമായോ, ക്ഷാരവുമായോ സംയോജിച്ച് നിര്വീര്യതന്മാത്ര നല്കുന്നു. | 1. ഒരു ന്യൂക്ലിയോഫൈലുമായോ, ക്ഷാരവുമായോ സംയോജിച്ച് നിര്വീര്യതന്മാത്ര നല്കുന്നു. | ||
| - | + | ||
| - | + | [[ചിത്രം:Vol7_324_formula5.jpg|300px]] | |
| - | + | ||
2. കാര്ബോണിയം അയോണില് നിന്ന് പ്രാട്ടോണ് നീക്കം ചെയ്യപ്പെട്ട് ഒലിഫീനുകള് ലഭിക്കുന്നു. | 2. കാര്ബോണിയം അയോണില് നിന്ന് പ്രാട്ടോണ് നീക്കം ചെയ്യപ്പെട്ട് ഒലിഫീനുകള് ലഭിക്കുന്നു. | ||
| + | |||
| + | [[ചിത്രം:Vol7_324_formula6.jpg|300px]] | ||
3. ഒരു പ്രമറി കാര്ബോണിയം അയോണ് തന്മാത്രീയ പുനഃക്രമീകരണത്തിലൂടെ കൂടുതല് സ്ഥിരതയുള്ള കാര്ബോണിയം അയോണ് (സെക്കന്ഡറി/ടെര്ഷ്യറി) ആയി മാറുന്നു. | 3. ഒരു പ്രമറി കാര്ബോണിയം അയോണ് തന്മാത്രീയ പുനഃക്രമീകരണത്തിലൂടെ കൂടുതല് സ്ഥിരതയുള്ള കാര്ബോണിയം അയോണ് (സെക്കന്ഡറി/ടെര്ഷ്യറി) ആയി മാറുന്നു. | ||
| - | + | ||
| - | + | [[ചിത്രം:Vol7_324_formula7.jpg|300px]] | |
| - | + | ||
| - | + | ||
| - | + | ||
(ഡോ. കെ.പി. ധര്മരാജയ്യര്) | (ഡോ. കെ.പി. ധര്മരാജയ്യര്) | ||
Current revision as of 11:15, 7 ജൂലൈ 2014
കാര്ബോണിയം അയോണ്
Carbonium Ion
പോസിറ്റീവ് ചാര്ജ് വഹിക്കുന്ന കാര്ബണ് അയോണ്. ഇലക്ട്രാ നെഗറ്റീവത കൂടിയ ഒരു ആറ്റമോ ഗ്രൂപ്പോ കാര്ബണുമായി രൂപീകരിക്കുന്ന ബന്ധനം ഹെറ്ററോളിറ്റികമായി വിഛേദിക്കപ്പെടുമ്പോള് പ്രസ്തുത ആറ്റം / ഗ്രൂപ്പ് ബന്ധന ഇലക്ട്രാണ് ജോടിയെ സ്വന്തമാക്കുന്നതിനാല് കാര്ബണ് ഒരു ഇലക്ട്രാണ് നഷ്ടപ്പെട്ട് പോസിറ്റീവ് ചാര്ജുള്ള അയോണായി മാറുന്നു. ഇപ്രകാരം രൂപീകരിക്കപ്പെടുന്ന കാറ്റയോണിക സ്പീഷീസിനെ കാര്ബോണിയം അയോണ് എന്നു പറയുന്നു (ഇപ്പോള് കാര്ബോ കാറ്റയോണ് എന്നറിയപ്പെടുന്നു).
R1, R2, R3 എന്നിവ ഏകസംയോജക ആറ്റങ്ങളോ ഗ്രൂപ്പുകളോ ആണ്. പോസിറ്റീവ് ചാര്ജ് വഹിക്കുന്ന കാര്ബണ് ആറ്റത്തെ അടിസ്ഥാനമാക്കി കാര്ബോണിയം അയോണുകളെ പ്രമറി (1º), സെക്കന്ഡറി (2º), ടെര്ഷ്യറി (3º) എന്നിങ്ങനെ മൂന്നായി തിരിക്കാം.
ഇത്തരം അയോണുകള് കാര്ബണിക സംയുക്തങ്ങളുടെ പ്രതിപ്രവര്ത്തനങ്ങളില് മാധ്യസ്പീഷീസുകളാണെന്ന് തെളിയിക്കപ്പെട്ടിട്ടുണ്ട്. ന്യൂക്ലിയോ ഫിലികപ്രതിസ്ഥാപനങ്ങളുടെ ക്രിയാവിധി വ്യാഖ്യാനിക്കുന്നതിന് ഇത്തരം കാര്ബോണിയം അയോണുകളുടെ അസ്തിത്വം ആവശ്യമായിവരുന്നു. ഇലക്ട്രാണ്ദാരിദ്യ്രം ഉള്ളവയാകയാല് കാര്ബോണിയം അയോണുകള് പ്രബലമായ ഇലക്ട്രാഫിലികത പ്രദര്ശിപ്പിക്കുന്നുണ്ട്. തന്മൂലം ഇവ ഉള്പ്പെടുന്ന പ്രതിപ്രവര്ത്തനങ്ങള് അമ്ലങ്ങളാല് ഉത്പ്രരിതമായിരിക്കും.
കാര്ബണ് അണുവിലെ ചാര്ജ് കേന്ദ്രീകരണം അസ്ഥിരതയുണ്ടാക്കുന്നതുകൊണ്ട് ചാര്ജ് വിസ്ഥാനീകരണ (charge spreading) സാധ്യതയുണ്ടെങ്കിലേ കാര്ബോണിയം അയോണുകള്ക്ക് അസ്തിത്വം ലഭിക്കുകയുള്ളൂ. ചാര്ജ്വിസ്ഥാനീകരണത്തിന്റെ വര്ധനവിനനുസരിച്ച് സ്ഥിരതയും വര്ധിക്കുന്നു. ഇന്ഡക്റ്റീവ് പ്രഭാവവും (+I effect) സംരചനാധിഷ്ഠിതമായ മറ്റു ചില കാരണങ്ങളും(ഉദാ. അനുനാദം)കൊണ്ട് ഈ അയോണുകള്ക്ക് സ്ഥിരത കിട്ടുന്നു. കേന്ദ്രകാര്ബണിനു ചുറ്റുമുള്ള ആല്ക്കൈല് ഗ്രൂപ്പുകളുടെ എണ്ണം കൂടുന്തോറും കാര്ബോണിയം അയോണിന്റെ സ്ഥിരത കൂടുന്നു. ചില കാര്ബാനയോണുകളുടെ സ്ഥിരതാക്രമം താഴെപറയും പ്രകാരമാണ്.
ഇവയെ സാമാന്യവത്കരിച്ചാല് ടെര്ഷ്യറി > സെക്കണ്ടറി > പ്രമറി, കാര്ബോണിയം അയോണ്. കാര്ബോണിയം അയോണുകള് പൊതുവേ മൂന്നു രീതിയില് ഉത്പാദിപ്പിക്കപ്പെടുന്നു.
(i) ഒരു രാസബന്ധത്തിന്റെ ഹിറ്ററോളിറ്റികമായ വിച്ഛേദം
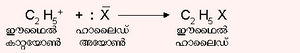
(ii) ഒരു സ്വതന്ത്ര റാഡിക്കലില്നിന്ന് ഇലക്ട്രാണ് നീക്കം ചെയ്യപ്പെടല് (b) R + Mn+ → R+ + M(n-1)+
(iii) പ്രാട്ടോണ്പോലെ അനുയോജ്യമായ ഒരു ചാര്ജിതകണം തന്മാത്രകളില് നടത്തുന്ന ആക്രമണം.
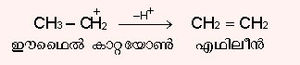
ടെര്ഷ്യറി കാര്ബണ് ആറ്റമുള്ള സംയുക്തങ്ങളുടെ (ഉദാ. ടെര്ഷ്യറി ബ്യൂട്ടൈല് ഹാലൈഡുകള്) പ്രതിസ്ഥാപന പ്രക്രിയകളില് എല്ലാം കാര്ബോണിയം അയോണ് മാധ്യമമായുള്ള ക്രിയാവിധിയാണുള്ളത്. ഉദാ.
ഒരേ തന്മാത്രയില്ത്തന്നെ രണ്ടു വ്യത്യസ്ത കാര്ബണ് ആറ്റങ്ങളില് ധനചാര്ജ് ഉള്ള ബിസ്കാര്ബോണിയം അയോണുകളും കണ്ടുപിടിക്കപ്പെട്ടിട്ടുണ്ട്.
കാര്ബോണിയം അയോണുകള് മൂന്നുതരം അഭിക്രിയകളില് പങ്കെടുക്കുന്നു. 1. ഒരു ന്യൂക്ലിയോഫൈലുമായോ, ക്ഷാരവുമായോ സംയോജിച്ച് നിര്വീര്യതന്മാത്ര നല്കുന്നു.
2. കാര്ബോണിയം അയോണില് നിന്ന് പ്രാട്ടോണ് നീക്കം ചെയ്യപ്പെട്ട് ഒലിഫീനുകള് ലഭിക്കുന്നു.
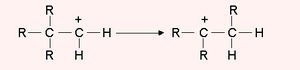
3. ഒരു പ്രമറി കാര്ബോണിയം അയോണ് തന്മാത്രീയ പുനഃക്രമീകരണത്തിലൂടെ കൂടുതല് സ്ഥിരതയുള്ള കാര്ബോണിയം അയോണ് (സെക്കന്ഡറി/ടെര്ഷ്യറി) ആയി മാറുന്നു.
(ഡോ. കെ.പി. ധര്മരാജയ്യര്)