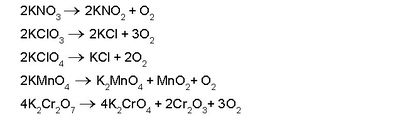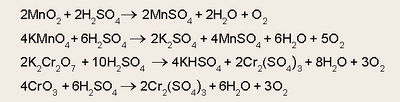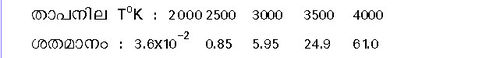This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ഓക്സിജന്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
Mksol (സംവാദം | സംഭാവനകള്) (പുതിയ താള്: == ഓക്സിജന് == == Oxygen == ഒരു രാസമൂലകം. ഇത് ആവർത്തനപ്പട്ടികയിലെ എ...) |
Mksol (സംവാദം | സംഭാവനകള്) (→Oxygen) |
||
| (ഇടക്കുള്ള 2 പതിപ്പുകളിലെ മാറ്റങ്ങള് ഇവിടെ കാണിക്കുന്നില്ല.) | |||
| വരി 5: | വരി 5: | ||
== Oxygen == | == Oxygen == | ||
| - | ഒരു രാസമൂലകം. ഇത് | + | ഒരു രാസമൂലകം. ഇത് ആവര്ത്തനപ്പട്ടികയിലെ എട്ടാമത്തെ മൂലകമാണ്. പതിനാറാമത്തെ ഗ്രൂപ്പില് ഛാല്ക്കോജനുകളില് പ്രഥമസ്ഥാനത്ത് സ്ഥിതിചെയ്യുന്നു. സിംബല്: ഛ; അണുസംഖ്യ: 8; അണുഭാരം: 15.9994. ഈ മൂലകത്തിന് 16, 17, 18 ഭാരമുള്ള മൂന്ന് ഐസോടോപ്പുകള് 99.76 : 0.04 : 0.20 എന്ന അനുപാതത്തില് പ്രകൃതിയിലുണ്ട്. O<sup>14</sup>, O<sup>15</sup> എന്നിവയാണ് റേഡിയോ ആക്റ്റിവതയുള്ള മറ്റു രണ്ട് ഐസോടോപ്പുകള്. |
| - | + | ||
| - | + | ചരിത്രം. 1772-ല് കാള് വില്ഹം ഷീലെ (Carl Wilhem Scheele-1742-86)എന്ന സ്വീഡിഷ് ശാസ്ത്രജ്ഞനാണ് ആദ്യമായി ഈ വാതകം വേര്തിരിച്ചത്. പൊട്ടാസ്യം നൈട്രറ്റും മെര്ക്കുറിക് ഓക്സൈഡും മറ്റു ലോഹ ഓക്സൈഡുകളും ചൂടാക്കിയപ്പോള് ലഭിച്ച ഈ വാതകത്തെ ഇദ്ദേഹം "അഗ്നിവായു'(fire air) എന്നു വിളിക്കുകയും ചെയ്തു. ജോസഫ് പ്രീസ്റ്റലി 1777-ല് മെര്ക്കുറിക് ഓക്സൈഡ് ചൂടാക്കി ഓക്സിജന് നിര്മിക്കുകയും അതിനെ ഡിഫ്ളോജിസ്റ്റിഗേറ്റഡ് എയര് (dephlogistigated air) എന്ന് പേരിടുകയും ചെയ്തു. ലോഹ ഓക്സൈഡുകള് ചൂടാക്കുമ്പോള് അവ വായുവില്നിന്നു ഫ്ളോജിസ്റ്റണ് എന്ന പദാര്ഥം അവശോഷിക്കുകയും, ലോഹങ്ങള് കത്തി ഓക്സൈഡായിത്തീരുമ്പോള് ഫ്ളോജിസ്റ്റന് മോചിക്കപ്പെടുകയും ചെയ്യുന്നു എന്ന് പ്രീസ്റ്റലി വാദിച്ചു. എന്നാല് ഇത് ശരിയല്ലെന്ന് എ.എല്. ലവോസിയേ (Lavoisier, 1743-94)എന്ന ഫ്രഞ്ചു ശാസ്ത്രജ്ഞന് തന്റെ പരീക്ഷണങ്ങള് വഴി തെളിയിച്ചു. ലോഹങ്ങളും മറ്റും കത്തുമ്പോള് വായുവിലെ ഒരു ഭാഗവുമായി സംയോജിച്ചാണ് അവയുടെ ഭാരം കൂടുന്നതെന്നും വായുവിലെ ആ ഭാഗം ഒരു മൂലകമാണെന്നും ആദ്യമായി മനസ്സിലാക്കിയത് ലവോസിയേ ആയിരുന്നു. അമ്ലജനകമെന്നര്ഥമുള്ള ഒരു ഗ്രീക്കുപദത്തില്നിന്ന് ഓക്സിജന് എന്ന പേര് അദ്ദേഹം ആ മൂലകത്തിനു നല്കുകയുണ്ടായി. | |
| - | + | ||
| - | + | ഓക്സിജന്റെ ഉപസ്ഥിതി. പ്രകൃതിയില് ഏറ്റവും സമൃദ്ധമായി കണ്ടുവരുന്ന മൂലകമാണ് ഓക്സിജന്. ഇതു സ്വതന്ത്രാവസ്ഥയിലും യൗഗികാവസ്ഥയിലും കാണപ്പെടുന്നു. അന്തരീക്ഷവായുവിന്റെ 23 ശതമാനം ഭാരം (20 ശ.മാ. വ്യാപ്തം) ഓക്സിജനാണ്. ജലത്തില് ലേയത്വം കുറവാണെങ്കിലും കടല്വെള്ളത്തിലും പുഴവെള്ളത്തിലും മറ്റും അല്പമായി അലിഞ്ഞുചേര്ന്നിട്ടുള്ള ഓക്സിജന് ജലജന്തുക്കളുടെ ജീവിതത്തിന് അനിവാര്യമാണ്. | |
| - | + | യൗഗികാവസ്ഥയില് ഓക്സിജന് പ്രകൃതിയില് ഉടനീളം സ്ഥിതിചെയ്യുന്നു. ജലത്തിന്റെ ഭാരത്തില് 89 ശതമാനവും ഭൂമിയുടെ ഉപരിതലത്തിന്റെ ഭാരത്തില് 50 ശതമാനവും ഓക്സിജന്റേതാണ്. പാറകളിലും മണലിലും മണ്ണിലും മറ്റു മൂലകങ്ങളുമായി ചേര്ന്നനിലയില് ഓക്സിജന് ഉണ്ട്. സിലിക്കണ്, ഇരുമ്പ്, അലുമിനിയം മുതലായവയുടെ യൗഗികങ്ങള് പ്രകൃതിയില് ധാരാളം ലഭിക്കുന്നു. ഓക്സൈഡുകള്, കാര്ബണേറ്റുകള്, സള്ഫേറ്റുകള്, ഫോസ്ഫേറ്റുകള്, സിലിക്കേറ്റുകള് തുടങ്ങിയ നിരവധി ഖനിജങ്ങളിലും ഓക്സിജന് അടങ്ങിയിട്ടുണ്ട്. സസ്യങ്ങളുടെയും ജന്തുക്കളുടെയും ശരീരനിര്മിതിക്ക് ഉപയോഗിക്കപ്പെട്ടിട്ടുള്ള പദാര്ഥങ്ങളില് പ്രമുഖസ്ഥാനമാണ് ഓക്സിജനുള്ളത്. മനുഷ്യശരീരത്തിന്റെ 65 ശതമാനം ഭാരം ഓക്സിജന്റേതാണ്. | |
| - | + | ||
| - | + | നിര്മാണം. ഓക്സിജന്റെ നിര്മാണത്തിന് അനേകം വിധികളുണ്ട്. മെര്ക്കുറി, വെള്ളി, സ്വര്ണം, പ്ലാറ്റിനം തുടങ്ങിയ ലോഹങ്ങളുടെ ഓക്സൈഡുകള് തപിപ്പിച്ചാല് ഓക്സിജന് മോചിക്കപ്പെടുന്നു. | |
| + | [[ചിത്രം:Vol5_739_formula4.jpg|400px]] | ||
| + | ഓക്സിജന് അധികമുള്ള നൈട്രറ്റുകള്, ക്ലോറേറ്റുകള്, പെര്ക്ലോറേറ്റുകള്, ബ്രാമേറ്റുകള്, അയോഡേറ്റുകള്, പെര്സല്ഫേറ്റുകള്, പെര്മാംഗനേറ്റുകള്, ഡൈക്രാമേറ്റുകള് തുടങ്ങിയവ ചൂടാക്കുമ്പോഴും ഓക്സിജന് കിട്ടുന്നു. | ||
| + | [[ചിത്രം:Vol5_739_formula5.jpg|400px]] | ||
| - | ഓക്സിജന് | + | പൊട്ടാസ്യം പെര്മാംഗനേറ്റ് ചൂടാക്കി കിട്ടുന്ന ഓക്സിജന് ശുദ്ധമാണ്. |
| + | സോഡിയം മുതലായ ലോഹങ്ങളുടെ പെറോക്സൈഡും ജലവും തമ്മില് പ്രവര്ത്തിപ്പിച്ച് ഓക്സിജന് നിര്മിക്കാവുന്നതാണ്. | ||
| - | + | [[ചിത്രം:Vol5_740_Formula1.jpg|400px]] | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ക്ലോറിന്ജലം വെയിലത്തു വയ്ക്കുകയോ സാന്ദ്രബ്ലീച്ചിങ് പൗഡര് ലായനിയോടു കോബാള്ട്ട് ക്ലോറൈഡ് ചേര്ക്കുകയോ ചെയ്യുമ്പോള് ഓക്സിജന് മോചിപിക്കപ്പെടുന്നു. | |
| - | + | ||
| - | + | [[ചിത്രം:Vol5_740_Formula2.jpg|400px]] | |
| - | + | അരുണതപ്തമായ പോര്സെലിന് നാളിയില്ക്കൂടി നീരാവിയും ക്ലോറിനും അടങ്ങിയ മിശ്രിതം കടത്തിവിടുമ്പോള് ഓക്സിജന് ലഭ്യമാകുന്നു. | |
| - | + | [[ചിത്രം:Vol5_740_Formula3.jpg|400px]] | |
| - | + | ||
| - | + | മാംഗനീസ് ഡൈഓക്സൈഡ്, പൊട്ടാസ്യം പെര്മാംഗനേറ്റ്, ഡൈക്രാമേറ്റ്, ക്രാമിയം ട്രഓക്സൈഡ് മുതലായ ലവണങ്ങളോട് സാന്ദ്ര സള്ഫ്യൂരിക് അമ്ലം ചേര്ത്തുചൂടാക്കിയും ഓക്സിജന് നിര്മിക്കാവുന്നതാണ്. | |
| - | + | [[ചിത്രം:Vol5_740_Formula4.jpg|400px]] | |
| - | + | അല്പം അമ്ലമോ അഥവാ അല്പം ക്ഷാരമോ ചേര്ന്ന ജലം വിദ്യുദപഘടനം ചെയ്യുമ്പോള് ആനോഡില് ഓക്സിജന് മോചിക്കപ്പെടുന്നു. | |
| - | + | [[ചിത്രം:Vol5_740_Formula5.jpg|400px]] | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ബേരിയം ഹൈഡ്രാക്സൈഡിന്റെ ജലലായനി വിദ്യുദപഘടനവിധേയമാക്കുമ്പോള് ആനോഡില് ശുദ്ധ ഓക്സിജന് ലഭിക്കുന്നു. | |
| + | പരീക്ഷണശാലയില് പൊട്ടാസ്യം ക്ലോറേറ്റ് ചൂടാക്കിയാണ് ഓക്സിജന് സാധാരണയായി നിര്മിക്കുന്നത്. ഉത്പ്രരകമായി മാംഗനീസ് ഡൈഓക്സൈഡും ഉപയോഗിക്കുന്നു. | ||
| - | + | [[ചിത്രം:Vol5_740_Formula6.jpg|400px]] | |
| - | + | പരിശുദ്ധ ഓക്സിജന് ലഭിക്കുവാന് പൊട്ടാസ്യം പെര്മാംഗനേറ്റ് നേര്ത്ത സല്ഫ്യൂരിക് അമ്ലത്തില് അലിയിച്ചു കിട്ടുന്ന ലായനി, ഹൈഡ്രജന് പെറോക്സൈഡ് ലായനിയോട് ചേര്ക്കുകയാണ് പതിവ്. | |
| - | + | ||
| - | + | [[ചിത്രം:Vol5_740_Formula7.jpg|400px]] | |
| - | + | ||
| - | + | വ്യാവസായിക നിര്മാണം. ഓക്സിജന്റെ വ്യാവസായികനിര്മാണത്തിന് മൂന്നു പ്രക്രിയകള് ഉപയോഗിച്ചുവരുന്നു. | |
| + | 1. ബ്രിന് പ്രക്രിയ. ബ്രിന് ആവിഷ്കരിച്ച ഈ പ്രക്രിയയില് അന്തരീക്ഷ ഓക്സിജന്, ബേരിയം ഓക്സൈഡ് ഉപയോഗിച്ചു വേര്തിരിക്കുന്നു. ബേരിയം ഓക്സൈഡ് അരുണതപ്തമാകുന്നതുവരെ ചൂടാക്കുമ്പോള് അത് അന്തരീക്ഷത്തില്നിന്ന് ഓക്സിജന് അവശോഷണം ചെയ്ത് ബേരിയം പെറോക്സൈഡായി മാറുന്നു. | ||
| - | + | [[ചിത്രം:Vol5_740_Formula8.jpg|400px]] | |
| - | + | കുറേക്കൂടി ശക്തിയായി ചൂടാക്കുമ്പോള് പെറോക്സൈഡ് വിഘടിച്ച് ഓക്സൈഡായി മാറുന്നതോടൊപ്പം ഓക്സിജന് മോചിപിക്കപ്പെടുകയും ചെയ്യുന്നു. | |
| - | + | ||
| - | + | [[ചിത്രം:Vol5_740_Formula9.jpg|400px]] | |
| - | + | ഇപ്രകാരം ഇടവിട്ടിടവിട്ട് താപനില കൂട്ടുകയും കുറയ്ക്കുകയും ചെയ്ത് അന്തരീക്ഷത്തിലെ ഓക്സിജന് വന്തോതില് വേര്തിരിച്ച് എടുക്കുന്നു. താപനില കൂട്ടുന്നതിനുപകരം മര്ദം കുറയ്ക്കുകയാണെങ്കില് ബേരിയം പെറോക്സൈഡ് വിഘടിച്ച് ബേരിയം ഓക്സൈഡും ഓക്സിജനുമായി മാറുന്നു. ഓക്സിജന് നീക്കംചെയ്തു മര്ദം കൂട്ടിയാല് ബേരിയം ഓക്സൈഡ് വായുവിനെ ഓക്സിജനുമായി സംയോജിപിച്ച് പെറോക്സൈഡായി മാറുന്നു. ഇത് വീണ്ടും ഉപയോഗിക്കാം. | |
| - | + | 2. ക്ലൗഡ് പ്രക്രിയ. വായുവില്നിന്ന് ഓക്സിജനും നൈട്രജനും വേര്തിരിക്കുകയാണ് ക്ലൗഡ് ആവിഷ്കരിച്ച ഈ പ്രക്രിയയില് ചെയ്യുന്നത്. ഓക്സിജന്റെ തിളനില-182.5°C-ഉം നൈട്രജന്റേത്-195°C-ഉം ആകുന്നു. തിളനിലകള് തമ്മില് 12.5°C-ന്റെ വ്യത്യാസമുള്ളതിനാല് ആംശികസ്വേദനം (fractional distillation)വഴി രണ്ടു വാതകങ്ങളെയും ദ്രവവായുവില് നിന്നും വേര്തിരിക്കുവാന് സാധിക്കുന്നു. | |
| - | + | 20-35 അന്തരീക്ഷമര്ദത്തില് വായുശേഖരിച്ച് രുദ്ധതാപീയവികാസം ഉപയോഗിച്ചു തണുപ്പിച്ച് ക്ലൗഡ് ഉപകരണത്തിലേക്ക് കടത്തുന്നു. നേരത്തേ ലഭിച്ചിട്ടുള്ള ദ്രവ ഓക്സിജന്കൊണ്ട് ആവൃതങ്ങളായ ഇടുങ്ങിയ പൈപ്പുകളില്ക്കൂടി മുകളിലേക്ക് പ്രവഹിക്കുന്ന സമ്മര്ദിതവായു ഒന്നുകൂടി തണുക്കുകയും തത്ഫലമായി അതിന്റെ ഒരു ഭാഗം ദ്രവീകരിച്ച് ഒരു പാത്രത്തില് വീഴുകയും ചെയ്യുന്നു. ഓക്സിജന്റെ തിളനില നൈട്രജന്റെ തിളനിലയെക്കാള് ഉയര്ന്നതാകയാല് ഈ ദ്രവവായു ഓക്സിജന് സമൃദ്ധമായിരിക്കും. നൈട്രജന്-സമൃദ്ധമായ ദ്രവീകരിക്കാത്ത വായുവാകട്ടെ മുകളിലേക്ക് പ്രവഹിച്ച് പിന്നീട് ദ്രവീഭവിക്കുകയും മറ്റൊരു പാത്രത്തില് വീഴുകയുംചെയ്യുന്നു. ഓക്സിജന് സമൃദ്ധദ്രവം വീണ്ടും മുകളിലേക്ക് പ്രവഹിച്ച് ശുദ്ധ ഓക്സിജന് സമൃദ്ധമാവുകയും തുടര്ന്ന് ഇതില്നിന്നു വീണ്ടും ദ്രവീകരിച്ച് കിട്ടുന്ന അംശം ശുദ്ധഓക്സിജനായി മാറുകയും ചെയ്യുന്നു. ഇവിടെ ദ്രവീകരിക്കാതെ മുകളിലേക്ക് പ്രവഹിക്കുന്ന വായു നേരത്തേ ഉണ്ടായ നൈട്രജന് പ്രവാഹവുമായി കൂട്ടിമുട്ടുകയും ദ്രവ നൈട്രജന്റെ തണുപ്പുകാരണം, വായുവിലടങ്ങിയതും അതുവരെ ദ്രവീകരിക്കാത്തതുമായ ഓക്സിജന് ദ്രവീകരിക്കുകയും ശുദ്ധ ഓക്സിജന് സംഭരണിയില് ചെന്നുവീഴുകയും ചെയ്യുന്നു. ക്ലൗഡ് പ്രക്രിയയില് ശുദ്ധ ഓക്സിജനോടൊപ്പം തന്നെ ശുദ്ധ നൈട്രജനും വേര്തിരിച്ചുകിട്ടുന്നുണ്ട്. | |
| - | + | 3. വിദ്യുതപഘടനാരീതി. അല്പം അമ്ലമോ അഥവാ ക്ഷാരമോ ചേര്ത്ത ജലം വിദ്യുതപഘടനം ചെയ്യുമ്പോള് അത് ഹൈഡ്രജന് വാതകവും ഓക്സിജന് വാതകവുമായി വിഘടിക്കുന്നു. | |
| - | + | ||
| - | + | 10 ശതമാനം കോസ്റ്റിക് സോഡാലായനി നിക്കല് ലേപിതമായ ഇരുമ്പു ഇലക്ട്രാഡുകള് ഉപയോഗിച്ച് വിദ്യുതപഘടനം ചെയ്യുമ്പോള് കാഥോഡില് ഹൈഡ്രജനും ആനോഡില് ഓക്സിജനും മോചിക്കപ്പെടുന്നു. | |
| - | 10 ശതമാനം കോസ്റ്റിക് സോഡാലായനി | + | |
| - | + | [[ചിത്രം:Vol5_740_Formula10.jpg|400px]] | |
| - | വിദ്യുച്ഛക്തിക്ക് വിലകുറഞ്ഞ സ്ഥലങ്ങളിലാണ് ഓക്സിജന് | + | വിദ്യുച്ഛക്തിക്ക് വിലകുറഞ്ഞ സ്ഥലങ്ങളിലാണ് ഓക്സിജന് നിര്മാണത്തിന് ഈ രീതി ഉപയോഗിച്ചുവരുന്നത്. |
| - | + | ||
| - | + | ||
| + | ഭൗതികഗുണധര്മങ്ങള്. ഓക്സിജന് മൂലകത്തിന് നിറമോ മണമോ രുചിയോ ഇല്ല. ഒരു വാതകമാണ്. വായുവിനെക്കാള് അല്പം കൂടുതല് സാന്ദ്രമാണ്. ഘനത്വം 1.429 ഗ്രാം/ലിറ്റര്. ക്രാന്തിക താപനില-118.75°C-ഉം ക്രാന്തികമര്ദം 49.7 അന്തരീക്ഷവുമാണ്. വെള്ളത്തില് അല്പമായി മാത്രമേ ലയിക്കുന്നുള്ളു; ഒരു ലിറ്റര് വെള്ളത്തില് 0°C-ഉം, 760 മില്ലി മീറ്റര് മര്ദമുള്ള ഓക്സിജന്വാതകം 48.9 മില്ലി ലിറ്റര് മാത്രമേ ലയിക്കുന്നുള്ളൂ. | ||
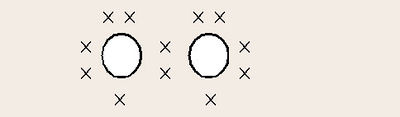
| + | ദ്രവഓക്സിജന്. നേര്ത്ത നീലനിറമാണ് ഇതിനുള്ളത്. തിളനില-183°C-ഉം ഘനത്വം 1.1315 ഗ്രാം/ഘന സെന്റീമീറ്ററും ആകുന്നു. ദ്രവഓക്സിജന്റെ തന്മാത്രയിലുള്ള രണ്ട് ഓക്സിജന് പരമാണുക്കളിലും ഓരോ അയുഗ്മ ഇലക്ട്രാണുകള് ഉള്ളതിനാല് ഇത് അനുകാന്തീയ സ്വഭാവം കാണിക്കുന്നു. | ||
| + | [[ചിത്രം:Vol5_741_Formula1.jpg|400px]] | ||
| - | ഖര ഓക്സിജന്. ഇതിന്റെയും നിറം നീലയാണ്. | + | ഖര ഓക്സിജന്. ഇതിന്റെയും നിറം നീലയാണ്. ഉരുകല്നില-218.4°C-ഉം ഘനത്വം 1.568 ഗ്രാം/ഘന സെന്റീമീറ്ററും ആകുന്നു. ദ്രവ ഓക്സിജന് ശീഘ്രബാഷ്പീകരണംമൂലം ഖരപദാര്ഥമാവുകയില്ല. എന്നാല് ഖര ഹൈഡ്രജന് ഉപയോഗിച്ച് തണുപ്പിക്കുന്ന പക്ഷം ദ്രവഓക്സിജനില് നിന്നു ക്രിസ്റ്റലുകള് വേര്തിരിഞ്ഞു കിട്ടുന്നതാണ്. ഓക്സിജന്റെ മൂന്നു ക്രിസ്റ്റലീയ രൂപാന്തരങ്ങളുണ്ട്. |
| - | മരക്കരി തുടങ്ങിയവ ഓക്സിജനെ താഴ്ന്ന | + | |
| + | മരക്കരി തുടങ്ങിയവ ഓക്സിജനെ താഴ്ന്ന ഊഷ്മാവില് അവശോഷിക്കുന്നു. ഉയര്ന്ന ഊഷ്മാവിലാകട്ടെ ഈ ഓക്സിജന് പുറന്തള്ളപ്പെടുന്നു. സ്വര്ണം, വെള്ളി, പ്ലാറ്റിനം, പലേഡിയം തുടങ്ങിയ ലോഹങ്ങള് ഓക്സിജനെ ഉയര്ന്ന ഊഷ്മാവിലാണ് അവശോഷിക്കുന്നത്. ഉരുകിയ വെള്ളിയില് അവശോഷിക്കപ്പെടുന്ന ഓക്സിജന് പുറന്തള്ളപ്പെടണമെങ്കില് ലോഹത്തെ തണുപ്പിക്കുകയാണു വേണ്ടത്. | ||
ക്ഷാരീയ പൈറോഗലോള് ഓക്സിജന്റെ നല്ല വിലായകമാണ്. | ക്ഷാരീയ പൈറോഗലോള് ഓക്സിജന്റെ നല്ല വിലായകമാണ്. | ||
| - | ഓക്സിജന്റെ അപരരൂപമാണ് ഓസോണ്. ഓസോണിന്റെ | + | ഓക്സിജന്റെ അപരരൂപമാണ് ഓസോണ്. ഓസോണിന്റെ തന്മാത്രയില് മൂന്ന് ഓക്സിജന് അണുക്കളാണുള്ളത്. |
| - | + | ||
| - | സാധാരണ | + | രാസഗുണധര്മങ്ങള്. ഓക്സിജന് അമ്ലീയമോ ക്ഷാരീയമോ അല്ല. ദാഹ്യവുമല്ല. എന്നാല് ഒരു നല്ല ദഹനസഹായിയാണ്. സാധാരണതാപനിലയില് ഓക്സിജന് രാസപ്രവര്ത്തനങ്ങളില് ഊര്ജസ്വലമല്ല, ഉയര്ന്ന താപനിലയിലാകട്ടെ, മിക്കവാറും എല്ലാ മൂലകങ്ങളും ഓക്സിജനുമായി സംയോജിച്ച് ഓക്സൈഡായി രൂപാന്തരപ്പെടുന്നു. വായുവില് കത്തുന്ന പദാര്ഥങ്ങള് ഓക്സിജനില് കൂടുതല് പ്രകാശത്തോടെ കത്തുന്നു. താപത്തെയും പ്രകാശത്തെയും മോചിപ്പിച്ചുകൊണ്ട് പദാര്ഥങ്ങള് ഓക്സിജനില് കത്തുന്ന പ്രക്രിയ ജ്വലനമെന്ന പേരിലാണ് അറിയപ്പെടുന്നത്. |
| + | |||
| + | സാധാരണ താപനിലയില് സോഡിയം, പൊട്ടാസ്യം, ഫോസ്ഫറസ്, സല്ഫര് തുടങ്ങിയ മൂലകങ്ങള് ഓക്സിജനില് കത്തി ഓക്സൈഡായി മാറുന്നു. സോഡിയം മഞ്ഞജ്വാലയോടും പൊട്ടാസ്യം ലൈലാക് (lilac) ജ്വാലയോടും ഫോസ്ഫറസ് കണ്ണഞ്ചിപ്പിക്കുന്ന ശ്വേതപ്രകാശത്തോടെയും സല്ഫര് നീലകലര്ന്ന വയലറ്റ് ജ്വാലയോടുംകൂടി കത്തുന്നു. ചുവന്നു തപ്തമായ കരിക്കട്ട ഓക്സിജനില് ഉജ്ജ്വലശോഭയോടെ കത്തി കാര്ബണ് ഡൈഓക്സൈഡായിത്തീരുന്നു. കത്തുന്ന മഗ്നീഷ്യം കൂടുതല് ശോഭയോടെ കത്തുകയും മഗ്നീഷ്യം ഓക്സൈഡ് ഉണ്ടാവുകയും ചെയ്യുന്നു. ഹൈഡ്രജനും ഓക്സിജനും തമ്മിലുള്ള സംയോജനത്തെ സ്പോഞ്ജിക-അസ്ബസ്റ്റോസ് ഉത്പ്രരിപ്പിക്കുന്നു. വെള്ളമാണ് ഈ സംയോജനത്തിന്റെ ഫലമായി ലഭിക്കുന്നത്. ചെമ്പ്, മെര്ക്കുറി മുതലായവ വളരെ പ്രയാസപ്പെട്ടുമാത്രമേ ഓക്സിജനില് കത്തി ഓക്സൈഡ് ആയി രൂപാന്തരപ്പെടുന്നുള്ളൂ. ഹീലിയം, ആര്ഗോണ് തുടങ്ങിയ നിഷ്ക്രിയ വാതകങ്ങള് ഓക്സിജനുമായി പ്രതിപ്രവര്ത്തിക്കുന്നില്ല. പല യൗഗികങ്ങളുമായും ഓക്സിജന് രാസപ്രവര്ത്തനം നടത്തുന്നുണ്ട്. ഓക്സിജന് നൈട്രിക് ഓക്സൈഡുമായി സംയോജിച്ച് നൈട്രജന് ഡൈ ഓക്സൈഡിന്റെ ചുവന്ന ധൂമമായി മാറുന്നു. | ||
| + | |||
| + | [[ചിത്രം:Vol5_741_Formula2.jpg|400px]] | ||
| + | |||
| + | പ്ലാറ്റിനീകരിച്ച ആസ്ബസ്റ്റാസിന്റെ സാന്നിധ്യത്തില് ഓക്സിജന്, സല്ഫര് ഡൈഓക്സൈഡുമായി പ്രവര്ത്തിച്ച് സല്ഫര് ട്രഓക്സൈഡ് ആയി മാറുന്നു. | ||
| + | |||
| + | [[ചിത്രം:Vol5_741_Formula3.jpg|300px]] | ||
| - | + | അമോണിയ, ഹൈഡ്രജന് ക്ലോറൈഡ് എന്നീ യൗഗികങ്ങളുമായി പ്രവര്ത്തിച്ച് ഓക്സിജന് അവയെ യഥാക്രമം നൈട്രിക് ഓക്സൈഡ്, ക്ലോറിന് എന്നിവയായി രൂപാന്തരപ്പെടുത്തുന്നു. | |
| - | + | [[ചിത്രം:Vol5_741_Formula4.jpg|400px]] | |
| - | + | ||
| - | + | ഈ പ്രതിപ്രവര്ത്തനങ്ങള് വ്യാവസായികമണ്ഡലത്തില് അതിപ്രധാനങ്ങളാണ്. | |
| + | നിദര്ശനം. (1) ഓക്സിജന് ഒരു ഈര്ക്കില് കനലിനെ ആളിക്കത്തിക്കാന് സാധിക്കും. (2) ക്ഷാരകീയ പൈറോഗാലേറ്റ് ലായനി ഓക്സിജനെ അവശോഷിക്കുന്നു. (3) നൈട്രിക് ഓക്സൈഡുമായി കൂട്ടിക്കലര്ത്തിയാല് ഓക്സിജന് അതിനോട് സംയോജിച്ച് നൈട്രജന് ഡൈഓക്സൈഡിന്റെ ചുവന്ന ധൂമം തരുന്നു. | ||
| - | + | അണുഓക്സിജന്. സാധാരണ താപനിലയില് ഓക്സിജന്റെ തന്മാത്രകള് സ്ഥായിയാണ്. എന്നാല് വളരെ ഉയര്ന്ന താപനിലയില് അവ വിഘടിക്കുന്നു. | |
| - | + | O<sub>2</sub> = 2[O] - 116.4കിലോ കലോറി 760 മില്ലി മീറ്റര് മര്ദമുള്ള ഓക്സിജന്റെ വിഘടന ശതമാനം വിവിധ താപനിലകളില് താഴെ കൊടുത്തിരിക്കുന്നു: | |
| - | + | [[ചിത്രം:Vol5_741_Formula5.jpg|500px]] | |
| - | + | ||
| - | + | താഴ്ന്ന മര്ദത്തിലുള്ള ഓക്സിജന് വാതകം വൈദ്യുതവിസര്ജനത്തിന് പാത്രമാകുമ്പോള് ഓക്സിജനിലെ ഉദ്ദേശം 20 ശതമാനം തന്മാത്രകള് അണുക്കളായി വിഘടിക്കുന്നതു കാണാം. | |
| - | + | ||
| - | + | അണു ഓക്സിജന് സാധാരണ ഓക്സിജനിലും കൂടുതല് പ്രവര്ത്തനക്ഷമതയുള്ളതാണ്. ഇത് ഹൈഡ്രജന് ക്ലോറൈഡിനെ ചെറിയതോതില് മാത്രമേ വിഘടിപ്പിക്കുന്നുള്ളൂ. എന്നാല് ഹൈഡ്രജന് ബ്രാമൈഡിനെ ഓക്സിഡൈസ് ചെയ്ത് ബ്രാമിനും ജലവും തരുന്നു. അമോണിയയുമായി ചേരുമ്പോള് അത് ഒരു സ്ഫോടകപദാര്ഥമായിത്തീരുന്നു. ക്ലോറിനുമായി പ്രവര്ത്തിച്ച് ക്ലോറസ് ഓക്സൈഡും ക്ലോറിന് ഡൈഓക്സൈഡും തരുന്നു. | |
| - | + | ||
| - | + | ഉപയോഗങ്ങള്. ജീവസന്ധാരണത്തിന് ഓക്സിജന് അനിവാര്യമാണ്. ഓക്സിജന് ഇല്ലെങ്കില് ജീവന്റെ നിലനില്പ്പ് അസാധ്യമാണ്. മിനിട്ടുകള്പോലും ജീവന് നിലനില്ക്കുകയില്ല. പദാര്ഥങ്ങളുടെ ജ്വലനത്തിന് ഓക്സിജന് കൂടിയേ തീരൂ. പര്വതാരോഹകര്ക്കും വെള്ളത്തിനടിയില് മുങ്ങുന്നവര്ക്കും അഗ്നിശമനപ്രവര്ത്തകര്ക്കും ബഹിരാകാശസഞ്ചാരികള്ക്കും ശ്വസനാവശ്യത്തിന് ഓക്സിജന് പ്രത്യേകമായി വേണ്ടതുണ്ട്. 5-10 ശതമാനം കാര്ബണ് ഡൈഓക്സൈഡ് ചേര്ത്ത ഓക്സിജനാണ് ഇതിനുപയുക്തം. സാധാരണഗതിയിലുള്ള ശ്വസനം വിഷമകരമായി അനുഭവപ്പെടുന്ന രോഗികള്ക്ക് ശ്വസനത്തിനുവേണ്ടി ആശുപത്രികളില് ഓക്സിജന് ഉപയോഗിക്കുന്നു. ലോഹനിഷ്കര്ഷണപ്രക്രിയകളിലും മറ്റു വ്യാവസായികപ്രക്രിയകളിലും ഓക്സീകാരിയായി ഇതുപയോഗിക്കുന്നു. ഓക്സിജനില് സല്ഫര് കത്തിച്ചുകിട്ടുന്ന സല്ഫര് ഡൈഓക്സൈഡ് വീണ്ടും ഓക്സീകരിച്ച് സല്ഫര് ട്ര ഓക്സൈഡാക്കി മാറ്റി സല്ഫ്യൂരിക് അമ്ലം ഉണ്ടാക്കുവാന് ഉപയോഗിക്കുന്നു. ഓസ്വാള്ഡ് പ്രക്രിയയിലാകട്ടെ, ഓക്സിജന് ഉപയോഗിച്ച് ഓക്സീകരിച്ച അമോണിയയില്നിന്നാണ് നൈട്രിക് അമ്ലം ഉത്പാദിപ്പിക്കുന്നത്. ഇരുമ്പു വ്യവസായത്തിലും സ്റ്റീല് വ്യവസായത്തിലും ഓക്സിജന് വളരെയേറെ പ്രയോജനകാരിയാണ്. കരി, ലിഗ്നൈറ്റ്, ഹൈഡ്രാകാര്ബണുകള് മുതലായവ വാട്ടര് ഗ്യാസാക്കി മാറ്റുവാന് ഓക്സിജന് അത്യന്താപേക്ഷിതമാണ്. അസറ്റാള്ഡിഹൈഡ്, ലിന്സീഡ് എണ്ണ മുതലായവ ഓക്സീകരിക്കാനും ഓക്സിജന് ഉപയോഗിക്കുന്നു. ഉയര്ന്ന ഉരുകല്നിലയുള്ള ലോഹങ്ങള് ഉരുക്കുവാനും മുറിക്കുവാനും കൂട്ടിച്ചേര്ക്കുവാനും വിളക്കുവാനുംവേണ്ടി ഉപകരിക്കുന്ന ഓക്സി-അസറ്റലിന് ബ്ലോപൈപ്പിലും, ഓക്സി-ഹൈഡ്രജന് ബ്ലോപൈപ്പിലും ഓക്സിജന് വേണം. ഓക്സി-അസറ്റലിന് ജ്വാലകൊണ്ട് 3100-3315ºC- വരെയും ഓക്സി-ഹൈഡ്രജന് ജ്വാലകൊണ്ട് 2800ºC-വരെയും ഉയര്ന്ന താപനില ലഭിക്കുന്നു. നോ. ഓക്സൈഡുകള്; ഓക്സിഡൈസിങ് ഏജന്റുകള്; ഓക്സിഡേഷന് റിഡക്ഷന് | |
| - | + | ||
| - | ഉപയോഗങ്ങള്. ജീവസന്ധാരണത്തിന് ഓക്സിജന് അനിവാര്യമാണ്. ഓക്സിജന് | + | |
| - | ( | + | (ആര്. രത്നാംബാള്) |
Current revision as of 08:30, 7 ഓഗസ്റ്റ് 2014
ഓക്സിജന്
Oxygen
ഒരു രാസമൂലകം. ഇത് ആവര്ത്തനപ്പട്ടികയിലെ എട്ടാമത്തെ മൂലകമാണ്. പതിനാറാമത്തെ ഗ്രൂപ്പില് ഛാല്ക്കോജനുകളില് പ്രഥമസ്ഥാനത്ത് സ്ഥിതിചെയ്യുന്നു. സിംബല്: ഛ; അണുസംഖ്യ: 8; അണുഭാരം: 15.9994. ഈ മൂലകത്തിന് 16, 17, 18 ഭാരമുള്ള മൂന്ന് ഐസോടോപ്പുകള് 99.76 : 0.04 : 0.20 എന്ന അനുപാതത്തില് പ്രകൃതിയിലുണ്ട്. O14, O15 എന്നിവയാണ് റേഡിയോ ആക്റ്റിവതയുള്ള മറ്റു രണ്ട് ഐസോടോപ്പുകള്.
ചരിത്രം. 1772-ല് കാള് വില്ഹം ഷീലെ (Carl Wilhem Scheele-1742-86)എന്ന സ്വീഡിഷ് ശാസ്ത്രജ്ഞനാണ് ആദ്യമായി ഈ വാതകം വേര്തിരിച്ചത്. പൊട്ടാസ്യം നൈട്രറ്റും മെര്ക്കുറിക് ഓക്സൈഡും മറ്റു ലോഹ ഓക്സൈഡുകളും ചൂടാക്കിയപ്പോള് ലഭിച്ച ഈ വാതകത്തെ ഇദ്ദേഹം "അഗ്നിവായു'(fire air) എന്നു വിളിക്കുകയും ചെയ്തു. ജോസഫ് പ്രീസ്റ്റലി 1777-ല് മെര്ക്കുറിക് ഓക്സൈഡ് ചൂടാക്കി ഓക്സിജന് നിര്മിക്കുകയും അതിനെ ഡിഫ്ളോജിസ്റ്റിഗേറ്റഡ് എയര് (dephlogistigated air) എന്ന് പേരിടുകയും ചെയ്തു. ലോഹ ഓക്സൈഡുകള് ചൂടാക്കുമ്പോള് അവ വായുവില്നിന്നു ഫ്ളോജിസ്റ്റണ് എന്ന പദാര്ഥം അവശോഷിക്കുകയും, ലോഹങ്ങള് കത്തി ഓക്സൈഡായിത്തീരുമ്പോള് ഫ്ളോജിസ്റ്റന് മോചിക്കപ്പെടുകയും ചെയ്യുന്നു എന്ന് പ്രീസ്റ്റലി വാദിച്ചു. എന്നാല് ഇത് ശരിയല്ലെന്ന് എ.എല്. ലവോസിയേ (Lavoisier, 1743-94)എന്ന ഫ്രഞ്ചു ശാസ്ത്രജ്ഞന് തന്റെ പരീക്ഷണങ്ങള് വഴി തെളിയിച്ചു. ലോഹങ്ങളും മറ്റും കത്തുമ്പോള് വായുവിലെ ഒരു ഭാഗവുമായി സംയോജിച്ചാണ് അവയുടെ ഭാരം കൂടുന്നതെന്നും വായുവിലെ ആ ഭാഗം ഒരു മൂലകമാണെന്നും ആദ്യമായി മനസ്സിലാക്കിയത് ലവോസിയേ ആയിരുന്നു. അമ്ലജനകമെന്നര്ഥമുള്ള ഒരു ഗ്രീക്കുപദത്തില്നിന്ന് ഓക്സിജന് എന്ന പേര് അദ്ദേഹം ആ മൂലകത്തിനു നല്കുകയുണ്ടായി.
ഓക്സിജന്റെ ഉപസ്ഥിതി. പ്രകൃതിയില് ഏറ്റവും സമൃദ്ധമായി കണ്ടുവരുന്ന മൂലകമാണ് ഓക്സിജന്. ഇതു സ്വതന്ത്രാവസ്ഥയിലും യൗഗികാവസ്ഥയിലും കാണപ്പെടുന്നു. അന്തരീക്ഷവായുവിന്റെ 23 ശതമാനം ഭാരം (20 ശ.മാ. വ്യാപ്തം) ഓക്സിജനാണ്. ജലത്തില് ലേയത്വം കുറവാണെങ്കിലും കടല്വെള്ളത്തിലും പുഴവെള്ളത്തിലും മറ്റും അല്പമായി അലിഞ്ഞുചേര്ന്നിട്ടുള്ള ഓക്സിജന് ജലജന്തുക്കളുടെ ജീവിതത്തിന് അനിവാര്യമാണ്.
യൗഗികാവസ്ഥയില് ഓക്സിജന് പ്രകൃതിയില് ഉടനീളം സ്ഥിതിചെയ്യുന്നു. ജലത്തിന്റെ ഭാരത്തില് 89 ശതമാനവും ഭൂമിയുടെ ഉപരിതലത്തിന്റെ ഭാരത്തില് 50 ശതമാനവും ഓക്സിജന്റേതാണ്. പാറകളിലും മണലിലും മണ്ണിലും മറ്റു മൂലകങ്ങളുമായി ചേര്ന്നനിലയില് ഓക്സിജന് ഉണ്ട്. സിലിക്കണ്, ഇരുമ്പ്, അലുമിനിയം മുതലായവയുടെ യൗഗികങ്ങള് പ്രകൃതിയില് ധാരാളം ലഭിക്കുന്നു. ഓക്സൈഡുകള്, കാര്ബണേറ്റുകള്, സള്ഫേറ്റുകള്, ഫോസ്ഫേറ്റുകള്, സിലിക്കേറ്റുകള് തുടങ്ങിയ നിരവധി ഖനിജങ്ങളിലും ഓക്സിജന് അടങ്ങിയിട്ടുണ്ട്. സസ്യങ്ങളുടെയും ജന്തുക്കളുടെയും ശരീരനിര്മിതിക്ക് ഉപയോഗിക്കപ്പെട്ടിട്ടുള്ള പദാര്ഥങ്ങളില് പ്രമുഖസ്ഥാനമാണ് ഓക്സിജനുള്ളത്. മനുഷ്യശരീരത്തിന്റെ 65 ശതമാനം ഭാരം ഓക്സിജന്റേതാണ്.
നിര്മാണം. ഓക്സിജന്റെ നിര്മാണത്തിന് അനേകം വിധികളുണ്ട്. മെര്ക്കുറി, വെള്ളി, സ്വര്ണം, പ്ലാറ്റിനം തുടങ്ങിയ ലോഹങ്ങളുടെ ഓക്സൈഡുകള് തപിപ്പിച്ചാല് ഓക്സിജന് മോചിക്കപ്പെടുന്നു.
ഓക്സിജന് അധികമുള്ള നൈട്രറ്റുകള്, ക്ലോറേറ്റുകള്, പെര്ക്ലോറേറ്റുകള്, ബ്രാമേറ്റുകള്, അയോഡേറ്റുകള്, പെര്സല്ഫേറ്റുകള്, പെര്മാംഗനേറ്റുകള്, ഡൈക്രാമേറ്റുകള് തുടങ്ങിയവ ചൂടാക്കുമ്പോഴും ഓക്സിജന് കിട്ടുന്നു.
പൊട്ടാസ്യം പെര്മാംഗനേറ്റ് ചൂടാക്കി കിട്ടുന്ന ഓക്സിജന് ശുദ്ധമാണ്. സോഡിയം മുതലായ ലോഹങ്ങളുടെ പെറോക്സൈഡും ജലവും തമ്മില് പ്രവര്ത്തിപ്പിച്ച് ഓക്സിജന് നിര്മിക്കാവുന്നതാണ്.
ക്ലോറിന്ജലം വെയിലത്തു വയ്ക്കുകയോ സാന്ദ്രബ്ലീച്ചിങ് പൗഡര് ലായനിയോടു കോബാള്ട്ട് ക്ലോറൈഡ് ചേര്ക്കുകയോ ചെയ്യുമ്പോള് ഓക്സിജന് മോചിപിക്കപ്പെടുന്നു.
അരുണതപ്തമായ പോര്സെലിന് നാളിയില്ക്കൂടി നീരാവിയും ക്ലോറിനും അടങ്ങിയ മിശ്രിതം കടത്തിവിടുമ്പോള് ഓക്സിജന് ലഭ്യമാകുന്നു.
മാംഗനീസ് ഡൈഓക്സൈഡ്, പൊട്ടാസ്യം പെര്മാംഗനേറ്റ്, ഡൈക്രാമേറ്റ്, ക്രാമിയം ട്രഓക്സൈഡ് മുതലായ ലവണങ്ങളോട് സാന്ദ്ര സള്ഫ്യൂരിക് അമ്ലം ചേര്ത്തുചൂടാക്കിയും ഓക്സിജന് നിര്മിക്കാവുന്നതാണ്.
അല്പം അമ്ലമോ അഥവാ അല്പം ക്ഷാരമോ ചേര്ന്ന ജലം വിദ്യുദപഘടനം ചെയ്യുമ്പോള് ആനോഡില് ഓക്സിജന് മോചിക്കപ്പെടുന്നു.
ബേരിയം ഹൈഡ്രാക്സൈഡിന്റെ ജലലായനി വിദ്യുദപഘടനവിധേയമാക്കുമ്പോള് ആനോഡില് ശുദ്ധ ഓക്സിജന് ലഭിക്കുന്നു. പരീക്ഷണശാലയില് പൊട്ടാസ്യം ക്ലോറേറ്റ് ചൂടാക്കിയാണ് ഓക്സിജന് സാധാരണയായി നിര്മിക്കുന്നത്. ഉത്പ്രരകമായി മാംഗനീസ് ഡൈഓക്സൈഡും ഉപയോഗിക്കുന്നു.
പരിശുദ്ധ ഓക്സിജന് ലഭിക്കുവാന് പൊട്ടാസ്യം പെര്മാംഗനേറ്റ് നേര്ത്ത സല്ഫ്യൂരിക് അമ്ലത്തില് അലിയിച്ചു കിട്ടുന്ന ലായനി, ഹൈഡ്രജന് പെറോക്സൈഡ് ലായനിയോട് ചേര്ക്കുകയാണ് പതിവ്.
വ്യാവസായിക നിര്മാണം. ഓക്സിജന്റെ വ്യാവസായികനിര്മാണത്തിന് മൂന്നു പ്രക്രിയകള് ഉപയോഗിച്ചുവരുന്നു. 1. ബ്രിന് പ്രക്രിയ. ബ്രിന് ആവിഷ്കരിച്ച ഈ പ്രക്രിയയില് അന്തരീക്ഷ ഓക്സിജന്, ബേരിയം ഓക്സൈഡ് ഉപയോഗിച്ചു വേര്തിരിക്കുന്നു. ബേരിയം ഓക്സൈഡ് അരുണതപ്തമാകുന്നതുവരെ ചൂടാക്കുമ്പോള് അത് അന്തരീക്ഷത്തില്നിന്ന് ഓക്സിജന് അവശോഷണം ചെയ്ത് ബേരിയം പെറോക്സൈഡായി മാറുന്നു.
കുറേക്കൂടി ശക്തിയായി ചൂടാക്കുമ്പോള് പെറോക്സൈഡ് വിഘടിച്ച് ഓക്സൈഡായി മാറുന്നതോടൊപ്പം ഓക്സിജന് മോചിപിക്കപ്പെടുകയും ചെയ്യുന്നു.
ഇപ്രകാരം ഇടവിട്ടിടവിട്ട് താപനില കൂട്ടുകയും കുറയ്ക്കുകയും ചെയ്ത് അന്തരീക്ഷത്തിലെ ഓക്സിജന് വന്തോതില് വേര്തിരിച്ച് എടുക്കുന്നു. താപനില കൂട്ടുന്നതിനുപകരം മര്ദം കുറയ്ക്കുകയാണെങ്കില് ബേരിയം പെറോക്സൈഡ് വിഘടിച്ച് ബേരിയം ഓക്സൈഡും ഓക്സിജനുമായി മാറുന്നു. ഓക്സിജന് നീക്കംചെയ്തു മര്ദം കൂട്ടിയാല് ബേരിയം ഓക്സൈഡ് വായുവിനെ ഓക്സിജനുമായി സംയോജിപിച്ച് പെറോക്സൈഡായി മാറുന്നു. ഇത് വീണ്ടും ഉപയോഗിക്കാം.
2. ക്ലൗഡ് പ്രക്രിയ. വായുവില്നിന്ന് ഓക്സിജനും നൈട്രജനും വേര്തിരിക്കുകയാണ് ക്ലൗഡ് ആവിഷ്കരിച്ച ഈ പ്രക്രിയയില് ചെയ്യുന്നത്. ഓക്സിജന്റെ തിളനില-182.5°C-ഉം നൈട്രജന്റേത്-195°C-ഉം ആകുന്നു. തിളനിലകള് തമ്മില് 12.5°C-ന്റെ വ്യത്യാസമുള്ളതിനാല് ആംശികസ്വേദനം (fractional distillation)വഴി രണ്ടു വാതകങ്ങളെയും ദ്രവവായുവില് നിന്നും വേര്തിരിക്കുവാന് സാധിക്കുന്നു.
20-35 അന്തരീക്ഷമര്ദത്തില് വായുശേഖരിച്ച് രുദ്ധതാപീയവികാസം ഉപയോഗിച്ചു തണുപ്പിച്ച് ക്ലൗഡ് ഉപകരണത്തിലേക്ക് കടത്തുന്നു. നേരത്തേ ലഭിച്ചിട്ടുള്ള ദ്രവ ഓക്സിജന്കൊണ്ട് ആവൃതങ്ങളായ ഇടുങ്ങിയ പൈപ്പുകളില്ക്കൂടി മുകളിലേക്ക് പ്രവഹിക്കുന്ന സമ്മര്ദിതവായു ഒന്നുകൂടി തണുക്കുകയും തത്ഫലമായി അതിന്റെ ഒരു ഭാഗം ദ്രവീകരിച്ച് ഒരു പാത്രത്തില് വീഴുകയും ചെയ്യുന്നു. ഓക്സിജന്റെ തിളനില നൈട്രജന്റെ തിളനിലയെക്കാള് ഉയര്ന്നതാകയാല് ഈ ദ്രവവായു ഓക്സിജന് സമൃദ്ധമായിരിക്കും. നൈട്രജന്-സമൃദ്ധമായ ദ്രവീകരിക്കാത്ത വായുവാകട്ടെ മുകളിലേക്ക് പ്രവഹിച്ച് പിന്നീട് ദ്രവീഭവിക്കുകയും മറ്റൊരു പാത്രത്തില് വീഴുകയുംചെയ്യുന്നു. ഓക്സിജന് സമൃദ്ധദ്രവം വീണ്ടും മുകളിലേക്ക് പ്രവഹിച്ച് ശുദ്ധ ഓക്സിജന് സമൃദ്ധമാവുകയും തുടര്ന്ന് ഇതില്നിന്നു വീണ്ടും ദ്രവീകരിച്ച് കിട്ടുന്ന അംശം ശുദ്ധഓക്സിജനായി മാറുകയും ചെയ്യുന്നു. ഇവിടെ ദ്രവീകരിക്കാതെ മുകളിലേക്ക് പ്രവഹിക്കുന്ന വായു നേരത്തേ ഉണ്ടായ നൈട്രജന് പ്രവാഹവുമായി കൂട്ടിമുട്ടുകയും ദ്രവ നൈട്രജന്റെ തണുപ്പുകാരണം, വായുവിലടങ്ങിയതും അതുവരെ ദ്രവീകരിക്കാത്തതുമായ ഓക്സിജന് ദ്രവീകരിക്കുകയും ശുദ്ധ ഓക്സിജന് സംഭരണിയില് ചെന്നുവീഴുകയും ചെയ്യുന്നു. ക്ലൗഡ് പ്രക്രിയയില് ശുദ്ധ ഓക്സിജനോടൊപ്പം തന്നെ ശുദ്ധ നൈട്രജനും വേര്തിരിച്ചുകിട്ടുന്നുണ്ട്.
3. വിദ്യുതപഘടനാരീതി. അല്പം അമ്ലമോ അഥവാ ക്ഷാരമോ ചേര്ത്ത ജലം വിദ്യുതപഘടനം ചെയ്യുമ്പോള് അത് ഹൈഡ്രജന് വാതകവും ഓക്സിജന് വാതകവുമായി വിഘടിക്കുന്നു.
10 ശതമാനം കോസ്റ്റിക് സോഡാലായനി നിക്കല് ലേപിതമായ ഇരുമ്പു ഇലക്ട്രാഡുകള് ഉപയോഗിച്ച് വിദ്യുതപഘടനം ചെയ്യുമ്പോള് കാഥോഡില് ഹൈഡ്രജനും ആനോഡില് ഓക്സിജനും മോചിക്കപ്പെടുന്നു.
വിദ്യുച്ഛക്തിക്ക് വിലകുറഞ്ഞ സ്ഥലങ്ങളിലാണ് ഓക്സിജന് നിര്മാണത്തിന് ഈ രീതി ഉപയോഗിച്ചുവരുന്നത്.
ഭൗതികഗുണധര്മങ്ങള്. ഓക്സിജന് മൂലകത്തിന് നിറമോ മണമോ രുചിയോ ഇല്ല. ഒരു വാതകമാണ്. വായുവിനെക്കാള് അല്പം കൂടുതല് സാന്ദ്രമാണ്. ഘനത്വം 1.429 ഗ്രാം/ലിറ്റര്. ക്രാന്തിക താപനില-118.75°C-ഉം ക്രാന്തികമര്ദം 49.7 അന്തരീക്ഷവുമാണ്. വെള്ളത്തില് അല്പമായി മാത്രമേ ലയിക്കുന്നുള്ളു; ഒരു ലിറ്റര് വെള്ളത്തില് 0°C-ഉം, 760 മില്ലി മീറ്റര് മര്ദമുള്ള ഓക്സിജന്വാതകം 48.9 മില്ലി ലിറ്റര് മാത്രമേ ലയിക്കുന്നുള്ളൂ.
ദ്രവഓക്സിജന്. നേര്ത്ത നീലനിറമാണ് ഇതിനുള്ളത്. തിളനില-183°C-ഉം ഘനത്വം 1.1315 ഗ്രാം/ഘന സെന്റീമീറ്ററും ആകുന്നു. ദ്രവഓക്സിജന്റെ തന്മാത്രയിലുള്ള രണ്ട് ഓക്സിജന് പരമാണുക്കളിലും ഓരോ അയുഗ്മ ഇലക്ട്രാണുകള് ഉള്ളതിനാല് ഇത് അനുകാന്തീയ സ്വഭാവം കാണിക്കുന്നു.
ഖര ഓക്സിജന്. ഇതിന്റെയും നിറം നീലയാണ്. ഉരുകല്നില-218.4°C-ഉം ഘനത്വം 1.568 ഗ്രാം/ഘന സെന്റീമീറ്ററും ആകുന്നു. ദ്രവ ഓക്സിജന് ശീഘ്രബാഷ്പീകരണംമൂലം ഖരപദാര്ഥമാവുകയില്ല. എന്നാല് ഖര ഹൈഡ്രജന് ഉപയോഗിച്ച് തണുപ്പിക്കുന്ന പക്ഷം ദ്രവഓക്സിജനില് നിന്നു ക്രിസ്റ്റലുകള് വേര്തിരിഞ്ഞു കിട്ടുന്നതാണ്. ഓക്സിജന്റെ മൂന്നു ക്രിസ്റ്റലീയ രൂപാന്തരങ്ങളുണ്ട്.
മരക്കരി തുടങ്ങിയവ ഓക്സിജനെ താഴ്ന്ന ഊഷ്മാവില് അവശോഷിക്കുന്നു. ഉയര്ന്ന ഊഷ്മാവിലാകട്ടെ ഈ ഓക്സിജന് പുറന്തള്ളപ്പെടുന്നു. സ്വര്ണം, വെള്ളി, പ്ലാറ്റിനം, പലേഡിയം തുടങ്ങിയ ലോഹങ്ങള് ഓക്സിജനെ ഉയര്ന്ന ഊഷ്മാവിലാണ് അവശോഷിക്കുന്നത്. ഉരുകിയ വെള്ളിയില് അവശോഷിക്കപ്പെടുന്ന ഓക്സിജന് പുറന്തള്ളപ്പെടണമെങ്കില് ലോഹത്തെ തണുപ്പിക്കുകയാണു വേണ്ടത്. ക്ഷാരീയ പൈറോഗലോള് ഓക്സിജന്റെ നല്ല വിലായകമാണ്.
ഓക്സിജന്റെ അപരരൂപമാണ് ഓസോണ്. ഓസോണിന്റെ തന്മാത്രയില് മൂന്ന് ഓക്സിജന് അണുക്കളാണുള്ളത്.
രാസഗുണധര്മങ്ങള്. ഓക്സിജന് അമ്ലീയമോ ക്ഷാരീയമോ അല്ല. ദാഹ്യവുമല്ല. എന്നാല് ഒരു നല്ല ദഹനസഹായിയാണ്. സാധാരണതാപനിലയില് ഓക്സിജന് രാസപ്രവര്ത്തനങ്ങളില് ഊര്ജസ്വലമല്ല, ഉയര്ന്ന താപനിലയിലാകട്ടെ, മിക്കവാറും എല്ലാ മൂലകങ്ങളും ഓക്സിജനുമായി സംയോജിച്ച് ഓക്സൈഡായി രൂപാന്തരപ്പെടുന്നു. വായുവില് കത്തുന്ന പദാര്ഥങ്ങള് ഓക്സിജനില് കൂടുതല് പ്രകാശത്തോടെ കത്തുന്നു. താപത്തെയും പ്രകാശത്തെയും മോചിപ്പിച്ചുകൊണ്ട് പദാര്ഥങ്ങള് ഓക്സിജനില് കത്തുന്ന പ്രക്രിയ ജ്വലനമെന്ന പേരിലാണ് അറിയപ്പെടുന്നത്.
സാധാരണ താപനിലയില് സോഡിയം, പൊട്ടാസ്യം, ഫോസ്ഫറസ്, സല്ഫര് തുടങ്ങിയ മൂലകങ്ങള് ഓക്സിജനില് കത്തി ഓക്സൈഡായി മാറുന്നു. സോഡിയം മഞ്ഞജ്വാലയോടും പൊട്ടാസ്യം ലൈലാക് (lilac) ജ്വാലയോടും ഫോസ്ഫറസ് കണ്ണഞ്ചിപ്പിക്കുന്ന ശ്വേതപ്രകാശത്തോടെയും സല്ഫര് നീലകലര്ന്ന വയലറ്റ് ജ്വാലയോടുംകൂടി കത്തുന്നു. ചുവന്നു തപ്തമായ കരിക്കട്ട ഓക്സിജനില് ഉജ്ജ്വലശോഭയോടെ കത്തി കാര്ബണ് ഡൈഓക്സൈഡായിത്തീരുന്നു. കത്തുന്ന മഗ്നീഷ്യം കൂടുതല് ശോഭയോടെ കത്തുകയും മഗ്നീഷ്യം ഓക്സൈഡ് ഉണ്ടാവുകയും ചെയ്യുന്നു. ഹൈഡ്രജനും ഓക്സിജനും തമ്മിലുള്ള സംയോജനത്തെ സ്പോഞ്ജിക-അസ്ബസ്റ്റോസ് ഉത്പ്രരിപ്പിക്കുന്നു. വെള്ളമാണ് ഈ സംയോജനത്തിന്റെ ഫലമായി ലഭിക്കുന്നത്. ചെമ്പ്, മെര്ക്കുറി മുതലായവ വളരെ പ്രയാസപ്പെട്ടുമാത്രമേ ഓക്സിജനില് കത്തി ഓക്സൈഡ് ആയി രൂപാന്തരപ്പെടുന്നുള്ളൂ. ഹീലിയം, ആര്ഗോണ് തുടങ്ങിയ നിഷ്ക്രിയ വാതകങ്ങള് ഓക്സിജനുമായി പ്രതിപ്രവര്ത്തിക്കുന്നില്ല. പല യൗഗികങ്ങളുമായും ഓക്സിജന് രാസപ്രവര്ത്തനം നടത്തുന്നുണ്ട്. ഓക്സിജന് നൈട്രിക് ഓക്സൈഡുമായി സംയോജിച്ച് നൈട്രജന് ഡൈ ഓക്സൈഡിന്റെ ചുവന്ന ധൂമമായി മാറുന്നു.
പ്ലാറ്റിനീകരിച്ച ആസ്ബസ്റ്റാസിന്റെ സാന്നിധ്യത്തില് ഓക്സിജന്, സല്ഫര് ഡൈഓക്സൈഡുമായി പ്രവര്ത്തിച്ച് സല്ഫര് ട്രഓക്സൈഡ് ആയി മാറുന്നു.
അമോണിയ, ഹൈഡ്രജന് ക്ലോറൈഡ് എന്നീ യൗഗികങ്ങളുമായി പ്രവര്ത്തിച്ച് ഓക്സിജന് അവയെ യഥാക്രമം നൈട്രിക് ഓക്സൈഡ്, ക്ലോറിന് എന്നിവയായി രൂപാന്തരപ്പെടുത്തുന്നു.
ഈ പ്രതിപ്രവര്ത്തനങ്ങള് വ്യാവസായികമണ്ഡലത്തില് അതിപ്രധാനങ്ങളാണ്. നിദര്ശനം. (1) ഓക്സിജന് ഒരു ഈര്ക്കില് കനലിനെ ആളിക്കത്തിക്കാന് സാധിക്കും. (2) ക്ഷാരകീയ പൈറോഗാലേറ്റ് ലായനി ഓക്സിജനെ അവശോഷിക്കുന്നു. (3) നൈട്രിക് ഓക്സൈഡുമായി കൂട്ടിക്കലര്ത്തിയാല് ഓക്സിജന് അതിനോട് സംയോജിച്ച് നൈട്രജന് ഡൈഓക്സൈഡിന്റെ ചുവന്ന ധൂമം തരുന്നു.
അണുഓക്സിജന്. സാധാരണ താപനിലയില് ഓക്സിജന്റെ തന്മാത്രകള് സ്ഥായിയാണ്. എന്നാല് വളരെ ഉയര്ന്ന താപനിലയില് അവ വിഘടിക്കുന്നു. O2 = 2[O] - 116.4കിലോ കലോറി 760 മില്ലി മീറ്റര് മര്ദമുള്ള ഓക്സിജന്റെ വിഘടന ശതമാനം വിവിധ താപനിലകളില് താഴെ കൊടുത്തിരിക്കുന്നു:
താഴ്ന്ന മര്ദത്തിലുള്ള ഓക്സിജന് വാതകം വൈദ്യുതവിസര്ജനത്തിന് പാത്രമാകുമ്പോള് ഓക്സിജനിലെ ഉദ്ദേശം 20 ശതമാനം തന്മാത്രകള് അണുക്കളായി വിഘടിക്കുന്നതു കാണാം.
അണു ഓക്സിജന് സാധാരണ ഓക്സിജനിലും കൂടുതല് പ്രവര്ത്തനക്ഷമതയുള്ളതാണ്. ഇത് ഹൈഡ്രജന് ക്ലോറൈഡിനെ ചെറിയതോതില് മാത്രമേ വിഘടിപ്പിക്കുന്നുള്ളൂ. എന്നാല് ഹൈഡ്രജന് ബ്രാമൈഡിനെ ഓക്സിഡൈസ് ചെയ്ത് ബ്രാമിനും ജലവും തരുന്നു. അമോണിയയുമായി ചേരുമ്പോള് അത് ഒരു സ്ഫോടകപദാര്ഥമായിത്തീരുന്നു. ക്ലോറിനുമായി പ്രവര്ത്തിച്ച് ക്ലോറസ് ഓക്സൈഡും ക്ലോറിന് ഡൈഓക്സൈഡും തരുന്നു.
ഉപയോഗങ്ങള്. ജീവസന്ധാരണത്തിന് ഓക്സിജന് അനിവാര്യമാണ്. ഓക്സിജന് ഇല്ലെങ്കില് ജീവന്റെ നിലനില്പ്പ് അസാധ്യമാണ്. മിനിട്ടുകള്പോലും ജീവന് നിലനില്ക്കുകയില്ല. പദാര്ഥങ്ങളുടെ ജ്വലനത്തിന് ഓക്സിജന് കൂടിയേ തീരൂ. പര്വതാരോഹകര്ക്കും വെള്ളത്തിനടിയില് മുങ്ങുന്നവര്ക്കും അഗ്നിശമനപ്രവര്ത്തകര്ക്കും ബഹിരാകാശസഞ്ചാരികള്ക്കും ശ്വസനാവശ്യത്തിന് ഓക്സിജന് പ്രത്യേകമായി വേണ്ടതുണ്ട്. 5-10 ശതമാനം കാര്ബണ് ഡൈഓക്സൈഡ് ചേര്ത്ത ഓക്സിജനാണ് ഇതിനുപയുക്തം. സാധാരണഗതിയിലുള്ള ശ്വസനം വിഷമകരമായി അനുഭവപ്പെടുന്ന രോഗികള്ക്ക് ശ്വസനത്തിനുവേണ്ടി ആശുപത്രികളില് ഓക്സിജന് ഉപയോഗിക്കുന്നു. ലോഹനിഷ്കര്ഷണപ്രക്രിയകളിലും മറ്റു വ്യാവസായികപ്രക്രിയകളിലും ഓക്സീകാരിയായി ഇതുപയോഗിക്കുന്നു. ഓക്സിജനില് സല്ഫര് കത്തിച്ചുകിട്ടുന്ന സല്ഫര് ഡൈഓക്സൈഡ് വീണ്ടും ഓക്സീകരിച്ച് സല്ഫര് ട്ര ഓക്സൈഡാക്കി മാറ്റി സല്ഫ്യൂരിക് അമ്ലം ഉണ്ടാക്കുവാന് ഉപയോഗിക്കുന്നു. ഓസ്വാള്ഡ് പ്രക്രിയയിലാകട്ടെ, ഓക്സിജന് ഉപയോഗിച്ച് ഓക്സീകരിച്ച അമോണിയയില്നിന്നാണ് നൈട്രിക് അമ്ലം ഉത്പാദിപ്പിക്കുന്നത്. ഇരുമ്പു വ്യവസായത്തിലും സ്റ്റീല് വ്യവസായത്തിലും ഓക്സിജന് വളരെയേറെ പ്രയോജനകാരിയാണ്. കരി, ലിഗ്നൈറ്റ്, ഹൈഡ്രാകാര്ബണുകള് മുതലായവ വാട്ടര് ഗ്യാസാക്കി മാറ്റുവാന് ഓക്സിജന് അത്യന്താപേക്ഷിതമാണ്. അസറ്റാള്ഡിഹൈഡ്, ലിന്സീഡ് എണ്ണ മുതലായവ ഓക്സീകരിക്കാനും ഓക്സിജന് ഉപയോഗിക്കുന്നു. ഉയര്ന്ന ഉരുകല്നിലയുള്ള ലോഹങ്ങള് ഉരുക്കുവാനും മുറിക്കുവാനും കൂട്ടിച്ചേര്ക്കുവാനും വിളക്കുവാനുംവേണ്ടി ഉപകരിക്കുന്ന ഓക്സി-അസറ്റലിന് ബ്ലോപൈപ്പിലും, ഓക്സി-ഹൈഡ്രജന് ബ്ലോപൈപ്പിലും ഓക്സിജന് വേണം. ഓക്സി-അസറ്റലിന് ജ്വാലകൊണ്ട് 3100-3315ºC- വരെയും ഓക്സി-ഹൈഡ്രജന് ജ്വാലകൊണ്ട് 2800ºC-വരെയും ഉയര്ന്ന താപനില ലഭിക്കുന്നു. നോ. ഓക്സൈഡുകള്; ഓക്സിഡൈസിങ് ഏജന്റുകള്; ഓക്സിഡേഷന് റിഡക്ഷന്
(ആര്. രത്നാംബാള്)