This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
അയോണിക ക്രിസ്റ്റല്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
(→അയോണിക ക്രിസ്റ്റല്) |
Mksol (സംവാദം | സംഭാവനകള്) (→അയോണിക ക്രിസ്റ്റല്) |
||
| (ഇടക്കുള്ള 6 പതിപ്പുകളിലെ മാറ്റങ്ങള് ഇവിടെ കാണിക്കുന്നില്ല.) | |||
| വരി 2: | വരി 2: | ||
Ionic crystal | Ionic crystal | ||
| - | [[Image:page137a1.png| | + | [[Image:page137a1.png|200px|right]] |
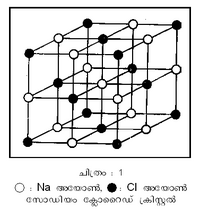
ക്രിസ്റ്റലുകളുടെ ഒരു വിഭാഗം. ഒരു ക്രിസ്റ്റലിലെ അണുക്കളെ തമ്മില് ബന്ധിപ്പിച്ചു നിര്ത്തി അതിനു ദൃഢത നല്കുന്ന ബലങ്ങളുടെ തോതനുസരിച്ച് ക്രിസ്റ്റലുകളെ നാലു വകുപ്പായി തിരിച്ചിട്ടുള്ളതില് ഒരു വിഭാഗമാണിത്. അയോണുകള് തമ്മിലുള്ള ആകര്ഷണമാണ് അയോണിക ക്രിസ്റ്റലുകളുടെ ഘടനയിലെ മുഖ്യാംശം. അതായത് ചില അണുക്കള് മറ്റു ചിലതിന് ഇലക്ട്രോണുകള് പ്രദാനം ചെയ്യുകയും അങ്ങനെയുണ്ടാകുന്ന അയോണുകള് തമ്മില് ആകര്ഷണബലംകൊണ്ട് ഉറച്ചുനില്ക്കുകയും ചെയ്യുന്നു. ഉദാ. സോഡിയം ക്ലോറൈഡ് (Na Cl) ക്രിസ്റ്റല്. ഒരു ഇലക്ട്രോണ് ക്ലോറിന് അണുവിനു വിട്ടുകൊടുത്ത Na<sup>+</sup> അയോണും ഇലക്ട്രോണ് നേടിയ Cl<sup>-</sup> അയോണും തമ്മിലുള്ള വൈദ്യുത ആകര്ഷണം അതില് പ്രവര്ത്തിക്കുന്നു. ധനാത്മകവും ഋണാത്മകവും ആയ ചാര്ജുകള് തമ്മിലുള്ളത് 'കൂളും' (Coulomb) ആകര്ഷണം തന്നെയാണ്. ഈ ബലത്തെ ആസ്പദമാക്കി ക്രിസ്റ്റലിന്റെ ജാലികോര്ജം (lattice energy) ഏറെക്കുറെ നിര്ണയിക്കാന് സാധിക്കുമെന്ന് ബോണ് എന്ന ശാസ്ത്രജ്ഞന് തെളിയിച്ചു. ഉദാ. സോഡിയം ക്ലോറൈഡിന്റെ ഘടന നോക്കുക (ചിത്രം 1). ഒരു ക്യൂബിന്റെ രൂപമാണ് അതിലെ മാനകത്തിനുള്ളത്. മൂലകളില് Na<sup>+</sup>,Cl<sup>-</sup>എന്നീ അയോണുകള് ഇടവിട്ടു സ്ഥിതിചെയ്യുന്നു. ഒരു പ്രത്യേക Na<sup>+</sup> അയോണ് സങ്കല്പിച്ചാല് അതിനു ചുറ്റും തൊട്ടടുത്തുള്ളത് 6 Cl<sup>-</sup> അയോണുകളായിരിക്കും. പിന്നെ വരുന്നത് | ക്രിസ്റ്റലുകളുടെ ഒരു വിഭാഗം. ഒരു ക്രിസ്റ്റലിലെ അണുക്കളെ തമ്മില് ബന്ധിപ്പിച്ചു നിര്ത്തി അതിനു ദൃഢത നല്കുന്ന ബലങ്ങളുടെ തോതനുസരിച്ച് ക്രിസ്റ്റലുകളെ നാലു വകുപ്പായി തിരിച്ചിട്ടുള്ളതില് ഒരു വിഭാഗമാണിത്. അയോണുകള് തമ്മിലുള്ള ആകര്ഷണമാണ് അയോണിക ക്രിസ്റ്റലുകളുടെ ഘടനയിലെ മുഖ്യാംശം. അതായത് ചില അണുക്കള് മറ്റു ചിലതിന് ഇലക്ട്രോണുകള് പ്രദാനം ചെയ്യുകയും അങ്ങനെയുണ്ടാകുന്ന അയോണുകള് തമ്മില് ആകര്ഷണബലംകൊണ്ട് ഉറച്ചുനില്ക്കുകയും ചെയ്യുന്നു. ഉദാ. സോഡിയം ക്ലോറൈഡ് (Na Cl) ക്രിസ്റ്റല്. ഒരു ഇലക്ട്രോണ് ക്ലോറിന് അണുവിനു വിട്ടുകൊടുത്ത Na<sup>+</sup> അയോണും ഇലക്ട്രോണ് നേടിയ Cl<sup>-</sup> അയോണും തമ്മിലുള്ള വൈദ്യുത ആകര്ഷണം അതില് പ്രവര്ത്തിക്കുന്നു. ധനാത്മകവും ഋണാത്മകവും ആയ ചാര്ജുകള് തമ്മിലുള്ളത് 'കൂളും' (Coulomb) ആകര്ഷണം തന്നെയാണ്. ഈ ബലത്തെ ആസ്പദമാക്കി ക്രിസ്റ്റലിന്റെ ജാലികോര്ജം (lattice energy) ഏറെക്കുറെ നിര്ണയിക്കാന് സാധിക്കുമെന്ന് ബോണ് എന്ന ശാസ്ത്രജ്ഞന് തെളിയിച്ചു. ഉദാ. സോഡിയം ക്ലോറൈഡിന്റെ ഘടന നോക്കുക (ചിത്രം 1). ഒരു ക്യൂബിന്റെ രൂപമാണ് അതിലെ മാനകത്തിനുള്ളത്. മൂലകളില് Na<sup>+</sup>,Cl<sup>-</sup>എന്നീ അയോണുകള് ഇടവിട്ടു സ്ഥിതിചെയ്യുന്നു. ഒരു പ്രത്യേക Na<sup>+</sup> അയോണ് സങ്കല്പിച്ചാല് അതിനു ചുറ്റും തൊട്ടടുത്തുള്ളത് 6 Cl<sup>-</sup> അയോണുകളായിരിക്കും. പിന്നെ വരുന്നത് | ||
| - | 12 Na<sup>+</sup> അയോണുകളാണ്. ഇങ്ങനെ എല്ലാ അയോണുകളുടെയും ആകര്ഷണവികര്ഷണങ്ങളുടെ കണക്കനുസരിച്ചു ലഭിക്കുന്ന ഊര്ജത്തെ Ec = -Ae<sup>2</sup>/r എന്നെഴുതാം. ഇതില് | + | 12 Na<sup>+</sup> അയോണുകളാണ്. ഇങ്ങനെ എല്ലാ അയോണുകളുടെയും ആകര്ഷണവികര്ഷണങ്ങളുടെ കണക്കനുസരിച്ചു ലഭിക്കുന്ന ഊര്ജത്തെ Ec = -Ae<sup>2</sup>/r എന്നെഴുതാം. ഇതില് A മഡേലുങ് സ്ഥിരാങ്കം (Madelung constant) എന്നറിയപ്പെടുന്നു. Na Cl ക്രിസ്റ്റലില് A = 1.747558ഉം e ഒരു അയോണ് ചാര്ജിന്റെ അളവിനെയും സൂചിപ്പിക്കുന്നു. എന്നാല് ആകര്ഷണം മാത്രമേ പ്രവര്ത്തിക്കുന്നുള്ളുവെങ്കില് അണുക്കള് തമ്മില് കൂടിച്ചേര്ന്നുപോകും. അതു സംഭവിക്കാത്തതിനാല് ഇതിനെതിരായ ഒരു വികര്ഷണവും പ്രവര്ത്തിക്കുന്നുണ്ട് എന്നു കരുതാം. അതിന്റെ ഊര്ജം B/r<sup>n</sup> (B ഒരു സ്ഥിരാങ്കം, r അയോണുകള് തമ്മിലുള്ള ദൂരം, n ഒരു പൂര്ണസംഖ്യ) ആണ് എന്നു ബോണ് സങ്കല്പിച്ചു. രണ്ടുംകൂടിച്ചേരുമ്പോള് ആകെ ഊര്ജം |
| - | + | -Ae<sup>2</sup>/r + B/r<sup>n</sup> | |
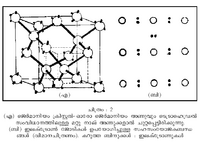
| + | എന്നു കിട്ടുന്നു. അത് ഏറ്റവും കുറവാകുന്നത് ഏതു ദൂരത്തിലാണോ ആ ദൂരത്തിലാണ് അയോണുകള് തമ്മില് സന്തുലിതാവസ്ഥ ഉണ്ടാകുന്നത്. അയോണിക ക്രിസ്റ്റലിന്റെ ഘടനയ്ക്ക് അടിസ്ഥാനം ഇതാണ്. | ||
| + | [[Image:page137a2.png|200px|left]] | ||
ക്വാണ്ടം ബലതന്ത്ര തത്ത്വങ്ങള്കൂടി ഉള്പ്പെടുത്തി മേല്പറഞ്ഞ സിദ്ധാന്തം സൂക്ഷ്മമായ പരിശോധനകള്ക്കു വിധേയമാക്കിയിട്ടുണ്ട്. അതനുസരിച്ച് താഴെ പറയുന്ന ഘടകങ്ങള്കൂടി പരിഗണിക്കപ്പെടണം. (1) വികര്ഷണോര്ജത്തിനു മുകളില് കൊടുത്തിട്ടുള്ള വാക്യം (B/r<sup>n</sup> ) അല്ല, Ce<sup>-r</sup> /ρ എന്നാണു വേണ്ടത്. (C,ρഎന്നിവ സ്ഥിരാങ്കങ്ങള്); (2) വാന്ഡര് വാള്സ് (Vander Waals) ബലങ്ങളെക്കൂടി ആകര്ഷണബലത്തില് ചേര്ക്കണം; (3) ക്രിസ്റ്റലിന്റെ ശൂന്യാങ്ക ഊര്ജവും (zero point energy) പരിഗണിക്കണം. നോ: അയോണ്; അയോണ് പ്രകീര്ണനം; അയോണീകാരിവികിരണം | ക്വാണ്ടം ബലതന്ത്ര തത്ത്വങ്ങള്കൂടി ഉള്പ്പെടുത്തി മേല്പറഞ്ഞ സിദ്ധാന്തം സൂക്ഷ്മമായ പരിശോധനകള്ക്കു വിധേയമാക്കിയിട്ടുണ്ട്. അതനുസരിച്ച് താഴെ പറയുന്ന ഘടകങ്ങള്കൂടി പരിഗണിക്കപ്പെടണം. (1) വികര്ഷണോര്ജത്തിനു മുകളില് കൊടുത്തിട്ടുള്ള വാക്യം (B/r<sup>n</sup> ) അല്ല, Ce<sup>-r</sup> /ρ എന്നാണു വേണ്ടത്. (C,ρഎന്നിവ സ്ഥിരാങ്കങ്ങള്); (2) വാന്ഡര് വാള്സ് (Vander Waals) ബലങ്ങളെക്കൂടി ആകര്ഷണബലത്തില് ചേര്ക്കണം; (3) ക്രിസ്റ്റലിന്റെ ശൂന്യാങ്ക ഊര്ജവും (zero point energy) പരിഗണിക്കണം. നോ: അയോണ്; അയോണ് പ്രകീര്ണനം; അയോണീകാരിവികിരണം | ||
(ഡോ. സി.പി. മേനോന്) | (ഡോ. സി.പി. മേനോന്) | ||
Current revision as of 11:43, 14 നവംബര് 2014
അയോണിക ക്രിസ്റ്റല്
Ionic crystal
ക്രിസ്റ്റലുകളുടെ ഒരു വിഭാഗം. ഒരു ക്രിസ്റ്റലിലെ അണുക്കളെ തമ്മില് ബന്ധിപ്പിച്ചു നിര്ത്തി അതിനു ദൃഢത നല്കുന്ന ബലങ്ങളുടെ തോതനുസരിച്ച് ക്രിസ്റ്റലുകളെ നാലു വകുപ്പായി തിരിച്ചിട്ടുള്ളതില് ഒരു വിഭാഗമാണിത്. അയോണുകള് തമ്മിലുള്ള ആകര്ഷണമാണ് അയോണിക ക്രിസ്റ്റലുകളുടെ ഘടനയിലെ മുഖ്യാംശം. അതായത് ചില അണുക്കള് മറ്റു ചിലതിന് ഇലക്ട്രോണുകള് പ്രദാനം ചെയ്യുകയും അങ്ങനെയുണ്ടാകുന്ന അയോണുകള് തമ്മില് ആകര്ഷണബലംകൊണ്ട് ഉറച്ചുനില്ക്കുകയും ചെയ്യുന്നു. ഉദാ. സോഡിയം ക്ലോറൈഡ് (Na Cl) ക്രിസ്റ്റല്. ഒരു ഇലക്ട്രോണ് ക്ലോറിന് അണുവിനു വിട്ടുകൊടുത്ത Na+ അയോണും ഇലക്ട്രോണ് നേടിയ Cl- അയോണും തമ്മിലുള്ള വൈദ്യുത ആകര്ഷണം അതില് പ്രവര്ത്തിക്കുന്നു. ധനാത്മകവും ഋണാത്മകവും ആയ ചാര്ജുകള് തമ്മിലുള്ളത് 'കൂളും' (Coulomb) ആകര്ഷണം തന്നെയാണ്. ഈ ബലത്തെ ആസ്പദമാക്കി ക്രിസ്റ്റലിന്റെ ജാലികോര്ജം (lattice energy) ഏറെക്കുറെ നിര്ണയിക്കാന് സാധിക്കുമെന്ന് ബോണ് എന്ന ശാസ്ത്രജ്ഞന് തെളിയിച്ചു. ഉദാ. സോഡിയം ക്ലോറൈഡിന്റെ ഘടന നോക്കുക (ചിത്രം 1). ഒരു ക്യൂബിന്റെ രൂപമാണ് അതിലെ മാനകത്തിനുള്ളത്. മൂലകളില് Na+,Cl-എന്നീ അയോണുകള് ഇടവിട്ടു സ്ഥിതിചെയ്യുന്നു. ഒരു പ്രത്യേക Na+ അയോണ് സങ്കല്പിച്ചാല് അതിനു ചുറ്റും തൊട്ടടുത്തുള്ളത് 6 Cl- അയോണുകളായിരിക്കും. പിന്നെ വരുന്നത് 12 Na+ അയോണുകളാണ്. ഇങ്ങനെ എല്ലാ അയോണുകളുടെയും ആകര്ഷണവികര്ഷണങ്ങളുടെ കണക്കനുസരിച്ചു ലഭിക്കുന്ന ഊര്ജത്തെ Ec = -Ae2/r എന്നെഴുതാം. ഇതില് A മഡേലുങ് സ്ഥിരാങ്കം (Madelung constant) എന്നറിയപ്പെടുന്നു. Na Cl ക്രിസ്റ്റലില് A = 1.747558ഉം e ഒരു അയോണ് ചാര്ജിന്റെ അളവിനെയും സൂചിപ്പിക്കുന്നു. എന്നാല് ആകര്ഷണം മാത്രമേ പ്രവര്ത്തിക്കുന്നുള്ളുവെങ്കില് അണുക്കള് തമ്മില് കൂടിച്ചേര്ന്നുപോകും. അതു സംഭവിക്കാത്തതിനാല് ഇതിനെതിരായ ഒരു വികര്ഷണവും പ്രവര്ത്തിക്കുന്നുണ്ട് എന്നു കരുതാം. അതിന്റെ ഊര്ജം B/rn (B ഒരു സ്ഥിരാങ്കം, r അയോണുകള് തമ്മിലുള്ള ദൂരം, n ഒരു പൂര്ണസംഖ്യ) ആണ് എന്നു ബോണ് സങ്കല്പിച്ചു. രണ്ടുംകൂടിച്ചേരുമ്പോള് ആകെ ഊര്ജം
-Ae2/r + B/rn
എന്നു കിട്ടുന്നു. അത് ഏറ്റവും കുറവാകുന്നത് ഏതു ദൂരത്തിലാണോ ആ ദൂരത്തിലാണ് അയോണുകള് തമ്മില് സന്തുലിതാവസ്ഥ ഉണ്ടാകുന്നത്. അയോണിക ക്രിസ്റ്റലിന്റെ ഘടനയ്ക്ക് അടിസ്ഥാനം ഇതാണ്.
ക്വാണ്ടം ബലതന്ത്ര തത്ത്വങ്ങള്കൂടി ഉള്പ്പെടുത്തി മേല്പറഞ്ഞ സിദ്ധാന്തം സൂക്ഷ്മമായ പരിശോധനകള്ക്കു വിധേയമാക്കിയിട്ടുണ്ട്. അതനുസരിച്ച് താഴെ പറയുന്ന ഘടകങ്ങള്കൂടി പരിഗണിക്കപ്പെടണം. (1) വികര്ഷണോര്ജത്തിനു മുകളില് കൊടുത്തിട്ടുള്ള വാക്യം (B/rn ) അല്ല, Ce-r /ρ എന്നാണു വേണ്ടത്. (C,ρഎന്നിവ സ്ഥിരാങ്കങ്ങള്); (2) വാന്ഡര് വാള്സ് (Vander Waals) ബലങ്ങളെക്കൂടി ആകര്ഷണബലത്തില് ചേര്ക്കണം; (3) ക്രിസ്റ്റലിന്റെ ശൂന്യാങ്ക ഊര്ജവും (zero point energy) പരിഗണിക്കണം. നോ: അയോണ്; അയോണ് പ്രകീര്ണനം; അയോണീകാരിവികിരണം
(ഡോ. സി.പി. മേനോന്)