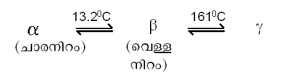This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ടിന്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
(New page: ടിന് ഠശി ഒരു ലോഹമൂലകം. സിം. ടി. സ്റ്റാനം (മിിൌാെേ) എന്ന ലത്തീന് പദത്തി...) |
(→ടിന്) |
||
| (ഇടക്കുള്ള 5 പതിപ്പുകളിലെ മാറ്റങ്ങള് ഇവിടെ കാണിക്കുന്നില്ല.) | |||
| വരി 1: | വരി 1: | ||
| - | ടിന് | + | =ടിന്= |
| + | Tin | ||
| - | + | ഒരു ലോഹമൂലകം. സിം. Sn സ്റ്റാനം (stannum) എന്ന ലത്തീന് പദത്തില്നിന്നാണ് ഈ സംജ്ഞ നിഷ്പന്നമായത്. അ. സ. 50, അ. ഭ. 118.69. ദ്ര. അ. 231.9°C . ക്വ. അ. 2270°C. ആവര്ത്തന പട്ടികയില് നാലാമത്തെ ഗ്രൂപ്പിലാണ് ടിന് ഉള്പ്പെട്ടിട്ടുള്ളത്. കാര്ബണ് (C<sup>6</sup>), സിലിക്കോണ് (Si<sup>14</sup>), ജര്മ്മേനിയം (Ge<sup>32</sup>), ലെഡ് (Pb<sup>82</sup>) എന്നിവയാണ് ഈ ഗ്രൂപ്പിലെ മറ്റ് മൂലകങ്ങള്. പ്രകൃതിയില് ടിന് സ്വതന്ത്രാവസ്ഥയില് ലഭ്യമല്ല. കാസിറ്ററൈറ്റ് (cassiterite) അഥവാ ടിന് സ്റ്റോണ് എന്ന ഓക്സൈഡ് ധാതു (SnO<sub>2</sub>) വില് നിന്നാണ് ടിന് വേര്തിരിച്ചെടുക്കുന്നത്. | |
| - | + | '''ഗുണധര്മങ്ങള്.''' വെള്ളി പോലെ തിളങ്ങുന്ന ലോഹമാണ് ടിന്. വായുവുമായി സമ്പര്ക്കം ഉണ്ടായാലും ഇതിന്റെ തിളക്കം മങ്ങുകയില്ല. ടിന്നിന് മൂന്ന് അലോട്രോപിക അവസ്ഥകളുണ്ട്. വെള്ള നിറമുള്ള β ടിന്, ചാര നിറമുള്ള αടിന്, റോമ്പിക് പരല് ഘടനയുള്ള&gama;ടിന്. | |
| - | + | [[Image:pno105.png]] | |
| - | + | ഏറ്റവും ശുദ്ധമായ ടിന് 13.2°C മുതല് സാവധാനം തണുക്കുമ്പോള് β ടിന്നില് നിന്ന് α ടിന്നിലേക്കുള്ള അവസ്ഥാന്തരം സംഭവിക്കും. എന്നാല് ടിന്നില് മാലിന്യങ്ങള് ഉണ്ടെങ്കില് അവ ഈ അവസ്ഥാന്തരത്തെ ചെറുക്കും. സാധാരണ ടിന്നില് (99.8% ശുദ്ധം) ബിസ്മത്ത്, ആന്റിമണി, ലെഡ്, സില്വര് തുടങ്ങിയ മാലിന്യങ്ങള് ഉണ്ടാവും. -50°C ല് താഴെയുള്ള താപനിലകളില് അവസ്ഥാന്തരം വളരെ വേഗത്തില് നടക്കുന്നതിനാല് ടിന് ചാരനിറത്തിലുള്ള പൊടിയായി തീരുന്നു. ഈ അവസ്ഥയെ ടിന്രോഗം എന്നു പറയുന്നു. ടിന് അടിച്ചു പരത്തി കനം കുറഞ്ഞ ഷീറ്റുകളാക്കാം (maleable). എന്നാല് വയറുകളും മറ്റും ഉണ്ടാക്കാന് സാധ്യമല്ല. ടിന്നിന് വളരെ വ്യവസ്ഥാപിതമായ ഒരു പരല് ഘടനയാണുള്ളത്. ടിന് തകിട് മടക്കുമ്പോള് ഈ പരലുകള് പൊട്ടുന്നതുകൊണ്ടാണ് പ്രത്യേക തരം ശബ്ദം (tin cry) ഉണ്ടാകുന്നത്. ടിന്നിന്റെ പത്ത് സമസ്ഥാനീയങ്ങള് പ്രകൃതിയില് ലഭ്യമാണ്. രാദശക്തിയുള്ള മറ്റ് ഇരുപത്തിയൊന്ന് സമസ്ഥാനീയങ്ങള് കൃത്രിമമായി ഉത്പാദിപ്പിച്ചിട്ടുമുണ്ട്. | |
| - | + | സാധാരണ താപനിലകളില് വായുവുമായി ടിന് പ്രതിപ്രവര്ത്തിക്കാറില്ല. 1500-1600°C വരെ ചൂടാക്കിയാല് വായുവില് കത്തിപ്പിടിക്കും. | |
| - | + | Sn + O<sub>2</sub> → SnO<sub>2</sub> | |
| - | + | അമ്ലങ്ങളുടെയും ക്ഷാരങ്ങളുടെയും ഗാഢലായനിയുമായി ടിന് പ്രതിപ്രവര്ത്തിക്കാറുണ്ട്. എന്നാല് നിര്വീര്യ ലായനികളും, എണ്ണ, ആല്ക്കഹോള്, ക്ലോറിനടങ്ങുന്ന ഹൈഡ്രോകാര്ബണുകള് തുടങ്ങിയ അജല ലായനികളുമായി ടിന് യാതൊരു വിധത്തിലും പ്രതിപ്രവര്ത്തിക്കുകയില്ല. +2, +4 എന്ന രണ്ട് സംയോജകതകള് ടിന് പ്രദര്ശിപ്പിക്കാറുണ്ട്. +2 സംയോജകതയുള്ള ടിന് സംയുക്തങ്ങള് സ്റ്റാനസ് സംയുക്തങ്ങള് എന്നും +4 സംയോജകതയുള്ളവ സ്റ്റാനിക് സംയുക്തങ്ങളെന്നുമാണ് അറിയപ്പെടുന്നത്. സ്റ്റാനസ് ഓക്സൈഡ് (SnO) കറുപ്പു കലര്ന്ന നീല നിറമുള്ള പരലുകളാണ്. സ്റ്റാനസ് ക്ലോറൈഡ് ക്ഷാരവുമായി പ്രതിപ്രവര്ത്തിച്ചുണ്ടാകുന്ന സ്റ്റാനസ് ഹൈഡ്രോക്സൈഡ്,p<sup>H</sup> നിയന്ത്രിതമായി നിലനിര്ത്തിക്കൊണ്ട് തിളപ്പിക്കുമ്പോള് SnO ഉണ്ടാകുന്നു. സ്റ്റാനസ് ഓക്സൈഡ് വായുവില് 385°C വരെ സ്ഥിരതയുള്ളതാണ്. അതിനു മുകളിലുള്ള താപനിലകളില് സ്റ്റാനിക് ഓക്സൈഡായി രൂപാന്തരം സംഭവിക്കുന്നു. അമ്ലങ്ങളിലും ക്ഷാരങ്ങളിലും അലേയമായ ഒരു വെളുത്ത പൊടിയാണ് സ്റ്റാനിക് ഓക്സൈഡ്. ഉയര്ന്ന മര്ദത്തിലുള്ള നീരാവിയുപയോഗിച്ച് കണികകളാക്കിയ ടിന്, ഓക്സിജന്റെ സാന്നിധ്യത്തില് കത്തിച്ചാണ് സ്റ്റാനിക് ഓക്സൈഡ് (SnO<sub>2</sub>2) ഉണ്ടാക്കുന്നത്. പാടലം, മഞ്ഞ, ചുവപ്പുകലര്ന്ന തവിട്ട് എന്നീ നിറങ്ങളിലുള്ള സിറാമിക്കുകളുടേയും, ഡൈ ഇലക്ട്രിക്, ഉച്ചതാപസഹപദാര്ഥങ്ങളുടെയും പ്രധാന ഘടകമാണ് SnO<sub>2</sub>. മാര്ബിള് തുടങ്ങിയ അലങ്കാര ശിലകള് മിനുക്കാനും സ്റ്റാനിക് ഓക്സൈഡ് ഉപയോഗിക്കാറുണ്ട്. ഹൈഡ്രജന് ക്ലോറൈഡ് വാതകവുമായോ ക്ലോറിനുമായി നേരിട്ടോ ടിന് പ്രതിപ്രവര്ത്തിപ്പിച്ച് സ്റ്റാനസ് ക്ലോറൈഡ് (SnCl<sub>2</sub>) ഉത്പാദിപ്പിക്കാം. കൂടുതല് ക്ലോറൈഡ് (Cl<sup>-</sup> ) അയോണിന്റെ സാന്നിധ്യത്തില് സ്റ്റാനിക് ക്ലോറൈഡ് (ടിഇഹSnCl<sub>4</sub>) ഉണ്ടാവുന്നു. എന്നാല് അതിലുമധികം Cl<sup>-</sup> അയോണ് ലായനിയിലുണ്ടെങ്കില് ക്ലോ റോസ്റ്റാനേറ്റ് എന്ന സങ്കീര്ണ അയോണ് (SnCl<sub>6</sub><sup>--</sup> ) രൂപീകൃതമാവുന്നു. സ്റ്റാനസ് ക്ലോറൈഡിലേക്ക്, NaOH ലായനി ചേര്ത്താല് സ്റ്റാനസ് ഹൈഡ്രോക്സൈഡ് Sn(OH)<sup>2</sup> ലഭിക്കുന്നു. Sn(OH)<sub>2</sub> കൂടുതലുള്ള NaOH-ല് ലയിച്ച് സ്റ്റാനൈറ്റ് അയോണ് Sn(OH)<sub>3</sub> ഉണ്ടാകുന്നു. സ്റ്റാനസ് ലവണങ്ങളിലേക്ക് ഹൈഡ്രജന് സള്ഫൈഡ് (H<sub>2</sub>S) കടത്തിവിടുമ്പോള് കടുംതവിട്ടുനിറത്തിലുള്ള അവക്ഷിപ്തമായി SnS ഉണ്ടാവുന്നു. സ്റ്റാനിക് ലവണങ്ങളില് നിന്ന് മഞ്ഞനിറത്തിലുള്ള സ്റ്റാനിക് സള്ഫൈഡ് (SnS<sub>2</sub>) ലഭ്യമാവുന്നു. | |
| - | + | ഓര്ഗാനോ ടിന് സംയുക്തങ്ങള് പ്രാധാന്യമര്ഹിക്കുന്നവയാണ്. ഈ സംയുക്തങ്ങളില് ഒരു കാര്ബണ് ടിന് ബന്ധം എങ്കിലും ഉണ്ടായിരിക്കും. ടിന് സാധാരണയായി +4 അവസ്ഥയിലായിരിക്കും. ടെട്രാ ഓര്ഗാനോ ടിന് സംയുക്തങ്ങളില് നിന്നാണ് മറ്റെല്ലാ ഓര്ഗാനോ ടിന് സംയുക്തങ്ങളും വ്യാവസായികമായി ഉത്പാദിപ്പിക്കുന്നത്. ആല്ക്കൈല്, അരൈല് ഗ്രൂപ്പുകള് അനായാസമായി ടിന്നിനു ചുറ്റുമായി അണിനിരക്കുന്നു എന്നതാണ് ഓര്ഗാനോ ടിന് സംയുക്തങ്ങളുടെ സവിശേഷത. ചിലയിനം ട്രൈ ആല്ക്കൈല്, ട്രൈ അരൈല് സംയുക്തങ്ങള്ക്ക് ജൈവനാശിക സ്വഭാവമുണ്ട്. മൂന്ന് കാര്ബണ് അണുക്കളുമായി ടിന് നേരിട്ട് ബന്ധപ്പെട്ടിരിക്കുകയും മൊത്തം കാര്ബണ് അണുക്കളുടെ എണ്ണം പന്ത്രണ്ട് ആയിരിക്കുകയും ചെയ്യുമ്പോഴാണ് ഈ സ്വഭാവം ഗാഢമാകുന്നത്. പൂപ്പല് നാശിനികള്, അണുനാശിനികള്, കീടനാശിനികള് എന്നീ നിലകളില് ഇത്തരം സംയുക്തങ്ങള് വ്യാപകമായി ഉപയോഗിച്ചു വരുന്നു. | |
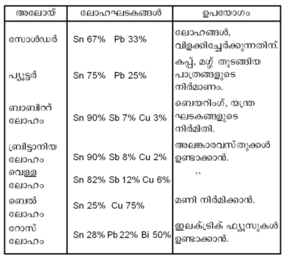
| - | + | '''ഉപയോഗങ്ങള്.''' അനേകം അലോയ്കളുടെ നിര്മാണത്തിന് ടിന് ഉപയോഗിക്കുന്നുണ്ട്. ടിന്നിന്റെ പ്രധാന അലോയ്കള്, ലോഹഘടകങ്ങള്, ഉപയോഗങ്ങള് എന്നിവ പട്ടികയില് കൊടുത്തിരിക്കുന്നു. | |
| - | + | [[Image:pno106.png|300px]] | |
| - | + | ടൂത്ത് പേസ്റ്റുകള്, ഔഷധ ലേപനങ്ങള് തുടങ്ങിയവ നിറയ്ക്കാനുള്ള ട്യൂബുകള് ടിന്നുകൊണ്ടാണുണ്ടാക്കുന്നത്. ശുദ്ധമായ ടിന്നും ടിന്നിന്റെ അലോയ്കളും ലോഹങ്ങള്ക്ക് ആവരണമായി ഉപയോഗിക്കാറുണ്ട്. വളരെ വേഗം ഓക്സീകൃതമായി ദ്രവിക്കുന്ന ലോഹങ്ങളുടെ സംരക്ഷണാവരണമായി ടിന് വര്ത്തിക്കും. ടിന് കൊണ്ടുള്ള ആവരണങ്ങള് അടിസ്ഥാനലോഹത്തിന് കൂടുതല് സോള്ഡറബിലിറ്റി, ആകര്ഷണീയത, പെയിന്റ് ചെയ്യാന് പറ്റുന്ന വൃത്തിയുള്ള ഒട്ടുന്ന പ്രതലം എന്നിവ പ്രദാനം ചെയ്യുന്നു. ഇരുമ്പ്, ഉരുക്ക് തുടങ്ങിയ ലോഹങ്ങള് ഉരുക്കിയ ടിന്നില് മുക്കിയശേഷം ചൂടുള്ള റോളറിലൂടെ കടത്തിവിട്ടാണ് ടിന് പ്ലേറ്റിങ് നടത്തുന്നത്. ടിന് അമാല്ഗം കണ്ണാടികളുടെ നിര്മാണത്തിനും ടിന് ഫോയിലുകള് സിഗററ്റ്, മിഠായി തുടങ്ങിയവ പൊതിയാനും ഉപയോഗിക്കുന്നു. | |
| - | + | ||
| - | + | ||
Current revision as of 10:27, 22 ഒക്ടോബര് 2008
ടിന്
Tin
ഒരു ലോഹമൂലകം. സിം. Sn സ്റ്റാനം (stannum) എന്ന ലത്തീന് പദത്തില്നിന്നാണ് ഈ സംജ്ഞ നിഷ്പന്നമായത്. അ. സ. 50, അ. ഭ. 118.69. ദ്ര. അ. 231.9°C . ക്വ. അ. 2270°C. ആവര്ത്തന പട്ടികയില് നാലാമത്തെ ഗ്രൂപ്പിലാണ് ടിന് ഉള്പ്പെട്ടിട്ടുള്ളത്. കാര്ബണ് (C6), സിലിക്കോണ് (Si14), ജര്മ്മേനിയം (Ge32), ലെഡ് (Pb82) എന്നിവയാണ് ഈ ഗ്രൂപ്പിലെ മറ്റ് മൂലകങ്ങള്. പ്രകൃതിയില് ടിന് സ്വതന്ത്രാവസ്ഥയില് ലഭ്യമല്ല. കാസിറ്ററൈറ്റ് (cassiterite) അഥവാ ടിന് സ്റ്റോണ് എന്ന ഓക്സൈഡ് ധാതു (SnO2) വില് നിന്നാണ് ടിന് വേര്തിരിച്ചെടുക്കുന്നത്.
ഗുണധര്മങ്ങള്. വെള്ളി പോലെ തിളങ്ങുന്ന ലോഹമാണ് ടിന്. വായുവുമായി സമ്പര്ക്കം ഉണ്ടായാലും ഇതിന്റെ തിളക്കം മങ്ങുകയില്ല. ടിന്നിന് മൂന്ന് അലോട്രോപിക അവസ്ഥകളുണ്ട്. വെള്ള നിറമുള്ള β ടിന്, ചാര നിറമുള്ള αടിന്, റോമ്പിക് പരല് ഘടനയുള്ള&gama;ടിന്.
ഏറ്റവും ശുദ്ധമായ ടിന് 13.2°C മുതല് സാവധാനം തണുക്കുമ്പോള് β ടിന്നില് നിന്ന് α ടിന്നിലേക്കുള്ള അവസ്ഥാന്തരം സംഭവിക്കും. എന്നാല് ടിന്നില് മാലിന്യങ്ങള് ഉണ്ടെങ്കില് അവ ഈ അവസ്ഥാന്തരത്തെ ചെറുക്കും. സാധാരണ ടിന്നില് (99.8% ശുദ്ധം) ബിസ്മത്ത്, ആന്റിമണി, ലെഡ്, സില്വര് തുടങ്ങിയ മാലിന്യങ്ങള് ഉണ്ടാവും. -50°C ല് താഴെയുള്ള താപനിലകളില് അവസ്ഥാന്തരം വളരെ വേഗത്തില് നടക്കുന്നതിനാല് ടിന് ചാരനിറത്തിലുള്ള പൊടിയായി തീരുന്നു. ഈ അവസ്ഥയെ ടിന്രോഗം എന്നു പറയുന്നു. ടിന് അടിച്ചു പരത്തി കനം കുറഞ്ഞ ഷീറ്റുകളാക്കാം (maleable). എന്നാല് വയറുകളും മറ്റും ഉണ്ടാക്കാന് സാധ്യമല്ല. ടിന്നിന് വളരെ വ്യവസ്ഥാപിതമായ ഒരു പരല് ഘടനയാണുള്ളത്. ടിന് തകിട് മടക്കുമ്പോള് ഈ പരലുകള് പൊട്ടുന്നതുകൊണ്ടാണ് പ്രത്യേക തരം ശബ്ദം (tin cry) ഉണ്ടാകുന്നത്. ടിന്നിന്റെ പത്ത് സമസ്ഥാനീയങ്ങള് പ്രകൃതിയില് ലഭ്യമാണ്. രാദശക്തിയുള്ള മറ്റ് ഇരുപത്തിയൊന്ന് സമസ്ഥാനീയങ്ങള് കൃത്രിമമായി ഉത്പാദിപ്പിച്ചിട്ടുമുണ്ട്.
സാധാരണ താപനിലകളില് വായുവുമായി ടിന് പ്രതിപ്രവര്ത്തിക്കാറില്ല. 1500-1600°C വരെ ചൂടാക്കിയാല് വായുവില് കത്തിപ്പിടിക്കും.
Sn + O2 → SnO2
അമ്ലങ്ങളുടെയും ക്ഷാരങ്ങളുടെയും ഗാഢലായനിയുമായി ടിന് പ്രതിപ്രവര്ത്തിക്കാറുണ്ട്. എന്നാല് നിര്വീര്യ ലായനികളും, എണ്ണ, ആല്ക്കഹോള്, ക്ലോറിനടങ്ങുന്ന ഹൈഡ്രോകാര്ബണുകള് തുടങ്ങിയ അജല ലായനികളുമായി ടിന് യാതൊരു വിധത്തിലും പ്രതിപ്രവര്ത്തിക്കുകയില്ല. +2, +4 എന്ന രണ്ട് സംയോജകതകള് ടിന് പ്രദര്ശിപ്പിക്കാറുണ്ട്. +2 സംയോജകതയുള്ള ടിന് സംയുക്തങ്ങള് സ്റ്റാനസ് സംയുക്തങ്ങള് എന്നും +4 സംയോജകതയുള്ളവ സ്റ്റാനിക് സംയുക്തങ്ങളെന്നുമാണ് അറിയപ്പെടുന്നത്. സ്റ്റാനസ് ഓക്സൈഡ് (SnO) കറുപ്പു കലര്ന്ന നീല നിറമുള്ള പരലുകളാണ്. സ്റ്റാനസ് ക്ലോറൈഡ് ക്ഷാരവുമായി പ്രതിപ്രവര്ത്തിച്ചുണ്ടാകുന്ന സ്റ്റാനസ് ഹൈഡ്രോക്സൈഡ്,pH നിയന്ത്രിതമായി നിലനിര്ത്തിക്കൊണ്ട് തിളപ്പിക്കുമ്പോള് SnO ഉണ്ടാകുന്നു. സ്റ്റാനസ് ഓക്സൈഡ് വായുവില് 385°C വരെ സ്ഥിരതയുള്ളതാണ്. അതിനു മുകളിലുള്ള താപനിലകളില് സ്റ്റാനിക് ഓക്സൈഡായി രൂപാന്തരം സംഭവിക്കുന്നു. അമ്ലങ്ങളിലും ക്ഷാരങ്ങളിലും അലേയമായ ഒരു വെളുത്ത പൊടിയാണ് സ്റ്റാനിക് ഓക്സൈഡ്. ഉയര്ന്ന മര്ദത്തിലുള്ള നീരാവിയുപയോഗിച്ച് കണികകളാക്കിയ ടിന്, ഓക്സിജന്റെ സാന്നിധ്യത്തില് കത്തിച്ചാണ് സ്റ്റാനിക് ഓക്സൈഡ് (SnO22) ഉണ്ടാക്കുന്നത്. പാടലം, മഞ്ഞ, ചുവപ്പുകലര്ന്ന തവിട്ട് എന്നീ നിറങ്ങളിലുള്ള സിറാമിക്കുകളുടേയും, ഡൈ ഇലക്ട്രിക്, ഉച്ചതാപസഹപദാര്ഥങ്ങളുടെയും പ്രധാന ഘടകമാണ് SnO2. മാര്ബിള് തുടങ്ങിയ അലങ്കാര ശിലകള് മിനുക്കാനും സ്റ്റാനിക് ഓക്സൈഡ് ഉപയോഗിക്കാറുണ്ട്. ഹൈഡ്രജന് ക്ലോറൈഡ് വാതകവുമായോ ക്ലോറിനുമായി നേരിട്ടോ ടിന് പ്രതിപ്രവര്ത്തിപ്പിച്ച് സ്റ്റാനസ് ക്ലോറൈഡ് (SnCl2) ഉത്പാദിപ്പിക്കാം. കൂടുതല് ക്ലോറൈഡ് (Cl- ) അയോണിന്റെ സാന്നിധ്യത്തില് സ്റ്റാനിക് ക്ലോറൈഡ് (ടിഇഹSnCl4) ഉണ്ടാവുന്നു. എന്നാല് അതിലുമധികം Cl- അയോണ് ലായനിയിലുണ്ടെങ്കില് ക്ലോ റോസ്റ്റാനേറ്റ് എന്ന സങ്കീര്ണ അയോണ് (SnCl6-- ) രൂപീകൃതമാവുന്നു. സ്റ്റാനസ് ക്ലോറൈഡിലേക്ക്, NaOH ലായനി ചേര്ത്താല് സ്റ്റാനസ് ഹൈഡ്രോക്സൈഡ് Sn(OH)2 ലഭിക്കുന്നു. Sn(OH)2 കൂടുതലുള്ള NaOH-ല് ലയിച്ച് സ്റ്റാനൈറ്റ് അയോണ് Sn(OH)3 ഉണ്ടാകുന്നു. സ്റ്റാനസ് ലവണങ്ങളിലേക്ക് ഹൈഡ്രജന് സള്ഫൈഡ് (H2S) കടത്തിവിടുമ്പോള് കടുംതവിട്ടുനിറത്തിലുള്ള അവക്ഷിപ്തമായി SnS ഉണ്ടാവുന്നു. സ്റ്റാനിക് ലവണങ്ങളില് നിന്ന് മഞ്ഞനിറത്തിലുള്ള സ്റ്റാനിക് സള്ഫൈഡ് (SnS2) ലഭ്യമാവുന്നു.
ഓര്ഗാനോ ടിന് സംയുക്തങ്ങള് പ്രാധാന്യമര്ഹിക്കുന്നവയാണ്. ഈ സംയുക്തങ്ങളില് ഒരു കാര്ബണ് ടിന് ബന്ധം എങ്കിലും ഉണ്ടായിരിക്കും. ടിന് സാധാരണയായി +4 അവസ്ഥയിലായിരിക്കും. ടെട്രാ ഓര്ഗാനോ ടിന് സംയുക്തങ്ങളില് നിന്നാണ് മറ്റെല്ലാ ഓര്ഗാനോ ടിന് സംയുക്തങ്ങളും വ്യാവസായികമായി ഉത്പാദിപ്പിക്കുന്നത്. ആല്ക്കൈല്, അരൈല് ഗ്രൂപ്പുകള് അനായാസമായി ടിന്നിനു ചുറ്റുമായി അണിനിരക്കുന്നു എന്നതാണ് ഓര്ഗാനോ ടിന് സംയുക്തങ്ങളുടെ സവിശേഷത. ചിലയിനം ട്രൈ ആല്ക്കൈല്, ട്രൈ അരൈല് സംയുക്തങ്ങള്ക്ക് ജൈവനാശിക സ്വഭാവമുണ്ട്. മൂന്ന് കാര്ബണ് അണുക്കളുമായി ടിന് നേരിട്ട് ബന്ധപ്പെട്ടിരിക്കുകയും മൊത്തം കാര്ബണ് അണുക്കളുടെ എണ്ണം പന്ത്രണ്ട് ആയിരിക്കുകയും ചെയ്യുമ്പോഴാണ് ഈ സ്വഭാവം ഗാഢമാകുന്നത്. പൂപ്പല് നാശിനികള്, അണുനാശിനികള്, കീടനാശിനികള് എന്നീ നിലകളില് ഇത്തരം സംയുക്തങ്ങള് വ്യാപകമായി ഉപയോഗിച്ചു വരുന്നു.
ഉപയോഗങ്ങള്. അനേകം അലോയ്കളുടെ നിര്മാണത്തിന് ടിന് ഉപയോഗിക്കുന്നുണ്ട്. ടിന്നിന്റെ പ്രധാന അലോയ്കള്, ലോഹഘടകങ്ങള്, ഉപയോഗങ്ങള് എന്നിവ പട്ടികയില് കൊടുത്തിരിക്കുന്നു.
ടൂത്ത് പേസ്റ്റുകള്, ഔഷധ ലേപനങ്ങള് തുടങ്ങിയവ നിറയ്ക്കാനുള്ള ട്യൂബുകള് ടിന്നുകൊണ്ടാണുണ്ടാക്കുന്നത്. ശുദ്ധമായ ടിന്നും ടിന്നിന്റെ അലോയ്കളും ലോഹങ്ങള്ക്ക് ആവരണമായി ഉപയോഗിക്കാറുണ്ട്. വളരെ വേഗം ഓക്സീകൃതമായി ദ്രവിക്കുന്ന ലോഹങ്ങളുടെ സംരക്ഷണാവരണമായി ടിന് വര്ത്തിക്കും. ടിന് കൊണ്ടുള്ള ആവരണങ്ങള് അടിസ്ഥാനലോഹത്തിന് കൂടുതല് സോള്ഡറബിലിറ്റി, ആകര്ഷണീയത, പെയിന്റ് ചെയ്യാന് പറ്റുന്ന വൃത്തിയുള്ള ഒട്ടുന്ന പ്രതലം എന്നിവ പ്രദാനം ചെയ്യുന്നു. ഇരുമ്പ്, ഉരുക്ക് തുടങ്ങിയ ലോഹങ്ങള് ഉരുക്കിയ ടിന്നില് മുക്കിയശേഷം ചൂടുള്ള റോളറിലൂടെ കടത്തിവിട്ടാണ് ടിന് പ്ലേറ്റിങ് നടത്തുന്നത്. ടിന് അമാല്ഗം കണ്ണാടികളുടെ നിര്മാണത്തിനും ടിന് ഫോയിലുകള് സിഗററ്റ്, മിഠായി തുടങ്ങിയവ പൊതിയാനും ഉപയോഗിക്കുന്നു.