This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ക്രിസ്റ്റല് വിജ്ഞാനീയം
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
(→ഷഡ്ഭുജീയഘടന) |
(→സോഡിയം ക്ലോറൈഡ് ഘടന (Sodium chloride structure)) |
||
| വരി 105: | വരി 105: | ||
====സോഡിയം ക്ലോറൈഡ് ഘടന (Sodium chloride structure)==== | ====സോഡിയം ക്ലോറൈഡ് ഘടന (Sodium chloride structure)==== | ||
| - | ഇതില് ഓരോ ധന അയോണിനു ചുറ്റും ആറു നെഗറ്റീവ് അയോണുകള് വര്ത്തിക്കുന്നു-മറിച്ചും. ഇത്തരം ഘടനയുടെ 'കോ-ഓര്ഡിനേഷന്' എന്നാകുന്നു. ഒരാറ്റത്തിന്റെ അയോണുകളുടെ (അണുക്കളുടെ) സംഖ്യയ്ക്കാണ് കോ-ഓര്ഡിനേഷന് നമ്പര് എന്നു പറയുന്നത്. രണ്ടുതരം അയോണുകളും രണ്ടു മുഖ കേന്ദ്രിത ക്യൂബുകളായി ഇടകലര്ന്നു നില്ക്കുന്നു. ഒരു ക്യൂബിന്റെ പാര്ശ്വം 'a' ആണെങ്കില്, ഓരോ ക്യൂബിന്റെയും ദൂരത്തിലാണ് മറ്റേ ക്യൂബിന്റെ സ്ഥാനം. ഇത്തരം ഘടനയുള്ള പദാര്ഥങ്ങളെക്കുറിച്ചുള്ള പഠനത്തില്നിന്ന് താഴെപ്പറയുന്ന വസ്തുതകള് വ്യക്തമായിട്ടുണ്ട്. | + | [[ചിത്രം:Pg422_pic_11.png|200px|right]] |
| + | ഇതില് ഓരോ ധന അയോണിനു ചുറ്റും ആറു നെഗറ്റീവ് അയോണുകള് വര്ത്തിക്കുന്നു-മറിച്ചും. ഇത്തരം ഘടനയുടെ 'കോ-ഓര്ഡിനേഷന്' എന്നാകുന്നു. ഒരാറ്റത്തിന്റെ അയോണുകളുടെ (അണുക്കളുടെ) സംഖ്യയ്ക്കാണ് കോ-ഓര്ഡിനേഷന് [[ചിത്രം:Pg_422_form01.png]] നമ്പര് എന്നു പറയുന്നത്. രണ്ടുതരം അയോണുകളും രണ്ടു മുഖ കേന്ദ്രിത ക്യൂബുകളായി ഇടകലര്ന്നു നില്ക്കുന്നു. ഒരു ക്യൂബിന്റെ പാര്ശ്വം 'a' ആണെങ്കില്, ഓരോ ക്യൂബിന്റെയും [[ചിത്രം:Pg422_form003.png]] ദൂരത്തിലാണ് മറ്റേ ക്യൂബിന്റെ സ്ഥാനം. ഇത്തരം ഘടനയുള്ള പദാര്ഥങ്ങളെക്കുറിച്ചുള്ള പഠനത്തില്നിന്ന് താഴെപ്പറയുന്ന വസ്തുതകള് വ്യക്തമായിട്ടുണ്ട്. | ||
1. ഓരോ അയോണിലും നിശ്ചിതമായ ഒരു വ്യാസാര്ധമുണ്ടെന്നു സങ്കല്പിക്കാവുന്നതാണ്. ഒരു ധന അയോണ് അതിന്റെ ആറ്റത്തിനേക്കാള് ചെറുതും ഋണ അയോണ് വലുതുമാണ്. | 1. ഓരോ അയോണിലും നിശ്ചിതമായ ഒരു വ്യാസാര്ധമുണ്ടെന്നു സങ്കല്പിക്കാവുന്നതാണ്. ഒരു ധന അയോണ് അതിന്റെ ആറ്റത്തിനേക്കാള് ചെറുതും ഋണ അയോണ് വലുതുമാണ്. | ||
16:13, 29 സെപ്റ്റംബര് 2015-നു നിലവിലുണ്ടായിരുന്ന രൂപം
ക്രിസ്റ്റല് വിജ്ഞാനീയം
Crystallography
ഒരു ഭൗതികശാസ്ത്രശാഖ. ക്രിസ്റ്റല് ഭൗതികമെന്നും അറിയപ്പെടുന്നു. ക്രിസ്റ്റലുകളുടെ ബാഹ്യരൂപത്തെ വിവരിക്കുന്ന ജ്യാമതീയ ക്രിസ്റ്റല് വിജ്ഞാനീയം (Geometrical Crystallography), ആന്തരമായ അറ്റോമിക സ്ഥിതിരൂപങ്ങളുടെ വിവരണവും നിര്ണയനവും ഉള്ക്കൊള്ളുന്ന ഘടനാത്മക ക്രിസ്റ്റല് വിജ്ഞാനീയം (Structural Crystallography), രാസബന്ധങ്ങളെ പരാമര്ശിക്കുന്ന രാസിക ക്രിസ്റ്റല് വിജ്ഞാനീയം, ഭൗതികഗുണങ്ങളെ വിവരിക്കുന്ന ഭൗതിക ക്രിസ്റ്റല് വിജ്ഞാനീയം എന്നിങ്ങനെ പല വിഭാഗങ്ങളായി ക്രിസ്റ്റല് വിജ്ഞാനീയശാഖയെ തരംതിരിക്കാം.
ജ്യാമിതീയ ക്രിസ്റ്റല് വിജ്ഞാനീയം
ഖരാവസ്ഥയിലുള്ള പല പദാര്ഥങ്ങളും പ്രകൃതിയില് ക്രിസ്റ്റലുകളായിട്ടാണ് രൂപപ്പെടുന്നത്. ഒരേ പദാര്ഥത്തിന്റെതന്നെ ക്രിസ്റ്റലുകള്ക്കു തമ്മില് രൂപത്തിലും വലുപ്പത്തിലും വ്യത്യാസം കാണാനുണ്ടെങ്കിലും ഘടനാപരമായ മൗലികരൂപം അവയിലെല്ലാം സമാനമായിരിക്കും. സുദൃഢമായും പ്രത്യേകക്രമത്തിലും ബന്ധിതമായിട്ടാണ് ക്രിസ്റ്റലുകളില് ആറ്റങ്ങള് സ്ഥിതിചെയ്യുന്നത്. ഓരോ പദാര്ഥത്തിനും അതിന്റേതായ ഒരു അറ്റോമികശില്പരൂപം ഇങ്ങനെ കൈവരുന്നു.
ക്രിസ്റ്റലുകളുടെ മൗലികഘടകത്തിന്റെ വിവരണത്തെ സംബന്ധിച്ച് ഒരു പ്രധാനനിയമം (Steno's law) 1669-ല് സ്റ്റെനോ കണ്ടെത്തി. ഇതനുസരിച്ച് ഒരേ പദാര്ഥത്തിന്റെ ക്രിസ്റ്റലുകളിലെല്ലാം സംഗതമുഖങ്ങള് (corresponding faces) തമ്മിലുള്ള കോണങ്ങള് തുല്യമാണ്. ഈ നിയമത്തില്നിന്ന് ക്രിസ്റ്റലിന്റെ അഗ്രങ്ങള്(edges) തമ്മിലുള്ള കോണങ്ങളും ബാഹ്യരൂപമനുസരിച്ച് മാറുന്നതല്ലെന്നു സിദ്ധിക്കുന്നു. ക്രിസ്റ്റലിന്റെ സ്ഥൂലമായ വലുപ്പമോ ആകൃതിയോ അപ്രധാനമാണ്. ക്രിസ്റ്റലിന്റെ അഗ്രങ്ങളും മുഖങ്ങള്ക്കു ലംബമായ രേഖകളുമാണ് അതിന്റെ സവിശേഷത കുറിക്കുന്നത്.
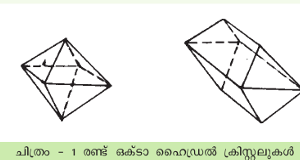
ഉദാ. ചിത്രം 1-ല് കാണുന്ന രണ്ടു ക്രിസ്റ്റലുകളും ജ്യാമിതീയമായി തുല്യമാണ്. രണ്ടും ഒക്ടാഹെഡ്രലുകള് (Octahedrals). ഒന്ന് ഒരു അഗ്രത്തിനു സമാന്തരമായി മറ്റേതിനെക്കാള് നീണ്ടിരിക്കുന്നു എന്ന വ്യത്യാസമേയുള്ളൂ. ക്രിസ്റ്റലിന്റെ മുഖങ്ങള് തമ്മിലുള്ള കോണങ്ങള് അളക്കുവാന് ഗോണിയോമീറ്റര് (Goniometer) ഉപയോഗിക്കുന്നു. മുഖങ്ങളെയോ, തലങ്ങളെ(planes)യോ അഗ്രങ്ങളെയോ നിര്ദേശിക്കുവാന് ക്രിസ്റ്റലില്ത്തന്നെ മൂന്നു നിര്ദേശാകഅക്ഷങ്ങള് (co-ordinate axes)സങ്കല്പിക്കുന്നു. ഗണനസൗകര്യങ്ങളും മറ്റും മുന്നിര്ത്തിയാണ് അക്ഷങ്ങളുടെ വിന്യസനം നിര്ണയിക്കുക. ഇക്കാര്യം വിശദമാക്കുവാന് ക്രിസ്റ്റലുകളിലുള്ള ത്രിവിമീയമായ ആറ്റങ്ങളുടെ വിന്യാസത്തിനുപകരം ഒരു ദ്വിവിമീയ സംവിധാനം സങ്കല്പിക്കുക. (ചിത്രം 2)
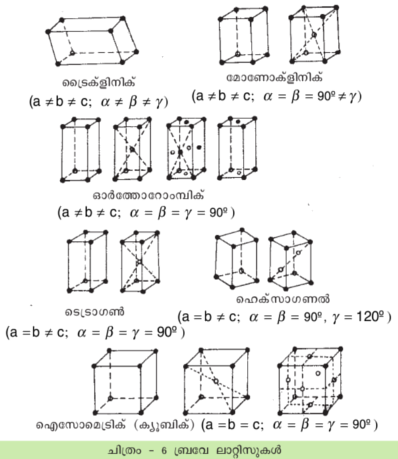
ഈ ജാലിക(lattice) രൂപംകൊള്ളുന്നത് അതില് സങ്കല്പിക്കാവുന്ന ഏതെങ്കിലും ഒരു ചെറിയ രൂപത്തിന്റെ ആവര്ത്തനം കൊണ്ടാണെന്നു കരുതാം. ഉദാ. ABCD എന്ന ചതുര്ഭുജമെടുക്കുക. AB ക്കും AC ക്കും സമാന്തരമായി ഇതു നീക്കിക്കൊണ്ടിരുന്നാല് ജാലികയുടെ പൂര്ണരൂപമുണ്ടാക്കുവാന് സാധിക്കും. ഈ അടിസ്ഥാനരൂപത്തെ ഒരു യൂണിറ്റ് സെല് (unit cell) എന്നു പറയുന്നു. അതിന്റെ വശങ്ങളുടെ ദൈര്ഘ്യം t1, t2 എന്നിവയും അവയ്ക്കിടയിലുള്ള കോണം ' α'യും ആകുന്നു. പക്ഷേ ഈ വിധത്തിലല്ലാതെ മറ്റേതെങ്കിലും ചതുര്ഭുജത്തെയും യൂണിറ്റ്സെല് ആക്കാവുന്നതാണ്-EFGH അല്ലെങ്കില് PQRS എന്നിവയെപ്പോലെ. അപ്പോള് അഗ്രദൈര്ഘ്യവും-അഥവാ അക്ഷദൈര്ഘ്യവും-കോണവും മാറിപ്പോകും. ഇതുമാതിരി ക്രിസ്റ്റലുകളുടെ ത്രിമാന ജാലികയ്ക്കും സൗകര്യമുള്ള ഒരു യൂണിറ്റ്സെല് സങ്കല്പിക്കാവുന്നതാണ്. ഈ സെല്ലുകള്കൊണ്ടാണ് ക്രിസ്റ്റല് കെട്ടിപ്പടുത്തിട്ടുള്ളത്. ആ ശില്പത്തെ 'സ്പേസ് ലാറ്റിസ്' എന്നുപറയുന്നു. ക്രിസ്റ്റല് സെല്ലിന് മൂന്ന് അഗ്രദൈര്ഘ്യങ്ങളും (സാധാരണയായി a, b, c) അവയ്ക്കിടയില് മൂന്നു കോണങ്ങളും ( α, β, γ) ഉണ്ട്. ഏറ്റവും ലളിതമായ യൂണിറ്റ്സെല് ഒരു ക്യൂബ് (cube) ആകുന്നു. ഇതിനു a = b = c : α, β, γ = 90o. ക്രിസ്റ്റലിന്റെ സമമിതി ഗുണങ്ങളെ (symmetry properties) അടിസ്ഥാനമാക്കിയാണ് യൂണിറ്റ് സെല് നിര്ണയിക്കുക.
സമമിതി ഗുണങ്ങള്
ക്രിസ്റ്റലിനുള്ള ആറ്റങ്ങള് ഓരോ ദിശയിലും നിശ്ചിതക്രമത്തില് ആവര്ത്തിച്ചു സ്ഥിതിചെയ്യുന്നതുകൊണ്ട് ഓരോ ക്രിസ്റ്റലിനും പ്രത്യേകമായ സമമിതി ഗുണങ്ങള് സിദ്ധിക്കുന്നു. ക്രിസ്റ്റലുകളെക്കുറിച്ചുള്ള പഠനങ്ങളില് അതിപ്രധാനമായ വിഷയമാണ് അവയുടെ സമമിതി ഗുണങ്ങള്.
ഒരു വസ്തുവിനുള്ള സമമിതി നിര്ണയിക്കുന്നത് അതിനനുസരിച്ചുള്ള ഒരു സമമിതി സംക്രിയ (symmetry operation) കൊണ്ടാണ്. ഉദാഹരണമായി ഒരു വസ്തുവിനെ ഏതെങ്കിലും ഒരു അക്ഷത്തിനു ചുറ്റും ഘൂര്ണന (rotation) വിധേയമാക്കിയാല് ആ വസ്തു പൂര്വതുല്യമായ സ്ഥാനം കൈക്കൊള്ളുന്നുണ്ടെങ്കില് ആ ഘൂര്ണനം അതിന്റെ ഒരു സമമിതിസംക്രിയയാണ്.
ചിത്രത്തില്ക്കാണുന്ന ലളിതമായ രൂപത്തിലുള്ള ഒരു വസ്തുവിനെ അതിന്റെ മധ്യബിന്ദുവിലൂടെയുള്ള ഒരു ലംബാക്ഷത്തിനു ചുറ്റും 120o തിരിച്ചാല്, വസ്തു പൂര്വസ്ഥിതിക്കു തുല്യമായ ഒരു സ്ഥാനം കൈക്കൊള്ളുന്നു. വീണ്ടും 120o കൂടി തിരിച്ചാല് ഈ സ്ഥിതി ആവര്ത്തിക്കുന്നു. പൂര്ണമായ 360o ഘൂര്ണനത്തില് ഇങ്ങനെ മൂന്നു തുല്യസ്ഥാനങ്ങള് വരുന്നു. അതിനാല് വസ്തുവിന് ഒരു ത്രിഗുണ സമമിതി അക്ഷം (3-fold symmetry axis) ഉണ്ടെന്നു സിദ്ധിക്കുന്നു. ഇതു ഘൂര്ണന സമമിതിയാണ്. ഇതുപോലെ വേറെയും ഘൂര്ണനാക്ഷങ്ങള് ഇതിനുണ്ട്. ചിത്രത്തില് വസ്തു പ്രതലത്തിലുള്ള ഒരു അക്ഷം (AB) കാണിച്ചിരിക്കുന്നു. ഇതിനുചുറ്റും 180o തിരിച്ചാലും വസ്തു ദൃശ്യം മാറുന്നില്ല. ദ്വിഗുണ സമമിതി നല്കുന്ന ഒരു ഘൂര്ണനാക്ഷമാണിത് (ഇത്തരം മൂന്നു അക്ഷങ്ങളുണ്ട്). ത്രിമാനവസ്തുക്കള്ക്കും ഇതുപോലെ ഘൂര്ണനസമമിതി നല്കുന്ന പലതരം അക്ഷങ്ങളുണ്ടാകാം.
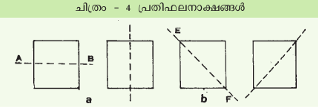
സമമിതിയുടെ മറ്റൊരടിസ്ഥാനം വസ്തുവിനു പ്രതിഫലനതലങ്ങളുണ്ടാവുകയെന്നതാണ്.
ചിത്രം ഒരു സമചതുരമാണ്. AB എന്ന രേഖ അതിനെ രണ്ടു തുല്യഭാഗങ്ങളായി വിഭജിക്കുന്നു. ഈ രേഖയില് വസ്തുതലത്തിനു ലംബമായി ഒരു ദര്പ്പണം വയ്ക്കുകയാണെങ്കില് വസ്തുവിന്റെ ഒരര്ധത്തിന്റെ പ്രതിബിംബത്തിനു തുല്യമായിരിക്കും മറ്റേ അര്ധം എന്നുകാണാം. ഇതൊരു പ്രതിഫലനസമമിതിയാണ്. പക്ഷേ AB എന്ന രേഖ രണ്ടുവിധത്തിലാവാം. മാത്രമല്ല EF എന്ന രേഖയും സമചതുരത്തെ രണ്ടു തുല്യഭാഗങ്ങളായി വിഭജിക്കുന്നു. ഇതും പ്രതിഫലന സമമിതി നല്കുന്നു. ഇങ്ങനെയുള്ള സമമിതിയെ സൂചിപ്പിക്കുന്നത് 'm' എന്ന അക്ഷരംകൊണ്ടാണ്. ഘൂര്ണനാക്ഷങ്ങളുടെ എണ്ണത്തെ 1, 2, 3, 4,.... മുതലായ പൂര്ണസംഖ്യകള്കൊണ്ടാണ് സൂചിപ്പിക്കാറ്.
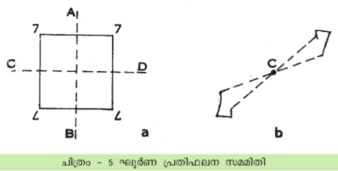
ചില വസ്തുക്കള്ക്കു ഘൂര്ണനവും തുടര്ന്ന് ഒരു പ്രതിഫലനവും കൂടിച്ചേര്ന്നുള്ള സമമിതി കാണാം (rotoreflection axis). ചിത്രത്തില്ക്കാണുന്ന സമചതുരത്തിന്റെ നടുവിലൂടെയുള്ള ഒരു അക്ഷമാണ് AB. ഈ അക്ഷത്തിനു ചുറ്റും 180o തിരിക്കുകയും അതിനുശേഷം ഈ അക്ഷത്തിനു ലംബമായ CD എന്ന തലത്തില് പ്രതിഫലനം നിര്വഹിക്കുകയും ചെയ്താല് വസ്തു പൂര്ണരൂപം പ്രാപിക്കുന്നു. ഒരു ദ്വിഗുണാക്ഷ ഘൂര്ണനവും പ്രതിഫലനവും ഒത്തുചേര്ന്നുള്ള സമമിതിയാണിത് എന്നിങ്ങനെ ഇത്തരം സമമിതിയെ കുറിക്കുന്നു.
വസ്തുവിന് ഒരു വ്യുത്ക്രമണകേന്ദ്രം ഉണ്ടാവുക എന്നതാണ് മറ്റൊരു സമമിതി.
ചിത്രത്തില് വ്യുത്ക്രമണകേന്ദ്രം C എന്ന ബിന്ദുവാണ്. ചിത്രത്തിലെ ഓരോ ബിന്ദുവും C-യോടു യോജിപ്പിച്ച് അത്രയും ദൂരത്തില് മറുവശത്തേക്കു നീട്ടിയാല് അതിന്റെ വ്യുത്ക്രമിതരൂപമുണ്ടാവുന്നു. ഈ കേന്ദ്രത്തെ ഒരു ഭ്രമണാക്ഷത്തോടുകൂടി യോജിപ്പിച്ചാല് ഘൂര്ണന വ്യുത്ക്രമണ സമമിതി ലഭിക്കുന്നു. ഇതിനെ ![]() എന്നു സൂചിപ്പിക്കുന്നു.
എന്നു സൂചിപ്പിക്കുന്നു.
ക്രിസ്റ്റലുകളില് മേല്പറഞ്ഞവയ്ക്കു പുറമേ രണ്ടു സമമിതികള് കൂടിയുണ്ട്: 'സ്ക്രൂ അക്ഷ' (screw axis)വും 'ഗ്ലൈഡ് തല' (glide plane)വും. ഒരു ഘൂര്ണനത്തോടൊപ്പം സ്ഥാനാന്തരണ (translation)വുമുള്ള സംക്രിയ ഒരു സ്ക്രൂവിന്റെ തിരിച്ചിലിനോടു സദൃശമാണ്. ഈ ചലനത്തിനു സംഗതമായ സമമിതി-അംഗത്തെ (element) സ്ക്രൂ അക്ഷമെന്നു പറയുന്നു. ക്രിസ്റ്റലിലുള്ള ഏതെങ്കിലും സ്ഥാനന്തരണദിശയാണ് അക്ഷമായിട്ടെടുക്കേണ്ടത്. ഇതുപോലെതന്നെ സ്ഥാനാന്തരണത്തോടൊപ്പം ഒരു പ്രതിഫലനം കൂട്ടിച്ചേര്ത്താല് ഗ്ലൈഡ് പ്രതിഫലനമായി. ഇത്തരം സമമിതിക്കു ഗ്ലൈഡ് തലം എന്നുപേര്.
സമമിതി ഗ്രൂപ്പുകള്
സമമിതി ഗ്രൂപ്പുകള്(symmetry groups). മേല്പറഞ്ഞ സമമിതികളുടെ പല സംയോജനങ്ങളാണ് (combination) ക്രിസ്റ്റലുകള് പ്രദര്ശിപ്പിക്കുന്നത്. ഏതെങ്കിലും ഒരു ബിന്ദുവിനു ചുറ്റും കാണപ്പെടുന്ന സമമിതി സമുച്ചയത്തിനു 'പോയിന്റ് ഗ്രൂപ്പ്' (point group) എന്നു പറയുന്നു. ഒരേ പോയിന്റ് ഗ്രൂപ്പ് സമമിതിയുള്ള ക്രിസ്റ്റലുകളെ ഒരു ക്രിസ്റ്റല് വര്ഗമായി (crystal class) പരിഗണിക്കുന്നു. സമമിതികളുടെ സംയോജനങ്ങള്കൊണ്ട് ഏതെല്ലാം തരത്തിലുള്ള ഗ്രൂപ്പുകള് ഉണ്ടാകാമെന്ന് ഗ്രൂപ്പൂസിദ്ധാന്ത(group theory)ത്തിന്റെ സഹായത്തോടെ നിര്ണയിക്കാന് കഴിയും. അങ്ങനെ സ്ഥാനാന്തരണമെന്ന സംക്രിയ ഉള്പ്പെടുത്താതെ 32 പോയിന്റ് ഗ്രൂപ്പുകളുണ്ടാകാമെന്നു കണ്ടെത്തിയിട്ടുണ്ട്. താഴെയുള്ള പട്ടികയില് ക്രിസ്റ്റല് സിസ്റ്റവും ക്രിസ്റ്റല് വര്ഗവും കാണിച്ചിരിക്കുന്നു. 32 പോയിന്റ് ഗ്രൂപ്പുകള് ആറു 'സിസ്റ്റ'ങ്ങളില്പ്പെടുന്നു. പട്ടികയില് 'm' എന്നതു പ്രതിഫലനസമമിതിയാണ്. ഘൂര്ണനത്തോടൊപ്പം അതിന്റെ അക്ഷത്തിനു ലംബമായ ഒരു ദര്പ്പണതലത്തിലെ പ്രതിഫലനംകൂടി എടുത്താലുണ്ടാകുന്ന സമമിതി ![]() എന്നിവയാണ്. ദര്പ്പണതലം അക്ഷത്തിനു സമാന്തരമായാല് സമമിതി 2mm, 3m, 4mm, 6mm. മേല്പറഞ്ഞ രീതിയില്ത്തന്നെ ഘൂര്ണപ്രതിഫലനവും ദര്പ്പണതലവുമെടുത്താലുണ്ടാകുന്ന സമമിതിയും സൂചിപ്പിക്കപ്പെടുന്നു.
എന്നിവയാണ്. ദര്പ്പണതലം അക്ഷത്തിനു സമാന്തരമായാല് സമമിതി 2mm, 3m, 4mm, 6mm. മേല്പറഞ്ഞ രീതിയില്ത്തന്നെ ഘൂര്ണപ്രതിഫലനവും ദര്പ്പണതലവുമെടുത്താലുണ്ടാകുന്ന സമമിതിയും സൂചിപ്പിക്കപ്പെടുന്നു.
സ്പേസ് ഗ്രൂപ്പുകള്
മേല്പറഞ്ഞ മുപ്പത്തിരണ്ടു പോയിന്റ് ഗ്രൂപ്പുകളും സ്ഥാനാന്തരണത്തോടു ചേര്ന്നുള്ള സമമിതികളും സംയോജിപ്പിക്കുമ്പോള് ത്രിമാനസംവിധാനത്തില് 230 സമമിതി ഗ്രൂപ്പുകളുണ്ടാവുന്നു. ഇവയാണ് സ്പേസ് ഗ്രൂപ്പുകള്. ക്രിസ്റ്റലുകളുടെ സെല്ലിലുള്ള അണുസംവിധാനത്തിന്റെ സമമിതിയെയാണിവ സൂചിപ്പിക്കുന്നത്. പക്ഷേ യൂണിറ്റ് സെല്ലുകളുടെ ജ്യാമിതീയരൂപവും വലുപ്പവും മാത്രം പരിഗണിച്ചാല് പതിനാലു തരത്തിലുള്ള യൂണിറ്റ് സെല്ലുകളേയുള്ളൂ. ഇവയെ ബ്രവേ ലാറ്റിസുകള് (Bravais lattices) എന്നു പറയുന്നു. ഇവ ആറു ക്രിസ്റ്റല് സിസ്റ്റത്തില്പ്പെടുന്നു-മോണോക്ലിനിക് രണ്ട്, ഓര്ത്തോറോംബിക് നാല്, ടെട്രാഗണല് രണ്ട്, ഹെക്സാഗണല് രണ്ട്, ഐസോമെട്രിക് മൂന്ന്, ട്രൈക്ലിനിക് ഒന്ന്. യൂണിറ്റ് സെല്ലിന്റെ മധ്യത്തിലോ പാര്ശ്വമുഖങ്ങളുടെ മധ്യത്തിലോ അണുക്കള് സ്ഥിതി ചെയ്യാവുന്നതുകൊണ്ടാണ് ചില സിസ്റ്റങ്ങളില് ഒന്നില്ക്കൂടുതല് യൂണിറ്റ്സെല്ലുകള് ഉണ്ടാകുന്നത്.
ക്രിസ്റ്റല് തലങ്ങള്
ക്രിസ്റ്റല് തലങ്ങള് (Crystal planes). ക്രിസ്റ്റലിലെ തലങ്ങളെ മില്ലര് സൂചകങ്ങള്(Miller Indicies) ഉപയോഗിച്ചാണ് വ്യവഹരിക്കുന്നത്. ഏതെങ്കിലും ഒരു തലം a, b, c എന്ന അക്ഷങ്ങളെ അക്ഷയകേന്ദ്രത്തില്നിന്ന് ![]() എന്നീ ദൂരങ്ങളില് ഖണ്ഡിക്കുന്നുവെന്നു കരുതുക. അക്ഷാംശങ്ങളായ
എന്നീ ദൂരങ്ങളില് ഖണ്ഡിക്കുന്നുവെന്നു കരുതുക. അക്ഷാംശങ്ങളായ ![]() എന്നിവയുടെ വ്യുത്ക്രമങ്ങളെടുത്താല് 2, 4, 3 എന്നു കിട്ടുന്നു. ഈ സംഖ്യകളാണ് ഈ തലത്തിന്റെ മില്ലര് സൂചകങ്ങള്. സാധാരണയായി (h k l) എന്നാണ് സൂചകങ്ങളുടെ സംജ്ഞ. ഈ സൂചകങ്ങള് ഒരു പ്രത്യേകതലത്തെ മാത്രമല്ല, അതിനു സമാന്തരമായ എല്ലാ തലങ്ങളെയും സൂചിപ്പിക്കുന്നു.
എന്നിവയുടെ വ്യുത്ക്രമങ്ങളെടുത്താല് 2, 4, 3 എന്നു കിട്ടുന്നു. ഈ സംഖ്യകളാണ് ഈ തലത്തിന്റെ മില്ലര് സൂചകങ്ങള്. സാധാരണയായി (h k l) എന്നാണ് സൂചകങ്ങളുടെ സംജ്ഞ. ഈ സൂചകങ്ങള് ഒരു പ്രത്യേകതലത്തെ മാത്രമല്ല, അതിനു സമാന്തരമായ എല്ലാ തലങ്ങളെയും സൂചിപ്പിക്കുന്നു.
ഘടനാത്മക ക്രിസ്റ്റല് വിജ്ഞാനീയം
സമമിതിയെ അടിസ്ഥാനമാക്കി ഏതെല്ലാം രൂപങ്ങള് ക്രിസ്റ്റലുകള്ക്ക് ഉണ്ടാകാമെന്നാണ് മുമ്പു സൂചിപ്പിച്ചത്. 230 സ്പേസ് ഗ്രൂപ്പുകളില് ഏതെങ്കിലും ഒന്നില്പ്പെട്ടതാവണം ഏതു ക്രിസ്റ്റലും. ക്രിസ്റ്റലിന്റെ ഘടന നിര്ണയിക്കുന്നതില് അതിന്റെ ജ്യാമിതീയ രൂപവും അതിലുള്ള ആറ്റങ്ങളുടെ പരസ്പര സ്ഥാനങ്ങളും ഉള്പ്പെടുന്നു. ഏതെല്ലാം ആറ്റങ്ങള്, അഥവാ തന്മാത്രകള് ക്രിസ്റ്റലില് ഉണ്ടെന്ന് രാസപരിശോധനകൊണ്ടും മറ്റും കണ്ടുപിടിക്കാവുന്നതാണ്. പക്ഷേ, അവ പരസ്പരം ദൃഢമായി ക്രിസ്റ്റലില് ഏതു രീതിയിലാണ് നിലകൊള്ളുന്നതെന്ന് നിര്ണയിക്കുന്ന മാര്ഗങ്ങള് ഘടനാത്മക ക്രിസ്റ്റല് വിജ്ഞാനത്തില്പ്പെടുന്നു.
ഒരു ക്രിസ്റ്റലിന്റെ ഘടന നിര്ണയിക്കുവാന് എക്സ്-റേ, ന്യൂട്രോണ്, ഇലക്ട്രോണ് എന്നിവയുടെ വിഭംഗന(diffration)മാണ് അവലംബിക്കപ്പെടുന്നത്-മുഖ്യമായും ആദ്യത്തേത്. ഒരു ക്രിസ്റ്റലില്ക്കൂടി എക്സ്-റേ കടത്തിവിട്ടാല് അതിലുള്ള ആറ്റങ്ങളില് തട്ടിച്ചിതറി ബഹിര്ഗമിക്കുന്ന രശ്മികള്ക്കു ഘടനയെ ആസ്പദമാക്കി ചില മാറ്റങ്ങള് സംഭവിക്കുന്നു. ഈ രശ്മികള് ഒരു ഛായാഗ്രാഹകഫലകത്തില് പതിക്കുമ്പോള് പ്രത്യേക പാറ്റേണുകള് രൂപം കൊള്ളുന്നതായി കാണാം ഈ പാറ്റേണുകളെ അപഗ്രഥിച്ചാല് ക്രിസ്റ്റലിന്റെ ഘടനയെപ്പറ്റി ഒട്ടേറെ വിവരങ്ങള് ലഭിക്കും. ഇതാണ് എക്സ്-റേ വിഭംഗനത്തിന്റെ തത്ത്വം. ഘടന സങ്കീര്ണമാവുമ്പോള് മറ്റു രീതികള്കൂടി അനുപൂരകമായി സ്വീകരിക്കേണ്ടിവരും. കൂടാതെ ക്രിസ്റ്റലിന്റെ ചില പ്രത്യേക ഭൗതിക ഗുണങ്ങളെയും കൂടി അതിന്റെ ഘടന നിര്ണയിക്കുന്നതിനുള്ള ഉപാധികളാക്കാറുണ്ട്.
സാധാരണഘടനകള്
സാധാരണ ക്രിസ്റ്റലുകളുടെ ഘടന പൊതുവേ എട്ടുതരത്തില്പ്പെടുത്താമെന്നു പഠനങ്ങള് വ്യക്തമാക്കുന്നു. ഇവയില് മൂന്നെണ്ണം ലോഹങ്ങളിലും അഞ്ചെണ്ണം ഇതര ക്രിസ്റ്റല് സംയുക്തങ്ങളിലും കാണപ്പെടുന്നു.
ലോഹങ്ങള്
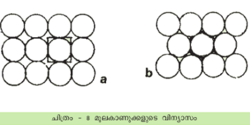
പൊതുവേ ലോഹഘടന സരളമാണ്. ഒരേ വലുപ്പമുള്ള മൂലകാറ്റങ്ങള് നിശ്ചിതക്രമത്തില് അടുക്കിവച്ചിരിക്കുന്ന ഘടനയാണിവയിലുള്ളത്. ഉയര്ന്ന തോതിലുള്ള സമമിതിയും ലോഹക്രിസ്റ്റലുകള്ക്കുണ്ട് (ഗാലിയം, മാങ്ഗനീസ്, രസം, ടങ്സ്റ്റണ് എന്നിവ അപവാദങ്ങള്). പല ലോഹങ്ങള്ക്കും അലോട്രോപിക് (allotropic) രൂപങ്ങളുണ്ട്. അതായത് ഒരേ ലോഹത്തിനുതന്നെ ഒന്നില്ക്കൂടുതല് വ്യത്യസ്ത ഘടനകള് ഉണ്ടാകാം. ലോഹങ്ങളിലെ ആറ്റങ്ങളെത്തമ്മില് ബന്ധിപ്പിക്കുന്ന ബലങ്ങള് ദിശാനിരപേക്ഷമാണ്. അതിനാല് ഓരോ ആറ്റത്തിനു ചുറ്റും പരമാവധി ആറ്റങ്ങള് തിങ്ങിക്കൂടിനില്ക്കുന്നു. തുല്യ വലുപ്പമുള്ള ഗോളങ്ങള് അടുക്കിവച്ചാലുണ്ടാകുന്ന ഒരു ശില്പത്തോട് ഈ ഘടനയെ ഉപമിക്കാം.
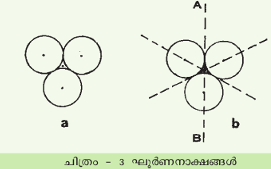
ഗോളങ്ങള് അടുക്കിവച്ചിരിക്കുന്നത് ലഭ്യമായ സ്ഥലം പരമാവധി നിറഞ്ഞിരിക്കുന്ന രീതിയിലാണ്. തുല്യവലുപ്പമുള്ള ഗോളങ്ങളെ സംബന്ധിച്ചിടത്തോളം ഇതു പല വിധത്തില് സാധ്യമാണ്. ദ്വിമാന തലത്തില്ത്തന്നെ ഇങ്ങനെയുള്ള വിന്യാസം രണ്ടു തരത്തിലാവാം. കാണുന്ന മാതിരി ഗോളങ്ങള് നിരത്തിയാല് ഓരോ ഗോളത്തെയും മറ്റു നാലു ഗോളങ്ങള് സ്പര്ശിക്കുന്നതായി കാണാം. ഇതുകൊണ്ടു സംജാതമാകുന്ന ലാറ്റിസ് ഒരു സമചതുരമാണ്. ഓരോ ഗോളവും മറ്റു ആറെണ്ണത്തെ സ്പര്ശിക്കുന്ന രീതികാണാം. ഇവിടെ ഹെക്സാഗണല് രൂപം സിദ്ധിക്കുന്നു. ദ്വിമാനതലത്തില് ഇതിനെക്കാള് കൂടുതലായി ഇടതൂര്ന്നു ഗോളങ്ങളെ നിരത്തുവാന് സാധ്യമല്ല. ഇതാണ് നിബിഡതമായ പാക്കിങ്.
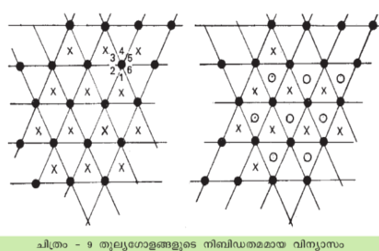
ത്രിമാന രൂപങ്ങളിലേക്കു കടക്കുമ്പോള് നിബിഡതമമായ വിന്യാസങ്ങള് അനന്തമാതൃകയിലാവാം. മേല്പറഞ്ഞ ഹെക്സാഗണല് തലങ്ങളെ ഒന്നിനു മുകളിലായി മറ്റൊന്നു വച്ചുകൊണ്ട് ഒരു ത്രിമാനശില്പം കെട്ടിപ്പടുക്കാം. ഓരോ ഗോളവും അപ്പോള് മറ്റു പന്ത്രണ്ടു ഗോളങ്ങളെ സ്പര്ശിച്ചിരിക്കും. അതില്ക്കൂടുതല് സാധ്യവുമല്ല. പക്ഷേ ഓരോ തലവും ചുവട്ടിലുള്ളതിനെ അപേക്ഷിച്ച് എത്രയ്ക്കു സ്ഥാനമാറ്റത്തിനു വിധേയമായിട്ടുണ്ട് എന്നതനുസരിച്ച് ഒരു സമമിതി ക്രിസ്റ്റലിനുണ്ടായിത്തീരുന്നു. ത്രിമാന ശില്പത്തെ സങ്കല്പിക്കുവാന് സഹായകമാണ്. A എന്ന തലത്തിലുള്ള ഗോളങ്ങളുടെ കേന്ദ്രങ്ങള് (ഷെയ്ഡ് ചെയ്ത വൃത്തങ്ങള്)ക്കിടയിലുള്ള പഴുതുകളില് 1, 3, 5 എന്നിവയിലാണ് അതിന്റെ മുകളിലത്തെ B എന്ന തലത്തിലെ ഗോളങ്ങള് വരുന്നത് (X എന്ന സ്ഥാനങ്ങള്). മൂന്നാമത്തെ തലത്തില് (C) വരേണ്ടഗോളങ്ങളെ വയ്ക്കുന്നതു രണ്ടുതരത്തിലാകാം. അവയെ A യിലെ ഗോളങ്ങള്ക്കു നേരെ മുകളിലാക്കാം. C എന്നതലം A യ്ക്കു തുല്യമായിരിക്കും. അപ്പോള് ABA എന്ന ഗോളവ്യവസ്ഥയുണ്ടാകുന്നു. അല്ലെങ്കില് C യിലെ ഗോളങ്ങളെ 2, 4, 6 എന്നീ പഴുതുകള്ക്കു നേരെ വയ്ക്കാം. ഇപ്പോള് C വ്യത്യസ്തമാണ്. ഈ അടുക്കിന് ABC എന്ന പേരുകൊടുക്കാം. ഇവയ്ക്കു മുകളില് ഇതുമാതിരി ഗോളങ്ങളുടെ അടുക്കുകളുണ്ടാക്കാം. പക്ഷേ ഒന്നിനുതൊട്ടു സമാനമായ മറ്റൊരടുക്ക് ഉണ്ടാവാന് വയ്യ എന്ന നിബന്ധനയേയുള്ളൂ. ABC എന്നീ സംജ്ഞകളെ അടിസ്ഥാനമാക്കി ഒരു ശില്പം വരാവുന്നത് ABC, BAB, CAC, BA... എന്നിങ്ങനെയാണ്. ഇങ്ങനെ ശ്രേണി അനന്തമായി ആവര്ത്തനമില്ലാതെ നീണ്ടുപോകാറില്ല. ഏതാനും അടുക്കുകള് കഴിയുമ്പോള് ക്രമം ആവര്ത്തിക്കുകയാണ് ചെയ്യുന്നത്. ഗോളങ്ങളുടെ എണ്ണം N ആണെങ്കില്, പഴുതുകളുടെ ആകെയെണ്ണം 3N ആകുന്നു. ഇവയില് 2N ടെട്രാഹെഡ്രലും ച ഒക്ടാഹെഡ്രലുമായിരിക്കും.
മുഖകേന്ദ്രിതഘനം (face centred cube)
ഈ ഘടനയില് ABC എന്ന അടുക്കുകള് ആവര്ത്തിച്ചുവരുന്നു. യൂണിറ്റ് സെല് ഒരു ക്യൂബാണ്. ഇതിന്റെ മുഖമധ്യങ്ങളിലും ഗോളകേന്ദ്രങ്ങളുണ്ട്. (ചിത്രം 6-ല് ഏറ്റവും ഒടുവില് കാണുന്ന ക്യൂബ്) ക്യൂബിന്റെ ഒട്ടാകെയുള്ള വ്യാപ്തത്തിന്റെ 73 ശതമാനം ഗോളങ്ങളുടെ വ്യാപ്തമാണ്. മുഖകര്ണരേഖയിലുള്ള (face diagonal) ഗോളങ്ങളാണ് സ്പര്ശിച്ചു നില്ക്കുന്നവ. ഉദാ. വെള്ളി, സ്വര്ണം, ഈയം മുതലായ ലോഹങ്ങള്.
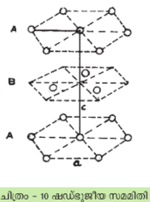
ഷഡ്ഭുജീയഘടന
ഇതില് ABAB....എന്ന ക്രമം ആവര്ത്തിക്കുന്നു. യൂണിറ്റ് സെല്ലിനു ഷഡ്ഭുജീയ സമമിതിയാണ്. ഇതില് c/a എന്ന അനുപാതം 1.633 ആകുന്നു. ഉദാ. കാഡ്മിയം, ബെറിലിയം.
അന്തഃകേന്ദ്രിതഘനം(Body centered cube)
ഓരോ ഗോളവും മറ്റ് എട്ടു ഗോളങ്ങളെ സ്പര്ശിക്കുന്ന വിധത്തിലുള്ള സംവിധാനമായാല് അന്തഃകേന്ദ്രിത ഘടനയുണ്ടാകുന്നു (ചിത്രം 6-ല് നടുവിലെ ക്യൂബ് നോക്കുക). സ്പര്ശിക്കുന്ന ഗോളങ്ങള് ക്യൂബിന്റെ അന്തഃകര്ണരേഖയിലായിരിക്കും. ഇതില് ഗോളവ്യാപ്തം ക്യൂബിന്റെ 67 ശതമാനമാകുന്നു. അതിനാല് മുന്പറഞ്ഞ ഘടനയെക്കാള് സാന്ദ്രത കുറഞ്ഞ സംരചനയാണിതിനുള്ളത് (ഉദാ. ക്രോമിയം, ടങ്സ്റ്റണ്).
ക്രിസ്റ്റലീയ സംയുക്തങ്ങള്
സംയുക്തങ്ങളിലെ ലളിതമായ ഘടനകള് അവ ആദ്യമായി കണ്ടെത്തിയ പദാര്ഥത്തിന്റെ പേരിലാണ് അറിയപ്പെടുന്നത്. ഡയമണ്ട്, സിങ്ക് സള്ഫൈഡ് (ZnS), സീസിയം ക്ലോറൈഡ് (CsCl), സോഡിയം ക്ലോറൈഡ് (NaCl), കാത്സ്യം ഫ്ളൂറൈഡ് (CaF2) എന്നിങ്ങനെ. A, X എന്ന രണ്ടു മൂലകങ്ങള് ചേര്ന്നുണ്ടാകുന്ന A+X–, A++X2– എന്നീ തരത്തിലുള്ള സംയുക്തങ്ങള് ഈ വകുപ്പില്പ്പെടുന്നു (+, - ചിഹ്നങ്ങള് അയോണുകളെ സൂചിപ്പിക്കുന്നു). ഇവയ്ക്കെല്ലാം ഉയര്ന്ന സമമിതിയും ക്യൂബിക് ഘടനയുമുണ്ട്. അയോണുകള് യൂണിറ്റ് സെല്ലിന്റെ കോണുകളിലും മറ്റുചില പ്രത്യേക സ്ഥാനങ്ങളിലും നിലകൊള്ളുന്നു.
സോഡിയം ക്ലോറൈഡ് ഘടന (Sodium chloride structure)
ഇതില് ഓരോ ധന അയോണിനു ചുറ്റും ആറു നെഗറ്റീവ് അയോണുകള് വര്ത്തിക്കുന്നു-മറിച്ചും. ഇത്തരം ഘടനയുടെ 'കോ-ഓര്ഡിനേഷന്' എന്നാകുന്നു. ഒരാറ്റത്തിന്റെ അയോണുകളുടെ (അണുക്കളുടെ) സംഖ്യയ്ക്കാണ് കോ-ഓര്ഡിനേഷന് ![]() നമ്പര് എന്നു പറയുന്നത്. രണ്ടുതരം അയോണുകളും രണ്ടു മുഖ കേന്ദ്രിത ക്യൂബുകളായി ഇടകലര്ന്നു നില്ക്കുന്നു. ഒരു ക്യൂബിന്റെ പാര്ശ്വം 'a' ആണെങ്കില്, ഓരോ ക്യൂബിന്റെയും
നമ്പര് എന്നു പറയുന്നത്. രണ്ടുതരം അയോണുകളും രണ്ടു മുഖ കേന്ദ്രിത ക്യൂബുകളായി ഇടകലര്ന്നു നില്ക്കുന്നു. ഒരു ക്യൂബിന്റെ പാര്ശ്വം 'a' ആണെങ്കില്, ഓരോ ക്യൂബിന്റെയും ![]() ദൂരത്തിലാണ് മറ്റേ ക്യൂബിന്റെ സ്ഥാനം. ഇത്തരം ഘടനയുള്ള പദാര്ഥങ്ങളെക്കുറിച്ചുള്ള പഠനത്തില്നിന്ന് താഴെപ്പറയുന്ന വസ്തുതകള് വ്യക്തമായിട്ടുണ്ട്.
ദൂരത്തിലാണ് മറ്റേ ക്യൂബിന്റെ സ്ഥാനം. ഇത്തരം ഘടനയുള്ള പദാര്ഥങ്ങളെക്കുറിച്ചുള്ള പഠനത്തില്നിന്ന് താഴെപ്പറയുന്ന വസ്തുതകള് വ്യക്തമായിട്ടുണ്ട്.
1. ഓരോ അയോണിലും നിശ്ചിതമായ ഒരു വ്യാസാര്ധമുണ്ടെന്നു സങ്കല്പിക്കാവുന്നതാണ്. ഒരു ധന അയോണ് അതിന്റെ ആറ്റത്തിനേക്കാള് ചെറുതും ഋണ അയോണ് വലുതുമാണ്.
2. ഓരോ അയോണും വിപരീതചിഹ്നമുള്ള അയോണുകളെക്കൊണ്ട് പരമാവധി വലയിതമായിരിക്കും.
ഈ നിബന്ധനകളനുസരിച്ച് ഘടനയെ നിര്ണയിക്കുന്നത് രണ്ടു ഘടകങ്ങളാണ്; ഒന്ന്, അയോണിന്റെ വലുപ്പം (ഏകദേശം ഗോളങ്ങളായി അയോണുകളെ പരിഗണിക്കാം); രണ്ട്, ഊര്ജപരമായി എത്രത്തോളം ചെറിയ വ്യാപ്തത്തില് വൈദ്യുതമായ നിര്വീര്യത (neutrality) ഉണ്ടാകാമെന്നുള്ള പരിഗണന. ആദര്ശഘടനയില് എല്ലാ അയോണുകളും പരസ്പരം തൊട്ടിരിക്കണം. അതായത്, അയോണുകളുടെ വ്യാസാര്ധം rA, rX ആണെങ്കില് അഥവാ എന്ന അനുപാതം 0.41-നെക്കാള് ചെറുതായാല് അയോണുകള് തമ്മില് സമ്പര്ക്കമില്ലെന്നര്ഥം. അസ്ഥിരമായ ഘടനയാണത്. ![]() നെക്കാള് വലുതായാല് പോസിറ്റീവ് അയോണുകള് തമ്മില് സമ്പര്ക്കമുണ്ടാവുകയില്ല. പക്ഷേ വിപരീത അയോണുകള് തമ്മില് സ്പര്ശിച്ചിരിക്കും. ഈ ഘടന
നെക്കാള് വലുതായാല് പോസിറ്റീവ് അയോണുകള് തമ്മില് സമ്പര്ക്കമുണ്ടാവുകയില്ല. പക്ഷേ വിപരീത അയോണുകള് തമ്മില് സ്പര്ശിച്ചിരിക്കും. ഈ ഘടന ![]() എന്ന പരിധി വരെ ദൃഢമായിരിക്കും. സീസിയം ക്ലോറൈഡില് ഇതാണ് സംഭവിക്കുന്നത്.
എന്ന പരിധി വരെ ദൃഢമായിരിക്കും. സീസിയം ക്ലോറൈഡില് ഇതാണ് സംഭവിക്കുന്നത്.
സീസിയം ക്ലോറൈഡ് ഘടന (Cesium Chloride Structure)
ഈ ഘടനയുടെ കോ-ഓര്ഡിനേഷന് ![]() ആകുന്നു; ധന അയോണുകള് ഒരു ക്യൂബ്; ഋണ അയോണുകള് മറ്റൊരു ക്യൂബ്-ഇവയുടെ കേന്ദ്രങ്ങള് തമ്മിലുള്ള അകലം
ആകുന്നു; ധന അയോണുകള് ഒരു ക്യൂബ്; ഋണ അയോണുകള് മറ്റൊരു ക്യൂബ്-ഇവയുടെ കേന്ദ്രങ്ങള് തമ്മിലുള്ള അകലം ![]() . അയോണുകള് തമ്മില് സ്പര്ശിക്കുന്നത് ആന്തരകര്ണരേഖയിലാണ്.
. അയോണുകള് തമ്മില് സ്പര്ശിക്കുന്നത് ആന്തരകര്ണരേഖയിലാണ്.
ഡയമണ്ട് ഘടന
ഇതില് ഓരോ ആറ്റവും തൊട്ടടുത്തുള്ള നാല് ആറ്റങ്ങള് രൂപം കൊടുക്കുന്ന ഒരു ടെട്രാഹെഡ്രന്റെ (tetrahedron) നടുവില് നിലകൊള്ളുന്നു. കാര്ബണ് മൂലകത്തിന്റെ സംയോജകത (valency) യ്ക്കുള്ള പ്രത്യേകതകൊണ്ടാണിതുണ്ടാകുന്നത്. ആറ്റങ്ങളെ മുഖകേന്ദ്രിതമായ രണ്ടുതരം ക്യൂബുകളായി പരിഗണിക്കാം. ക്യൂബുകള് തമ്മിലുള്ള അകലം ![]() . സിങ്ക് സള്ഫൈഡ് ഘടനയും ഇതുപോലെതന്നെ.
. സിങ്ക് സള്ഫൈഡ് ഘടനയും ഇതുപോലെതന്നെ.
കാത്സ്യം ഫ്ളൂറൈഡ് ഘടന
ഈ ഘടനയില്, യൂണിറ്റ് സെല് (ക്യൂബിക്) എട്ടുതുല്യമായ ക്യൂബുകളാക്കി വിഭജിക്കുന്നു എന്നു സങ്കല്പിച്ചാല് സെല്ലിന്റെ മൂലകളിലും മുഖകേന്ദ്രങ്ങളിലും കാത്സ്യം അയോണുകളും ചെറിയ ക്യൂബുകളുടെ മധ്യത്തില് ഫ്ളൂറിന് അയോണുകളും വര്ത്തിക്കുന്നു. മുഖകേന്ദ്രിതമായ മൂന്നു ക്യൂബുകളുടെ സങ്കലനമാണ് ഇതുകൊണ്ടുണ്ടാകുന്നത്.
ക്രിസ്റ്റലുകളുടെ രാസബന്ധങ്ങള്
ക്രിസ്റ്റലുകളുടെ രാസബന്ധങ്ങള് (Chemical bonds). ക്രിസ്റ്റല് ആറ്റങ്ങളെ പരസ്പരം ബന്ധിപ്പിച്ചു നിര്ത്തുന്നത് വൈദ്യുതബലങ്ങളാണ്. നാലു തരത്തിലുള്ള ബന്ധങ്ങള് ഇതുകൊണ്ടുണ്ടാകുന്നു; അയോണികം (ionic), സഹസംയോജകം (covalent), ലോഹപരം (mechanic), അവശിഷ്ടപരം (residual).
അയോണികബന്ധം
ഇതില് പരസ്പരം ബന്ധിക്കപ്പെട്ടു നില്ക്കുന്ന കണികകള് അയോണുകളായി വര്ത്തിക്കുന്നു. ഇവയുടെ ബാഹ്യഭ്രമണപഥത്തില് സാധാരണയായി എട്ടോ പതിനെട്ടോ ഇലക്ട്രോണുകളുണ്ടായിരിക്കും. വിപരീതചാര്ജുള്ള അയോണുകള് തമ്മില് വൈദ്യുതാകര്ഷണവും സമാനചാര്ജുള്ളവ തമ്മില് വികര്ഷണവും സംഭവിക്കുന്നു. ഈ രണ്ടു ബലങ്ങളുടെയും സമതുലനംകൊണ്ടാണ് ക്രിസ്റ്റലിന്റെ ഘടന ദൃഢമായി നിലനില്ക്കുന്നത്. അയോണുകളെ ചെറിയ ഗോളങ്ങളായി കരുതാം. അയോണുകളുടെ വലുപ്പം കുറയുകയും ചാര്ജു കൂടുകയും ചെയ്യുമ്പോള് അവ തമ്മിലുള്ള അകല്ച്ച കുറയുന്നു; ബന്ധം ദൃഢതരമാകുന്നു. മറിച്ച്, അയോണുകളുടെ വലുപ്പം കൂടുമ്പോള് ബന്ധം ദുര്ബലമായിരിക്കും. ഇതിനുപുറമേ സ്വതന്ത്രമായ ഇലക്ട്രോണുകള് ഇല്ലാത്തതിനാല് ഇത്തരം ക്രിസ്റ്റലുകളുടെ വൈദ്യുതചാലകത കുറഞ്ഞിരിക്കുകയും ചെയ്യും. സോഡിയം ക്ലോറൈഡ് ക്രിസ്റ്റലില് ഇത്തരം രാസബന്ധമാണുള്ളത്. Na+, Cl- എന്നീ അയോണുകളാണ് അതിലുള്ളത്.
സഹസംയോജകബന്ധം
സഹസംയോജകബന്ധങ്ങളില് കണികകള് തമ്മില് ഇലക്ട്രോണുകളെ പങ്കിടുന്നു. ഇതിനാല് ആറ്റങ്ങളുടെ ബാഹ്യവലയങ്ങളില് ഇലക്ട്രോണുകളുടെ എണ്ണം എട്ടോ പതിനെട്ടോ ആയി പൂര്ത്തിയാവുന്നു. ഉദാ. രണ്ടു ക്ലോറിന് ആറ്റങ്ങള് സംയോജിക്കുമ്പോള് ബാഹ്യവലയത്തിലെ ഇലക്ട്രോണ് വിതരണം :Cl:Cl: എന്ന രീതിയിലാണ് ഇത് ഒരു സിംഗിള് ബോണ്ട് (single bond) ആകുന്നു.
ഒരാറ്റത്തില് ഏഴ് സംയോജക ഇലക്ട്രോണുകളുണ്ടെങ്കില് (n = 7). അതിന് അതേ തരത്തിലുള്ള ഒരണുവിനോടു മാത്രമേ ബന്ധിതമാകാന് പറ്റൂ. ബാഹ്യവലയത്തിലെ ഇലക്ട്രോണുകളുടെ എണ്ണം നാലില് കുറവാണെങ്കില് അത്തരം അണുക്കള് തമ്മില് സഹസംയോജകബന്ധം രൂപപ്പെടുകയുമില്ല.
ബന്ധങ്ങള്ക്കു പ്രത്യേക ദിശകളുണ്ടെന്ന ഒരു സവിശേഷതയും ഇതിലുണ്ട്. അതിനാല് തന്മാത്രകള്ക്കു നിശ്ചിതമായ ആകൃതിയും കൈവരുന്നു. ഉദാ. നൈട്രജന്, ഹൈഡ്രജന് എന്നിവ ചേര്ന്നുണ്ടാകുന്ന അമോണിയ (NH3) തന്മാത്രയ്ക്ക് ഒരു പിരമിഡിന്റെ രൂപമാണുള്ളത്. ജലതന്മാത്ര രേഖീയമല്ല. കാര്ബണ് മൂലകത്തിന്റെ ഒറ്റ ബന്ധങ്ങള് ടെട്രാഹെഡ്രല് കോണുകളിലായതിനാല് കാര്ബണ് മാത്രമുള്ള വജ്റ (diamond)ത്തില് ആറ്റങ്ങള് പരസ്പരം ടെട്രാഹെഡ്രല് സ്ഥാനങ്ങളില് നിലകൊള്ളുന്നു. ക്വാണ്ടം ബലതന്ത്രമനുസരിച്ച് സഹസംയോജകബന്ധങ്ങള് ഉണ്ടാവുന്നത് 'ഹൈബ്രിഡിത ഓര്ബിറ്റലുകള്' (hybridised orbitals) മൂലമാണ്.
ലോഹബന്ധം
ലോഹങ്ങളിലെ ആറ്റങ്ങളില് നിന്നു ബാഹ്യ ഇലക്ട്രോണുകള് വിമുക്തമായി ഒരു ഇലക്ട്രോണ് വാതകം ലോഹത്തില് നിലനില്ക്കുന്നുണ്ടെന്ന് ഡ്രൂഡെ (Drude) സങ്കല്പിച്ചു. ഈ സ്വതന്ത്ര ഇലക്ട്രോണുകള് ലോഹത്തിന് ഉയര്ന്ന വൈദ്യുത ചാലകത നല്കുന്നു. ഇങ്ങനെ ചില ലോഹഗുണങ്ങളെ വ്യാഖ്യാനിക്കുവാന് സ്വതന്ത്ര ഇലക്ട്രോണ് സിദ്ധാന്തം പര്യാപ്തമാണെങ്കില് വിശിഷ്ടതാപം മുതലായ ചില ഗുണങ്ങളെപ്പറ്റി പ്രതിപാദിക്കാന് അത് അപര്യാപ്തമാണ്. ആധുനിക സിദ്ധാന്ത പ്രകാരം ലോഹബന്ധം സഹസംയോജകബന്ധത്തോടു സദൃശമാണ്. ഉദാ. രണ്ടു സോഡിയം ആറ്റങ്ങള് പരസ്പരം അടുക്കുന്നുവെന്നു കരുതുക. സോഡിയം ആറ്റത്തില് ബാഹ്യവലയത്തില് ഒറ്റയായ ഒരു ഇലക്ട്രോണ് മാത്രമാണുള്ളത്. ഇത് അയുഗ്മിത (unpaired)മാണ്. രണ്ടാറ്റങ്ങള് തമ്മില് അടുക്കുമ്പോള് അവ തമ്മില് ഒരു യുഗ്മബന്ധം ഉണ്ടാകുന്നു. മൂന്നാമതൊരു ആറ്റം ഈ ആറ്റങ്ങളുടെ സമീപമെത്തുമ്പോള് അതിലുള്ള ഏക ഇലക്ട്രോണ് ഒന്നാമത്തെ ആറ്റത്തിലുള്ള ഇലക്ട്രോണുമായി ക്ഷണികമായ ഒരു യുഗ്മനം പ്രാപിക്കുന്നു. അതായത്, ഒന്നാമത്തെ ആറ്റത്തിലെ ഇലക്ട്രോണ് ചുറ്റും വന്നുകൂടുന്ന ആറ്റങ്ങളിലെ ഇലക്ട്രോണുകളോടു താത്കാലികമായി മാറിമാറി ബന്ധപ്പെടുകയാണ്. ഇങ്ങനെ ഓരോ സോഡിയം അണുവിനു ചുറ്റും ഏട്ട് മറ്റു സോഡിയം ആറ്റങ്ങള് സ്ഥാനമുറപ്പിക്കുന്നു. സോഡിയം ക്രിസ്റ്റലിന്റെ ഘടനയാണിത്. പക്ഷേ ഇലക്ട്രോണുകള് തമ്മില് ദൃഢമായി നിബന്ധമല്ലാത്തതിനാല് അവ മിക്കവാറും സ്വതന്ത്രമായ രീതിയില്ത്തന്നെ ലോഹത്തില് വര്ത്തിക്കുന്നു.
അവശിഷ്ടബന്ധം
ദ്വിധ്രുവങ്ങള് (dipols) തമ്മിലുള്ള ആകര്ഷണമാണ് ഈ ബന്ധത്തിനടിസ്ഥാനം. ദ്വിധ്രുവങ്ങള് മൂന്നുവിധത്തിലാകാം-(1) സ്ഥിരമായവ, ഉദാ. ജലം, അമോണിയ എന്നീ തന്മാത്രകള്; (2) പ്രേരിതമായവ; (3) ഗതികധ്രുവണം (Dynamic polarisation)കൊണ്ട് ഉണ്ടാകുന്നവ. ഇത്തരം ബന്ധംകൊണ്ട് തന്മാത്രകള് ദ്രാവകത്തിലോ ബാഷ്പത്തിലോ വര്ത്തിക്കുന്നതു പോലെ ക്രിസ്റ്റലില് നിലകൊള്ളുന്നു. ക്രിസ്റ്റലുകള് സുതാര്യവും അചാലകവുമായിരിക്കും.
മേല്പറഞ്ഞവയ്ക്കു പുറമേ കണികകളെ ബന്ധിപ്പിക്കുന്ന ഒരു ബലം ഹൈഡ്രജന് ബന്ധമാണ് (hydrogen bond). ചില ആറ്റങ്ങള്ക്ക് ശക്തമായ ഇലക്ട്രോണിക ബന്ധുത(electron affinity)യുണ്ട്. ഉദാ. ഓക്സിജന്, ഫ്ളൂറിന്, നൈട്രജന് മുതലായവ. ഈ ആറ്റങ്ങള് ഒരു പ്രോട്ടോണിലൂടെ പരസ്പരം സംയോജിക്കുകയും അവയുടെ സ്വായത്തമായ വലുപ്പം കുറഞ്ഞതുപോലെ അടുത്തുചേര്ന്ന് ഒരു കണിക രൂപംകൊള്ളുകയും ചെയ്യുന്നു. ഓക്സിജന് അയോണിന്റെ വ്യാസാര്ധം 1.32 A ആണെങ്കിലും അവ രണ്ടെണ്ണം ഒരു പ്രോട്ടോണിലൂടെ ബന്ധപ്പെടുമ്പോള് അവ തമ്മിലുള്ള ദൂരം 2.55 A ആയിത്തീരുന്നു. മുഖ്യമായും ഓര്ഗാനിക് ക്രിസ്റ്റലുകളിലാണ് ഹൈഡ്രജന് ബന്ധങ്ങള് ഉണ്ടാകുന്നത്.
അറ്റോമികബന്ധങ്ങള് മേല്പറഞ്ഞ വിധം പല തരത്തിലുണ്ടെങ്കിലും സാധാരണയായി ക്രിസ്റ്റലുകളില് അവ കൂടിക്കലര്ന്നുള്ള സങ്കരബന്ധങ്ങളാണ് കാണുന്നത്. തന്മൂലം കണികകളുടെ വലുപ്പവും ബന്ധദൈര്ഘ്യവും എല്ലാ ക്രിസ്റ്റലുകളിലും ഒരുപോലെയല്ല. രണ്ടു കാര്ബണ് ചേര്ന്നുണ്ടാകുന്ന C-C എന്ന ബന്ധ(സിംഗിള്)ത്തിന് ദൈര്ഘ്യം 1.54 A യും C-C എന്ന ഡബിള് ബന്ധത്തിന് 1.35A യുമാണ്. പക്ഷേ ബന്സീന് വലയത്തില് (benzene ring) ഇത് 1.39 A ആയിത്തീരുന്നു. രണ്ടുതരം ബന്ധങ്ങളുടെയും ഒരു സങ്കരമാണ് ഇതെന്നു വ്യക്തം. അനുനാദബന്ധങ്ങള് (resonance bonds) എന്ന പേരില് അറിയപ്പെടുന്നു.
ക്രിസ്റ്റല് ജാലികയിലെ ജ്യാമിതീയ ബിന്ദുക്കളുടെ സ്ഥാനത്തുള്ള കണികകള് ആറ്റങ്ങളോ അയോണുകളോ തന്മാത്രകളോ ആയിരിക്കും. ആറ്റങ്ങളും അയോണുകളും നിശ്ചിത വ്യാസമുള്ള ഗോളങ്ങളെപ്പോലെ നിലകൊള്ളുന്നു. ധനചാര്ജ് കുറയുന്നതനുസരിച്ച് അയോണുകളുടെ വലുപ്പവും വര്ധിക്കുന്നു. ഈയത്തിന്റെ അയോണുകളുടെ വലുപ്പവും (വ്യാസാര്ധം) ചാര്ജും തമ്മിലുള്ള ബന്ധം നോക്കുക:
മാത്രമല്ല, ഒരു കണികയുടെ വലുപ്പം ക്രിസ്റ്റലില് അതിനെ സ്പര്ശിച്ചിരിക്കുന്ന കണികകളുടെ എണ്ണത്തെയും ആസ്പദമാക്കി മാറുന്നു. ഈ കോ-ഓര്ഡിനേഷന് സംഖ്യ വര്ധിക്കുമ്പോള് കണികയുടെ വലുപ്പവും കൂടുതലായിരിക്കും. ഇതിനും പുറമേ കണികയുടെ വൈദ്യുത ധ്രുവീകരണം (electric polarisation) അതിന്റെ വലുപ്പത്തെ ചെറുതാക്കുന്ന ഒരു പ്രതിഭാസവുമാണ്.
എല്ലാ ക്രിസ്റ്റലുകളിലും കണികകള് ഗോളാകൃതിയിലല്ല വര്ത്തിക്കുന്നത്. തന്മാത്രകളുടെ സങ്കീര്ണതയനുസരിച്ച് ക്രിസ്റ്റലിനും സങ്കീര്ണഘടനകള് ഉണ്ടായിത്തീരുന്നു.
ക്രിസ്റ്റലുകളുടെ ഭൗതികഗുണങ്ങള്
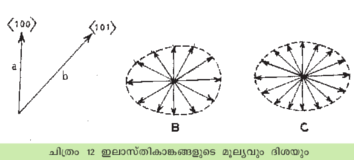
ഒരു ക്രിസ്റ്റലിന്റെ സമമിതിയും അതിന്റെ ഭൗതികഗുണങ്ങളും തമ്മില് പല സാദൃശ്യങ്ങളുമുണ്ട്. ക്രിസ്റ്റലിന്റെ ഘടന ഒരു ബിന്ദുവില്നിന്ന് ഏതു ദിശയില് നോക്കിയാലും സമാനമാണെങ്കില്-ക്രിസ്റ്റല് സമദൈര്ശികം (Isotopic) ആണെങ്കില്-അതിന്റെ ചില ഗുണങ്ങള്ക്കും സമദൈശികതയുണ്ടായിരിക്കും. ഉദാ. ഇലാസ്തികത (elasticity), ഒരു ക്രിസ്റ്റലിന്മേല് ഒരു ബലം പ്രയോഗിച്ചാല് അതിലെ ആറ്റങ്ങള് തമ്മിലുള്ള ദൂരം മാറുന്നു. ഈ മാറ്റം പല ദിശയിലും പലമാതിരിയായിരിക്കും. സോഡിയം ക്ലോറൈഡ് ക്രിസ്റ്റലില് <100> എന്ന ദിശയില് ഒരു സമ്മര്ദബലം (compressive force) പ്രയോഗിച്ചാല് അസദൃശമായ ആറ്റങ്ങള് (Na, Cl) തമ്മിലുള്ള ദൂരമാണ് ഏറിയകൂറും കുറഞ്ഞുപോകുന്നത്. ഈ ബലം <101> എന്ന ദിശയിലാണെങ്കില് സദൃശാറ്റങ്ങള് തമ്മിലുള്ള ദൂരമാണ് കുറയുക. അതിനാല് ഈ രണ്ടു ദിശകളില് ഇലാസ്തികാങ്കം (elastic constant) വ്യത്യസ്തമാകുമെന്ന് അനുമാനിക്കാം. ഈ ഇലാസ്തികാങ്കങ്ങളുടെ മൂല്യവും ദിശയും രണ്ടു സദിശരേഖകള്(vectors) കൊണ്ടു സൂചിപ്പിക്കാവുന്നതാണ്.
ഇതുപോലെ എല്ലാ ദിശകളും അവയിലുള്ള ഇലസ്തികാങ്കവും പരിഗണിച്ചാല് ചിത്രത്തില് കാണുന്നമാതിരി അനേകം സദിശങ്ങള് വരയ്ക്കാവുന്നതാണ്. ഈ സദിശങ്ങളുടെ അഗ്രബിന്ദുക്കള് ഒരു സദിശതലം(vector surface) സൃഷ്ടിക്കുന്നു. ഇലാസ്തികാങ്കം എല്ലാ ദിശയിലും തുല്യമാണെങ്കില്, സദിശങ്ങളും തുല്യ ദൈര്ഘ്യമുള്ളവയായിരിക്കും. തന്മൂലം സദിശതലം ഗോളാകൃതിയാകുന്നു. ഇലാസ്തികതയെപ്പോലെ ക്രിസ്റ്റലിന്റെ ഇതര ഗുണങ്ങള്ക്കും അതാതിന്റെ സദിശതലങ്ങള് വരയ്ക്കാവുന്നതാണ്. ഈ തലങ്ങള്ക്കു ക്രിസ്റ്റലിനെക്കാളധികം സമമിതി ഗുണങ്ങളുണ്ടായെന്നു വരാം. ഉദാ. താപീയ വികാസം പരിഗണിക്കുക. ക്യൂബിക് സമമിതിയുള്ള ഒരു ക്രിസ്റ്റല് ചൂടാക്കിയാല് അത് എല്ലാ ദിശയിലും ഒന്നുപോലെ വികസിക്കുന്നു. അതിനാല് അതിന്റെ താപീയ വികസനാങ്കം എല്ലാ ദിശയിലും തുല്യവും മേല്പറഞ്ഞ സദിശതലം ഗോളീയവുമാണ്. ഗോളത്തിന് ക്യൂബിക് ക്രിസ്റ്റലിനെക്കാളധികം സമമിതിയുമുണ്ട്.
ക്യൂബിക് അല്ലാത്ത ക്രിസ്റ്റലുകളില് ഒരു പ്രത്യേക ദിശയില്-അക്ഷത്തില്-താപീയ വികാസത്തിന് ഒരു പ്രത്യേക മൂല്യവും അതിനു ലംബമായിട്ടുള്ള ദിശകളില് വികസനത്തിനു സമമിതിയുമുണ്ടെങ്കില് മേല്പ്പറഞ്ഞ സദിശതലം ദീര്ഘവൃത്താകാരമായിരിക്കും (ellipsoid). ഈ സദിശതലത്തിന്റെ സമമിതിയും ക്രിസ്റ്റലിന്റെ സമമിതിയും തമ്മില് താരതമ്യം ചെയ്താല് താപീയവികാസം ഓരോ ദിശയിലും ഏതു രീതിയില് സംഭവിക്കുന്നുവെന്നു കണ്ടെത്താന് കഴിയും. ഏതായാലും ഭൗതികഗുണങ്ങള് സമമിതിയുടെ അടിസ്ഥാനത്തിലാണ് ഓരോ ദിശയിലും പ്രത്യക്ഷപ്പെടുന്നത്. ഒരു പ്രത്യേക ഗുണത്തിന് ഏതെങ്കിലും സമമിതിയുടെ അഭാവമുണ്ടെങ്കില് ക്രിസ്റ്റല് ഘടനയിലും ആ സമമിതി ഇല്ലെന്നുറപ്പിക്കാം.
സമമിതിയെ ആസ്പദമാക്കിയുള്ള പ്രധാനമായ ഒരു പ്രതിഭാസമാണ് ക്രിസ്റ്റലുകളില് കാണപ്പെടുന്ന ദ്വി-അപവര്ത്തനം (double-refSraction).
ക്രിസ്റ്റല് പ്രാകാശികം
ക്രിസ്റ്റല് പ്രാകാശികം (Crystal optics). ക്രിസ്റ്റലുകളുടെ ദ്വി-അപവര്ത്തന(double refraction)വും ധ്രുവണഘൂര്ണകതയും ക്രിസ്റ്റല് ഘടനയിലെ അസമദൈശികത കാരണമായി സംഭവിക്കുന്ന രണ്ട് പ്രധാന പ്രതിഭാസങ്ങളാണ്.
ദ്വി-അപവര്ത്തനം
ഒരു പ്രതലത്തില് പതിക്കുന്ന പ്രകാശകിരണത്തിന് അപവര്ത്തനം സംഭവിച്ച് രണ്ടു അപവര്ത്തിത കിരണങ്ങളുണ്ടാകുന്നതാണ് ദ്വി-അപവര്ത്തനം. ക്യൂബിക് ക്രിസ്റ്റലുകളില് ഇതു സംഭവിക്കുന്നില്ല. ക്യൂബിക് ക്രിസ്റ്റലുകളില് പ്രകാശം എല്ലാ ദിശയിലും ഒരേ വേഗത്തില് സഞ്ചരിക്കുന്നതിനാല് പ്രകാശവേഗത്തെ സൂചിപ്പിക്കുന്ന സദിശതലം ഗോളമായിരിക്കും. പക്ഷേ ക്യൂബിക് അല്ലാത്ത ക്രിസ്റ്റലുകളില് അങ്ങനെയല്ല. ട്രൈഗണല് (trigonal), ടെട്രാഗണല്(tetragonal), ഹെക്സാഗണല് (hexagonal) എന്നീ ആകൃതിയില്പ്പെടുന്ന ക്രിസ്റ്റലുകളില് പതിക്കുന്ന ഓരോ പ്രകാശരശ്മിയും ദ്വി-അപവര്ത്തനം സംഭവിച്ചു രണ്ടുതരം രശ്മികളായി പിരിയുന്നു. ഇവയ്ക്കു പരസ്പരം ലംബമായ ധ്രുവണവും വ്യത്യസ്തമായ പ്രകാശവേഗവുമാണുള്ളത്. അതായത്, പ്രകാശവേഗത്തിന് ഈ ക്രിസ്റ്റലുകളില് രണ്ടു സദിശതലങ്ങളുണ്ട്- ഒന്ന് ഗോളം; മറ്റൊന്ന് ആയതഗോളം എല്ലാ ദിശയിലും ഒരേ വേഗത്തില് സഞ്ചരിക്കുന്ന രശ്മിയെ 'സാധാരണരശ്മി' (ordinary ray) എന്നു പറയുന്നു.
ഈ സാധാരണ രശ്മി സ്നെല്ലിന്റെ അപവര്ത്തന നിയമങ്ങള്ക്കനുസൃതമായിരിക്കും. എന്നാല് മറ്റേ രശ്മി അപവര്ത്തന നിയമങ്ങള്ക്കതീതമായി വിഭിന്ന ദിശകളില് വ്യത്യസ്ത വേഗങ്ങളില് സഞ്ചരിക്കുകയും ചെയ്യും. അതിനാല് ഈ രശ്മിയെ 'അസാധാരണ രശ്മി' (extra ordinary ray) എന്നു വിളിക്കുന്നു. ഈ അസാധാരണ രശ്മിക്ക് വിവിധ ദിശകളില് വ്യത്യസ്തങ്ങളായ അപവര്ത്തനാങ്ക (refractive index)മാണുള്ളത്. ഒരു പ്രത്യേക അക്ഷദിശയില് മാത്രം ഈ രണ്ടുതരം രശ്മികളും ഒരേവേഗത്തില് സഞ്ചരിക്കുകയും ദ്വി-അപവര്ത്തനം സംഭവിക്കാതിരിക്കുകയും ചെയ്യുന്നു. ആ അക്ഷത്തിന് പ്രാകാശികാക്ഷം (optic axis) എന്നു പേര്.
സാധാരണരശ്മിയുടെ വേഗം അസാധാരണ രശ്മിയുടേതിനെക്കാള് കൂടുതലോ കുറവോ ആയെന്നുവരാം. കൂടുതലാണെങ്കില് സാധാരണ രശ്മി വേഗത്തിന്റെ സദിശഗോളം ആയതഗോളത്തിന്റെ പുറത്തും, കുറവാണെങ്കില് അതിന്റെ അകത്തുമായിരിക്കും. ഇതില് ഒന്നാമത്തെ തരത്തിലുള്ള ക്രിസ്റ്റലുകളെ ധാനാത്മക ക്രിസ്റ്റലുക (positive crystals)ളെന്നും രണ്ടാമത്തെ തരത്തിലുള്ളവയെ ഋണാത്മക ക്രിസ്റ്റലുകളെ (negative crsytals)ന്നും വിളിക്കുന്നു. ക്വാര്ട്സ് (quartz) ക്രിസ്റ്റലുകള് ധനാത്മകവും കാല്സൈറ്റ് (calcite) ക്രിസ്റ്റലുകള് ഋണാത്മകവുമാണ്. പ്രാകാശികാക്ഷങ്ങള് ഓര്തോറോംബിക്, മോണോക്ലിനിക്, ട്രൈക്ലിനിക് എന്നീ ക്രിസ്റ്റലുകളില് രണ്ടുണ്ട്.
ധ്രുവണഘൂര്ണകത
ചില ക്രിസ്റ്റലുകള് അവയില്ക്കൂടി സഞ്ചരിക്കുന്ന സമതലധ്രുവിത പ്രകാശ( plane polarised light)ത്തിന്റെ ധ്രുവണതലത്തെ തിരിക്കുവാന് കഴിവുള്ളവയാണ്. ഇത്തരത്തിലുള്ള ക്രിസ്റ്റലുകളിലൊന്നാണ് ക്വാര്ട്ട്സ്. സമതല ധ്രുവിത പ്രകാശം പ്രാകാശികാക്ഷത്തിന്റെ ദിശയില് സഞ്ചരിക്കുമ്പോഴാണ് ഈ ഘൂര്ണനം ഏറ്റവുമധികം അനുഭവപ്പെടുന്നത്. ധ്രുവണതലത്തെ വലത്തോട്ടു തിരിക്കുന്ന ക്രിസ്റ്റലുകളെ ദക്ഷിണധ്രുവണഘൂര്ണകങ്ങളെ (dextro rotatory)ന്നും, ഇടത്തോട്ടു തിരിക്കുന്നവയെ വാമധ്രുവണഘൂര്ണകങ്ങളെ (laevo rotatory)ന്നും വിളിക്കുന്നു. ക്വാര്ട്സ് ക്രിസ്റ്റലുകളില് ഈ രണ്ടു തലത്തിലുള്ള ക്രിസ്റ്റലുകളും കാണാം. ക്രിസ്റ്റലുകളിലെ തന്മാത്രകള് പ്രാകാശികാക്ഷത്തിനു ചുറ്റും സര്പ്പിലമായി ആവര്ത്തനം (spiral repition) ചെയ്യപ്പെടുന്നതിനാലാണ് പ്രകാശത്തിന് ഇത്തരത്തിലുള്ള ധ്രുവണഘൂര്ണനം സംഭവിക്കുന്നത്. ഘൂര്ണനത്തിന്റെ അളവ് പ്രകാശം കടന്നുപോകുന്ന ദൂരത്തിന് ആനുപാതികമായിരിക്കും. വിവിധ വര്ണങ്ങളിലുള്ള രശ്മികള്ക്ക് വിഭിന്നമായ ഘൂര്ണനമാണ് സംഭവിക്കുന്നത്. ചുവപ്പിന് ഏറ്റവും കുറവും വയലറ്റിന് ഏറ്റവുമധികവും ഘൂര്ണനം സംഭവിക്കുന്നു.
ക്രിസ്റ്റല് ന്യൂനതകള്
സാധാരണ ക്രിസ്റ്റലുകളില് ജ്യാമിതീയമായി പരിപൂര്ണമെന്നു കരുതാവുന്ന ഘടനയില്ല. അവയുടെ ലാറ്റിസുകളില് പലതരത്തിലുള്ള അപൂര്ണതകളും ന്യൂനതകളുമുണ്ടെന്നു മാത്രമല്ല, ആ ന്യൂനതകള് കാരണം ക്രിസ്റ്റലുകള്ക്ക് സവിശേഷമായ ചില സ്വഭാവങ്ങളുണ്ടാവുകയും ചെയ്യുന്നു. താഴെപ്പറയുന്ന ന്യൂനതകളാണ് ക്രിസ്റ്റലുകളില് കാണുന്നത്.
തന്മാത്രകളുടെ താപീയചലനം
ആറ്റങ്ങള് ഒരിടത്ത് നിശ്ചലമായി വര്ത്തിക്കുന്നില്ല. ക്രിസ്റ്റലിന്റെ താപനിലയനുസരിച്ച് അവ പ്രകമ്പനത്തിനു വിധേയമാണ്. ഉദാ. NaCl ക്രിസ്റ്റലില് അന്തരീക്ഷതാപനിലയില് സോഡിയം അണുവിന്റെ പ്രകമ്പനായാമം (amplitude of vibration) 0.245 A-യും ക്ലോറിന്റേത് 0.235 A-യുമാകുന്നു. താപനില 900oK ആകുമ്പോള് ഇത് ഏകദേശം 0.58A ആയി വര്ധിക്കുന്നു.
ഘൂര്ണനം ചെയ്യുന്ന അംശങ്ങള്
ദ്രവണാങ്കത്തോട് അടുക്കുമ്പോള് പല ക്രിസ്റ്റലുകളിലും റാഡിക്കലുകളോ തന്മാത്രകളോ ഭ്രമണം ചെയ്യുന്നു. ഇതുമൂലം സമമിതിക്കു മാറ്റം വരികയും വിശിഷ്ടതാപത്തിന്റെ അസാംഗത്യം (specific heat anomaly) മുതലായി ചില ഗുണമാറ്റങ്ങള് ഉണ്ടാവുകയും ചെയ്യുന്നു.
ഉപരിതലത്തിന്റെ ഉള്വലിവ്
ക്രിസ്റ്റലിന്റെ ഉപരിതലത്തിനു സമാന്തരമായി ഉള്ഭാഗത്തുള്ള ആറ്റതലങ്ങളെടുത്താല് അവ തമ്മിലുള്ള അകലം ഉപരിതലവും അതിനു തൊട്ടുതാഴെയുള്ള തലവും തമ്മിലുള്ള ദൂരത്തില്നിന്നു വ്യത്യസ്തമാണെന്നു കാണാം. സോഡിയം ക്ലോറൈഡിന്റെ ഉപരിതലത്തിലുള്ള അണുക്കള് അന്തര്ഭാഗത്തുള്ളവയെ അപേക്ഷിച്ച് അഞ്ചുശതമാനത്തോളം ഉള്ളിലേക്ക് വലിഞ്ഞിരിക്കുന്നു.
തന്മാത്രകളുടെയും മറ്റും ഉത്തേജിതാവസ്ഥ
ഒന്നോ അതിലധികമോ ഇലക്ട്രോണുകള് ഉത്തേജിതമാവുകയും ഈ ഉത്തേജിതാവസ്ഥ ക്രിസ്റ്റലില്ക്കൂടി നീങ്ങിക്കൊണ്ടിരിക്കുകയും ചെയ്യുന്നു. ഉത്തേജനം സംഭവിക്കുന്നത് അള്ട്രാവയലറ്റ് വികിരണം പതിക്കുന്നതുകൊണ്ടോ മറ്റോ ആകാം. ഇത്തരം ഉത്തേജനം ക്ഷയിക്കുമ്പോള് ക്രിസ്റ്റലില്നിന്ന് സമാനമായ വികിരണം ബഹിര്ഗമിക്കുകയും ചെയ്യും.
സ്വതന്ത്രമായ ഇലക്ട്രോണുകളുടെയും 'ദ്വാര'(hole) ങ്ങളുടെയും സാന്നിധ്യം
ഒരണുവിന്റെ വലയത്തില് നിന്ന് ഒരു ഇലക്ട്രോണ് സ്വതന്ത്രമായി ക്രിസ്റ്റലില്ക്കൂടി സഞ്ചരിക്കുന്നുവെന്നു വരാം. ഇലക്ട്രോണ് നഷ്ടപ്പെട്ട സ്ഥാനത്തെ ഒരു ധനാത്മക ദ്വാരം (positive hole) ആയി കണക്കാക്കുന്നു. അടുത്തുള്ള മറ്റൊരു ഇലക്ട്രോണ് ഈ ദ്വാരത്തിലേക്കു നീങ്ങുകയാണെങ്കില് ദ്വാരം ആ സ്ഥാനത്തേക്കു മാറുന്നു. ഇങ്ങനെ ഒരു ക്രിസ്റ്റലില്ക്കൂടി ഇലക്ട്രോണുകളുടെ ഒരു പ്രവാഹവും അതിനെതിരായ ദിശയില് ദ്വാരങ്ങളുടെ ഒരു പ്രവാഹവും സംഭവിക്കുന്നു. അര്ധചാലക വസ്തുക്കള്ക്ക് (Semi conductors) പ്രത്യേക ഗുണങ്ങള് ഇത്തരം പ്രവാഹങ്ങള്കൊണ്ടാണ് ഉണ്ടാകുന്നത്.
ഘടനയിലെ വൈകല്യങ്ങയയള്
ലാറ്റിസിലുള്ള ചില സ്ഥാനങ്ങളില് ആറ്റങ്ങള് ഇല്ലാതിരിക്കുകയും പകരം സ്ഥാനങ്ങളില് ഇലക്ട്രോണുകള് വര്ത്തിക്കുകയും ചെയ്യുന്നതാണ് ഒരു വൈകല്യം. മറ്റൊന്ന്, ആറ്റങ്ങള് സ്വസ്ഥാനത്തിലല്ലാതെ മറ്റാറ്റങ്ങളുടെ ഇടയിലേക്കു കടന്നുവര്ത്തിക്കുന്നതാണ്.
മാലിന്യങ്ങള്
ഒരു ക്രിസ്റ്റലിന്റെ തനതായ ആറ്റങ്ങളുടെ സ്ഥാനത്തോ അവയ്ക്കിടയിലോ മറ്റേതെങ്കിലും മൂലകത്തിന്റെ ആറ്റങ്ങള് വന്നുചേരുമ്പോള് ക്രിസ്റ്റലിന്റെ സ്വഭാവങ്ങള്ക്ക് ഗണ്യമായ പരിണാമം സംഭവിക്കുന്നു. ഒരു ജെര്മേനിയം ക്രിസ്റ്റലില് 0.01 ശതമാനം ആഴ്സെനിക് ആറ്റങ്ങള് കലര്ത്തിയാല് ആ ക്രിസ്റ്റലിന് ഒരു ഡയോഡുപോലെ പ്രയോജനപ്പെടുത്താനുതകുന്ന ചില ഗുണങ്ങള് കൈവരുന്നു. ചെമ്പില് ഇത്രയുംതന്നെ ബിസ്മത്ത് ആറ്റങ്ങള് കലര്ത്തിയാല്, അതിനു ഭംഗുരത (brittleness) ഉണ്ടാകുന്നു.
ക്രിസ്റ്റലിനകത്തുള്ള വിഭാഗീയ ചലനം
ക്രിസ്റ്റലിന്റെ ഒരു ഭാഗം മറ്റൊരു ഭാഗത്തിനു സമാന്തരമായി നിരങ്ങിപ്പോയെന്നുവരാം. ഇതുകൊണ്ട് ഘടനയില് ഒരു ക്രമഭംഗമുണ്ടാകുന്നു. ഇങ്ങനെ ആറ്റതലങ്ങള്ക്കു സ്ഥാനഭ്രംശമുണ്ടായ മേഖലയുടെ പരിധിരേഖയെ ഒരു ക്രമഭംഗരേഖ എന്നു പറയുന്നു. ക്രിസ്റ്റലുകളില് ഇത്തരം രേഖകള് ധാരാളമായി ഉണ്ടാകാറുണ്ട്. ക്രിസ്റ്റല് രൂപീകൃതമാവുന്ന ഘട്ടത്തില്ത്തന്നെ ഇവ ആവിര്ഭവിച്ചിരിക്കും.
ക്രിസ്റ്റലുകളുടെ ഘടന ഏകാത്മകമാണെങ്കിലും ഓരോ ക്രിസ്റ്റലും ചെറിയ ബ്ളോക്കുകളായി തിരിഞ്ഞാണ് നിലകൊള്ളുന്നത്. അതായത് ഒരു മൊസേക്ക് ഘടനയാണ് ക്രിസ്റ്റലിനുള്ളത്.
വൈദ്യുതചാലകത
സുതാര്യമായ ക്രിസ്റ്റലുകള് പൊതുവേ വൈദ്യുതരോധകങ്ങള് (Insulators) ആണ്. അവയുടെ വൈദ്യുത പ്രതിരോധം 1010-നെക്കാള് മേലെയാവുന്നു. പക്ഷേ ഇവയില് അയോണികമായ സംവഹനം സംഭവിക്കാറുണ്ട്. ക്രിസ്റ്റലിന്റെ ഘടനയില് അയോണുകള്ക്ക് സഞ്ചരിക്കാവുന്ന വിധത്തിലുള്ള സംവഹനപഥങ്ങളുണ്ടാകാം. ക്വാര്ട്സ് ക്രിസ്റ്റലില്ക്കൂടി മുഖ്യാക്ഷത്തിന്റെ ദിശയില് ലിഥിയം, സോഡിയം എന്നീ അയോണുകള്ക്കു ചലിക്കുവാന് സാധിക്കും. പക്ഷേ ഇവയെക്കാള് വലുപ്പംകൂടിയ പൊട്ടാസ്യം, ചെമ്പ് എന്നീ അയോണുകളുടെ ചലനം സാധ്യമല്ല. മുമ്പു പ്രസ്താവിച്ച വൈകല്യങ്ങളാകാം സംവഹനത്തിന്റെ മറ്റൊരടിസ്ഥാനം. ശൂന്യസ്ഥാനങ്ങളും ആറ്റങ്ങള്ക്കിടയിലുള്ള അയോണുകളും ക്രിസ്റ്റലില്ക്കൂടി വിസരണം ചെയ്യുന്നു. ബാഹ്യമായ ഒരു പൊട്ടന്ഷ്യല് പ്രവര്ത്തിക്കുമ്പോള് ഇവ ഒരു പ്രത്യേകദിശയില് ചലിക്കുകയും അയോണിക ചലനം ഉണ്ടാവുകയും ചെയ്യുന്നു.
ഈ രീതിയില് പൊട്ടാസ്യം ക്ലോറൈഡ് (KCl) ക്രിസ്റ്റലില് താപനില ഉയര്ന്നിരിക്കുമ്പോള് രണ്ട് അയോണുകളും നീങ്ങുന്നു. AgCl (സില്വര് ക്ലോറൈഡ്) ക്രിസ്റ്റലില് സില്വര് മാത്രവും ചെറിയ തോതിലുള്ള മാലിന്യംപോലും ചിലപ്പോള് വൈദ്യുതചാലകതയെ സാരമായി ബാധിച്ചേക്കാം. സില്വര് ക്ലോറൈഡ് (AgCl)ല് ആയിരത്തിലൊരംശം ലെഡ്ക്ലോറൈഡ് (PbCl2) കലര്ന്നാല് അതിന്റെ ചാലകത ഗണ്യമായി വര്ധിക്കുന്നു.
സാധാരണ നാം കാണുന്ന വൈദ്യുതപ്രവാഹം ഇലക്ട്രോണിക സംവഹനമാണ്. ഒരു ക്രിസ്റ്റലിലെ ആറ്റങ്ങള്ക്കിടയിലൂടെ ഇലക്ട്രോണുകള്ക്ക് സ്വതന്ത്രമായി സഞ്ചരിക്കാന് കഴിയുമെങ്കില് ആ ക്രിസ്റ്റണ് ഒരു ചാലകവസ്തുവാണ്; അല്ലെങ്കില് രോധകവും. ലോഹങ്ങളില് അറ്റോമികബന്ധത്തില് നിന്ന് വിമുക്തമായ സ്വതന്ത്ര ഇലക്ട്രോണുകള് ധാരാളമുള്ളതിനാല് ചെറിയൊരു പൊട്ടന്ഷ്യല് പ്രവര്ത്തിച്ചാല്പ്പോലും വൈദ്യുതപ്രവാഹം ഉണ്ടാകുന്നു. ക്രിസ്റ്റലില് ആറ്റങ്ങള് പരസ്പരം അടുത്തിരിക്കുന്നതിനാല് ഊര്ജസ്തരങ്ങള് രേഖകളായിട്ടല്ല, ബാന്ഡുകള് (bands) ആയിട്ടാണ് വര്ത്തിക്കുന്നത്. ഇലക്ട്രോണുകള് ഭാഗികമായി നിറഞ്ഞിരിക്കുന്ന ഒരു ബാന്ഡ് ഉണ്ടെങ്കില് നേരിയ തോതിലുള്ള ഉത്തേജനംകൊണ്ട് ഇലക്ട്രോണുകളെ പ്രവഹിപ്പിക്കുവാന് സാധിക്കും. ചില പദാര്ഥങ്ങള്ക്കു ചാലകതയുണ്ടാവുന്നത് അങ്ങനെയാണ്. പൂരിതമായ ഒരു ബാന്ഡില്നിന്ന് ഒഴിഞ്ഞ ഒരു ബാന്ഡിലേക്ക് അകല്ച്ച വളരെ കൂടുതലാണെങ്കില് സാധാരണ വോള്ട്ടതകൊണ്ട് ഇലക്ട്രോണ് പ്രവാഹം ഉണ്ടാവുകയില്ല. അത്തരം ക്രിസ്റ്റലുകള് അചാലകങ്ങളാണ്. ബാന്ഡുകള് താരതമ്യേന അടുത്താണെങ്കില് പദാര്ഥം അര്ധചാലകമായിത്തീരുന്നു.
കാന്തികഗുണങ്ങള്
ഇലക്ട്രോണുകളുടെ ഭ്രമണംകൊണ്ടും ചക്രണംകൊണ്ടും ചില മൂലകങ്ങളുടെ ആറ്റങ്ങള്ക്കുതന്നെ മൊത്തത്തില് ഒരു കാന്തിക ആഘൂര്ണം (magnetic moment) സ്വായത്തമായുണ്ട്. ഉദാ. ഇരുമ്പ്, നിക്കല് മുതലായവ. ഇത്തരം ആറ്റങ്ങള് ക്രിസ്റ്റല്രൂപത്തില് അണിനിരക്കുമ്പോള് ആ വസ്തു കാന്തികസ്വഭാവങ്ങള് പ്രകടിപ്പിക്കുന്നു. എല്ലാ ആറ്റങ്ങളുടെയും കാന്തികആഘൂര്ണം ഒരേ ദിശയിലാകുമ്പോഴാണ് ഇതു സംഭവിക്കുന്നത്. ഇതിനായി ഒരു കാന്തവത്കരണബലം വസ്തുവില് പ്രയോഗിക്കേണ്ടിവരും. സാധാരണയായി ഒരിരുമ്പു കഷണമെടുത്താല് അതിനു കാന്തികഗുണം പ്രകടമായി കാണപ്പെടുന്നില്ല. എല്ലാ ആറ്റങ്ങളുടെയും കാന്തദിശ സമാന്തരമല്ലാത്തതാണ് ഇതിനുകാരണം. വസ്തുവില് വിവിധ കാന്തികമേഖലകളുണ്ട്. അവയില് ഓരോ മേഖലയുടെയും പരിണതകാന്തത ഓരോ ദിശയിലായതുകൊണ്ട് വസ്തുവിനു ഒട്ടാകെ കാന്തികഗുണം ഇല്ലാതാവുന്നു. ഈ മേഖലകളിലെ കാന്തികദിശകളെ എല്ലാം ഒരേ ദിശയിലേക്കു കൊണ്ടുവരുമ്പോഴാണു വസ്തു ഒരു കാന്തമാവുന്നത്. വസ്തുവിന്റെ താപനിലയും കാന്തവത്കരണത്തില് ഒരു നിര്ണായകഘടകമാണ്. കാന്തവത്കരണബലം മാറ്റിയശേഷം കാന്തികഗുണം സ്ഥിരമായി നിലനില്ക്കുന്ന പദാര്ഥങ്ങളെയാണ് സ്ഥിര കാന്തങ്ങളുണ്ടാക്കുവാന് ഉപയോഗിക്കുന്നത്.
(ഡോ. സി.പി. മേനോന്, പ്രൊഫ. കെ. പാപ്പൂട്ടി)