This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
അധിശോഷണം
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
Mksol (സംവാദം | സംഭാവനകള്) (→അധിശോഷണം) |
|||
| (ഇടക്കുള്ള 4 പതിപ്പുകളിലെ മാറ്റങ്ങള് ഇവിടെ കാണിക്കുന്നില്ല.) | |||
| വരി 18: | വരി 18: | ||
'''വാതകങ്ങളുടെ അധിശോഷണം''' | '''വാതകങ്ങളുടെ അധിശോഷണം''' | ||
| - | താപനില = 15 | + | താപനില = 15°c അധിശോഷകം = 1 ഗ്രാം മരക്കരി |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| + | [[Image:p441a.png|thumb|300x200px|centre|A]] | ||
| + | |||
'''2. അധിശോഷകത്തിന്റെ സ്വഭാവം.''' അധിശോഷണം ഒരു പ്രതലപ്രക്രിയ ആകയാല് അധിശോഷകത്തിന്റെ പ്രതലവിസ്തീര്ണം വര്ധിക്കുന്തോറും അതിന്റെ അധിശോഷണക്ഷമതയും ഏറിവരും. നിശ്ചിതമായ ഒരു താപനിലയിലും മര്ദത്തിലും വിവിധ-അധിശോഷകങ്ങളുടെ അധിശോഷണക്ഷമതയും വിഭിന്നമാണ്. പട്ടിക കാണുക: | '''2. അധിശോഷകത്തിന്റെ സ്വഭാവം.''' അധിശോഷണം ഒരു പ്രതലപ്രക്രിയ ആകയാല് അധിശോഷകത്തിന്റെ പ്രതലവിസ്തീര്ണം വര്ധിക്കുന്തോറും അതിന്റെ അധിശോഷണക്ഷമതയും ഏറിവരും. നിശ്ചിതമായ ഒരു താപനിലയിലും മര്ദത്തിലും വിവിധ-അധിശോഷകങ്ങളുടെ അധിശോഷണക്ഷമതയും വിഭിന്നമാണ്. പട്ടിക കാണുക: | ||
| - | |||
| - | |||
| - | + | [[Image:p441b.png|thumb|300x200px|centre|B]] | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
സരന്ധ്രങ്ങളായ സിലിക്കാജെല്, മരക്കരി, അസ്ഥിക്കരി, ചിരട്ടക്കരി, രക്തക്കരി (blood charcoal) എന്നിവയും ഒന്നാംതരം അധിശോഷകങ്ങളാണ്. ക്രിയാശീലം വരുത്തിയും ഒരു വസ്തുവിന്റെ അധിശോഷണക്ഷമത വര്ധിപ്പിക്കാം. | സരന്ധ്രങ്ങളായ സിലിക്കാജെല്, മരക്കരി, അസ്ഥിക്കരി, ചിരട്ടക്കരി, രക്തക്കരി (blood charcoal) എന്നിവയും ഒന്നാംതരം അധിശോഷകങ്ങളാണ്. ക്രിയാശീലം വരുത്തിയും ഒരു വസ്തുവിന്റെ അധിശോഷണക്ഷമത വര്ധിപ്പിക്കാം. | ||
| വരി 68: | വരി 32: | ||
'''3. മര്ദവും താപനിലയും.''' അധികമര്ദത്തില് അധികം വാതകം അധിശോഷിതമാകുന്നു. താപനില ചുരുക്കിയാലും അതുതന്നെയാണ് ഫലം. താഴെ പട്ടികയില് ചില ദൃഷ്ടാന്തങ്ങള് കൊടുത്തിരിക്കുന്നു: | '''3. മര്ദവും താപനിലയും.''' അധികമര്ദത്തില് അധികം വാതകം അധിശോഷിതമാകുന്നു. താപനില ചുരുക്കിയാലും അതുതന്നെയാണ് ഫലം. താഴെ പട്ടികയില് ചില ദൃഷ്ടാന്തങ്ങള് കൊടുത്തിരിക്കുന്നു: | ||
| - | |||
| - | |||
| - | + | [[Image:p441c.png|thumb|300x200px|centre|C]] | |
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
| - | + | ||
ഒരു നിശ്ചിത താപനിലയില് അധിശോഷിത വാതകത്തിന്റെ അളവ് മര്ദത്തിനനുസൃതമായി മാറുന്നതിനെ ഒരു ഗ്രാഫ് പേപ്പറില് വരച്ചാല് കിട്ടുന്ന രേഖയ്ക്ക് (ആ താപനിലയിലെ) അധിശോഷണ സമതാപിവക്രം (adsorption isotherm) എന്നു പറയുന്നു. | ഒരു നിശ്ചിത താപനിലയില് അധിശോഷിത വാതകത്തിന്റെ അളവ് മര്ദത്തിനനുസൃതമായി മാറുന്നതിനെ ഒരു ഗ്രാഫ് പേപ്പറില് വരച്ചാല് കിട്ടുന്ന രേഖയ്ക്ക് (ആ താപനിലയിലെ) അധിശോഷണ സമതാപിവക്രം (adsorption isotherm) എന്നു പറയുന്നു. | ||
| + | '''അധിശോഷണ സമതാപിവക്രങ്ങള്.''' അധിശോഷിതവാതകത്തിന്റെ പരിമാണവും മര്ദവും തമ്മിലുള്ള ഈ ബന്ധത്തെ ഒരു ആനുഭവികസൂത്രം (empirical formula) കൊണ്ട് ഫ്രോയിന്ഡ്ലിഷ് എന്ന ശാസ്ത്രജ്ഞന് ഗണിതാത്മകമായും നിര്ദേശിച്ചിട്ടുണ്ട്. | ||
| - | + | a = k.p<sup>1/n</sup>ഇതില്, a = 1 ഗ്രാം അധിശോഷകം അധിശോഷിപ്പിക്കുന്ന വാതകത്തിന്റെ പരിമാണം. | |
| - | + | ||
| - | a = k.p | + | |
p = വാതകമര്ദം (സന്തുലിതാവസ്ഥയില്) | p = വാതകമര്ദം (സന്തുലിതാവസ്ഥയില്) | ||
| വരി 98: | വരി 48: | ||
'''ലാങ്മ്യൂറിന്റെ സിദ്ധാന്തം.''' ലാങ്മ്യൂര് (Langmuir) എന്ന അമേരിക്കന് ശാസ്ത്രജ്ഞന് 1916-ല് അധിശോഷണത്തെക്കുറിച്ച് ചില ധാരണകള് ഉള്ക്കൊള്ളിച്ചുകൊണ്ട് ഒരു സിദ്ധാന്തം അവതരിപ്പിച്ചു. ഏകതാന്മാത്രികതാസിദ്ധാന്ത(unimolecular theory)ത്തിന്റെ ധാരണകള് താഴെ പറയുന്നവയാണ്: | '''ലാങ്മ്യൂറിന്റെ സിദ്ധാന്തം.''' ലാങ്മ്യൂര് (Langmuir) എന്ന അമേരിക്കന് ശാസ്ത്രജ്ഞന് 1916-ല് അധിശോഷണത്തെക്കുറിച്ച് ചില ധാരണകള് ഉള്ക്കൊള്ളിച്ചുകൊണ്ട് ഒരു സിദ്ധാന്തം അവതരിപ്പിച്ചു. ഏകതാന്മാത്രികതാസിദ്ധാന്ത(unimolecular theory)ത്തിന്റെ ധാരണകള് താഴെ പറയുന്നവയാണ്: | ||
| - | + | [[Image:p.no.417.jpg|thumb|175x200px|right|Froigndelish]] | |
| - | 1. ഒരു വാതകം ഖരപദാര്ഥത്തിന്റെ പ്രതലത്തില് അധിശോഷിതമാകുമ്പോള് രണ്ടു വിപരീതബലങ്ങള് പ്രവര്ത്തിക്കുന്നുണ്ട്. വാതകപ്രാവസ്ഥയില് ( | + | 1. ഒരു വാതകം ഖരപദാര്ഥത്തിന്റെ പ്രതലത്തില് അധിശോഷിതമാകുമ്പോള് രണ്ടു വിപരീതബലങ്ങള് പ്രവര്ത്തിക്കുന്നുണ്ട്. വാതകപ്രാവസ്ഥയില് (gaseous phase) നിന്ന് തന്മാത്രകള് പ്രതലത്തില് അധിശോഷിതമാകുവാനും അധിശോഷിതങ്ങളായ തന്മാത്രകളില് ചിലത് തിരികെ ബാഷ്പീഭവിക്കുവാനും ഉള്ള പ്രവണതകളാണ് വിപരീത ദിശയില് പ്രവര്ത്തിക്കുന്നത്. |
2. ഈ വിപരീതബലങ്ങളുടെ ഫലമായി വാതകാവസ്ഥയിലും അധിശോഷിതാവസ്ഥയിലും ഉള്ള തന്മാത്രകള് തമ്മില് സന്തുലനം സ്ഥാപിതമാകുന്നു. | 2. ഈ വിപരീതബലങ്ങളുടെ ഫലമായി വാതകാവസ്ഥയിലും അധിശോഷിതാവസ്ഥയിലും ഉള്ള തന്മാത്രകള് തമ്മില് സന്തുലനം സ്ഥാപിതമാകുന്നു. | ||
| വരി 105: | വരി 55: | ||
3. അധിശോഷിതവാതകത്തിന്റെ പാളി (layer) ഏകതാന്മാത്രികമാണ്. | 3. അധിശോഷിതവാതകത്തിന്റെ പാളി (layer) ഏകതാന്മാത്രികമാണ്. | ||
| - | 4. പ്രതലം മുഴുവന് അധിശോഷിത വാതകത്തിന്റെ | + | 4. പ്രതലം മുഴുവന് അധിശോഷിത വാതകത്തിന്റെ ഏകതാന്മാത്രികപാളി രൂപപ്പെട്ടു കഴിഞ്ഞാല് പിന്നീട് ആ പ്രക്രിയ തുടരുകയില്ല. |
പ്രസ്തുത ധാരണകളുടെ അടിസ്ഥാനത്തില് തന്റെ സിദ്ധാന്തത്തിന് ഗണിതാത്മകമായ ഒരു രൂപവും ലാങ്മ്യൂര് നല്കുകയുണ്ടായി: | പ്രസ്തുത ധാരണകളുടെ അടിസ്ഥാനത്തില് തന്റെ സിദ്ധാന്തത്തിന് ഗണിതാത്മകമായ ഒരു രൂപവും ലാങ്മ്യൂര് നല്കുകയുണ്ടായി: | ||
| - | a= | + | a=k<sub>1<sub>.k<sub>2<sub>.p/l+k<sub>1<sub>p |
| - | ഈ സമീകരണത്തില് a, p എന്നിവയ്ക്ക് നേരത്തെ സൂചിപ്പിച്ച അര്ഥങ്ങള് തന്നെയാണ്. | + | ഈ സമീകരണത്തില് a, p എന്നിവയ്ക്ക് നേരത്തെ സൂചിപ്പിച്ച അര്ഥങ്ങള് തന്നെയാണ്. k<sub>1<sub>, k<sub>2<sub> എന്നിവ രണ്ടു അചരങ്ങളാണ്. ചില പ്രത്യേക സാഹചര്യത്തില് ഇതിനെ ഫ്രോയിന്ഡ്ലിഷ്-ആനുഭവിക സൂത്രത്തിന്റെ രൂപത്തില് ലഘൂകരിക്കുവാന് സാധിക്കും. ഏതായാലും ലാങ്മ്യൂറിന്റെ ഈ സമീകരണം ഉന്നതതാപനിലയിലും നിമ്നമര്ദത്തിലും മാത്രമേ സാധുവായിക്കാണുന്നുള്ളു. |
'''ബി.ഇ.റ്റി. സിദ്ധാന്തം'''. ലാങ്മ്യൂറിന്റെ ഏകതാന്മാത്രികതാ സിദ്ധാന്തം സാധുവാണെങ്കിലും മറ്റു പല പ്രതലങ്ങളുടെ വിഷയത്തിലും അസാധുവായിക്കണ്ടതിന്റെ ഫലമായി 1938-ല് ബ്രൂണാര് (Brunauer), എമ്മെറ്റ് (Emmet), ടെല്ലര് (Teller) എന്നീ ശാസ്ത്രജ്ഞന്മാര് തങ്ങളുടെ ബഹുതന്മാത്രികതാവാദവുമായി (multimolecular theory) മുമ്പോട്ടു വന്നു. അധിശോഷണപാളി ഏകതാന്മാത്രികമല്ല, ബഹുതാന്മാത്രികമാണ് എന്നതാണ് ആ വാദത്തിന്റെ പൊരുള്. ഈ ശാസ്ത്രജ്ഞന്മാരുടെ പേരുകളിലെ ആദ്യാക്ഷരങ്ങള് ഉപയോഗിച്ചാണ് അതിന് 'ബി.ഇ.റ്റി. സിദ്ധാന്തം' എന്ന പേര് ലഭിച്ചത്. മിക്ക ഖരരൂപതലങ്ങളിലും നടക്കുന്ന വാതകങ്ങളുടെയും ബാഷ്പങ്ങളുടെയും അധിശോഷണ പ്രക്രിയയെ ഈ സിദ്ധാന്തത്തിന് കൂടുതല് സമര്ഥമായി വ്യാഖ്യാനിക്കുവാന് കഴിഞ്ഞതുകൊണ്ട് ലാങ്മ്യൂര്-സിദ്ധാന്തത്തിന്റെ അംഗീകാരം ഇന്നു കുറഞ്ഞിരിക്കുകയാണ്. | '''ബി.ഇ.റ്റി. സിദ്ധാന്തം'''. ലാങ്മ്യൂറിന്റെ ഏകതാന്മാത്രികതാ സിദ്ധാന്തം സാധുവാണെങ്കിലും മറ്റു പല പ്രതലങ്ങളുടെ വിഷയത്തിലും അസാധുവായിക്കണ്ടതിന്റെ ഫലമായി 1938-ല് ബ്രൂണാര് (Brunauer), എമ്മെറ്റ് (Emmet), ടെല്ലര് (Teller) എന്നീ ശാസ്ത്രജ്ഞന്മാര് തങ്ങളുടെ ബഹുതന്മാത്രികതാവാദവുമായി (multimolecular theory) മുമ്പോട്ടു വന്നു. അധിശോഷണപാളി ഏകതാന്മാത്രികമല്ല, ബഹുതാന്മാത്രികമാണ് എന്നതാണ് ആ വാദത്തിന്റെ പൊരുള്. ഈ ശാസ്ത്രജ്ഞന്മാരുടെ പേരുകളിലെ ആദ്യാക്ഷരങ്ങള് ഉപയോഗിച്ചാണ് അതിന് 'ബി.ഇ.റ്റി. സിദ്ധാന്തം' എന്ന പേര് ലഭിച്ചത്. മിക്ക ഖരരൂപതലങ്ങളിലും നടക്കുന്ന വാതകങ്ങളുടെയും ബാഷ്പങ്ങളുടെയും അധിശോഷണ പ്രക്രിയയെ ഈ സിദ്ധാന്തത്തിന് കൂടുതല് സമര്ഥമായി വ്യാഖ്യാനിക്കുവാന് കഴിഞ്ഞതുകൊണ്ട് ലാങ്മ്യൂര്-സിദ്ധാന്തത്തിന്റെ അംഗീകാരം ഇന്നു കുറഞ്ഞിരിക്കുകയാണ്. | ||
| വരി 155: | വരി 105: | ||
(പ്രൊഫ. ആര്. രത്നാംബാള്) | (പ്രൊഫ. ആര്. രത്നാംബാള്) | ||
| + | [[Category:പദാര്ത്ഥവിജ്ഞാനീയം]] | ||
Current revision as of 10:18, 23 നവംബര് 2014
അധിശോഷണം
Adsorption
ഒരു ഖരവസ്തുവിന്റെ (ദ്രവത്തിന്റെയും) പ്രതലത്തില് മറ്റൊരു വസ്തുവിന്റെ അണുക്കളോ തന്മാത്രകളോ അയോണുകളോ അധികമായി സാന്ദ്രീകരിക്കുന്ന പ്രക്രിയ. സ്വീഡിഷ് ശാസ്ത്രജ്ഞനായ ഷീലെ ആണ് ആദ്യമായി ഈ പ്രക്രിയ വിവരിച്ചത് (1773). മരക്കരിക്ക് വാതകങ്ങളെ ഉള്ക്കൊള്ളാനുള്ള കഴിവുണ്ടെന്ന് ചില പരീക്ഷണങ്ങളിലൂടെ അദ്ദേഹം മനസ്സിലാക്കി. തുടര്ന്ന് 1777-ല് ഫൊണ്ടാന എന്ന വൈജ്ഞാനികന് ഇതേപ്പറ്റി കുറച്ചുകൂടി വിശദമായി പഠിക്കുകയുണ്ടായി. മരക്കരിക്ക് വാതകങ്ങളെ മാത്രമല്ല, ചില ലായനികളിലെ നിറങ്ങളെയും അധിശോഷിപ്പിക്കുവാനുള്ള കഴിവുണ്ടെന്ന് 1785-ല് ലോവിറ്റ്ഡ് എന്ന ശാസ്ത്രജ്ഞന് കണ്ടുപിടിച്ചു. 20-ാം ശ.-ത്തിലാണ് ഇതിന്റെ സൈദ്ധാന്തിക പഠനം സമഗ്രമായി നടന്നത്.
ഒരു ഖരപദാര്ഥത്തിന്റെ (ദ്രവത്തിന്റെയും) പ്രതലത്തില് അസന്തുലിതബലം അഥവാ അവശിഷ്ടബലം (residual force) എല്ലായ്പ്പോഴും സ്ഥിതി ചെയ്യുന്നുണ്ട്. തത്ഫലമായി തന്റെ സമ്പര്ക്കത്തിലുള്ള മറ്റു പദാര്ഥങ്ങളുടെ അണുക്കളെ (തന്മാത്രകളെ, അയോണുകളെ) ഈ ബലത്തിന്റെ സഹായത്താല് ആകര്ഷിച്ച് സ്വന്തം പ്രതലത്തില് തടഞ്ഞുവെക്കാനുള്ള പ്രവണത അത് പ്രദര്ശിപ്പിക്കുന്നു. അണുക്കള് (തന്മാത്രകള്, അയോണുകള്) ഖരവസ്തുവിന്റെ ഉള്ളിലേക്ക് അധികം കടക്കാതെ പ്രതലത്തില് മാത്രം അധിവസിക്കുന്നതിനാല് അവയുടെ സാന്ദ്രത ഉള്ഭാഗത്തെ അപേക്ഷിച്ച് പ്രതലത്തില് കൂടുതലായിരിക്കും. പ്രതലത്തിലെ അവശോഷണം (absorption) ആണ് അധിശോഷണം. അധിശോഷകത്തിന്റെ പ്രതലത്തിലും ഉള്ഭാഗത്തും അധിശോഷിതവസ്തുവിന്റെ സാന്ദ്രത സമാനമാണെങ്കില് അത് അവശോഷണം ആണ്.
അനുയോജ്യമായ അധിശോഷകം ഉണ്ടെങ്കില് എല്ലാ പദാര്ഥങ്ങളെയും അധിശോഷണവിധേയമാക്കാം. ഒരു അധിശോഷകത്തിന് ഒന്നിലധികം പദാര്ഥങ്ങളെ അധിശോഷിപ്പിക്കുവാന് സാധിക്കും; അധിശോഷണനിരക്ക് വ്യത്യാസപ്പെടുമെന്നു മാത്രം.
ഭൌതികം (Physical) എന്നും രാസികം (chemical) എന്നും അധിശോഷണത്തെ രണ്ടായിത്തിരിക്കാം. സിലിക്കാജെല്, കരി തുടങ്ങിയവയിന്മേല് ഹൈഡ്രോ കാര്ബണുകളുടെയും എല്ലാവിധ ഖരപദാര്ഥങ്ങളിന്മേല് നിഷ്ക്രിയവാതകങ്ങളുടെയും (inert gases) അധിശോഷണം ആദ്യത്തെ ഇനത്തില്പ്പെടുന്നു. ഭൌതികബലം (അഥവാ വാന്ഡര്വാള്സ് ബലം) ആണ് ഭൌതികാധിശോഷണത്തിന് നിദാനം. സാഹചര്യങ്ങള് വേണ്ടവണ്ണം നിയന്ത്രിച്ച് എല്ലാ ഖരപദാര്ഥങ്ങളിന്മേലും വാതകങ്ങളെ ഭൌതികമായി അധിശോഷിപ്പിക്കാം. ഭൌതികാധിശോഷണത്തിന്റെ നിരക്ക് രാസാധിശോഷണത്തെ (chemisorption) അപേക്ഷിച്ച് വളരെ കൂടുതലാണ്. പക്ഷേ അതിവേഗം അധിശോഷിതമാകുന്ന വാതകം, പരിസരത്തിലെ വായുമര്ദം കുറയുമ്പോള് വേഗം പുറംതള്ളപ്പെടുകയും ചെയ്യും.
രാസാധിശോഷണത്തില് രാസബലം ആണ് നിദാനം. അധിശോഷകവും അധിശോഷിതവും ചേര്ന്ന പ്രതലത്തില് ഒരു സങ്കീര്ണപദാര്ഥം - പ്രതലയൌഗികം - ഉണ്ടാകുന്നു. രാസാധിശോഷണത്തിന്റെ നിരക്ക് താരതമ്യേന കുറവാണ്; താപനിലയനുസരിച്ച് അതു മാറിക്കൊണ്ടിരിക്കുകയും ചെയ്യും. താരതമ്യേന ഉയര്ന്ന താപനിലകളില് മാത്രമേ രാസപരമായി അധിശോഷണം ചെയ്യപ്പെട്ട വാതകം പുറംതള്ളപ്പെടുകയുള്ളൂ. ഇരുമ്പ് നൈട്രജനേയും നിക്കല് ഹൈഡ്രജനേയും ടങ്സ്റ്റണ് (tungsten) ഓക്സിജനേയും രാസപരമായിട്ടാണ് അധിശോഷിപ്പിക്കുന്നത്. തന്മൂലം വാതകതന്മാത്രകളുടെ അണുക്കള് തമ്മിലുള്ള ബന്ധം (bond) അറ്റുപോവുകയും വാതകം കൂടുതല് പ്രതിക്രിയാക്ഷമതയുള്ളതാകുകയും ചെയ്യും.
ചില നിര്ണായക-ഘടകങ്ങള്. എല്ലാ ഖരപദാര്ഥങ്ങളും എല്ലാ വാതകങ്ങളെയും അധിശോഷണം ചെയ്യും. എന്നാല് അധിശോഷിതവാതകത്തിന്റെ പരിമാണം (quantity) ചില നിര്ണായകഘടകങ്ങളെ ആശ്രയിച്ചാണിരിക്കുന്നത്:
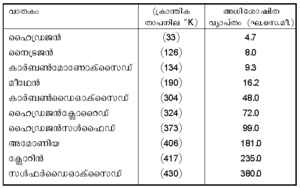
1. വാതകത്തിന്റെ സ്വഭാവം. നിശ്ചിതമായ മര്ദത്തിലും താപനിലയിലും സ്ഥിരവാതകങ്ങളെ (ഉദാ. ഹൈഡ്രജന്, നൈട്രജന്) അപേക്ഷിച്ച് അനായാസേന ദ്രവീഭവിക്കുന്ന വാതകങ്ങള് (ഉദാ. അമോണിയ, ഹൈഡ്രജന്ക്ളോറൈഡ്) അധികമായി അധിശോഷിതമാകുന്നു. താഴെ കൊടുത്തിരിക്കുന്ന പട്ടിക നോക്കുക.
വാതകങ്ങളുടെ അധിശോഷണം
താപനില = 15°c അധിശോഷകം = 1 ഗ്രാം മരക്കരി
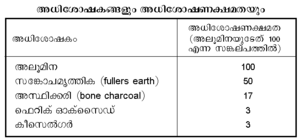
2. അധിശോഷകത്തിന്റെ സ്വഭാവം. അധിശോഷണം ഒരു പ്രതലപ്രക്രിയ ആകയാല് അധിശോഷകത്തിന്റെ പ്രതലവിസ്തീര്ണം വര്ധിക്കുന്തോറും അതിന്റെ അധിശോഷണക്ഷമതയും ഏറിവരും. നിശ്ചിതമായ ഒരു താപനിലയിലും മര്ദത്തിലും വിവിധ-അധിശോഷകങ്ങളുടെ അധിശോഷണക്ഷമതയും വിഭിന്നമാണ്. പട്ടിക കാണുക:
സരന്ധ്രങ്ങളായ സിലിക്കാജെല്, മരക്കരി, അസ്ഥിക്കരി, ചിരട്ടക്കരി, രക്തക്കരി (blood charcoal) എന്നിവയും ഒന്നാംതരം അധിശോഷകങ്ങളാണ്. ക്രിയാശീലം വരുത്തിയും ഒരു വസ്തുവിന്റെ അധിശോഷണക്ഷമത വര്ധിപ്പിക്കാം.
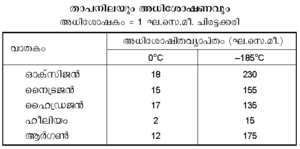
3. മര്ദവും താപനിലയും. അധികമര്ദത്തില് അധികം വാതകം അധിശോഷിതമാകുന്നു. താപനില ചുരുക്കിയാലും അതുതന്നെയാണ് ഫലം. താഴെ പട്ടികയില് ചില ദൃഷ്ടാന്തങ്ങള് കൊടുത്തിരിക്കുന്നു:
ഒരു നിശ്ചിത താപനിലയില് അധിശോഷിത വാതകത്തിന്റെ അളവ് മര്ദത്തിനനുസൃതമായി മാറുന്നതിനെ ഒരു ഗ്രാഫ് പേപ്പറില് വരച്ചാല് കിട്ടുന്ന രേഖയ്ക്ക് (ആ താപനിലയിലെ) അധിശോഷണ സമതാപിവക്രം (adsorption isotherm) എന്നു പറയുന്നു. അധിശോഷണ സമതാപിവക്രങ്ങള്. അധിശോഷിതവാതകത്തിന്റെ പരിമാണവും മര്ദവും തമ്മിലുള്ള ഈ ബന്ധത്തെ ഒരു ആനുഭവികസൂത്രം (empirical formula) കൊണ്ട് ഫ്രോയിന്ഡ്ലിഷ് എന്ന ശാസ്ത്രജ്ഞന് ഗണിതാത്മകമായും നിര്ദേശിച്ചിട്ടുണ്ട്.
a = k.p1/nഇതില്, a = 1 ഗ്രാം അധിശോഷകം അധിശോഷിപ്പിക്കുന്ന വാതകത്തിന്റെ പരിമാണം.
p = വാതകമര്ദം (സന്തുലിതാവസ്ഥയില്)
k = ഒരു അചരം
n = മറ്റൊരു അചരം (n > 1)
ലാങ്മ്യൂറിന്റെ സിദ്ധാന്തം. ലാങ്മ്യൂര് (Langmuir) എന്ന അമേരിക്കന് ശാസ്ത്രജ്ഞന് 1916-ല് അധിശോഷണത്തെക്കുറിച്ച് ചില ധാരണകള് ഉള്ക്കൊള്ളിച്ചുകൊണ്ട് ഒരു സിദ്ധാന്തം അവതരിപ്പിച്ചു. ഏകതാന്മാത്രികതാസിദ്ധാന്ത(unimolecular theory)ത്തിന്റെ ധാരണകള് താഴെ പറയുന്നവയാണ്:
1. ഒരു വാതകം ഖരപദാര്ഥത്തിന്റെ പ്രതലത്തില് അധിശോഷിതമാകുമ്പോള് രണ്ടു വിപരീതബലങ്ങള് പ്രവര്ത്തിക്കുന്നുണ്ട്. വാതകപ്രാവസ്ഥയില് (gaseous phase) നിന്ന് തന്മാത്രകള് പ്രതലത്തില് അധിശോഷിതമാകുവാനും അധിശോഷിതങ്ങളായ തന്മാത്രകളില് ചിലത് തിരികെ ബാഷ്പീഭവിക്കുവാനും ഉള്ള പ്രവണതകളാണ് വിപരീത ദിശയില് പ്രവര്ത്തിക്കുന്നത്.
2. ഈ വിപരീതബലങ്ങളുടെ ഫലമായി വാതകാവസ്ഥയിലും അധിശോഷിതാവസ്ഥയിലും ഉള്ള തന്മാത്രകള് തമ്മില് സന്തുലനം സ്ഥാപിതമാകുന്നു.
3. അധിശോഷിതവാതകത്തിന്റെ പാളി (layer) ഏകതാന്മാത്രികമാണ്.
4. പ്രതലം മുഴുവന് അധിശോഷിത വാതകത്തിന്റെ ഏകതാന്മാത്രികപാളി രൂപപ്പെട്ടു കഴിഞ്ഞാല് പിന്നീട് ആ പ്രക്രിയ തുടരുകയില്ല.
പ്രസ്തുത ധാരണകളുടെ അടിസ്ഥാനത്തില് തന്റെ സിദ്ധാന്തത്തിന് ഗണിതാത്മകമായ ഒരു രൂപവും ലാങ്മ്യൂര് നല്കുകയുണ്ടായി:
a=k1.k2.p/l+k1p
ഈ സമീകരണത്തില് a, p എന്നിവയ്ക്ക് നേരത്തെ സൂചിപ്പിച്ച അര്ഥങ്ങള് തന്നെയാണ്. k1, k2 എന്നിവ രണ്ടു അചരങ്ങളാണ്. ചില പ്രത്യേക സാഹചര്യത്തില് ഇതിനെ ഫ്രോയിന്ഡ്ലിഷ്-ആനുഭവിക സൂത്രത്തിന്റെ രൂപത്തില് ലഘൂകരിക്കുവാന് സാധിക്കും. ഏതായാലും ലാങ്മ്യൂറിന്റെ ഈ സമീകരണം ഉന്നതതാപനിലയിലും നിമ്നമര്ദത്തിലും മാത്രമേ സാധുവായിക്കാണുന്നുള്ളു.
ബി.ഇ.റ്റി. സിദ്ധാന്തം. ലാങ്മ്യൂറിന്റെ ഏകതാന്മാത്രികതാ സിദ്ധാന്തം സാധുവാണെങ്കിലും മറ്റു പല പ്രതലങ്ങളുടെ വിഷയത്തിലും അസാധുവായിക്കണ്ടതിന്റെ ഫലമായി 1938-ല് ബ്രൂണാര് (Brunauer), എമ്മെറ്റ് (Emmet), ടെല്ലര് (Teller) എന്നീ ശാസ്ത്രജ്ഞന്മാര് തങ്ങളുടെ ബഹുതന്മാത്രികതാവാദവുമായി (multimolecular theory) മുമ്പോട്ടു വന്നു. അധിശോഷണപാളി ഏകതാന്മാത്രികമല്ല, ബഹുതാന്മാത്രികമാണ് എന്നതാണ് ആ വാദത്തിന്റെ പൊരുള്. ഈ ശാസ്ത്രജ്ഞന്മാരുടെ പേരുകളിലെ ആദ്യാക്ഷരങ്ങള് ഉപയോഗിച്ചാണ് അതിന് 'ബി.ഇ.റ്റി. സിദ്ധാന്തം' എന്ന പേര് ലഭിച്ചത്. മിക്ക ഖരരൂപതലങ്ങളിലും നടക്കുന്ന വാതകങ്ങളുടെയും ബാഷ്പങ്ങളുടെയും അധിശോഷണ പ്രക്രിയയെ ഈ സിദ്ധാന്തത്തിന് കൂടുതല് സമര്ഥമായി വ്യാഖ്യാനിക്കുവാന് കഴിഞ്ഞതുകൊണ്ട് ലാങ്മ്യൂര്-സിദ്ധാന്തത്തിന്റെ അംഗീകാരം ഇന്നു കുറഞ്ഞിരിക്കുകയാണ്.
അധിശോഷണ താപം. അധിശോഷണഫലമായി പ്രതലത്തിലെ അവശിഷ്ടബലം ഉപയോഗിക്കപ്പെടുന്നതിനാല് പ്രതലോര്ജം (surface energy) ക്രമേണ നഷ്ടപ്പെട്ട് താപത്തിന്റെ രൂപത്തില് ബഹിര്ഗമിക്കുന്നു. ഈ താപത്തെ അധിശോഷണ താപം (heat of adsorption) എന്നു പറയുന്നു. ഒരു 'മോള്' (ഒരു ഗ്രാം-തന്മാത്രാഭാരം) വാതകമോ ബാഷ്പമോ അധിശോഷിതമാകുമ്പോള് ഉദ്ഗമിക്കുന്ന താപത്തെ 'മോളാര് അധിശോഷണ താപം' (molar heat of adsorption) എന്നു പറയുന്നു. ഇതിന്റെ മൂല്യം വാതകത്തിന്റെ സ്വഭാവത്തെ ആശ്രയിച്ചിരിക്കും. അനുയോജ്യമായ 'കലോറി-മാപി' (calorimeter) ഉപയോഗിച്ച് അധിശോഷണ താപം അളന്നു കണ്ടുപിടിക്കാം.
ലേയത്തിന്റെ അധിശോഷണം. ഖരപദാര്ഥങ്ങള് വാതകങ്ങളെ അധിശോഷിപ്പിക്കുന്നതിനു പുറമേ ലായനികളില് നിന്ന് ലേയങ്ങളെയും (solute) അധിശോഷിപ്പിക്കുന്നതാണ്. ഉദാഹരണമായി പ്രതിക്രിയാക്ഷമതയുള്ള കാര്ബണ്, അസറ്റിക് അമ്ളത്തെ അതിന്റെ ജലീയലായനിയില് നിന്നും, അമോണിയം ഹൈഡ്രോക്സൈഡ്-ലായനിയില് നിന്ന് അമോണിയയും അധിശോഷിപ്പിക്കുന്നു. നവ-അവക്ഷേപിത-സില്വര് ക്ളോറൈഡ് (freshly precipitated silver chloride), സില്വര് അയോണിനെയോ ക്ളോറൈഡ് അയോണിനെയോ അധിശോഷിപ്പിക്കുന്നു. സാധാരണയായി കാര്ബണ് വിദ്യുത്-അനപഘട്യങ്ങളെ (nonelectrolytes) അധിശോഷിപ്പിക്കുന്നതിന് കൂടുതല് താത്പര്യം പ്രകടമാക്കുന്നു. തത്ഫലമായി ഋണ-അധിശോഷണം (negative adsorption) എന്ന ഒരു സ്ഥിതിവിശേഷം സംജാതമാകുന്നതു കാണാം. ഉദാഹരണമായി പൊട്ടാസിയംക്ളോറൈഡിന്റെ നേര്ത്ത ഒരു ജലീയ ലായനിയും രക്തക്കരിയും ചേര്ത്തു കുലുക്കിയാല് പൊട്ടാസിയം ക്ളോറൈഡിനെ അപേക്ഷിച്ച് ജലം കൂടുതലായി അധിശോഷിതമാകും. അപ്പോള് ലായനിയില് ലേയത്തിന്റെ സാന്ദ്രത കൂടുന്നു.
ചില അധിശോഷകങ്ങള് ചില ലേയങ്ങളെ പ്രത്യേകമായി അധിശോഷിപ്പിക്കുന്നതിനുള്ള താത്പര്യം കാണിക്കാറുണ്ട്. അധിശോഷകത്തിന്റെ പ്രതലവിസ്തീര്ണം വര്ധിപ്പിച്ചും താപനില മാറ്റിയും ലേയത്തെ കൂടുതലായി അധിശോഷിപ്പിക്കാം.
ഒരു ലായനിയില് രണ്ടോ അതിലധികമോ വസ്തുക്കള് അലിഞ്ഞു ചേര്ന്നിട്ടുണ്ടെങ്കില് ഏറ്റവും എളുപ്പത്തില് അധിശോഷണവിധേയമായ വസ്തുവാണ് പ്രതലത്തില് ആദ്യമായും അധികമായും അവശോഷിതമാകുന്നത്. ബാക്കിയുള്ളവ ലായനിയില്ത്തന്നെ കിടക്കും. ഇതു വരണാത്മക (selective) അധിശോഷണമാണ്. വര്ണരേഖാവിശ്ളേഷണത്തിന്റെ (Chromatographic analysis) ആസ്പദം തന്നെ വര്ണാത്മക അധിശോഷണമാണ്. നോ: ക്രൊമാറ്റോഗ്രാഫി
പ്രായോഗിക പ്രാധാന്യം.
1. അന്തരീക്ഷത്തില് നിന്ന് നിഷ്ക്രിയവാതകങ്ങളെ വേര്തിരിച്ചെടുക്കല്. മരക്കരിയുപയോഗിച്ച് വരണാത്മക അധിശോഷണം വഴിയാണ് ഇത് നിര്വഹിക്കപ്പെടുന്നത്.
2. ലായനികളിലെ നിറങ്ങള് നീക്കം ചെയ്യല്. അസ്ഥിക്കരിയാണ് ഈ പ്രക്രിയയിലുപയോഗിക്കുന്ന അധിശോഷകം. പഞ്ചസാരയുടെ ശുദ്ധീകരണം ഒരു ദൃഷ്ടാന്തമാണ്.
3. ശ്വാസവായു ശുദ്ധീകരിക്കല്. ഒന്നോ അതിലധികമോ അധിശോഷകങ്ങള് ഉള്ക്കൊള്ളിച്ച ഗ്യാസ് മാസ്ക്ക് (gas mask) വായുവിലെ വിഷവാതകങ്ങളെ അധിശോഷണം ചെയ്തു തടഞ്ഞുനിര്ത്തുന്നു.
4. അന്തരീക്ഷത്തിലെ ആര്ദ്രത നിയന്ത്രിക്കല്. ത്രാസിന്റെ കണ്ണാടിക്കൂട്ടില് സിലിക്കാജെല് വയ്ക്കുന്നത് ഈ ലക്ഷ്യം വച്ചുകൊണ്ടാണ്.
5. രജതമിതി (argentometry) തുടങ്ങിയ വ്യാപ്തവിശ്ളേഷണങ്ങളില് (volumetric analysis) ഉപയോഗിക്കുന്ന ചില സംസൂചകങ്ങള് (indicators) അധിശോഷകസ്വഭാവമുള്ള രാസവസ്തുക്കളാണ്. ഇയോസിന് (eosine), ഫ്ളൂറസീന് (fluorescein) തുടങ്ങിയ സംസൂചകങ്ങള് ഉദാഹരണങ്ങളാണ് (രജതമിതിയില്)
6. വര്ണരേഖാപൃഥക്കരണം, സ്തംഭവര്ണരേഖണം (column chromatography) തുടങ്ങിയ ആധുനിക വിശ്ളേഷണ രീതികളും അധിശോഷണം ഉള്ക്കൊള്ളുന്നവയാണ്.
7. മിശ്രിതത്തിലെ ഘടകങ്ങളെ ആകലനം (estimation) ചെയ്യാന് വരണാത്മകാധിശോഷണം പ്രയോജനപ്പെടുത്തുന്നു.
8. അമോണിയ, സള്ഫ്യൂറിക് അമ്ളം തുടങ്ങിയവയുടെ ഉത്പാദന പ്രക്രിയയില് അപരിഹാര്യമായിത്തീര്ന്നിട്ടുള്ള ഉത്പ്രേരകങ്ങളുടെ പ്രവര്ത്തനം അധിശോഷണത്തെ ആസ്പദമാക്കിയുള്ളതാണ്.
9. കമ്പി, പ്ളേറ്റ് തുടങ്ങിയ ഖരവസ്തുക്കളെ വെടിപ്പാക്കാന് ഉപയോഗിക്കുന്ന ആല്ക്കഹോളുകള്, സോപ്പുകള് മുതലായ രാസവസ്തുക്കള് പൊടി, അഴുക്ക് മുതലായവയുമായി കലര്ന്ന് അവയെ നീക്കം ചെയ്യുകയും അതോടൊപ്പം അധിശോഷണം വഴി അന്തരാപ്രതലവലിവ് (interfacial tension) കുറച്ച് പ്രതലത്തെ ചായമിടാനും സ്നേഹത്തിനും (lubrication) ജലരോധനത്തിനും (water proofing) സജ്ജമാക്കുകയും ചെയ്യുന്നു.
10. കൃത്രിമപ്പട്ടുനിര്മാണം, ഛായാഗ്രഹണം, സ്പ്രേ പെയിന്റിങ്, പെട്രോളിയം ഉത്പന്നങ്ങളുടെ സംസ്ക്കരണം തുടങ്ങിയ അനേകം വ്യാവസായികരംഗങ്ങളില് അധിശോഷണം അത്യന്തം പ്രായോഗികപ്രാധാന്യമുള്ള ഒരു പ്രക്രിയയാണ്.
11. കൊളോയ്ഡുകളുടെ അസ്തിത്വത്തിനു നിദാനം തന്നെ അധിശോഷണമാണ്.
12. ഖരപദാര്ഥങ്ങളുടെ-വിശേഷിച്ചും സൂക്ഷ്മചൂര്ണിതമോ സരന്ധ്രമോ ആയവയുടെ - പ്രതലവിസ്തീര്ണം കണക്കാക്കുമ്പോള് അധിശോഷണ പരീക്ഷണങ്ങള് സഹായിക്കുന്നു.
13. അധിശോഷണം പ്രകൃതിയില്ത്തന്നെ സാധാരണമായിക്കാണുന്ന ഒരു പ്രക്രിയയാണ്. മണ്ണിന്നടിയിലെ കളിമണ്കട്ടകള്, ചെടിക്കു വേണ്ട ആഹാരത്തെ അധിശോഷണം ചെയ്ത് വേരുകള് വഴി ചെടിക്കു എത്തിച്ചുകൊടുക്കുന്നു.
പ്രപഞ്ചത്തിന്റെ ഉത്പത്തിക്കുതന്നെ അടിസ്ഥാന കാരണം അധിശോഷണമാണെന്നു വിശ്വസിക്കപ്പെടുന്നു.
(പ്രൊഫ. ആര്. രത്നാംബാള്)