This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
തയോഫീന്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
(→തയോഫീന്) |
(→തയോഫീന്) |
||
| (ഇടക്കുള്ള 4 പതിപ്പുകളിലെ മാറ്റങ്ങള് ഇവിടെ കാണിക്കുന്നില്ല.) | |||
| വരി 1: | വരി 1: | ||
=തയോഫീന്= | =തയോഫീന്= | ||
| + | Thiophene | ||
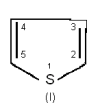
| - | + | ഒരു കാര്ബണിക ഹെറ്റ്റോസൈക്ലിക് സംയുക്തം. നാല് കാര്ബണും ഒരു സള്ഫറും അടങ്ങുന്ന ഒരു ഇരട്ട അപൂരിത ചാക്രിക സംയുക്തമാണിത് (I). | |
| - | + | ||
| - | ഒരു കാര്ബണിക | + | |
[[Image:p337gg.png|right]] | [[Image:p337gg.png|right]] | ||
| - | തയോഫീന്, മീതൈല് തയോഫീന്, ആല്ക്കൈല് തയോഫീന് എന്നിവ കോള്ടാറിലും പെട്രോളിയത്തിലും വളരെ ചെറിയ തോതില് അടങ്ങിയിട്ടുണ്ട്. കോള്ടാര് അംശിക സ്വേദനത്തിന് വിധേയമാക്കുമ്പോള് ബെന്സീനിനോടൊപ്പം തയോഫീനും ലഭിക്കുന്നു. കോള്ടാര് ബെന്സീന്, സള്ഫ്യൂറിക് | + | തയോഫീന്, മീതൈല് തയോഫീന്, ആല്ക്കൈല് തയോഫീന് എന്നിവ കോള്ടാറിലും പെട്രോളിയത്തിലും വളരെ ചെറിയ തോതില് അടങ്ങിയിട്ടുണ്ട്. കോള്ടാര് അംശിക സ്വേദനത്തിന് വിധേയമാക്കുമ്പോള് ബെന്സീനിനോടൊപ്പം തയോഫീനും ലഭിക്കുന്നു. കോള്ടാര് ബെന്സീന്, സള്ഫ്യൂറിക് അമ്ലം ഉപയോഗിച്ച് ശുദ്ധീകരിക്കുമ്പോള് വെള്ളത്തില് ലേയമായ തയോഫീന് സള്ഫോണിക് അമ്ലം ഉണ്ടാകുന്നു. കോള്ടാര് ബെന്സീന് ശുദ്ധീകരിക്കാന് അലൂമിനിയം ക്ലോറൈഡാണ് ഉപയോഗിക്കുന്നതെങ്കില് തയോഫീന് മാത്രം പോളിമറീകരണത്തിന് വിധേയമാകുന്നു. ഇപ്രകാരമുണ്ടാകുന്ന തയോഫീന് പോളിമറുകള് ബാഷ്പീകൃതമല്ലാത്തതിനാല് ബെന്സീനില് നിന്ന് വേര്തിരിക്കാം. 2,5 ഡൈ തൈ ഈനൈല് തയോഫീന് (II) എന്ന സംയുക്തം മെരിഗോള്ഡ് എന്ന സസ്യത്തിലടങ്ങിയിട്ടുണ്ട്. |
[[Image:p337hh.png|right]] | [[Image:p337hh.png|right]] | ||
ജലത്തില് ലേയമായ ബയോട്ടിന് എന്ന ജീവകം ഒരു ടെട്രാ ഹൈഡ്രോ തയോഫീന് വ്യുത്പന്നമാണ്. | ജലത്തില് ലേയമായ ബയോട്ടിന് എന്ന ജീവകം ഒരു ടെട്രാ ഹൈഡ്രോ തയോഫീന് വ്യുത്പന്നമാണ്. | ||
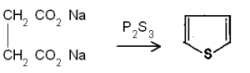
| - | + | '''സംശ്ലേഷണം.''' 1,4 ഡൈ കാര്ബണൈല് സംയുക്തങ്ങള് ഫോസ്ഫറസ് സള്ഫൈഡുകളുടെ സാന്നിദ്ധ്യത്തില് ചാക്രീകരിച്ച് തയോഫീന് സംശ്ലേഷണം ചെയ്യാം. | |
ഉദാ. സോഡിയം സക്സിനേറ്റ്, ഫോസ്ഫറസ് ട്രൈസള്ഫൈഡുമായി ചൂടാക്കുമ്പോള് തയോഫീന് ഉണ്ടാകുന്നു. | ഉദാ. സോഡിയം സക്സിനേറ്റ്, ഫോസ്ഫറസ് ട്രൈസള്ഫൈഡുമായി ചൂടാക്കുമ്പോള് തയോഫീന് ഉണ്ടാകുന്നു. | ||
| - | [[Image: | + | [[Image:p338aa.png|center]] |
| - | ഉയര്ന്ന താപത്തില് സള്ഫറോ സള്ഫര് സംയുക്തങ്ങളോ ഉപയോഗിച്ച് ഹൈഡ്രോകാര്ബണുകളെ ചാക്രീകരിച്ചും തയോ ഫീനുകള് | + | ഉയര്ന്ന താപത്തില് സള്ഫറോ സള്ഫര് സംയുക്തങ്ങളോ ഉപയോഗിച്ച് ഹൈഡ്രോകാര്ബണുകളെ ചാക്രീകരിച്ചും തയോ ഫീനുകള് സംശ്ലേഷണം ചെയ്യാം. അസെറ്റിലീന്,ഹൈഡ്രജന് സള്ഫൈഡ് മിശ്രിതം 4000°C ലുള്ള അലൂമിന അടങ്ങുന്ന ഒരു ട്യൂബിലൂടെ കടത്തി വിടുമ്പോള് തയോഫീന് ലഭ്യമാകുന്നു. |
[[Image:p338b.png|center]] | [[Image:p338b.png|center]] | ||
| - | ഇപ്രകാരം ബ്യൂട്ടേന്, ബ്യൂട്ടാഡൈഈന് എന്നിവ ചാക്രീകരിക്കുന്ന | + | ഇപ്രകാരം ബ്യൂട്ടേന്, ബ്യൂട്ടാഡൈഈന് എന്നിവ ചാക്രീകരിക്കുന്ന സംശ്ലേഷണ പ്രക്രിയയാണിന്ന് ഏറ്റവും വ്യാപകമായും വ്യാവസായികമായും ഉപയോഗിച്ചു വരുന്നത്. |
[[Image:p338c.png|center]] | [[Image:p338c.png|center]] | ||
| - | ഗുണധര്മങ്ങള്. തയോഫീന് ജലത്തില് അലേയമാണ്. ഉരുകല് നില 38.20 | + | '''ഗുണധര്മങ്ങള്.''' തയോഫീന് ജലത്തില് അലേയമാണ്. ഉരുകല് നില 38.20°C , തിളനില 84.20°C . ആപേക്ഷിക സാന്ദ്രത 1.0644 താപസ്ഥിരതയുള്ള ഈ സംയുക്തം നൈട്രേഷന്, സള്ഫോണേഷന്, അസറ്റൈലേഷന്, ഹാലജനേഷന് തുടങ്ങിയ ഇലക്ട്രോഫിലിക പ്രതിസ്ഥാപന പ്രക്രിയകളില് ബെന്സീനിനെക്കാള് വേഗത്തിലേര്പ്പെടുന്നു. എന്നാല് ഫ്യുറാന്, പൈറോള് എന്നിവയെ അപേക്ഷിച്ച് ഈ പ്രക്രിയകള് സാവധാനത്തിലാണ് നടക്കുന്നത്. αസ്ഥാനത്തുള്ള ഹൈഡ്രജനേയാണ് ആദേശം ചെയ്യുന്നത്. ആല്ക്കലികളോടും ന്യൂക്ലിയോഫിലിക് സംയുക്തങ്ങളോടും തയോഫീന് സ്ഥിരത പ്രദര്ശിപ്പിക്കുന്നു. |
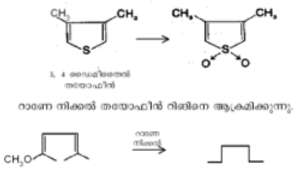
| - | നൈട്രിക് | + | നൈട്രിക് അമ്ലം, ഓസോണ്, ഹൈഡ്രജന് പെറോക്സൈഡ് തുടങ്ങിയ ഓക്സീകാരകങ്ങള് ഉപയോഗിച്ചുള്ള റിങ് തുറക്കല് പ്രക്രിയകള് തയോഫീനില് വിജയകരമല്ല. പെര്അസറ്റിക് അമ്ലം, പെര്ബെന്സോയിക് അമ്ലം എന്നിവ തയോഫീനുകളെ സള്ഫോണുകളായി ഓക്സീകരിക്കുന്നു. |
| - | [[Image: | + | [[Image:p338dd.png|center]] |
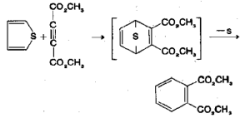
മോളിബ്ഡിനം അല്ലെങ്കില് കോബാള്ട്ട് സള്ഫൈഡ് ത്വരകങ്ങളുപയോഗിച്ചുള്ള ഹൈഡ്രജനേഷന് വഴി തയോഫിന് റിങ് പൂരിതമാക്കാം. പ്രതിക്രിയാക്ഷമമായ ഡൈ ഈനോഫൈലുകളുമായി തയോഫീന് ഡീല്സ് ആല്ഡര് അഭിക്രിയയിലേര്പ്പെടുന്നു. | മോളിബ്ഡിനം അല്ലെങ്കില് കോബാള്ട്ട് സള്ഫൈഡ് ത്വരകങ്ങളുപയോഗിച്ചുള്ള ഹൈഡ്രജനേഷന് വഴി തയോഫിന് റിങ് പൂരിതമാക്കാം. പ്രതിക്രിയാക്ഷമമായ ഡൈ ഈനോഫൈലുകളുമായി തയോഫീന് ഡീല്സ് ആല്ഡര് അഭിക്രിയയിലേര്പ്പെടുന്നു. | ||
[[Image:p338e.png|center]] | [[Image:p338e.png|center]] | ||
Current revision as of 08:31, 23 ജൂണ് 2008
തയോഫീന്
Thiophene
ഒരു കാര്ബണിക ഹെറ്റ്റോസൈക്ലിക് സംയുക്തം. നാല് കാര്ബണും ഒരു സള്ഫറും അടങ്ങുന്ന ഒരു ഇരട്ട അപൂരിത ചാക്രിക സംയുക്തമാണിത് (I).
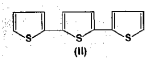
തയോഫീന്, മീതൈല് തയോഫീന്, ആല്ക്കൈല് തയോഫീന് എന്നിവ കോള്ടാറിലും പെട്രോളിയത്തിലും വളരെ ചെറിയ തോതില് അടങ്ങിയിട്ടുണ്ട്. കോള്ടാര് അംശിക സ്വേദനത്തിന് വിധേയമാക്കുമ്പോള് ബെന്സീനിനോടൊപ്പം തയോഫീനും ലഭിക്കുന്നു. കോള്ടാര് ബെന്സീന്, സള്ഫ്യൂറിക് അമ്ലം ഉപയോഗിച്ച് ശുദ്ധീകരിക്കുമ്പോള് വെള്ളത്തില് ലേയമായ തയോഫീന് സള്ഫോണിക് അമ്ലം ഉണ്ടാകുന്നു. കോള്ടാര് ബെന്സീന് ശുദ്ധീകരിക്കാന് അലൂമിനിയം ക്ലോറൈഡാണ് ഉപയോഗിക്കുന്നതെങ്കില് തയോഫീന് മാത്രം പോളിമറീകരണത്തിന് വിധേയമാകുന്നു. ഇപ്രകാരമുണ്ടാകുന്ന തയോഫീന് പോളിമറുകള് ബാഷ്പീകൃതമല്ലാത്തതിനാല് ബെന്സീനില് നിന്ന് വേര്തിരിക്കാം. 2,5 ഡൈ തൈ ഈനൈല് തയോഫീന് (II) എന്ന സംയുക്തം മെരിഗോള്ഡ് എന്ന സസ്യത്തിലടങ്ങിയിട്ടുണ്ട്.
ജലത്തില് ലേയമായ ബയോട്ടിന് എന്ന ജീവകം ഒരു ടെട്രാ ഹൈഡ്രോ തയോഫീന് വ്യുത്പന്നമാണ്.
സംശ്ലേഷണം. 1,4 ഡൈ കാര്ബണൈല് സംയുക്തങ്ങള് ഫോസ്ഫറസ് സള്ഫൈഡുകളുടെ സാന്നിദ്ധ്യത്തില് ചാക്രീകരിച്ച് തയോഫീന് സംശ്ലേഷണം ചെയ്യാം.
ഉദാ. സോഡിയം സക്സിനേറ്റ്, ഫോസ്ഫറസ് ട്രൈസള്ഫൈഡുമായി ചൂടാക്കുമ്പോള് തയോഫീന് ഉണ്ടാകുന്നു.
ഉയര്ന്ന താപത്തില് സള്ഫറോ സള്ഫര് സംയുക്തങ്ങളോ ഉപയോഗിച്ച് ഹൈഡ്രോകാര്ബണുകളെ ചാക്രീകരിച്ചും തയോ ഫീനുകള് സംശ്ലേഷണം ചെയ്യാം. അസെറ്റിലീന്,ഹൈഡ്രജന് സള്ഫൈഡ് മിശ്രിതം 4000°C ലുള്ള അലൂമിന അടങ്ങുന്ന ഒരു ട്യൂബിലൂടെ കടത്തി വിടുമ്പോള് തയോഫീന് ലഭ്യമാകുന്നു.
ഇപ്രകാരം ബ്യൂട്ടേന്, ബ്യൂട്ടാഡൈഈന് എന്നിവ ചാക്രീകരിക്കുന്ന സംശ്ലേഷണ പ്രക്രിയയാണിന്ന് ഏറ്റവും വ്യാപകമായും വ്യാവസായികമായും ഉപയോഗിച്ചു വരുന്നത്.
ഗുണധര്മങ്ങള്. തയോഫീന് ജലത്തില് അലേയമാണ്. ഉരുകല് നില 38.20°C , തിളനില 84.20°C . ആപേക്ഷിക സാന്ദ്രത 1.0644 താപസ്ഥിരതയുള്ള ഈ സംയുക്തം നൈട്രേഷന്, സള്ഫോണേഷന്, അസറ്റൈലേഷന്, ഹാലജനേഷന് തുടങ്ങിയ ഇലക്ട്രോഫിലിക പ്രതിസ്ഥാപന പ്രക്രിയകളില് ബെന്സീനിനെക്കാള് വേഗത്തിലേര്പ്പെടുന്നു. എന്നാല് ഫ്യുറാന്, പൈറോള് എന്നിവയെ അപേക്ഷിച്ച് ഈ പ്രക്രിയകള് സാവധാനത്തിലാണ് നടക്കുന്നത്. αസ്ഥാനത്തുള്ള ഹൈഡ്രജനേയാണ് ആദേശം ചെയ്യുന്നത്. ആല്ക്കലികളോടും ന്യൂക്ലിയോഫിലിക് സംയുക്തങ്ങളോടും തയോഫീന് സ്ഥിരത പ്രദര്ശിപ്പിക്കുന്നു.
നൈട്രിക് അമ്ലം, ഓസോണ്, ഹൈഡ്രജന് പെറോക്സൈഡ് തുടങ്ങിയ ഓക്സീകാരകങ്ങള് ഉപയോഗിച്ചുള്ള റിങ് തുറക്കല് പ്രക്രിയകള് തയോഫീനില് വിജയകരമല്ല. പെര്അസറ്റിക് അമ്ലം, പെര്ബെന്സോയിക് അമ്ലം എന്നിവ തയോഫീനുകളെ സള്ഫോണുകളായി ഓക്സീകരിക്കുന്നു.
മോളിബ്ഡിനം അല്ലെങ്കില് കോബാള്ട്ട് സള്ഫൈഡ് ത്വരകങ്ങളുപയോഗിച്ചുള്ള ഹൈഡ്രജനേഷന് വഴി തയോഫിന് റിങ് പൂരിതമാക്കാം. പ്രതിക്രിയാക്ഷമമായ ഡൈ ഈനോഫൈലുകളുമായി തയോഫീന് ഡീല്സ് ആല്ഡര് അഭിക്രിയയിലേര്പ്പെടുന്നു.