This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
ഈഥർ
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
ഈഥർ
Ether
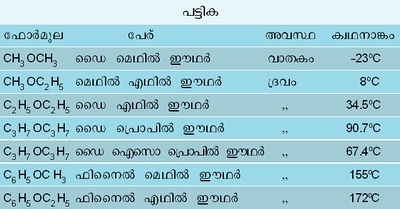
ഒരു കാര്ബണിക സംയുക്തം. ഫോര്മുല (C2H5)2O. 34.5oC-ല് തിളയ്ക്കുന്ന നിറമില്ലാത്ത ഈ ദ്രാവകം അതിമാത്രം ബാഷ്പശീലമുള്ളതാണ്. എളുപ്പം കത്തിപ്പിടിക്കും; ജ്വാലയ്ക്ക് നേരിയ പ്രകാശമുണ്ടായിരിക്കും. ഇതിന് അഭിലഷണീയമായ മണമുണ്ട്. രുചി നേരിയ മധുരമാണ്. ഇതിന്റെ ബാഷ്പം ഓക്സിജനുമായി ചേര്ത്ത് സ്ഫോടകസ്വഭാവമുള്ള മിശ്രിതമുണ്ടാക്കാം. ജലത്തില് അല്പലേയമാണ്. എന്നാല് ആല്ക്കഹോള്, ദ്രവഹൈഡ്രാകാര്ബണ് മുതലായവയില് ഏതനുപാതത്തിലും കലര്ന്നുചേരും. ദ്രുതബാഷ്പന സ്വഭാവമുള്ളതു കൊണ്ട് ശീതനം സംഭവിക്കും; ആകയാല് സ്ഥാനീയനിശ്ചേതകമായി (local anasthetic) ഈഥര് ഉപയോഗിക്കാം. ഈ വിഷയത്തില് ക്ലോറൊഫോമിനെ അപേക്ഷിച്ച് ഇത് കൂടുതല് മെച്ചപ്പെട്ടതാണ്. സാധാരണയായി ക്ലോറൊഫോമിന്റെയും ഈഥറിന്റെയും ബാഷ്പങ്ങള് മിശ്രണംചെയ്താണ് നിശ്ചേതകമായി ഉപയോഗിക്കപ്പെടുന്നത്. നൈട്രസ് ഓക്സൈഡ്, ഓക്സിജന് എന്നിവയുമായി കലര്ത്തിയും നിശ്ചേതകമായി പ്രയോജനപ്പെടുത്താം. ഈഥറും ആല്ക്കഹോളും കലര്ന്ന മിശ്രിതം നാറ്റലൈറ്റ് എന്ന പേരില് പെട്രാളിനു പകരം ഉപയോഗിക്കാവുന്നതാണ്. ഈഥര് നല്ല ഒരു കാര്ബണിക ലായകമാണ്; റെസിനുകള്, കൊഴുപ്പുകള്, എച്ചകള്, ആല്ക്കലോയ്ഡുകള്, സെല്ലുലോസ് എസ്റ്ററുകള് എന്നിവയ്ക്കു ലായകമായി ഉപയോഗിക്കുന്നു. അനേകം ഓര്ഗാനിക് വസ്തുക്കള്ക്ക് ജലത്തെക്കാള് മെച്ചപ്പെട്ട ലായകമാകയാല്, ജലീയലായനികളില്നിന്ന് ഈഥറുപയോഗിച്ച് അവയെ നിഷ്കര്ഷണം ചെയ്ത് പൃഥക്കരിച്ചു ലഭ്യമാക്കാന് കഴിയും.
രാസപരമായി ഈഥര്, എഥില് ഓക്സൈഡ് ആണ്; ഒരു ഓക്സിജന് അണുവിനോട് രണ്ട് എഥില് ഗ്രൂപ്പ് ഘടിപ്പിച്ചിരിക്കും (C2 H5 - O - C2 H5). ഇതിന് "എഥില് ഈഥര്' എന്നും "സള്ഫ്യൂറിക്ക് ഈഥര്' എന്നും പേരുകളുണ്ട്. സാന്ദ്രസള്ഫ്യൂറിക്ക് അമ്ലവും ആല്ക്കഹോളും തമ്മില് 140oC-ല് പ്രതിപ്രവര്ത്തിപ്പിച്ചാണ് ഈ യൗഗികം നിര്മിക്കുന്നത്.
അനുഭവത്തില് രണ്ട് ആല്ക്കഹോള് തന്മാത്രകള് ഒരു ജലതന്മാത്ര നഷ്ടപ്പെട്ടു യോജിപ്പിച്ചുണ്ടാകുന്ന പദാര്ഥമാണ് ഈഥര്. മാത്രമല്ല ആദ്യം ഉപയോഗിച്ച സള്ഫ്യൂറിക്ക് അമ്ലം അതേപടി പ്രതിപ്രവര്ത്തനത്തിനുശേഷം തിരിച്ചു ലഭ്യമാവുകയും ചെയ്യുന്നു. ആകയാല് ആവശ്യാനുസരണം ആല്ക്കഹോള് മാത്രം പ്രവര്ത്തനഭാജനത്തിലേക്ക് ഒഴിച്ചുകൊണ്ടിരുന്നാല് മതി. എന്നാല് പ്രസക്ത രാസപ്രവര്ത്തനത്തില് ഉത്പാദിപ്പിക്കപ്പെടുന്ന ജലാംശം ക്രമേണ സ്വരൂപിച്ചുവരുമ്പോള് സള്ഫ്യൂറിക്ക് അമ്ലത്തിന്റെ സാന്ദ്രത കുറയുകയും തന്മൂലം പ്രവര്ത്തനക്ഷമത ചുരുങ്ങുകയും ചെയ്യും. അപ്പോള് പുതിയ ആല്ക്കഹോള്-അമ്ല മിശ്രിതം ഉപയോഗിക്കണം. ഈഥര്ബാഷ്പം തണുപ്പിച്ചു ദ്രവമാക്കിയത് കാസ്റ്റിക് സോഡാലായനി കൊണ്ടു കഴുകി ചുച്ചാമ്പുപയോഗിച്ച് ഈര്പ്പരഹിതമാക്കി, വീണ്ടും സ്വേദനം ചെയ്തു ശുദ്ധീകരിക്കുന്നു. ഈഥര്, അടപ്പുള്ള കുപ്പികളിലാക്കി തണുപ്പുള്ള സ്ഥലത്തു സൂക്ഷിക്കേണ്ടതാണ്. ഈഥര് താരതമ്യേന നിഷ്ക്രിയമായ ഒരു ഓര്ഗാനിക് യൗഗികമാണ്. സോഡിയം, പൊട്ടാസ്യം എന്നീ ലോഹങ്ങളുമായോ, ആല്ക്കലികള്, അമ്ലങ്ങള് എന്നിവയുമായോ ഇതു പ്രവര്ത്തിക്കില്ല. 2000C-ല് ഈഥറും ഫോസ്ഫറസ് പെന്റാക്ലോറൈഡും തമ്മില് പ്രവര്ത്തിച്ച് എഥില് ക്ലോറൈഡ് ലഭ്യമാക്കുന്നു.
ഇത് ഒരു സ്ഫോടക പദാര്ഥമാണ്; കടുത്ത ലഹരിയുമുണ്ട്. ക്ലോറിന്, ബ്രാമിന് എന്നിവ ഈഥറുമായി ഇരുട്ടില് പ്രതിപ്രവര്ത്തിച്ച് മോണൊ-ഡൈ-ഹാലജനൊ ഈഥറുകള് ലഭ്യമാക്കുന്നു; ക്ഷാരീയ പൊട്ടാസ്യം പെര്മാങ്ഗനേറ്റ് (KMnO4) ഈഥറിനെ അസറ്റിക് ആസിഡ് ആക്കി മാറ്റുന്നു. 880oC-വരെ തപിപ്പിച്ച അലൂമിനയ്ക്കു മീതെ ഈഥര് ബാഷ്പം പ്രവഹിപ്പിച്ചാല് എഥിലീനും ജലവും ഉത്പന്നങ്ങളായി ലഭിക്കുന്നു.
ഈഥര് എന്ന പദം ഡൈഎഥില് ഈഥറിനെയാണ് സാമാന്യമായി വിവക്ഷിക്കുന്നതെങ്കിലും രണ്ട് ആല്കൈല് റാഡിക്കലുകള് ഒരു ഓക്സിജനണുവുമായി ബന്ധപ്പെട്ടുണ്ടാകുന്ന യൗഗികങ്ങള്ക്കു പൊതുവായുള്ള ഒരു വര്ഗനാമം കൂടിയാണ്. അങ്ങനെ വരുമ്പോള് ഈഥറിന്റെ പൊതു ഫോര്മുല R-O-R എന്നാകുന്നു. ഇതില് രണ്ടു R-ഉം ഡൈ എഥില് ഈഥറിലെന്നപോലെ ഒരേ തരക്കാരാവാം; ചിലപ്പോള് മെഥില് എഥില് ഈഥറിലെന്നപോലെ (CH3.O.C2H5) വ്യത്യസ്തങ്ങളുമാകാം. ഞ വേണമെങ്കില് ഒരു അപൂരിത ഹൈഡ്രാകാര്ബണ് റാഡിക്കലോ ആരൊമാറ്റിക് ഹൈഡ്രാകാര്ബണ് റാഡിക്കലോ ആകാം. എല്ലാറ്റിനും ഉദാഹരണങ്ങള് പട്ടികയില് കൊടുത്തിട്ടുണ്ട്. സംഗതമായ ആല്ക്കഹോളുകളില്നിന്ന് ആലിഫാറ്റിക ഈഥറുകളെല്ലാം സള്ഫ്യൂറിക് ആസിഡിന്റെ പ്രതി പ്രവര്ത്തനം വഴി ലഭ്യമാക്കാന് സാധിക്കും. എല്ലാ ഈഥറുകളും രാസപ്രതിപ്രവര്ത്തനങ്ങളില് സാദൃശ്യം വഹിക്കുന്നു. ഡയസോണിയം ലവണങ്ങളുപയോഗിച്ച് ആരൊമാറ്റിക് മിശ്ര-ഈഥറുകള് ലഭ്യമാക്കാവുന്നതാണ്.