This site is not complete. The work to converting the volumes of സര്വ്വവിജ്ഞാനകോശം is on progress. Please bear with us
Please contact webmastersiep@yahoo.com for any queries regarding this website.
Reading Problems? see Enabling Malayalam
കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള്
സര്വ്വവിജ്ഞാനകോശം സംരംഭത്തില് നിന്ന്
(→Complex Compounds) |
(→Complex Compounds) |
||
| വരി 112: | വരി 112: | ||
ഇത്തരം ഐസോമെറിസത്തെ സിസ്-ട്രാന്സ് ഐസോമെറിസം എന്നു പറയുന്നു. രണ്ടു പ്രത്യേക ലിഗാന്ഡുകള് ഒരേവശത്തുവരുന്നത് സിസ്; അല്ലാത്തവ ട്രാന്സ്. | ഇത്തരം ഐസോമെറിസത്തെ സിസ്-ട്രാന്സ് ഐസോമെറിസം എന്നു പറയുന്നു. രണ്ടു പ്രത്യേക ലിഗാന്ഡുകള് ഒരേവശത്തുവരുന്നത് സിസ്; അല്ലാത്തവ ട്രാന്സ്. | ||
| + | |||
| + | [[ചിത്രം:910screen.png]] | ||
കോ-ഓര്ഡിനേഷന് സംഖ്യ രണ്ട്, മൂന്ന് എന്നിങ്ങനെയുള്ള യൗഗികങ്ങള് ഇത്തരം ഐസോമെറിസം പ്രദര്ശിപ്പിക്കുന്നില്ല. കാരണം ലിഗാന്ഡുകളുടെ സ്ഥാനം വളരെ അടുത്തായിരിക്കും. കോ-ഓര്ഡിനേഷന് നാലു മുതലുള്ള യൗഗികങ്ങളില് ഈ പ്രതിഭാസം പ്രകടമാണ്. കോ-ഓര്ഡിനേഷന് സംഖ്യ നാല് ആയിട്ടുള്ള യൗഗികങ്ങള് ചതുഷ്ഫലകീയമായും ആറ് ആയിട്ടുള്ളവ ഷഡ്ഫലകീയമായും ഘടന കൈക്കൊള്ളുന്നു. ഉദാ.[Co(NH<sub>3</sub>)<sub>4</sub>Cl<sub>2</sub>]<sup>2+</sup> എന്ന സങ്കരം ഷഡ്ഫലകീയമായ രണ്ടു സമരൂപികളെ സൃഷ്ടിക്കുന്നു. | കോ-ഓര്ഡിനേഷന് സംഖ്യ രണ്ട്, മൂന്ന് എന്നിങ്ങനെയുള്ള യൗഗികങ്ങള് ഇത്തരം ഐസോമെറിസം പ്രദര്ശിപ്പിക്കുന്നില്ല. കാരണം ലിഗാന്ഡുകളുടെ സ്ഥാനം വളരെ അടുത്തായിരിക്കും. കോ-ഓര്ഡിനേഷന് നാലു മുതലുള്ള യൗഗികങ്ങളില് ഈ പ്രതിഭാസം പ്രകടമാണ്. കോ-ഓര്ഡിനേഷന് സംഖ്യ നാല് ആയിട്ടുള്ള യൗഗികങ്ങള് ചതുഷ്ഫലകീയമായും ആറ് ആയിട്ടുള്ളവ ഷഡ്ഫലകീയമായും ഘടന കൈക്കൊള്ളുന്നു. ഉദാ.[Co(NH<sub>3</sub>)<sub>4</sub>Cl<sub>2</sub>]<sup>2+</sup> എന്ന സങ്കരം ഷഡ്ഫലകീയമായ രണ്ടു സമരൂപികളെ സൃഷ്ടിക്കുന്നു. | ||
''ഓപ്ടിക്കല് ഐസോമെറിസം.'' ജൈവ സംയുക്തങ്ങളെപ്പോലെ ഈ സങ്കരയൗഗികങ്ങളും ഓപ്ടിക്കല് ഐസോമെറിസം പ്രദര്ശിപ്പിക്കുമെന്ന് വെര്ണര്തന്നെ പ്രസ്താവിച്ചിരിക്കുന്നു. കോ-ഓര്ഡിനേറ്റിത ഗ്രൂപ്പുകള് (നാലോ ആറോ അതിലധികമോ) അസമമിതമായി വിന്യസിച്ചിട്ടുള്ള യൗഗികങ്ങളാണ് ഈ ഐസോമെറിസം സൃഷ്ടിക്കുന്നത്. കീലേറ്റ് വലയങ്ങളുള്ളവ കുറേക്കൂടി എളുപ്പത്തില് ഓപ്ടിക്കല് ഐസോമെറിസം പ്രദര്ശിപ്പിക്കുന്നു. ഉദാ. ട്രിസ് എഥിലിന് ഡൈ അമീന് കോബാള്ട്ടിക് അയോണ് അന്യോന്യം അധ്യാരോപിതമല്ലാത്ത രണ്ടു ഘടനകള് (സമാവയവികള്) സമ്മാനിക്കുന്നു. 2, 3, 5, 7, 8 എന്നീ കോ-ഓര്ഡിനേഷന് സംഖ്യകളുള്ള യൗഗികങ്ങളുടെ സ്റ്റീരിയോ ഐസോമെറിസം ഇനിയും കൂടുതലായി പഠിക്കേണ്ടതുണ്ട്. എക്സ്-റേ പഠനം, കാന്തികപഠനം, ദ്വിധ്രുവ ആഘൂര്ണപഠനം തുടങ്ങിയവയാണ് ഇത്തരം യൗഗികങ്ങളുടെ സ്റ്റീരിയോ ഐസോമെറിസ പഠനത്തിന് കൂടുതലായി ഉപയോഗിച്ചുവരുന്നത്. | ''ഓപ്ടിക്കല് ഐസോമെറിസം.'' ജൈവ സംയുക്തങ്ങളെപ്പോലെ ഈ സങ്കരയൗഗികങ്ങളും ഓപ്ടിക്കല് ഐസോമെറിസം പ്രദര്ശിപ്പിക്കുമെന്ന് വെര്ണര്തന്നെ പ്രസ്താവിച്ചിരിക്കുന്നു. കോ-ഓര്ഡിനേറ്റിത ഗ്രൂപ്പുകള് (നാലോ ആറോ അതിലധികമോ) അസമമിതമായി വിന്യസിച്ചിട്ടുള്ള യൗഗികങ്ങളാണ് ഈ ഐസോമെറിസം സൃഷ്ടിക്കുന്നത്. കീലേറ്റ് വലയങ്ങളുള്ളവ കുറേക്കൂടി എളുപ്പത്തില് ഓപ്ടിക്കല് ഐസോമെറിസം പ്രദര്ശിപ്പിക്കുന്നു. ഉദാ. ട്രിസ് എഥിലിന് ഡൈ അമീന് കോബാള്ട്ടിക് അയോണ് അന്യോന്യം അധ്യാരോപിതമല്ലാത്ത രണ്ടു ഘടനകള് (സമാവയവികള്) സമ്മാനിക്കുന്നു. 2, 3, 5, 7, 8 എന്നീ കോ-ഓര്ഡിനേഷന് സംഖ്യകളുള്ള യൗഗികങ്ങളുടെ സ്റ്റീരിയോ ഐസോമെറിസം ഇനിയും കൂടുതലായി പഠിക്കേണ്ടതുണ്ട്. എക്സ്-റേ പഠനം, കാന്തികപഠനം, ദ്വിധ്രുവ ആഘൂര്ണപഠനം തുടങ്ങിയവയാണ് ഇത്തരം യൗഗികങ്ങളുടെ സ്റ്റീരിയോ ഐസോമെറിസ പഠനത്തിന് കൂടുതലായി ഉപയോഗിച്ചുവരുന്നത്. | ||
| + | |||
| + | [[ചിത്രം:910_screen2.png]] | ||
''പ്രധാന കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള്.'' അമീനുകളും ഹൈഡ്രേറ്റുകളും കൂടാതെ സുപ്രധാനങ്ങളായ പല കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളുമുണ്ട്. ഭാരലോഹങ്ങളുടെ സങ്കര സയനൈഡ് യൗഗികങ്ങള് ഇലക്ട്രോപ്ലേറ്റിങ്ങില് ഉപയോഗിക്കുന്നു. ഫെറിക് ഫെറോസയനൈഡ്, പ്രഷ്യന് ബ്ലൂ തുടങ്ങിയ കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള്ക്ക് വര്ണങ്ങളുടെ നിര്മിതിയില് നല്ല പങ്കുണ്ട്. ഹീമോഗ്ലോബിന്, ക്ലോറോഫില് തുടങ്ങിയവ പ്രകൃതിദത്തമായ കോ-ഓര്ഡിനേഷന് വര്ണകങ്ങളാണ്. ലോഹകാര്ബൊണൈലുകളാണ് മറ്റൊരു പ്രധാനപ്പെട്ട കോ-ഓര്ഡിനേഷന് യൗഗികവിഭാഗം (ഇവയില് ലോഹത്തിന്റെ സംയോജകത പൂജ്യമാണ്). നിക്കല് കാര്ബൊണൈല്, അയണ് കാര്ബൊണൈല് Fe (Co)<sub>5</sub> തുടങ്ങിയ യൗഗികങ്ങള് വ്യാവസായിക പ്രാധാന്യം അര്ഹിക്കുന്നു. α ആമിനോ അമ്ലങ്ങള് ഉള്ച്ചേര്ന്നിട്ടുള്ള കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള് തുകല്വ്യവസായത്തിലും മറ്റും ഉപയോഗിച്ചുവരുന്നു. | ''പ്രധാന കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള്.'' അമീനുകളും ഹൈഡ്രേറ്റുകളും കൂടാതെ സുപ്രധാനങ്ങളായ പല കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളുമുണ്ട്. ഭാരലോഹങ്ങളുടെ സങ്കര സയനൈഡ് യൗഗികങ്ങള് ഇലക്ട്രോപ്ലേറ്റിങ്ങില് ഉപയോഗിക്കുന്നു. ഫെറിക് ഫെറോസയനൈഡ്, പ്രഷ്യന് ബ്ലൂ തുടങ്ങിയ കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള്ക്ക് വര്ണങ്ങളുടെ നിര്മിതിയില് നല്ല പങ്കുണ്ട്. ഹീമോഗ്ലോബിന്, ക്ലോറോഫില് തുടങ്ങിയവ പ്രകൃതിദത്തമായ കോ-ഓര്ഡിനേഷന് വര്ണകങ്ങളാണ്. ലോഹകാര്ബൊണൈലുകളാണ് മറ്റൊരു പ്രധാനപ്പെട്ട കോ-ഓര്ഡിനേഷന് യൗഗികവിഭാഗം (ഇവയില് ലോഹത്തിന്റെ സംയോജകത പൂജ്യമാണ്). നിക്കല് കാര്ബൊണൈല്, അയണ് കാര്ബൊണൈല് Fe (Co)<sub>5</sub> തുടങ്ങിയ യൗഗികങ്ങള് വ്യാവസായിക പ്രാധാന്യം അര്ഹിക്കുന്നു. α ആമിനോ അമ്ലങ്ങള് ഉള്ച്ചേര്ന്നിട്ടുള്ള കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള് തുകല്വ്യവസായത്തിലും മറ്റും ഉപയോഗിച്ചുവരുന്നു. | ||
(ചുനക്കര ഗോപാലകൃഷ്ണന്) | (ചുനക്കര ഗോപാലകൃഷ്ണന്) | ||
16:35, 31 ജൂലൈ 2015-നു നിലവിലുണ്ടായിരുന്ന രൂപം
കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള്
Complex Compounds
ഒരുകൂട്ടം സങ്കരയൗഗികങ്ങള്ക്കുള്ള പൊതുനാമം. തികച്ചും വ്യത്യസ്തമായ സ്വഭാവങ്ങളും സ്ഥിരതകളുമുള്ള ഒട്ടധികം യൗഗികങ്ങള് ഈ വിഭാഗത്തില്പ്പെടുന്നു. ആയതിനാല് എല്ലാറ്റിനെയും ഉള്ക്കൊള്ളിക്കാന് പറ്റിയ ഒരു നിര്വചനം ഇനിയും കണ്ടെത്തേണ്ടതുണ്ട്. എങ്കിലും പൊതുവായ ചില ഘടകങ്ങള് ഈ യൗഗികങ്ങളുടേതായി എടുത്തുകാണിക്കാന് കഴിയും. സാമാന്യമായ ചില നിര്വചനങ്ങളും സാധ്യമാണ്.
മധ്യത്തിലുള്ള അണുവിനെയോ അയോണിനെയോ ചുറ്റി ഒരു പറ്റം അയോണുകളോ തന്മാത്രകളോ സ്ഥിതിചെയ്യുന്ന തരത്തിലുള്ള ഘടനയോടുകൂടിയ യൗഗികങ്ങളെ പൊതുവേ കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള് എന്നു പറയാം. ഇത്തരം യൗഗികങ്ങള്ക്ക് ഭാഗികമായ വിയോജനം (dissociation) സംഭവിക്കുമെങ്കില്പ്പോലും ലായനികളിലും അവ തങ്ങളുടെ അസ്തിത്വം നിലനിര്ത്താറുണ്ട്. രണ്ടുതരം സംയോജകതകള് (valancies) ഈ യൗഗികങ്ങള്ക്കുണ്ട്. ഇവയെ പ്രാഥമിക സംയോജകത (Primary valancy) എന്നും ദ്വിതീയ സംയോജകത (secondary valancy) എന്നും വിളിക്കുന്നു. ഈ യൗഗികങ്ങളുടെ ഘടനയെപ്പറ്റി മൗലികമായ ഒരു സിദ്ധാന്തം ആവിഷ്കരിച്ചത് ആല്ഫ്രഡ് വെര്ണര് ആണ് (1893). അതിനാല് ഇവ വെര്ണര് യൗഗികങ്ങള് എന്ന പേരിലും അറിയപ്പെടുന്നു. സങ്കരയൗഗികങ്ങള്, കോ-ഓര്ഡിനേറ്റഡ് സങ്കരങ്ങള്, കിലേറ്റ് യൗഗികങ്ങള്, സങ്കര അയോണുകള് എന്നിങ്ങനെയും കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളെ വിശേഷിപ്പിക്കാറുണ്ട്.
ചരിത്രം. കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള് കണ്ടെത്തിയകാലം കൃത്യമായി നിര്ണയിക്കാന് കഴിഞ്ഞിട്ടില്ല. എന്നാല് 18-ാം ശതകത്തില് ഇവ പ്രചാരത്തിലുണ്ടായിരുന്നതിന് തെളിവുകളുണ്ട്. പ്രഷ്യന് നീലം (Prussian blue) 18-ാം ശതകത്തിന്റെ ആരംഭകാലത്തുതന്നെ ജര്മനിയില് ഉപയോഗിച്ചിരുന്നു. ഏറ്റവും ശ്രദ്ധിക്കപ്പെട്ട ആദ്യത്തെ കോ-ഓര്ഡിനേഷന് യൗഗികം ല്യൂട്ടിയോ കോബാള്ട്ടിക് ക്ലോറൈഡ് (Co Cl3.6 NH3) ആണ്. കോബാള്ട്ട് ക്ലോറൈഡ് (Co Cl3), അമോണിയ (NH3) എന്നീ രണ്ടു സ്വതന്ത്ര യൗഗികങ്ങള് തമ്മില് ചേര്ന്ന് സ്വതന്ത്രമായ മറ്റൊരു സ്ഥിരയൗഗികത്തിന് (Co Cl3.6 NH3) സാര്ട്ട് (Tassaert) എന്ന ശാസ്ത്രജ്ഞന് രൂപം നല്കി. എന്നാല് സാധാരണ സംയോജകതാ നിയമങ്ങള് കൊണ്ട് ഈ സങ്കരയൗഗികത്തെ വിശദീകരിക്കാന് കഴിഞ്ഞില്ല. ശാസ്ത്രജ്ഞര് ഈ യൗഗികത്തിലേക്ക് ആകര്ഷിക്കപ്പെടുവാനുള്ള മുഖ്യകാരണവും ഇതായിരുന്നു. ഈ യൗഗികത്തിന്റെ പഠനം നടന്നതോടൊപ്പംതന്നെ ഈ പ്രരൂപത്തില്പ്പെട്ട ഇരട്ട ലവണങ്ങളും (ഉദാ. Al F3,3 KF,KCl, Mg Cl2, 6 H2O, Fe(CN)2, 4 KCN തുടങ്ങിയവ) അമീനുകളും (ഉദാ. Ni Cl2, 6 NH3, Cu SO4 NH3 തുടങ്ങിയവ) മറ്റും കണ്ടുപിടിക്കപ്പെടുകയും ചെയ്തു. Co (III), Pt(IV), Pt(II) തുടങ്ങിയവയുടെ ഇത്തരം 'സങ്കലനയൗഗികങ്ങള്' (addition compound) എണ്ണത്തിലും സ്ഥിരതയിലും മുമ്പന്തിയില് നിന്നു. അതുകൊണ്ട് കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളുടെ ആദ്യകാലപഠനവും ഈ യൗഗികങ്ങളെയാണ് മുഖ്യമായും കേന്ദ്രീകരിച്ചിരുന്നത്.
ഇത്തരം സങ്കരയൗഗികങ്ങളുടെ രൂപവത്കരണം, ഘടന, സ്ഥിരത മുതലായവ വിവരിക്കുന്ന അനേകം സിദ്ധാന്തങ്ങള് രൂപംകൊണ്ടു. ജൈവയൗഗികങ്ങളിലെ കാര്ബണ് ശൃംഖലകള് പോലെ കോബാള്ട്ട്-അമോണിയ സങ്കരയൗഗികങ്ങളില് അമോണിയ ഗ്രൂപ്പുകളുടെ ശൃംഖലകള് നിലനില്ക്കുന്നുവെന്നതായിരുന്നു ഒരു സിദ്ധാന്തം. സ്വീഡിഷ് പ്രൊഫസറായ ബ്ലോമ്സ്ട്രാന്ഡ് (Blomstrand), അദ്ദേഹത്തിന്റെ ശിഷ്യനും കോപ്പന്ഹേഗനിലെ പ്രൊഫസറുമായ ജോറന്സണ് (Joryensen) എന്നിവര് ആവിഷ്കരിച്ച ഈ സിദ്ധാന്തം കുറേനാള് സജീവമായി നിലനിന്നു. എന്നാല് പിന്നീട് ജോറന്സണ് തന്നെ ഈ സിദ്ധാന്തം തെറ്റാണെന്നു തെളിയിക്കുകയുണ്ടായി. സൂറിച്ചിലെ രസതന്ത്ര പ്രൊഫസറായിരുന്ന ആല്ഫ്രഡ് വെര്ണറാണ് ഈ യൗഗികങ്ങളെപ്പറ്റി അടിസ്ഥാനപരമായ ചില സിദ്ധാന്തങ്ങള് ആവിഷ്കരിച്ചത് (1893).
വെര്ണറുടെ സിദ്ധാന്തങ്ങളെ ഇപ്രകാരം ക്രോഡീകരിക്കാം:
1. പല മൂലകങ്ങള്ക്കും രണ്ടുതരം സംയോജകതകള് ഉണ്ട്. ഇവയെ പ്രാഥമിക സംയോജകത (primary valancy), ദ്വിതീയ സംയോജകത (secondary valancy) എന്നിങ്ങനെ വിളിക്കാം. പ്രാഥമിക സംയോജകതകള് അയോണീകരണക്ഷമങ്ങളാണ്. കാരണം പ്രാഥമികസംയോജകതകള്മൂലം ബന്ധപ്പെട്ടിരിക്കുന്ന ഗ്രൂപ്പുകള് അയോണുകളായി സ്ഥിതിചെയ്യുന്നു. ദ്വിതീയ സംയോജകതകള് അയോണീകരണക്ഷമങ്ങളല്ല.
2. പ്രാഥമിക സംയോജകതകളെ ഓക്സീകരണഘട്ടം (Oxidation state) എന്നും ദ്വിതീയ സംയോജകതകളെ കോ-ഓര്ഡിനേഷന് സംഖ്യ (Co-ordination number) എന്നും വിളിക്കുന്നു.
3. ഒരു മൂലകത്തിന്റെ കോ-ഓര്ഡിനേഷന് സംഖ്യ സ്ഥിരമാണ്. ഉദാ. Co(3), Pt(4), Ir(3), Cr(3) എന്നിവയുടെ കോ-ഓര്ഡിനേഷന് സംഖ്യ ആറ് ആണ്.
4. യൗഗികരൂപവത്കരണത്തില് രണ്ടുതരം സംയോജകതകളും തൃപ്തിപ്പെടണം. പ്രാഥമിക സംയോജകതകളെ തൃപ്തിപ്പെടുത്താന് ഋണ-അയോണുകള് വേണം. ഉദാ. Co Cl3 - യില് Co+3യുടെ മൂന്നു സംയോജകതകളെ തൃപ്തിപ്പെടുത്താന് മൂന്ന് ഋണചാര്ജുകള് ഉപയോഗിച്ചിരിക്കുന്നു. ദ്വിതീയ സംയോജകതകളെ ഋണ-അയോണുകളാലോ ഉദാസീന തന്മാത്രകളാലോ തൃപ്തിപ്പെടുത്താന് കഴിയും. പലപ്പോഴും ഒരേ ഋണ-അയോണ് തന്നെ രണ്ടുതരം സംയോജകതകളെയും തൃപ്തിപ്പെടുത്താം. [Co(NH3)5Cl]Cl2 എന്ന യൗഗികത്തില് ഒരു ക്ലോറൈഡ് അയോണ് മറ്റു രണ്ട് ക്ലോറൈഡ് അയോണുകളില്നിന്നും വ്യത്യസ്തമാണ്. ഈ ക്ലോറൈഡ് അയോണിന് അതിന്റെ അയോണികസ്വഭാവം മിക്കവാറും നഷ്ടപ്പെട്ടിരിക്കും. തന്നെയുമല്ല അത് മറ്റ് രണ്ടിനെക്കാളും സ്പേസികമായി കോബാള്ട്ടിനോട് അടുത്തുമാണ് (അപൂര്വം ചില ധനഗ്രൂപ്പുകളും കോ-ഓര്ഡിനേഷന് സംഖ്യ തൃപ്തിപ്പെടുത്താറുണ്ടെന്ന് ആധുനികപഠനം കാണിക്കുന്നു).
5. ദ്വിതീയ സംയോജകതകള് മധ്യഭാഗത്തുള്ള പ്രധാന അണുവിന് അല്ലെങ്കില് അയോണിന് ചുറ്റുമായി വിന്യസിച്ചിരിക്കും.
6. ദ്വിതീയ സംയോജകതകള് തൃപ്തിപ്പെടുത്തുന്ന ഗ്രൂപ്പുകളെ ലിഗാന്ഡുകള് എന്നും വിളിക്കുന്നു.
വെര്ണര് സിദ്ധാന്തത്തിന്റെ വെളിച്ചത്തില് ഏതാനും കോബാള്ട്ട് അമീന് യൗഗികങ്ങളെ പരിശോധിക്കാം. Co Cl3. 6NH3-യില് കോബാള്ട്ടിനോട് നേരിട്ട് ആറ് അമോണിയാഗ്രൂപ്പുകള് ബന്ധിച്ചിരിക്കുന്നു. അതായത് കോബാള്ട്ടിന്റെ കോ-ഓര്ഡിനേഷന് മണ്ഡലത്തെ മുഴുവന് അമോണിയാഗ്രൂപ്പ് പിടിച്ചെടുത്തിരിക്കുന്നു. ക്ലോറിന് അയോണുകള് പ്രാഥമിക സംയോജകതകള് മുഖേനയാണ് കോബാള്ട്ടുമായി ബന്ധിച്ചിരിക്കുന്നത്. സ്പേസികമായി കോബാള്ട്ടിന് ചുറ്റും അണിനിരന്നിരിക്കുന്ന അമോണിയാ ഗ്രൂപ്പുകള് സ്വാഭാവികമായും കോബാള്ട്ടിനോട് അടുത്തിരിക്കും. പ്രാഥമിക സംയോജകതകളാല് ബന്ധിതമായിരിക്കുന്ന Cl- അയോണുകള് കോബാള്ട്ടില് നിന്ന് അകന്നുമിരിക്കും. അതുകൊണ്ടാണ് യൗഗികത്തില് Ag NO3 ചേര്ക്കുമ്പോള് Cl- അയോണുകള് മുഴുവന് Ag Cl ആയി അവക്ഷിപ്തമാകുന്നത്.
ചുരുക്കത്തില് ഈ യൗഗികത്തില് രണ്ടുതരം അയോണിക സംവിധാനം നിലനില്ക്കുന്നു. കോബാള്ട്ടും ആറ് അയോണികഗ്രൂപ്പുകളും ഉള്പ്പെട്ട ഒരു അയോണ്; Co(NH3)6+++. ക്ലോറിന് അയോണുകള് സൃഷ്ടിക്കുന്നതാണ് രണ്ടാമത്തെ സംവിധാനം. ഇവയ്ക്ക് രണ്ടിനും തനതായ അസ്തിത്വം സങ്കല്പിച്ച് Co Cl3.6NH3 എന്ന യൗഗികത്തെ കൂടുതല് ശരിയായി [Co(NH3)6]Cl3 എന്നെഴുതാം.
Co Cl3. 5 NH3 എന്ന യൗഗികത്തില് കോബാള്ട്ടിന്റെ ആറു കോ-ഓര്ഡിനേഷന് സംഖ്യകളില് അഞ്ചെണ്ണത്തെ അമോണിയാ ഗ്രൂപ്പും ഒന്നിനെ ക്ളോറിന് അയോണും തൃപ്തിപ്പെടുത്തുന്നു. ബാക്കി രണ്ടു ക്ലോറിന് അയോണുകള് പ്രാഥമിക സംയോജകതയെ തൃപ്തിപ്പെടുത്തുന്നു. അതുകൊണ്ട് ഈ യൗഗികത്തെ വെര്ണര് സിദ്ധാന്തപ്രകാരം [Co(NH3)Cl]Cl2 എന്ന് എഴുതാം. ഇതിന്റെ ലായനിയിലേക്ക് Ag NO3 ചേര്ക്കുമ്പോള് രണ്ടു Cl അയോണുകള് മാത്രമേ Ag Cl ആയി മാറുകയുള്ളൂ. Co Cl3.3NH3 എന്ന യൗഗികത്തിന്റെ വെര്ണര് സൂത്രം [Co(NH3)3 Cl3] എന്നാണ്. ഇതില് എല്ലാ ക്ളോറിന് അയോണുകളും കോ-ഓര്ഡിനേഷന് മണ്ഡലത്തിന് അകത്താണ്. ഈ ക്ലോറിനുകളെ Ag NO3 അവക്ഷിപ്തമാക്കുന്നില്ല. ഇവിടെ സൂചിപ്പിച്ച ആദ്യത്തെ യൗഗികം ലായനിയിലായിരിക്കുമ്പോള് നാല് അയോണുകളും രണ്ടാമത്തെ യൗഗികം അതേ അവസ്ഥയില് ആയിരിക്കുമ്പോള് മൂന്ന് അയോണുകളുമായിട്ടാവും സ്ഥിതിചെയ്യുക.
വിവിധ രാസ-ഭൗതിക പരീക്ഷണങ്ങളെ അടിസ്ഥാനപ്പെടുത്തിയാണ് വെര്ണര് വിവിധ ഗ്രൂപ്പുകളെ കോ-ഓര്ഡിനേഷന് ഗോളത്തില്പ്പെടുത്തിയിട്ടുള്ളത്. ഉദാഹരണത്തിന് പട്ടിക-1 കാണുക.
കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളുടെ ഘടന വിവരിക്കുന്ന പേരുകളും വെര്ണര് നല്കുകയുണ്ടായി. ഇവയില് പലതിനും പിന്നീട് ഇന്റര്നാഷണല് യൂണിയന് ഒഫ് കെമിസ്ട്രി ചില്ലറ ഭേദഗതികള് നിര്ദേശിച്ചു. Co Cl3.6NH3 എന്ന യൗഗികത്തിന് വെര്ണര് ഹെക്സാ അമീന് കോബാള്ട്ടി ക്ലോറൈഡ് എന്നാണ് പേരിട്ടത്. പുതിയ സമ്പ്രദായത്തില് ഈ പേര് ഹെക്സാ അമീന് കോബാള്ട്ട് (III) ക്ലോറൈഡ് എന്നായി.
വെര്ണറുടെ സിദ്ധാന്തങ്ങള് രൂപംകൊള്ളുന്ന കാലത്ത് അണുഘടനയെപ്പറ്റി കൃത്യമായി അറിവു ലഭിച്ചിരുന്നില്ല. പിന്നീടാണ് ഇലക്ട്രോണ് വിന്യാസങ്ങളും അണുഘടനയും തമ്മിലുള്ള ബന്ധം വ്യക്തമായി മനസ്സിലായത്. അപ്പോള് കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളെ അതതു മൂലകങ്ങളുടെ ഇലക്ട്രോണ് വിന്യാസങ്ങളെ അടിസ്ഥാനമാക്കി പഠിക്കേണ്ടിവന്നു.
യൗഗികങ്ങളില് മൂന്നുതരത്തിലുള്ള ബന്ധങ്ങളാണ് (bondings) പൊതുവേ നിലനില്ക്കുന്നത്; ഇലക്ട്രോണുകളെ അന്യോന്യം പങ്കിടുന്ന സഹസംയോജക ബന്ധം (covalent bond), ഒരു മൂലകം തനിക്ക് അത്യാവശ്യമില്ലാത്ത ഒരു ഇലക്ട്രോണിനെ മറ്റൊരു മൂലകത്തിന് സംഭാവന ചെയ്യുന്ന അയോണികബന്ധം (Ionic bond, electrovalent bond), ഒരു മൂലകം ഒരു ജോടി ഇലക്ട്രോണുകളെ മറ്റൊന്നിന് ദാനം ചെയ്ത് ഉണ്ടാകുന്ന ഉപസഹബന്ധം അഥവാ കോ-ഓര്ഡിനേറ്റ് ബോണ്ട്, കോ-ഓര്ഡിനേറ്റ് ബന്ധം കോവാലന്റ് ബന്ധത്തിന് സമാനമാണ്. പങ്കിടലിന് ആവശ്യമായ ഒരു ജോടി ഇലക്ട്രോണ് ഒരു പങ്കാളിയില് നിന്നുതന്നെ ലഭിക്കുന്നുവെന്നതാണ് ഇവ തമ്മിലുള്ള വ്യത്യാസം.
വെര്ണര് പ്രഖ്യാപിച്ചിട്ടുള്ള പ്രാഥമിക സംയോജകതകള് ഇലക്ട്രോ വാലന്റ് അഥവാ അയോണികബന്ധത്തെ കുറിക്കുന്നു.
നിര്ദിഷ്ട ലോഹ-അയോണിനുശേഷം ആവര്ത്തനപ്പട്ടികയില് പിന്നീട് ഏറ്റവും അടുത്തുവരുന്ന നിഷ്ക്രിയ വാതകത്തിന്റെ അണുസംഖ്യയില് എത്തുന്നതുവരെ ലോഹ-അണു ഇലക്ട്രോണ് യുഗ്മങ്ങളെ സ്വീകരിക്കുന്നു എന്നൊരാശയം ഓക്സ്ഫഡ് യൂണിവേഴ്സിറ്റി പ്രൊഫസര് സെഡ്ജ്വിക്ക് ആവിഷ്കരിക്കുകയുണ്ടായി. ഉദാഹരണമായി Pt(4)ല് 74 ഇലക്ട്രോണുകളുണ്ട്. [Pt(NH3)6]Cl4 എന്ന യൗഗികം രൂപമെടുക്കുമ്പോള് പ്ലാറ്റിനം ആറ് അമോണിയ ഗ്രൂപ്പുകള് ദാനം ചെയ്യുന്ന 12 ഇലക്ട്രോണുകളെ സ്വീകരിച്ച് ഇലക്ട്രോണുകളുടെ എണ്ണം തൊട്ടടുത്ത നിഷ്ക്രിയവാതകമായ റെഡോണിന് സമാനമാക്കുന്നു. അങ്ങനെ ദ്വിതീയ സംയോജകതയെന്നത് കോ-ഓര്ഡിനേഷന് ബന്ധത്തിന്റെ അടിസസ്ഥാനത്തില് വ്യാഖ്യാനിക്കപ്പെട്ടു. ഈ സിദ്ധാന്തമനുസരിച്ച് ഒരു സങ്കീര്ണയൗഗികത്തിലെ മധ്യ-അയോണിന് അഥവാ അണുവിന് സ്ഥിരത ലഭിക്കുവാന് ആവശ്യമായ അത്രയും ഇലക്ട്രോണുകളുടെ പകുതി ലിഗാന്ഡുകളുമായി അത് കോ-ഓര്ഡിനേറ്റ് ബന്ധം സ്ഥാപിക്കും. ഇലക്ട്രോണുകള് ദാനംചെയ്യുന്ന ലിഗാന്ഡുകളുടെ എണ്ണമാണ് ദ്വിതീയ സംയോജകതകളുടെ എണ്ണം അഥവാ കോ-ഓര്ഡിനേഷന് സംഖ്യ.
പല സങ്കരയൗഗികങ്ങളും ഈ സിദ്ധാന്തം അനുസരിക്കുന്നുണ്ടെങ്കിലും ഒട്ടധികം അപവാദങ്ങളും ചൂണ്ടിക്കാണിക്കാന് കഴിയും. ഒന്നില്ക്കൂടുതല് കോ-ഓര്ഡിനേഷന് സംഖ്യകളുള്ള ലോഹ-അയോണുകളെല്ലാം (ഉദാ. NI(II), Co(II), Zn(II), Ag(I) തുടങ്ങിയവ) ഈ നിയമത്തെ അനുസരിക്കുന്നില്ല. Fe(III) അയോണുകളുടെ കാര്യവും വ്യത്യസ്തമല്ല. ഒരു ഷഷ്ഠ-കോ-ഓര്ഡിനേറ്റിത ലോഹ-അയോണിന്റെ കാര്യത്തില് കേന്ദ്ര-അയോണിനോട് ആറ് ഇലക്ട്രോണ് യുഗ്മങ്ങള് കോ-ഓര്ഡിനേറ്റ് ചെയ്യപ്പെട്ടാല് ലോഹത്തില് ഋണവൈദ്യുതിയുടെ അധികരിച്ച ശേഖരണമായിരിക്കും ഫലം. ഇതിന്റെ അര്ഥം ലോഹ-അണുവും ലിഗാന്ഡുകളുമായുള്ള ബന്ധം കോ-ഓര്ഡിനേറ്റ് സിദ്ധാന്തംകൊണ്ട് പൂര്ണമായി വിവരിക്കാന് സാധ്യമല്ല എന്നതാണ്.
ആധുനിക രസതന്ത്രത്തില് വാലന്സ് ബോണ്ട് തിയറി (valance bond theory), ഇലക്ട്രോസ്റ്റാറ്റിക് ക്രിസ്റ്റല് ഫീല്ഡ് തിയറി (electrostatic crystal field theory), മോളിക്കുലാര് ഓര്ബിറ്റല് തിയറി (molecular orbital theory) എന്നിങ്ങനെ മൂന്നു സിദ്ധാന്തങ്ങങ്ങള് കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളുടെ പഠനത്തിന് ഉപയോഗിച്ചുവരുന്നു. ഇവയില് ക്രിസ്റ്റല് മണ്ഡല സിദ്ധാന്തവും (ക്രിസ്റ്റല് ഫീല്ഡ് തിയറി) മോളിക്കുലാര് ഓര്ബിറ്റല് സിദ്ധാന്തവും കൂട്ടിയിണക്കി ലിഗാന്ഡ് മണ്ഡലം എന്നൊരു സിദ്ധാന്തത്തിനും രൂപംകൊടുത്തിട്ടുണ്ട്. സങ്കരയൗഗികങ്ങള്ക്കു മാത്രം ബാധകമായതാണ് ഈ സിദ്ധാന്തം.
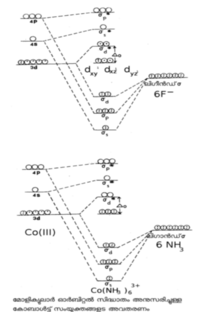
ലിനസ് പോളിങ് എന്ന അമേരിക്കന് ശാസ്ത്രജ്ഞനാണ് വാലന്സ് ബോണ്ട് തിയറി ആവിഷ്കരിച്ചത്. കേന്ദ്ര ലോഹ-അയോണിന്റെ മൂലാവസ്ഥയിലുള്ള ഇലക്ട്രോണികാ വിന്യാസമാണ് ഇവിടെ പ്രധാനം. ലിഗാന്ഡിലുള്ള ഇലക്ട്രോണ് യുഗ്മം ലോഹത്തിന്റെ സങ്കരിതമായ (hybrodised) അണുക ഓര്ബിറ്റലുകളില് പ്രവേശിക്കുന്നു. അങ്ങനെ തികച്ചും അയോണികമോ തികച്ചും സഹസംയോജകമോ (covalent) ആയ ഒരു ബന്ധനം ഇതുവഴി സാധ്യമാക്കുന്നു. ഇതാണ് ഈ സിദ്ധാന്തത്തിന്റെ മൌലികമായ അംശം. കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളുടെ ഒട്ടുമിക്ക ഗുണധര്മങ്ങളെയും ഈ സിദ്ധാന്തം വിശദീകരിക്കുന്നു. ചിത്രം 1-ലെ കോബാള്ട്ട് സങ്കരങ്ങളെ കാണുക.
Co(NH3)63+ന്റെ ഓര്ബിറ്റല് സങ്കരണത്തെ d2 sp3 എന്നു കുറിച്ചിരിക്കുന്നു. ഒരു ആന്തര ഓര്ബിറ്റല് സങ്കരമായാണ് ഇതിനെ കണക്കാക്കിയിരിക്കുന്നത്. ഈ കാറ്റയോണിന്റെ പ്രതികാന്തകീയ(diamagnetic) സ്വഭാവങ്ങളെ ഈ വ്യാഖ്യാനത്തിലൂടെ വിശദീകരിക്കാം. Co F63- ഒരു ബാഹ്യ ഓര്ബിറ്റല് സങ്കരമാണ്. ഇത് അനുകാന്തകീയവും (para magnetic) ആണ്.
ചാര്ജ് ബിന്ദുക്കളും ദ്വിധ്രുവങ്ങളും തമ്മിലുള്ള അന്യോന്യ ക്രിയകള്മൂലമാണ് ലോഹലിഗാന്ഡ് ബന്ധനം ഉണ്ടാകുന്നതെന്ന് ഇലക്ട്രോസ്റ്റാറ്റിക് ക്രിസ്റ്റല് ഫീല്ഡ് തിയറി പ്രസ്താവിക്കുന്നു. ബന്ധത്തിന് ഇലക്ട്രോണുകള് പങ്കിടുന്ന സാധ്യതകളെയും ഇതു നിരാകരിക്കുന്നു. സംക്രമണേതര മൂലകങ്ങളെ സംബന്ധിച്ചിടത്തോളം ലോഹലിഗാന്ഡ് ബന്ധനം നിര്ണയിക്കുന്നതിന് മധ്യ അയോണുകളുടെ ചാര്ജ്, വലുപ്പം എന്നിവയും ലിഗാന്ഡുകളുടെ ചാര്ജ്, ദ്വിധ്രുവ ആഘൂര്ണം, ധ്രുവണക്ഷമത, വലുപ്പം എന്നിവയും അറിഞ്ഞിരിക്കണം. സംക്രമണമൂലകങ്ങളുടെ കാര്യത്തില് ഇവയോടൊപ്പം d ഓര്ബിറ്റലുകളുടെ സ്പേസിലെ വിന്യാസക്രമവും അറിയേണ്ടതുണ്ട്. d ഓര്ബിറ്റലുകള്ക്കു സാധ്യമായ അഞ്ചുവിന്യാസക്രമങ്ങള് ഇപ്രകാരമാണ്. വാതകാവസ്ഥയിലുള്ള M അയോണിനെ സങ്കല്പിച്ചാല് അതിന്റെ എല്ലാ d ഓര്ബിറ്റലുകളും തുല്യഊര്ജം ഉള്ളവയായിരിക്കും. എന്നിരുന്നാലും dx2-y2, dz2 ഓര്ബിറ്റലുകള് ആറു ലിഗാന്ഡുകള്ക്കു നേരെയായി സ്ഥിതിചെയ്യും. ലിഗാന്ഡുകളുമായുള്ള വികര്ഷണത്തിന്റെ ഫലമായി ഇവ dxy, dxz, dyz എന്നിവയേക്കാള് ഉയര്ന്ന ഊര്ജനിലയിലും ആയിരിക്കും.
ഈ സിദ്ധാന്തം അനുസരിച്ച് മേല് സൂചിപ്പിച്ച Co(III) സങ്കരങ്ങളെ താഴെക്കാണുംപ്രകാരം ക്രമീകരിക്കാം.
Co(NH3)63+ ചക്രണ-യുഗ്മിത സങ്കരം എന്ന് അറിയപ്പെടുന്നു. എന്നാല് Co Fe63- ചക്രണ സ്വതന്ത്രമാണ്. ഉയര്ന്ന ക്രിസ്റ്റല് ഫീല്ഡ് വിഘടനംമൂലം (Δo)ആദ്യത്തേതില് ഇലക്ട്രോണുകള് യുഗ്മിതമായിരിക്കുമ്പോള് രണ്ടാമത്തേതില് അതിനെതിരായ കാരണം കൊണ്ട് ഇലക്ട്രോണുകള് യുഗ്മീകരിക്കുന്നില്ല. സങ്കര യൗഗികങ്ങളുടെ ഘടന, കാന്തിക സ്വഭാവങ്ങള് എന്നിവയെ മാത്രമല്ല, ലോഹസങ്കരങ്ങളുടെ ദൃശ്യ സ്പെക്ട്രത്തെയും ഈ സിദ്ധാന്തം കാര്യക്ഷമമായി വ്യാഖ്യാനിക്കുന്നു.
ഈ രണ്ടു സിദ്ധാന്തങ്ങളില് നിന്നു പല പ്രകാരത്തിലും വ്യത്യസ്തമാണ് മോളിക്കുലാര് ഓര്ബിറ്റര് തിയറി. ലോഹ ലിഗാന്ഡ് സിസ്റ്റത്തിലെ എല്ലാ അണുകേന്ദ്രങ്ങളെയും ഉള്ക്കൊള്ളുന്ന തന്മാത്രീയ ഓര്ബിറ്റലുകളിലൂടെ ഇലക്ട്രോണുകള് സഞ്ചരിക്കുന്നവെന്നതാണ് ഈ സിദ്ധാന്തത്തിന്റെ അടിസ്ഥാന സങ്കല്പം. ഈ അര്ഥത്തില് ഇത് വാലന്സ് ബോണ്ട് സിദ്ധാന്തത്തെയും ക്രിസ്റ്റല് ഫീല്ഡ് സിദ്ധാന്തത്തെയും ഉപയോഗപ്പെടുത്തുന്നു. കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളെ വ്യാഖ്യാനിക്കുന്നതിനുള്ള ഏറ്റവും അയവുള്ള സിദ്ധാന്തവും ഇതു തന്നെ. ഇത് സഹസംയോജക ബന്ധങ്ങളെയും അയോണിക ബന്ധങ്ങളെയും അംഗീകരിക്കുകയും വിവിധ ഊര്ജനിലകളിലായി d ഓര്ബിറ്റലുകള് വിഘടിക്കുന്നതിനെ ന്യായീകരിക്കുകയും ചെയ്യുന്നു. Co Fe63-, Co(NH3)63+ എന്നിവയുടെ മോളിക്കുലാര് ഓര്ബിറ്റര് ചിത്രം ചുവടെ കൊടുക്കുന്നു.
വാലന്സ് ബോണ്ട് സിദ്ധാന്തത്തിലെ സഹസംയോജക ബന്ധങ്ങള് സിഗ്മ (σ) ബന്ധിത മോളിക്യുലാര് ഓര്ബിറ്റലുകളായി സ്ഥിതിചെയ്യുന്നു. ഉദാ.σ s, σ p, σ d. അതുപോലെ ക്രിസ്റ്റല് ഫീല്ഡ് സിദ്ധാന്തം പ്രഖ്യാപിക്കുന്ന ക്രിസ്റ്റല് ഫീല്ഡു വിഭജനം (Δo) അബന്ധിത (non bonding) d ഓര്ബിറ്റലുകളും (dxy, dxz, dyz) ആന്റി ബോണ്ടിന് (anti bonding) സിഗ്മാ ഓര്ബിറ്റലുകളും (σ d+) തമ്മിലുള്ള ഊര്ജവ്യത്യാസത്തെ കുറിക്കുന്നു. കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളുടെ മിക്ക ഗുണധര്മങ്ങളെയും വിശദീകരിക്കാന് മോളിക്യുലാര് ഓര്ബിറ്റല് തിയറി പര്യാപ്തമാണ്.
സങ്കരങ്ങളുടെ സ്ഥിരത. കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളുടെ സ്ഥിരത അണുവിന്റെയും ലിഗാന്ഡിന്റെയും ഗുണധര്മങ്ങള്, ലായകത്തിന്റെ സ്വാധീനത, താപനില എന്നിവയെ ആശ്രയിച്ചിരിക്കുന്നു. ഇതേവരെയുള്ള പഠനങ്ങളില് നിന്ന് വ്യക്തമാകുന്നത് മധ്യഅയോണിന്റെ ചാര്ജ് വര്ധിക്കുകയും വലുപ്പം കുറയുകയും അതിന്റെ ഇലക്ട്രോണ് ആഭിമുഖ്യം (electro affinity) കൂടുകയും ചെയ്യുന്നതനുസരിച്ച് യൗഗികത്തിന്റെ സുസ്ഥിരത വര്ധിക്കുമെന്നാണ്. ഈ അടിസ്ഥാനത്തിലാണ് ക്ഷാരലോഹ-അയോണുകള്ക്ക് സങ്കരരൂപവത്കരണശേഷി കുറയുന്നതും സംക്രമണലോഹ അയോണുകള്ക്ക് പ്രസ്തുത ശേഷി വര്ധിക്കുന്നതും. ഈ ഘടകങ്ങള് കൂടാതെ തന്നെ അയോണിന്റെ ഇലക്ട്രോണിക വിന്യാസക്രമവും യൗഗികത്തിന്റെ സുസ്ഥിരതയില് കാര്യമായ പങ്കുവഹിക്കുന്നു. ലിഗാന്ഡുകള് ഏതുതന്നെയായാലും ദ്വിസംയോജക സംക്രമണലോഹ അയോണുകളുടെ യൗഗികരൂപവത്കരണശേഷി Mn<Fe<Co<M<Cu ഈ എന്നീ ക്രമത്തിലാണ്. ഏറ്റവുമധികം ധ്രുവണശേഷിയുള്ള പ്ലാറ്റിനം ലോഹങ്ങളാണ് സാധാരണയായി ഏറ്റവും സുസ്ഥിരമായ കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളെ ഉത്പാദിപ്പിക്കുന്നത്.
ക്ഷാരത, ഓരോ ലിഗാന്ഡിലും ഉള്ള ലോഹ-കീലേറ്റ് വലയങ്ങള്, കീലേറ്റ് വലയങ്ങളുടെ വലുപ്പം, ത്രിവിമീയ പ്രഭാവങ്ങള് (Steric effect), അനുനാദ പ്രഭാവം തുടങ്ങി ലിഗാന്ഡുകളുടെ പല സ്വഭാവങ്ങളും കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളുടെ സ്ഥിരതയെ ബാധിക്കുന്നുണ്ട്. അമ്ല-ക്ഷാര പ്രതിപ്രവര്ത്തനങ്ങള്മൂലം (ലോഹ-അയോണ് അമ്ലവും ലിഗാന്ഡുകള് ക്ഷാരവും) കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള് നിര്മിക്കുന്നതിനാല് ക്ഷാരകത ഏറ്റവും കൂടിയ ലിഗാന്ഡുകളാവും ഏറ്റവും സുസ്ഥിരമായ യൗഗികത്തെ സൃഷ്ടിക്കുക. അതുപോലെതന്നെ ബഹുദന്ത ലിഗാന്ഡുകളാണ് (Poly dentrate ligands) ഏകദന്ത ലിഗാന്ഡുകളെക്കാള് (mono dentrate ligands) പ്രബലങ്ങളായ യൗഗികങ്ങളെ സൃഷ്ടിക്കുന്നത്. ഉദാ. എഥിലിന് ഡൈ അമീന് സങ്കരയൗഗികങ്ങളാണ് അമോണിയ സങ്കരയൗഗികങ്ങളെക്കാള് സുസ്ഥിരങ്ങള്. എഥിലിന് ഡൈ അമീന് സങ്കരം കൂടുതല് കീലേറ്റിതം (chelated) ആയതിനാലാണ് അതിന്റെ സങ്കരം കൂടുതല് സുസ്ഥിരമായിട്ടുള്ളത്. കീലേഷനുള്ള സാധ്യത വര്ധിക്കുന്തോറും യൗഗികത്തിന്റെ സുസ്ഥിരതയും വര്ധിക്കുന്നു. കീലേറ്റ് വലയത്തിന്റെ വലുപ്പവും പ്രധാനപ്പെട്ട ഒരു ഘടകമാണ്. പൂരിത ലിഗാന്ഡുകള്ക്ക് അഞ്ചംഗ വലയങ്ങളാണ് ഏറ്റവും പറ്റിയത്. ദ്വിബന്ധങ്ങളുള്ള കീലേറ്റുകളുടെ കാര്യത്തില് ആറംഗ വലയങ്ങളാണ് കൂടുതല് സുസ്ഥിരം. സദൃശ യൗഗികങ്ങളില് കീലേറ്റ് വലയത്തിലെ ദ്വിബന്ധങ്ങളുടെ വര്ധനവ് സുസ്ഥിരതയെ വര്ധിപ്പിക്കും. ത്രിവിമഘടകങ്ങള് നല്ലൊരു പരിധിയില് യൗഗികത്തിന്റെ സുസ്ഥിരതയെ സ്വാധീനിക്കുന്നു. ലിഗാന്ഡ് അണുവിനോട് വലിയ ഗ്രൂപ്പുകള് ബന്ധിപ്പിക്കുമ്പോഴാണ് ഈ പ്രഭാവം സജീവമാകുന്നത്. ലിഗാന്ഡ് അണുതന്നെയും യൗഗികത്തിന്റെ സുസ്ഥിരതയെ വലിയൊരളവില് സ്വാധീനിക്കുന്നുണ്ട്. ഏറ്റവും ചെറുതും അതേസമയം ഏറ്റവും വലിയ ഇലക്ട്രോണ് സാന്ദ്രതയുള്ളതുമായ ലിഗാന്ഡ് അണുവാണ് ഏറ്റവും സ്ഥിരമായ ലോഹസങ്കരങ്ങള് ഉത്പാദിപ്പിക്കുന്നത്. ഇതനുസരിച്ച് ആവര്ത്തനപ്പട്ടികയില് രണ്ടാം പീരിയഡിലെ മൂലകങ്ങള് അവയുടെ ഗ്രൂപ്പിലെ മറ്റു മൂലകങ്ങളെ അപേക്ഷിച്ച് ശക്തിയുള്ള ലോഹ ലിഗാന്ഡ് ബന്ധങ്ങള് ഉണ്ടാക്കുന്നു.
ഏറ്റവും സുസ്ഥിരമായ യൗഗികം ഏറ്റവും കുറച്ചുമാത്രം പ്രവര്ത്തനക്ഷമമായിരിക്കും. അതുകൊണ്ട് പ്ളാറ്റിനം സങ്കരങ്ങളും [Co(III), Cu(III)] യൗഗികങ്ങളും പൊതുവേ ഏറ്റവും കുറച്ചുമാത്രം പ്രതിപ്രവര്ത്തനക്ഷമങ്ങളാണ്. മധ്യലോഹ-അയോണിന്റെ ഇലക്ട്രോണിക വിന്യാസം, അതിന്റെ കോ-ഓര്ഡിനേഷന് സംഖ്യ, കീലേഷന്റെ വ്യാപ്തി തുടങ്ങിയവ പ്രതിപ്രവര്ത്തന നിരക്കിനെ സ്വാധീനിക്കുന്നു.
ഐസോമെറിസം (സമാവയവത). കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള് പല തരത്തിലുള്ള ഐസോമെറിസം പ്രദര്ശിപ്പിക്കുന്നു.
പോളിമെറിസം. ഹെക്സമീന് കോബാള്ട്ടിക് ഹെക്സാനൈട്രോകോബാള്ട്ടേറ്റ് [Co(NH3)6] [Co(NO2)6] എന്ന യൗഗികത്തില് രണ്ടു കോ-ഓര്ഡിനേറ്റ് അയോണുകള് ഉണ്ട്. ഇത് അയോണികമല്ലാത്ത ട്രൈനൈട്രോ ട്രൈഅമീന് കോബാള്ട്ടിന്റെ [Co(NH3)3(NO2)3] പോളിമെറാണ്.
ഘടനാ ഐസോമെറിസം (Structural isomerism).
ഉദാ.[Co(NH3)5QNO2+] [CO(NH3NH5NO2)]2+
ഈ രണ്ടു യൗഗികങ്ങളിലും നൈട്രേറ്റ് അയോണ് കോ-ബാള്ട്ടിക് അയോണുമായി വ്യത്യസ്തമായി ബന്ധിച്ചിരിക്കുന്നു. ആദ്യയൗഗികത്തിന്റെ ഒരു പുനഃക്രമീകരണം മാത്രമാണ് രണ്ടാമത്തെ യൗഗികം. ആദ്യത്തെ നൈട്രോഅമീന് നല്ല ചുവപ്പുനിറത്തിലും മറ്റേത് തവിട്ടുനിറത്തിലും കാണപ്പെടുന്നു. രണ്ടാമത്തെ യൗഗികമാണ് കൂടുതല് സ്ഥിരം.
കോ-ഓര്ഡിനേഷന് ഐസോമെറിസം. ഈ ഐസോമെറിസത്തില് ധന, ഋണ-അയോണുകളിലെ ഗ്രൂപ്പുകള് അന്യോന്യം മാറ്റി സ്ഥാപിക്കപ്പെടുന്നു.
ഉദാ. Co(NH3)6] [Co(NO2)6]
Co(NH3)4](NO2)2] Co(NH3)2(NO2)4]
അയോണീകരണ ഐസോമെറിസം. ഇത് കോ-ഓര്ഡിനേഷന് ഐസോമെറിസവുമായി ബന്ധപ്പെട്ടതാണ്.
ഉദാ. [Co(NH3)5SO4]Br
[Co(NH3)5Br]SO4
രണ്ടു യൗഗികങ്ങളില് ആദ്യത്തേത് വിശ്ലേഷണപ്രക്രിയയില് ബ്രോമൈഡ് അയോണിന്റെ പരീക്ഷണഫലങ്ങള് തരുന്നു. രണ്ടാമത്തെ യൗഗികം സള്ഫേറ്റിന്റെ പരീക്ഷണഫലങ്ങളാണ് തരിക.
ഹൈഡ്രേറ്റ് ഐസോമെറിസം. ക്രോമിക് ക്ലോറൈഡിന്റെ ഹെക്സാഹൈഡ്രേറ്റ് ഇത്തരം ഐസോമെറിസം നല്കുന്നു.
ഉദാ. Cr(H2O)6d3(ഇരുണ്ട വയലറ്റ് നിറം)
[Cr(H2O)5Cl]d2.H2O)(പച്ച)
[Cr(H2O)4Cl2]Cl.2H2O)(പച്ച)
ഇവിടെ ജല തന്മാത്രകള് യൗഗികത്തിന്റെ ഭാഗമായല്ല കാണപ്പെടുന്നത്; യാന്ത്രികബലത്താല് ക്രിസ്റ്റല് ജാലികകള്ക്കുള്ളില് പിടിച്ചുനിര്ത്തപ്പെട്ട നിലയിലാണ്. AgNO3 ആദ്യയൗഗികത്തില് നിന്ന് മുഴുവന് ക്ലോറിനെയും രണ്ടാമത്തേതില് നിന്ന് 2/3 ക്ലോറിനെയും മൂന്നാമത്തേതില് നിന്ന് 1/3 ക്ലോറിനെയും അവക്ഷേപിക്കുന്നു.
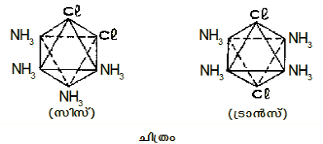
സ്റ്റീരിയോ ഐസോമെറിസം. അണുക്കളുടെ അഥവാ ഗ്രൂപ്പുകളുടെ വിവിധ ദിശകളിലുള്ള വിന്യാസംമൂലമാണ് ഈ ഐസോമെറിസം ഉണ്ടാകുന്നത്. ഉദാ. [Pt(NH3)2Cl2] എന്ന യൗഗികം സിസ്, ട്രാന്സ് എന്നീ രണ്ടുരൂപങ്ങളില് സ്ഥിതിചെയ്യുന്നു. ലേയത്വം, രാസസ്വഭാവങ്ങള് തുടങ്ങിയവയില് ഈ സിസ്, ട്രാന്സ് രൂപങ്ങള് വ്യത്യസ്തമായി പെരുമാറുന്നു.
ഇത്തരം ഐസോമെറിസത്തെ സിസ്-ട്രാന്സ് ഐസോമെറിസം എന്നു പറയുന്നു. രണ്ടു പ്രത്യേക ലിഗാന്ഡുകള് ഒരേവശത്തുവരുന്നത് സിസ്; അല്ലാത്തവ ട്രാന്സ്.
കോ-ഓര്ഡിനേഷന് സംഖ്യ രണ്ട്, മൂന്ന് എന്നിങ്ങനെയുള്ള യൗഗികങ്ങള് ഇത്തരം ഐസോമെറിസം പ്രദര്ശിപ്പിക്കുന്നില്ല. കാരണം ലിഗാന്ഡുകളുടെ സ്ഥാനം വളരെ അടുത്തായിരിക്കും. കോ-ഓര്ഡിനേഷന് നാലു മുതലുള്ള യൗഗികങ്ങളില് ഈ പ്രതിഭാസം പ്രകടമാണ്. കോ-ഓര്ഡിനേഷന് സംഖ്യ നാല് ആയിട്ടുള്ള യൗഗികങ്ങള് ചതുഷ്ഫലകീയമായും ആറ് ആയിട്ടുള്ളവ ഷഡ്ഫലകീയമായും ഘടന കൈക്കൊള്ളുന്നു. ഉദാ.[Co(NH3)4Cl2]2+ എന്ന സങ്കരം ഷഡ്ഫലകീയമായ രണ്ടു സമരൂപികളെ സൃഷ്ടിക്കുന്നു.
ഓപ്ടിക്കല് ഐസോമെറിസം. ജൈവ സംയുക്തങ്ങളെപ്പോലെ ഈ സങ്കരയൗഗികങ്ങളും ഓപ്ടിക്കല് ഐസോമെറിസം പ്രദര്ശിപ്പിക്കുമെന്ന് വെര്ണര്തന്നെ പ്രസ്താവിച്ചിരിക്കുന്നു. കോ-ഓര്ഡിനേറ്റിത ഗ്രൂപ്പുകള് (നാലോ ആറോ അതിലധികമോ) അസമമിതമായി വിന്യസിച്ചിട്ടുള്ള യൗഗികങ്ങളാണ് ഈ ഐസോമെറിസം സൃഷ്ടിക്കുന്നത്. കീലേറ്റ് വലയങ്ങളുള്ളവ കുറേക്കൂടി എളുപ്പത്തില് ഓപ്ടിക്കല് ഐസോമെറിസം പ്രദര്ശിപ്പിക്കുന്നു. ഉദാ. ട്രിസ് എഥിലിന് ഡൈ അമീന് കോബാള്ട്ടിക് അയോണ് അന്യോന്യം അധ്യാരോപിതമല്ലാത്ത രണ്ടു ഘടനകള് (സമാവയവികള്) സമ്മാനിക്കുന്നു. 2, 3, 5, 7, 8 എന്നീ കോ-ഓര്ഡിനേഷന് സംഖ്യകളുള്ള യൗഗികങ്ങളുടെ സ്റ്റീരിയോ ഐസോമെറിസം ഇനിയും കൂടുതലായി പഠിക്കേണ്ടതുണ്ട്. എക്സ്-റേ പഠനം, കാന്തികപഠനം, ദ്വിധ്രുവ ആഘൂര്ണപഠനം തുടങ്ങിയവയാണ് ഇത്തരം യൗഗികങ്ങളുടെ സ്റ്റീരിയോ ഐസോമെറിസ പഠനത്തിന് കൂടുതലായി ഉപയോഗിച്ചുവരുന്നത്.
പ്രധാന കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള്. അമീനുകളും ഹൈഡ്രേറ്റുകളും കൂടാതെ സുപ്രധാനങ്ങളായ പല കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങളുമുണ്ട്. ഭാരലോഹങ്ങളുടെ സങ്കര സയനൈഡ് യൗഗികങ്ങള് ഇലക്ട്രോപ്ലേറ്റിങ്ങില് ഉപയോഗിക്കുന്നു. ഫെറിക് ഫെറോസയനൈഡ്, പ്രഷ്യന് ബ്ലൂ തുടങ്ങിയ കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള്ക്ക് വര്ണങ്ങളുടെ നിര്മിതിയില് നല്ല പങ്കുണ്ട്. ഹീമോഗ്ലോബിന്, ക്ലോറോഫില് തുടങ്ങിയവ പ്രകൃതിദത്തമായ കോ-ഓര്ഡിനേഷന് വര്ണകങ്ങളാണ്. ലോഹകാര്ബൊണൈലുകളാണ് മറ്റൊരു പ്രധാനപ്പെട്ട കോ-ഓര്ഡിനേഷന് യൗഗികവിഭാഗം (ഇവയില് ലോഹത്തിന്റെ സംയോജകത പൂജ്യമാണ്). നിക്കല് കാര്ബൊണൈല്, അയണ് കാര്ബൊണൈല് Fe (Co)5 തുടങ്ങിയ യൗഗികങ്ങള് വ്യാവസായിക പ്രാധാന്യം അര്ഹിക്കുന്നു. α ആമിനോ അമ്ലങ്ങള് ഉള്ച്ചേര്ന്നിട്ടുള്ള കോ-ഓര്ഡിനേഷന് യൗഗികങ്ങള് തുകല്വ്യവസായത്തിലും മറ്റും ഉപയോഗിച്ചുവരുന്നു.
(ചുനക്കര ഗോപാലകൃഷ്ണന്)